Коллоидный журнал, 2020, T. 82, № 4, стр. 423-431
Адсорбция липофильного лекарственного вещества фелодипина на различных межфазных границах
Н. М. Задымова 1, *, В. Д. Должикова 1, А. Е. Харлов 1
1 Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, д. 1, стр. 3, Россия
* E-mail: zadymova@colloid.chem.msu.ru
Поступила в редакцию 30.12.2019
После доработки 09.01.2020
Принята к публикации 10.01.2020
Аннотация
В связи с разработкой способов транспортной доставки липофильных лекарственных веществ (ЛВ) в биодоступной форме использован комплексный подход к исследованию адсорбции гипотензивного ЛВ фелодипина на межфазных границах, моделирующих поверхности различных носителей. Получены изотермы адсорбции фелодипина из растворов в гептане (C = 2.13 × 10–5−4.26 × 10–4 М) на границах с водой и металлическим серебром, а также изотермы сжатия монослоев этого ЛВ, нанесенных на поверхность воды из растворов в гептане. Определены количественные характеристики исследованных слоев фелодипина, проанализировано их фазовое состояние, а также наиболее вероятная конформация адсорбированных молекул ЛВ с учетом данных молекулярно-динамического моделирования. Фазовое состояние монослоев фелодипина на границе гептан/вода хорошо описывается уравнением Ван-Лаара, на поверхности серебра образуется бислой; для нанесенных монослоев фелодипина обнаружен фазовый переход из газообразного в жидкорасширенное состояние.
ВВЕДЕНИЕ
Разработка новых лекарственных веществ (ЛВ) является чрезвычайно дорогостоящим, трудоемким и длительным процессом, связанным с высокими рисками, поэтому совершенствование лекарственных форм уже имеющихся ЛВ с целью повышения их биодоступности и эффективности является весьма перспективным и практичным подходом. Биодоступность ЛВ во многом определяется способностью проникать через биологические мембраны, которые липофильны, и растворимостью в воде, поскольку человеческий организм примерно на 90% состоит из воды [1, 2].
Липофильные ЛВ, доминирующие на фармацевтическом рынке [3], легко проникают через биологические мембраны, о чем, в частности, свидетельствуют работы, посвященные влиянию таких ЛВ на ленгмюровские монослои фосфолипидов, нанесенные на поверхность субфазы (вода или водные растворы электролитов) и моделирующих биомембраны [4–6]. Очевидно, что повышение растворимости липофильных ЛВ в воде является эффективным способом увеличения их биодоступности [7–9]. В последнее время возрос интерес к разработке способов инкорпорирования липофильных ЛВ в водной среде в различные типы наноразмерных носителей, которые не только увеличивают растворимость ЛВ в воде, но и защищают их от гидролиза и других видов деградации, включая ферментативное разложение, и обеспечивают их пролонгированную доставку. Важно подчеркнуть, что дисперсные системы, содержащие наноразмерные носители ЛВ, можно разделить на термодинамически устойчивые (мицеллярные растворы ПАВ [10–13], микроэмульсии [14–16]) и термодинамически неустойчивые, но характеризующиеся длительной кинетической стабильностью, т.е. квазиравновесные (наноэмульсии [17–22], везикулы [22–26], ниосомы [27–31], наночастицы серебра, золота [32, 33] и др.).
Эффективность иммобилизации ЛВ во многом определяется их адсорбцией на поверхности носителей, однако такой информации в литературе практически нет. Поэтому целью данной работы было исследование адсорбционных и нанесенных слоев липофильного ЛВ (фелодипина) на межфазных границах, моделирующих поверхности различных носителей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования
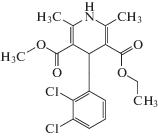
В качестве модельного гидрофобного ЛВ использовали фелодипин основание, который является блокатором кальциевых каналов и применяется в качестве эффективного средства от гипертензии и ишемической болезни сердца [34]. Фелодипин – (RS)-3-этил-5-метил-4-(2,3-дихлорфенил)-2,6-диметил-1,4-дигидропиридин-3,5-дикарбоксилат (рис. 1), молекулярная масса которого составляет 384.2 Да, характеризуется плохой растворимостью в воде (Sw = 2.2 × 10–6 M при 22°C [13]), низкой биодоступностью (не более 15−20% при пероральном применении [35]), электронейтрален, его растворимость не зависит от pH. При комнатной температуре фелодипин находится в твердом агрегатном состоянии (температура плавления − 142–145°C). В работе использован препарат компании PCAS (Финляндия), степень чистоты 99%.
Дважды дистиллированная вода имела удельную электропроводность 1.5 × 10–4 См/м (22°С). Гептан и н-пропанол марки “х. ч.” (ЭКОС-1, Россия) применяли без дополнительной очистки.
Методы исследования
Растворимость фелодипина в гептане оценивали с помощью УФ-спектроскопии. Использовали однолучевой спектрофотометр Agilent 8453 (США) и стандартные кварцевые кюветы толщиной 1 см. Спектры регистрировали дифференциальным методом относительно спектра растворителя соответствующего состава. Точность определения оптической плотности (A) составляла ±1 × 10–4.
Гептан предварительно насыщали фелодипином. Для этого его избыточную навеску вносили в гептан, который хранили в темном месте, периодически перемешивая с помощью магнитной мешалки. Перед спектрофотометрическими измерениями пробу раствора фелодипина над осадком фильтровали (0.22 мкм, Millipore) и растворяли в н-пропаноле, для которого известен молярный коэффициент экстинкции (Emax = = 6795 ± 20 М–1 см–1 [19]), соответствующий максимуму поглощения фелодипина на λmax = 363 нм. Постоянство значения оптической плотности в максимуме поглощения (A363) во времени свидетельствовало о достижении равновесия. Для насыщения гептана фелодипином потребовалось 7 суток, его растворимость в гептане рассчитывали из соотношения
(1)
${{S}_{{\text{Ф}}}} = {\text{ }}\left( {{{{{A}_{{363}}}} \mathord{\left/ {\vphantom {{{{A}_{{363}}}} {{{E}_{{\max }}}}}} \right. \kern-0em} {{{E}_{{\max }}}}}} \right)P,$Значение растворимости фелодипина составило 5.3 × 10–4 М (при 22°C). Растворы ЛВ в гептане требуемой концентрации готовили разбавлением насыщенного раствора.
Метод висящей капли применяли для измерения межфазного натяжения σ на границе гептан/вода. При помощи цифровой видеокамеры DCM-130, встроенной в горизонтальный микроскоп, фиксировали изображение капли. Значения σ рассчитывали с помощью программного пакета Drop Shape Analysis (Krüss) методом численного интегрирования уравнения Юнга–Лапласа. Время формирования капли варьировали в интервале 1−60 мин.
Поскольку растворимость фелодипина в гептане превышает его растворимость в воде более чем в 200 раз, массопереносом данного ЛВ в водную фазу при тензиометрических измерениях можно пренебречь.
Монослои фелодипина, нанесенные на поверхность воды из его раствора в гептане, исследовали методом Ленгмюра. Использовали тефлоновую ванну Ленгмюра MDT-LB5 (NT-MDT, Россия), имевшую площадь поверхности 450 мм × 110 мм и объем 600 см3. Исходная площадь поверхности между барьерами равна 396 см2, конечная − 44 см2, т.е. изменение площади при измерениях составляло 352 см2. Максимальная скорость движения подвижного барьера равна 480 мм/мин. Измерения поверхностного давления π с точностью ±0.05 мН/м проводили с использованием беззольной бумажной пластинки Вильгельми [36]. При поверхностном давлении монослоя <5 мН/м, скорость движения барьера составляла 10 мм/мин, в остальных случаях – 5 мм/мин.
Для формирования монослоя на поверхность воды по обе стороны пластинки Вильгельми наносили по 40 мкл насыщенного раствора фелодипина в гептане. Время формирования монослоя перед сжатием составляло 15 мин, его достаточно для испарения растворителя. Использовали циклический режим испытаний. Каждый цикл состоял из 3-х стадий: сжатие–пауза–расширение. Продолжительность каждой стадии составляла 15 мин. В каждом эксперименте выполнены 3 цикла.
Метод пьезоэлектрического микровзвешивания (ПМ) [37] использовали для изучения адсорбции фелодипина из растворов в гептане на поверхности серебра. Количество адсорбированного вещества измеряется на микровесах. Датчиком микровесов служит сенсор − кварцевый резонатор, чувствительной частью которого является серебряный электрод (площадь поверхности 0.5 см2). Высокая чувствительность метода ПМ (до 10–12 г) позволяет измерять ультрамалые значения адсорбции. Корректность метода ПМ при измерении адсорбции ПАВ на твердых поверхностях подтверждена другими методами определения адсорбции [38].
Физическая основа метода ПМ заключается в том, что частота колебаний f резонатора уменьшается при увеличении количества вещества, адсорбированного на его поверхности (Δm, г/см2), что определяется уравнением Зауэрбрея [37]
где Δf – изменение частоты (Гц), Cf – коэффициент массовой чувствительности, который находится расчетным путем, определяется свойствами кристалла кварца и собственной частотой колебаний резонатора f0. В работе использовали кварцевые резонаторы АТ-среза с серебряными электродами толщиной 200 нм и f0 = 5 мГц. Для таких резонаторов Сf = 56.75 × 106 (Гц см2)/г [38].В соответствии с уравнением (2) адсорбция (Γ, г/см2) рассчитывается как
(3)
$\Gamma = \Delta m = {{--\Delta f} \mathord{\left/ {\vphantom {{--\Delta f} {{{C}_{{\text{f}}}}}}} \right. \kern-0em} {{{C}_{{\text{f}}}}}}~ = --1.76 \times {{10}^{{--8}}}\Delta f.$Эксперименты проводили следующим образом. Измеряли собственную частоту колебаний кварцевых резонаторов f0. Далее сенсоры выдерживали в течение 30 мин в растворах фелодипина в гептане, промывали в гептане и высушивали в течение 24 ч при комнатной температуре. После высушивания определяли частоту f1 и по уравнению (3) рассчитывали адсорбцию, принимая Δf = = f1 – f0. Все измерения проводили в термостатированной ячейке при температуре 22 ± 1°C. Время измерения частоты колебаний сенсоров составляло приблизительно 2 ч, что соответствует установлению постоянных значений f0 и f1; точность измерения частоты ±1 Гц. Точность определения адсорбции составляла ± 1.8 × 10–8 г/см2 или, с учетом молекулярной массы фелодипина, ±0.5 × 10–6 моль/м2.
Краевые углы измеряли с помощью горизонтального микроскопа с гониометрической приставкой с точностью ±1°. Краевые углы натекания θа измеряли при нанесении капли жидкости объемом 2 мкл на твердую поверхность с помощью микрошприца, а краевые углы оттекания θr – при подведении пузырька воздуха к поверхности, погруженной в жидкость. Измерения проводили в закрытых кюветах при комнатной температуре для 3–5 капель (или пузырьков). На поверхности серебряных электродов краевые углы натекания и оттекания воды составляли 65° и 63° соответственно. Наблюдаемый незначительный гистерезис смачивания, Δθ = θа – θr = 2°, свидетельствует о чистоте и однородности поверхности серебряного электрода.
Сочетание методов ПМ и смачивания позволяет на одних и тех же образцах измерять адсорбцию и краевые углы, что дает возможность получить более полную информацию о строении адсорбционных слоев на твердой поверхности.
Методом молекулярной динамики проведена оценка наиболее вероятных конформационных состояний молекулы фелодипина в средах различной полярности (вода, гептан). Использован пакет прикладных программ Tinker 8.7 [39]. Для проведения расчетов были использованы значения параметров молекул (размер, валентные углы, потенциалы взаимодействия и т.д.), приведенные в работах [40, 41].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Адсорбционные слои фелодипина на межфазной границе гептан/вода
На рис. 2 приведена экспериментальная изотерма межфазного натяжения σ(C) для растворов фелодипина в гептане на границе с водой при 22°C, а также результаты расчетов по уравнению Шишковского
где σ0 – межфазное натяжение в отсутствие ПАВ. Рассчитанные значения констант составили: A = 2.4 × 104 М–1, b = 8.7 мДж/м2.Рис. 2.
Изотерма межфазного натяжения растворов фелодипина в гептане на границе с водой при 22°C: эксперимент (символы) и расчет по уравнению Шишковского (линия). Касательная подчеркивает начальный линейный участок изотермы.
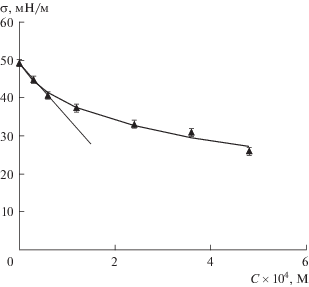
Изотерма σ(C) хорошо описывается уравнением (4). При этом фелодипин, адсорбируясь из масляной фазы, снижает межфазное натяжение на границе с водой до 25.9 мДж/м2.
Известно [42], что эмпирическое уравнение Шишковского (4) может быть получено теоретически при совместном решении уравнений Гиббса (Γ = (C/RT)(–dσ/dC), где Γ – адсорбция, R – универсальная газовая постоянная, T – абсолютная температура), и Ленгмюра (Γ = ΓmaxAC/(1 + AC), где Γmax – адсорбция ПАВ, соответствующая предельно заполненному монослою). Это позволяет охарактеризовать коэффициент A как константу адсорбционного равновесия, а коэффициент b как RTΓmax. Величина Γmax, рассчитанная по найденному значению b, составила 3.5 × 10–6 моль/м2, а площадь, приходящаяся на молекулу фелодипина в предельно заполненном монослое (S0 = 1/(ΓmaxNA), где NA – число Авогадро), − 0.47 нм2.
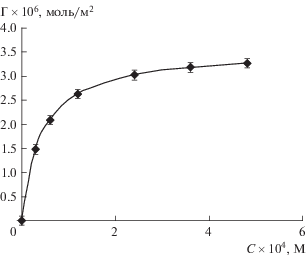
Дифференцирование уравнения Шишковского (4) позволяет получить выражение для производной dσ/dC = –Ab/(1 + AC) и по известным значениям констант A и b рассчитать ее значения для каждой концентрации. Далее по уравнению Гиббса можно определить адсорбцию фелодипина (рис. 3, символы). С другой стороны, изотерма Γ(C) может быть получена из уравнения Ленгмюра на основе рассчитанных значений А и Γmax (рис. 3, сплошная линия). Из рис. 3 следует, что изотерма адсорбции фелодипина хорошо описывается уравнением Ленгмюра.
Рис. 3.
Изотерма адсорбции фелодипина из растворов в гептане на границе с водой при 22°C. Символы – расчет по уравнению Гиббса, сплошная линия – расчет по уравнению Ленгмюра.
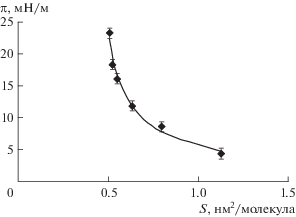
На рис. 4 приведена зависимость π(S) для адсорбционных слоев фелодипина на границе фаз гептан/вода (π = σ0 – σ, где σ0 − межфазное натяжение в отсутствие ЛВ, а S = 1/(ΓNA) − площадь, приходящаяся на молекулу фелодипина в монослое), полученная на основе тензиометрических измерений и значений Γ. На этом же рисунке представлена изотерма π(S), рассчитанная по уравнению Ван-Лаара [43] с использованием найденного значения S0:
(5)
$\pi = \left( {{{kT} \mathord{\left/ {\vphantom {{kT} {{{S}_{0}}}}} \right. \kern-0em} {{{S}_{0}}}}} \right){\text{ln}}\left[ {{S \mathord{\left/ {\vphantom {S {(S--{{S}_{0}})}}} \right. \kern-0em} {(S--{{S}_{0}})}}} \right],$Рис. 4.
Зависимость двухмерного давления π от площади S, приходящейся на молекулу фелодипина на границе фаз гептан/вода при 22°C. Символы − данные, полученные на основе тензиометрических измерений и значений адсорбции, сплошная линия − расчет по уравнению Ван-Лаара.
Поверхностная активность (J = lim(–dσ/dC)C→ 0) фелодипина на границе гептан/вода, найденная из начального линейного участка изотермы межфазного натяжения (рис. 2), равна 1.43 × × 105 мДж/(м2 М). Величина стандартной свободной энергии Гиббса адсорбции ΔG° определялась по уравнению Бетса и Петика [44]:
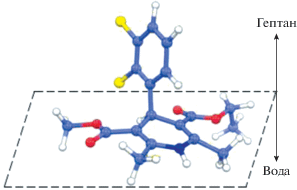
Основной вклад в величину ΔG°, равную ‒29.4 кДж/моль, при адсорбции фелодипина из масляной фазы на границе с водой, вероятно, вносит энтальпийная составляющая, обусловленная гидратацией его полярных групп и формированием водородных связей между молекулами воды и этого ЛВ. Ориентация адсорбированной молекулы фелодипина, которая содержит атом-донор и три атома-акцептора протонов [35], должна обеспечивать максимальную возможность образования соответствующих водородных связей (H2O⋅⋅⋅H–N и H–O–H⋅⋅⋅О). Наиболее вероятная конформация молекулы фелодипина, адсорбированной на межфазной поверхности (данные молекулярно-динамического моделирования), представлена на рис. 5. При этом 1,4-дигидропиридиновое кольцо молекулы располагается параллельно межфазной поверхности гептан/вода, а фенильный цикл находится в масляной фазе (рис. 5).Таким образом, фелодипин можно отнести к липофильным неионогенным ПАВ, эффективно снижающим межфазное натяжение на границе с водой при адсорбции из неполярной фазы. При этом применимость уравнений Ленгмюра и Ван-Лаара свидетельствует об отсутствии взаимодействий между адсорбированными молекулами фелодипина. Полученные данные могут быть использованы при разработке коллоидно-химических основ получения стабильных прямых наноэмульсий с инкорпорированными липофильными ЛВ.
Ленгмюровские монослои фелодипина на поверхности водной субфазы
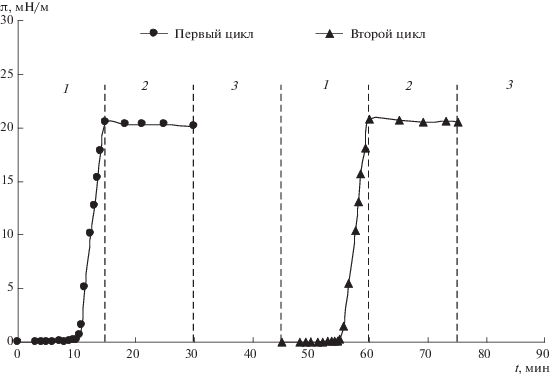
Полученные при циклических испытаниях кинетические зависимости двумерного давления π(t) для монослоя фелодипина, нанесенного на поверхность воды, представлены на рис. 6. Наблюдается полная воспроизводимость результатов, что свидетельствует о формировании стабильного монослоя.
Рис. 6.
Изменение двумерного давления во времени при циклических испытаниях нанесенного на поверхность воды монослоя фелодипина: 1 – сжатие, 2 – пауза, 3 – расширение.
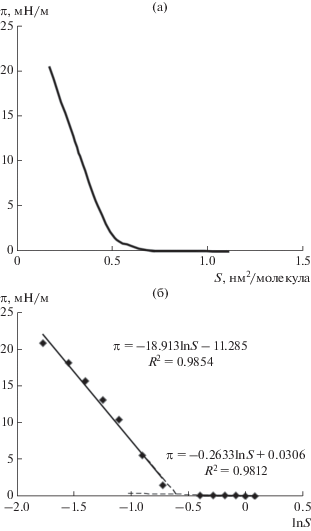
Изотерма сжатия π(S) монослоя фелодипина представлена на рис. 7а. Максимальное значение двумерного давления (πmax = 20.5 мН/м, рис. 7а) хорошо согласуется с результатами тензиометрических измерений, согласно которым максимальное снижение межфазного натяжения (σ0 – σmin) на границе раствор фелодипина в гептане/вода составило 22.5 мН/м (рис. 2). Следует отметить, что для нанесенного монослоя фелодипина наблюдается заметно большее значение πmax, нежели для монослоя липофильного противоракового ЛВ доцетакселя на поверхности водной субфазы (πmax = 13 мН/м [5]).
Известно, что модуль сжатия εs, который может служить характеристикой фазового состояния ленгмюровских монослоев [44, 45], определяется следующим образом [44–46]:
(7)
${{\varepsilon }_{{\text{s}}}} = --S{{({{d\pi } \mathord{\left/ {\vphantom {{d\pi } {dS}}} \right. \kern-0em} {dS}})}_{T}}.$(8)
${{\varepsilon }_{{\text{s}}}} = --{{({{d\pi } \mathord{\left/ {\vphantom {{d\pi } {d{\kern 1pt} {\text{ln}}{\kern 1pt} S}}} \right. \kern-0em} {d{\kern 1pt} {\text{ln}}{\kern 1pt} S}})}_{T}}.$Адсорбционные слои фелодипина на поверхности серебра
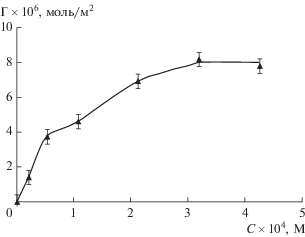
Экспериментальные данные, полученные методом ПМ, представлены в табл. 1, а изотерма адсорбции фелодипина из растворов в гептане на поверхности серебра − на рис. 8. Изотерма Γ(C) имеет точку перегиба при C = 1.07 × 10–4 М и выходит на плато при C ≥ 3.2 × 10–4 М, что, вероятно, свидетельствует о полислойном характере адсорбции. При концентрации раствора фелодипина в гептане 5.33 × 10–5 М величина Γ = 3.7 × × 10–6 моль/м2 и соответствует значению S = = 0.45 нм2/молекула, что практически совпадает с площадью, приходящейся на молекулу этого ЛВ в насыщенном монослое на границе фаз гептан/вода. Таким образом, при данной концентрации формируется насыщенный монослой, в котором молекулы фелодипина ориентированы так, что их 1.4-дигидропиридиновые кольца располагаются параллельно поверхности серебра. При этом адсорбция происходит за счет координационного взаимодействия молекул фелодипина, содержащих атом азота с неподеленной парой электронов, с серебром по донорно-акцепторному механизму [47]. Среднее значение адсорбции фелодипина в области плато составляет 8.0 × 10–6 моль/м2 и в пределах точности определения адсорбции совпадает с удвоенным значением Г для предельно заполненного монослоя, что подтверждает формирование бислоя молекул этого ЛВ на поверхности серебра. Поскольку молекула фелодипина содержит электроотрицательные атомы кислорода и азота, то весьма вероятно, что второй слой его молекул образуется за счет межмолекулярных водородных связей (=O⋅⋅⋅H–N). Возможность формирования бислоев вследствие возникновения водородных связей показана, например, при самоорганизации тиолов с терминальными карбоксильными и аминогруппами на поверхности золота [48].
Таблица 1.
Изменение частоты колебаний (Δf) резонатора при определении методом ПМ адсорбции (Г) фелодипина на поверхности серебра из растворов в гептане разной концентрации
| С × 104, М | 0.21 | 0.53 | 1.07 | 2.13 | 3.20 | 4.26 |
| Δf, Гц | –3 | –8 | –11 | –15 | –18 | –17 |
| Г × 107, г/см2 | 0.5 | 1.4 | 1.8 | 2.6 | 3.2 | 2.9 |
С целью оценки изменения поверхностных свойств серебра при модифицировании адсорбционными слоями фелодипина был использован метод смачивания, который позволяет определить свободную поверхностную энергию (σтг) твердого тела с учетом вкладов в нее дисперсионной ($\sigma _{{{\text{тг}}}}^{{\text{d}}}$) и недисперсионной ($\sigma _{{{\text{тг}}}}^{{\text{n}}}$) составляющих [49–51]:
(11)
${{\sigma }_{{{\text{тг}}}}} = \sigma _{{{\text{тг}}}}^{{\text{d}}} + \sigma _{{{\text{тг}}}}^{{\text{n}}},$(12)
${{\sigma }_{{{\text{жг}}}}}(1{\text{ }} + {\kern 1pt} \cos {\kern 1pt} \theta ) = 2{{(\sigma _{{{\text{жг}}}}^{{\text{d}}}\sigma _{{{\text{тг}}}}^{{\text{d}}})}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}} + 2{{(\sigma _{{{\text{жг}}}}^{{\text{n}}}\sigma _{{{\text{тг}}}}^{{\text{n}}})}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$Расчет величины σтг проводили, используя уравнения (11) и (12) в рамках модели Оуэнса–Вендта–Кабли [51], на основе измерения краевых углов θ двух тестовых жидкостей (воды и йодистого метилена) с известными значениями σжг, $\sigma _{{{\text{жг}}}}^{{\text{d}}}$ и $\sigma _{{{\text{жг}}}}^{{\text{n}}}$ [52]. Точность определения σтг составляла ±0.8 мДж/м2. Данные приведены в табл. 2, на их основе можно заключить, что модифицирование высокоэнергетической поверхности серебра (σтг = 1460 мДж/м2 [53]) адсорбционными слоями фелодипина приводит к уменьшению свободной поверхностной энергии серебра до значений 39–48 мДж/м2, характерных для низкоэнергетических поверхностей [54].
Таблица 2.
Значения краевых углов (θ) тестовых жидкостей на поверхности серебра, а также поверхностной энергии (σтг), ее дисперсионной ($\sigma _{{{\text{тг}}}}^{{\text{d}}}$) и недисперсионной ($\sigma _{{{\text{тг}}}}^{{\text{n}}}$) составляющих для поверхности серебра, модифицированной адсорбцией фелодипина из растворов в гептане разной концентрации
| С × 104, М | 0.21 | 0.53 | 1.07 | 2.13 | 3.20 | 4.26 |
| θ(Н2О), град | 67 | 77 | 80 | 83 | 84 | 85 |
| θ(СН2J2), град | 27 | 40 | 41 | 42 | 42 | 43 |
| $\sigma _{{{\text{тг}}}}^{{\text{d}}}{\text{,}}$ мДж/м2 | 39.0 | 35.1 | 35.4 | 35.6 | 35.8 | 36.5 |
| $\sigma _{{{\text{тг}}}}^{{\text{n}}}{\text{,}}$ мДж/м2 | 8.9 | 5.5 | 4.3 | 3.3 | 2.9 | 2.7 |
| σтг, мДж/м2 | 47.9 | 40.6 | 39.7 | 38.9 | 38.7 | 39.2 |
Следует отметить, что наибольшее значение σтг = 47.9 мДж/м2 наблюдалось при адсорбции фелодипина из самого разбавленного раствора, что, по-видимому, связано с низкой степенью заполнения поверхности его молекулами. Для проверки этого предположения данные по смачиваемости были проанализированы с помощью уравнения Касси–Бакстера [55]
(13)
${\text{cos}}{\kern 1pt} \theta = X{\kern 1pt} {\text{cos}}{\kern 1pt} {{\theta }_{1}} + (1--X){\text{cos}}{\kern 1pt} {{\theta }_{2}}.$Расчет с использованием значений θ = 67° (C = = 0.21 × 10–4 М), θ1 = 77° (С ≥ 0.53 × 10–4 М) и θ2 = = 65° (поверхность серебра) дал Х = 0.15. Таким образом, только при адсорбции фелодипина из самого разбавленного раствора наблюдалось низкое заполнение поверхности серебра, а во всех остальных случаях формировались предельно насыщенные моно- или бислои ЛВ.
Подчеркнем, что поверхность серебра даже без предварительного модифицирования лигандами, содержащими функциональные группы, способные связывать ЛВ, эффективно адсорбирует заметное количество фелодипина. Это открывает перспективы применения серебряных стентов – носителей этого гипотензивного ЛВ – в сосудистой хирургии.
Список литературы
Lipinski A. // Am. Pharm. Res. 2002. V. 19. P. 1894.
Yu L.X., Amidon G.L., Polli J.E., Zhao H., Mehta M.U., Conner D.P., Shah V.P., Lesko L.J., Chen M.-L., Lee V.H.L., Hussain A.S. // Pharm. Res. 2002. V. 19. P. 921.
Shidne S. // Latest Rev. 2007. V. 5. Paper no. 6.
Jabłonowska E., Bilewicz R. // Thin Solid Films. 2007. V. 515. P. 3962.
Fernandez-Botello A., Comelles F., Alsina M.A., Cea P., Reig F. // J. Phys. Chem. B. 2008. V. 112. P. 13834.
Casadó A., Giuffrida M.C., Sagristá M.L., Castelli F., Pujol M., Alsina M.A., Mora M. // Biochim. Biophys. Acta. 2016. V. 1858. P. 422.
Amidon G.L., Lennernas H., Shah V.P., Crison J.R. // Pharm. Res. 1995. V. 12. P. 413.
Vemula V.R., Lagishetty V., Lingala S. // Int. J. Pharm. Sci. Rev. Res. 2010. V. 5. P. 41.
Sharma D., Soni M., Kumar S., Gupta G. D. // Res. J. Pharm. and Tech. 2009. V. 2. P. 220.
Malmsten M. Surfactants and Polymers in Drug Delivery. New York: Marcel Dekker, 2002.
Malmsten M. // Soft Matter. 2006. V. 2. P. 760.
Rangel-Yagui C.O., Junior A.P., Tavares L.C. // J. Pharm. Pharm. Sci. 2005. V. 8. P. 147.
Задымова Н.М., Иванова Н.И. // Коллоид. журн. 2013. Т. 75. С. 179.
Patel M.R. // Latest Rev. 2007. V. 5. P. 1.
Lawrence M.J., Rees G.D. // Adv. Drug Deliv. Rev. 2000. V. 45. P. 89.
Sintov A.C., Shapiro L. // J. Control. Release. 2004. V. 95. P. 173.
Lovelyn C., Attama A.A. // J. Biomater. Nanobiotechnol. 2011. V. 2. P. 626.
Fryd M.M., Mason T.G. // Annu. Rev. Phys. Chem. 2012. V. 63. P. 493.
Аршакян Г.А., Задымова Н.М. // Коллоид. журн. 2016. Т. 78. С. 688.
Gupta A., Eral H.B., Hattona T.A., Doyle P.S. // Soft Matter. 2016. V. 12. P. 2826.
Kelmann R.G., Kuminek G., Teixeira H.F., Koester L.S. // Int. J. Pharm. 2007. V. 342. P. 231.
Ragelle H., Crauste-Manciet S., Seguin J., Brossard D., Scherman D., Arnaud P., Chabot G.G. // Int. J. Pharm. 2012. V. 427. P. 452.
Ali M.H., Kirby D.J., Mohammed A.R., Perrie Y. // J. Pharm. Pharmacol. 2010. V. 62. P. 1646.
Daneshpour N., Griffin M., Collighan R., Perrie Y. // J. Drug Target. 2011. V. 8. P. 624.
Fatouros D.G., Antimisiaris S.G. // J. Colloid Interface Sci. 2002. V. 251. P. 271.
Mohammed A.R., Weston N., Coombes A.G.A., Fitzgerald M., Perrie Y // Int. J. Pharm. 2004. V. 285. P. 23.
Uchegbu I.F., Florence A.T. // Adv. Colloid Interface Sci. 1995. V. 58. P. 1.
Devaraj G.N., Parakh S.R., Devraj R., Apte S.S., Rao B.R., Rambhau D. // J. Colloid Interface Sci. 2002. V. 251. P. 360.
Kumar G.P., Rajeshwarrao P. // Acta Pharm. Sin. B. 2011. V. 1. P. 208.
Parmar R.P., Parmar R.B. // Asian J. Pharm. Tech. 2013. V. 3. P. 52.
Moghassemi S., Hadjizadeh A. // J. Control. Release. 2014. V. 185. P. 22.
Станишевская И.Е., Стойнова А.М., Марахова А.И., Станишевский Я.М. // Разработка и регистрация лекарственных средств. 2016. Т. 14. С. 66.
Juinjun L., Weiyi S., Qiangbay L. Patent CN 103933067. Publ. 23.07.2014.
Söderlind E., Wollbradt M., von Corswant C. // Int. J. Pharm. 2003. V. 252. P. 61.
Drug Bank database − http://www.drugbank.ca/drugs/.
Ceccarellia M., Germania R., Massarib S., Petitc C., Nurissoc A., Wolfenderc J.-L., Goracci L. // Colloids Surf. B. 2015. V. 136. P. 175.
Sauerbrey G. // Z. Physik. 1959. V. 155. P. 206.
Богданова Ю.Г., Должикова В.Д., Бадун Г.А., Сумм Б.Д. // Известия АН. Серия хим. 2003. С. 2226.
Программа Tinker 8.7, доступна на https://dasher. wustl.edu/tinker/.
Кларк Т. Компьютерная химия. М.: Мир, 1990.
Каплан И.Г. Межмолекулярные взаимодействия. Физическая интерпретация, компьютерные расчеты и модельные потенциалы. 2-ое изд. М.: Бином. Лаборатория знаний, 2012.
Щукин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия. Учебник, 5-е изд. испр. М.: Высшая школа, 2007.
Дамаскин Б.Б. // Успехи коллоидной химии / Под ред. Ребиндера П.А., Фукса Г.И. М.: Наука, 1973. С. 61.
Задымова Н.М., Ямпольская Г.П. Практикум по коллоидной химии / Под ред. Куличихина В.Г. М.: Вузовский учебник: ИНФРА-М, 2012. С. 35.
Harkins W.D. The Physical Chemistry of Surface Films. New York: Reinhold, 1952.
Gaines G.L. Insoluble Monolayers at Liquid-Gas Interfaces. New York: Interscience Publishers, John Wiley & Sons, 1966.
Mishra T., Sahu R.K., Lim S.-H., Salamanca-Riba L.G., Bhattracharjee S. // Mater. Chem. Phys. 2010. V. 123. P. 540.
Wang H., Chen Sh., Li L., Jiang Sh. // Langmuir. 2005. V. 21. P. 2633.
Fowkes F.M. // J. Colloid Interface Sci. 1968. V. 28. P. 493.
Fowkes F.M. // Ind. Eng. Chem. Res. 1986. V. 60. P. 8.
Vojtechovska J., Kvitek L. // Acta Univ. Palacky. Olomouc. 2005. Chemica44. P. 25.
Carre A. // J. Adhesion Sci. Technol. 2007. V. 21. P. 961.
Wojciechowski K.F. // Surf. Sci. 1999. V. 437. P. 285.
Сумм Б.Д., Горюнов Ю.В. Физико-химические основы смачивания и растекания. М.: Химия, 1976.
Genzer J., Efimenko K. // Biofouling. 2006. V. 22. P. 339.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал