Коллоидный журнал, 2020, T. 82, № 4, стр. 416-422
Электроповерхностные свойства гидрозолей детонационного наноалмаза в зависимости от размера дисперсных частиц
А. Н. Жуков 1, *, А. В. Швидченко 2, Е. Б. Юдина 2
1 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
2 Физико-технический институт им. А.Ф. Иоффе
194021 Санкт-Петербург, Политехническая ул., 26, Россия
* E-mail: zhuk@AZ1038.spb.edu
Поступила в редакцию 04.03.2020
После доработки 10.03.2020
Принята к публикации 12.03.2020
Аннотация
Экспериментально исследованы электроповерхностные свойства фракций монодисперсных частиц гидрозолей детонационного наноалмаза (ДНА), полученных путем отжига агломератов в атмосфере воздуха, их деагломерации под действием ультразвука в деминерализованной воде и последующего центрифугирования гидрозолей. Методами кислотно-основного потенциометрического титрования и лазерного доплеровского электрофореза получены зависимости плотности поверхностного заряда и электрофоретической подвижности указанных наночастиц от pH 3.5–10.5 гидрозолей, содержащих 0.001 M KCl. Уменьшение среднего размера наночастиц ДНА приводит к росту абсолютных значений плотности отрицательного поверхностного заряда. Вычисленные высокие значения поверхностного потенциала указанных образцов ДНА являются независимыми от размера наночастиц. Абсолютные значения плотности электрокинетического заряда, которые на порядок величины меньше по сравнению с поверхностным зарядом, значительно увеличивается с уменьшением размера частиц.
ВВЕДЕНИЕ
Электроповерхностные свойства частиц детонационного наноалмаза (ДНА) в водных растворах электролитов, такие как удельный поверхностный заряд σ0 и электрокинетический потенциал ζ, в значительной степени определяют агрегативную устойчивость, коагуляцию и реологические свойства гидрозолей ДНА [1, 2]. В работе [3] получены экспериментальные зависимости σ0 и ζ монокристаллических частиц ДНА с размером 5 нм от pH 0.0001–0.01 M водных растворов KCl. Обнаружено, что с ростом pH в интервале 4.5–10.5 плотность отрицательного поверхностного заряда указанных частиц монотонно увеличивается, тогда как электрофоретическая подвижность частиц очень слабо зависит от pH и ионной силы растворов. Такое поведение, которое с позиции классической теории электроповерхностных явлений представляется аномальным, характерно для растворов полиэлектролитов [4] и гидрозолей [5, 6] в случае сильно заряженных макроионов или дисперсных частиц независимо от их размера, знака заряда и природы поверхностных функциональных групп (ПФГ). Причиной этого является связывание (электростатическая “конденсация”) противоионов с ионизированными ПФГ. Оно имеет место, если характеристическая длина Бьеррума в растворе фонового электролита λB = e2/(4πεε0kT) больше, чем b/v (здесь e – элементарный заряд, ε0 – диэлектрическая постоянная вакуума, ε – относительная диэлектрическая проницаемость раствора, k – постоянная Больцмана, T – абсолютная температура, b – расстояние между соседними ионизированными ПФГ, v – валентность противоионов).
В теории конденсации противоионов на поверхности частиц гидрозолей, разработанной Левиным с соавт. [5, 6], рассмотрены сильно заряженные монодисперсные сферические частицы с радиусом а и равномерно распределенным поверхностным зарядом, величина которого определяется зарядовым числом Z в расчете на одну частицу или соответствующей поверхностной плотностью σ0 = eZ/(4πa2). Такая частица вместе с конденсированными на ней n противоионами рассматривается как единая, обладающая неким “эффективным” поверхностным зарядом с плотностью σeff меньшей, чем плотность собственного (структурного) заряда. Отношение n/Z характеризует интенсивность процесса конденсации противоионов. Если величину σeff считать равной величине электрокинетического заряда σζ и v = 1, то n/Z = 1 − σζ/σ0.
В работе [7] представлены зависимости σ0, σζ, Z и n/Z монодисперсных частиц гидрозолей ДНА с размером 5 нм, вычисленные по экспериментальным данным, полученным в [3]. Показано, что с ростом pH в интервале 4.5–10.5 отрицательные значения σ0 монотонно увеличиваются от –3 до –15 мкКл/см2, тогда как значения σζ – от –2.7 до –3.7 мкКл/см2, а отношение n/Z возрастает до 0.75, что свидетельствует о существенном проявлении конденсации противоионов.
В литературе, как правило, молчаливо предполагается, что электроповерхностные свойства гидрозолей определяются только химической природой дисперсных частиц материала, но не зависят от их размера. Однако опубликован ряд работ [8–16], в которых исследованы электроповерхностные свойства монодисперсных наночастиц гидрозолей оксидов металлов и диоксида кремния c размерами от 1 до 50 нм: магнетита (Fe3O4) [8], анатаза (TiO2) [9–11] и кремнезема (SiO2) [12–16]. Обнаружено, что при уменьшении размеров частиц ниже 10 нм имеет место значительное увеличение плотности поверхностного заряда по сравнению с предельными значениями, наблюдаемыми для частиц с размерами более 20 нм. Такое увеличение величины σ0 объясняется повышенной эффективностью экранирования поверхностного заряда противоионами раствора (ионной конденсацией) в результате большой кривизны поверхности дисперсных наночастиц, что становится наиболее заметным при их диаметре менее 5 нм.
Целью настоящей работы является экспериментальное исследование зависимости удельного поверхностного заряда и электрокинетического заряда от размеров монодисперсных наночастиц в гидрозолях ДНА при различных значениях pH и фиксированной концентрации фонового электролита.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве исходного материала использовали промышленный ДНА производства СКТБ “Технолог” (Санкт-Петербург, Россия), который дополнительно очищали от металлических и инертных примесей [17].
Деагломерация частиц ДНА проводилась методом, описанным в [18]. Порошок ДНА подвергался отжигу на воздухе при 420°C в течение 6 ч. После этого было произведено диспергирование навески отожженного ДНА в деминерализованной воде с использованием ультразвукового облучения. После диспергирования полученный гидрозоль подвергался центрифугированию с целью осаждения остаточных агломератов. Полученный после центрифугирования гидрозоль ДНА содержал отдельные алмазные частицы размером 3–5 нм.
Для более тонкого разделения частиц ДНА по размерам проводили дополнительную серию центрифугирований. Гидрозоль деагломерированного ДНА центрифугировали (относительное ускорение 1.8 × 104g, время центрифугирования 100 мин). После этого отделяли осадок от надосадочной жидкости и разбавляли деминерализованной водой. В полученный гидрозоль объемом 20 мл с объемной долей частиц ДНА p = 0.0005 добавляли 1 M раствор фонового электролита KCl до установления концентрации соли 0.001 M в гидрозоле (образец SD-01).
Дважды повторяли процедуру центрифугирования полученной надосадочной жидкости с последующим отделением осадка. Осадок после второго центрифугирования разбавляли деминерализованной водой. В полученный гидрозоль объемом 20 мл с объемной долей частиц ДНА p = = 0.0005 добавляли 1 M раствор фонового электролита KCl до установления концентрации соли 0.001 M в гидрозоле (образец SD-02).
Полученную после трех центрифугирований надосадочную жидкость вновь подвергали центрифугированию (6 × 104g, 100 мин). Осадок после центрифугирования разбавляли деминерализованной водой. В полученный гидрозоль объемом 20 мл с объемной долей частиц ДНА p = = 0.0005 добавляли 1 M раствор фонового электролита KCl до установления концентрации соли 0.001 M (образец SD-03).
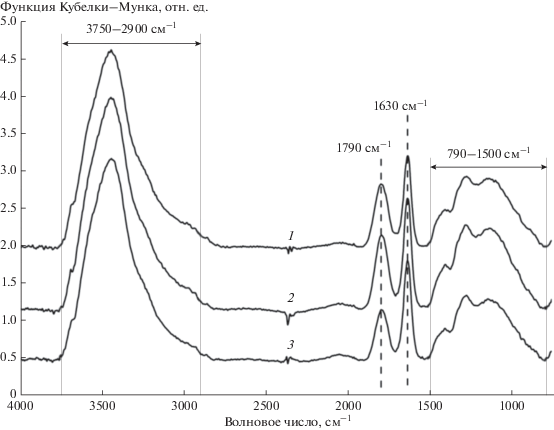
Анализ состава ПФГ частиц ДНА проводили методом ИК-спектроскопии. ИК-спектры диффузного отражения регистрировали с помощью спектрометра с фурье-преобразованием Инфралюм ФТ-08 (Люмэкс, Россия). Пробоподготовка заключалась в перемешивании в ступке 200 мг KBr и 2 мг образца. Для регистрации спектра производили 100 измерений с разрешением 4 см–1. Коррекция базовой линии производилась по методу наименьших квадратов.
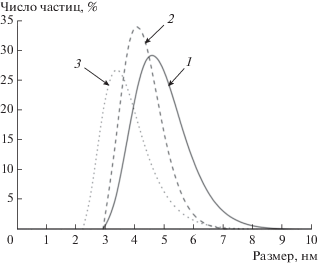
Размеры и электрофоретическую подвижность частиц в гидрозолях ДНА определяли методами динамического рассеяния света (ДРС) и лазерного доплеровского электрофореза соответственно. Измерения проводили на анализаторе Zetasizer Nano ZS (модель ZEN3600, Malvern Instruments, Англия).
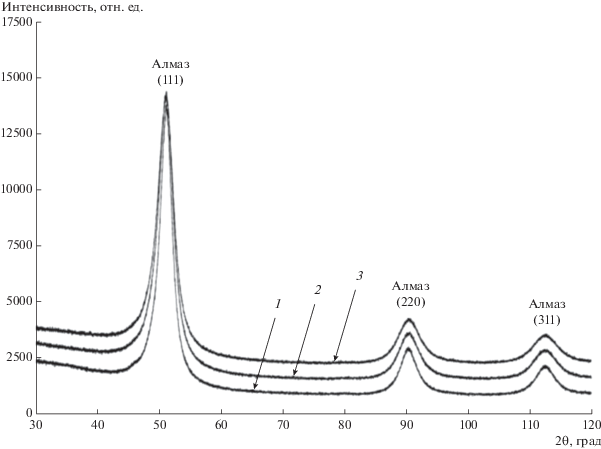
Рентгенофазовый анализ (РФА) частиц ДНА выполнен на порошковом дифрактометре Rigaku SmartLab III, оборудованном кобальтовым анодом, в геометрии Брегга–Брентано. Исследования порошков на дифрактометре проводились при следующих условиях: ускоряющее напряжение 40 кВ, сила тока 30 мА, щели Соллера 2.5°. Съемка велась в диапазоне углов 2θ = 30°–120°, шаг съемки 0.01°, скорость 1 град/мин.
Удельный поверхностный заряд частиц
Удельный поверхностный заряд частиц ДНА в водных растворах фонового электролита рассчитывали по данным кислотно-основного потенциометрического титрования, перед проведением которого гидрозоли ДНА разбавляли деминерализованной водой до получения объемной доли частиц p = 0.0005. В качестве фонового электролита использовали хлорид калия, концентрацию которого в гидрозолях ДНА с = 0.001 М, задавали добавлением соответствующих объемов 1 M водного раствора KCl.
В ячейку для титрования помещали гидрозоль ДНА объемом 20 мл с указанными значениями объемной доли частиц (p = 0.0005) и концентрации фонового электролита (с = 0.001 М), который титровали путем добавления 0.02 М растворов КОН или HCl. Измерение pH и добавление следующей порции титранта проводили каждые 2 мин. Титрование продолжали до установления постоянных значений pH при интенсивном перемешивании растворов. Для измерений pH использовали иономер И-160 (Гомельский завод измерительных приборов, Белоруссия) и H+-чувствительный комбинированный стеклянный электрод ЭСЛ-43-07. Изотермы адсорбции ионов Н+ и OH– определяли из кривых титрования по разностям объемов растворов KOH или HCl с известными титрами, добавляемых к гидрозолю и раствору KCl для достижения одинаковых значений pH. Удельный поверхностный заряд (σ0) частиц рассчитывали по формуле
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исходя из данных, полученных методом рентгеновской дифракции, были проанализированы состав и размеры частиц ДНА для всех трех образцов. Соответствующие дифрактограммы представлены на рис. 1. Все образцы ДНА являются монокристаллическими частицами алмаза, о чем свидетельствуют положения дифракционных максимумов. Анализ размеров с помощью формулы Шеррера позволил оценить размеры исследуемых кристаллитов. Полученные данные приведены в табл. 1.
Таблица 1.
Размеры частиц (d) ДНА, полученные методами РФА и ДРС, и соответствующие им значения удельной площади поверхности (s0).
| Образец | РФА | ДРС | ||
|---|---|---|---|---|
| d, нм | s0, м2/г | d, нм | s0, м2/г | |
| SD-01 | 4.4 ± 0.1 | 390 ± 13 | 4.7 ± 0.8 | 363 ± 62 |
| SD-02 | 3.6 ± 0.2 | 474 ± 20 | 4.2 ± 0.6 | 413 ± 57 |
| SD-03 | 3.3 ± 0.1 | 511 ± 18 | 3.6 ± 0.7 | 478 ± 93 |
Исходя из полученных размеров, был проведен расчет удельной площади поверхности частиц по формуле
где d – диаметр частицы, ρ – плотность алмаза (3.5 г/см3). Соответствующие значения s0 для исследуемых образцов также приведены в табл. 1.С помощью ДРС были проанализированы размеры частиц ДНА в золях (рис. 2). Средние значения гидродинамического диаметра частиц приведены в табл. 1. Во всех случаях распределения имеют справа вытянутый “хвост”, что указывает на их асимметрию. Такая особенность связана с присутствием в золях крупных частиц, размеры которых превышают средний размер частиц ДНА (см. табл. 1). Такие частицы дают существенный вклад в интенсивность рассеянного света. Вклад же в интенсивность рассеянного света от частиц, размеры которых значительно меньше, может оказаться неучтенным из-за ограниченности динамического диапазона используемого в анализаторе детектора [19]. Таким образом, в случае золей наночастиц, размеры которых меньше 10 нм, можно получить лишь достаточно грубую оценку их размера методом ДРС. Вследствие этого в дальнейших расчетах будут использоваться размеры частиц ДНА, оцененные с помощью РФА.
Анализ ИК-спектров не выявил существенных различий между исследуемыми образцами ДНА (рис. 3). Это может означать, что состав функциональных групп на поверхности не изменился в результате разделения частиц по размерам. Наличие широкой несимметричной полосы поглощения в области валентных колебаний O–H свидетельствует о наличии межмолекулярных водородных связях с участием гидроксильных групп. Пик в области 1630 см–1 отвечает деформационным колебаниям O–H. Полоса с максимумом в области 1790 см–1 соответствует характеристическому валентному колебанию карбонильной группы C=O, которая, как известно, может входить в состав лактонов, карбоксильных, сложноэфирных, кетонных и ангидридных групп. В области 1500–790 см–1 имеется набор широких полос, появление которых обусловлено колебаниями кислородсодержащих групп. Полосу в области 1390 см–1 можно отнести к валентным колебаниям C–O, а полосу в области 1267 см–1 – к деформационным колебаниям O–H, входящих в состав карбоксильных групп. Можно предположить, что валентные колебания связи C–O в составе фрагмента C–C(=O)–O, принадлежащего лактонам или сложным эфирам, проявляются в области 1114 см–1.
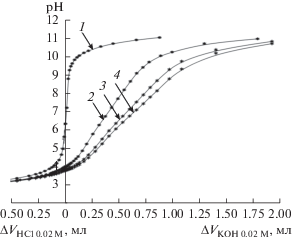
На рис. 4 представлены кривые кислотно-основного потенциометрического титрования гидрозолей ДНА с объемной долей частиц p = 0.0005 при концентрации фонового электролита с = = 0.001 М. Из графиков следует, что одно и то же значение pH в случае раствора KCl (кривая 1) и гидрозолей ДНА (кривые 2–4) достигается при разных объемах добавляемого к образцам раствора KOH. Видно, что уменьшение размеров частиц приводит к смещению кривой титрования в область бóльших объемов добавляемого титранта, необходимых для достижения одинаковых значений pH.
Рис. 4.
Кривые кислотно-основного потенциометрического титрования 0.001 М раствора KCl (1) и гидрозолей образцов ДНА SD-01 (2), SD-02 (3) и SD-03 (4) с объемной долей частиц p = 0.0005 при концентрации фонового электролита KCl 0.001 M.
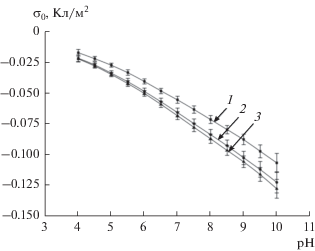
С использованием данных кислотно-основного потенциометрического титрования, были рассчитаны значения плотности поверхностного заряда частиц (рис. 5). В расчетах использовали значения удельной площади поверхности частиц из табл. 1. Представленные на рис. 5 графики свидетельствуют о том, что плотность поверхностного заряда зависит от размера частицы. Уменьшение диаметра частицы на 1 нм приводит к росту абсолютного значения плотности заряда на 20–25%.
Рис. 5.
Удельный поверхностный заряд частиц ДНА SD-01 (1), SD-02 (2) и SD-03 (3) в 0.001 M водном растворе KCl.
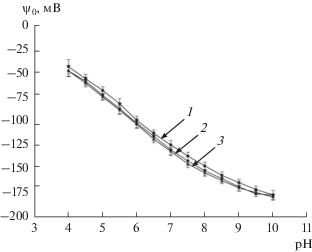
Для расчета поверхностного потенциала частиц ψ0 использовали представленное в работе [20] выражение, связывающее плотность поверхностного заряда твердых монолитных сферических частиц с величиной их поверхностного потенциала. Полученные результаты представлены на рис. 6. В отличие от удельного поверхностного заряда, значения поверхностного потенциала для всех образцов оказались близки в исследуемом диапазоне pH.
Рис. 6.
Поверхностный потенциал частиц ДНА SD-01 (1), SD-02 (2), SD-03 (3) в 0.001 M водном растворе KCl.
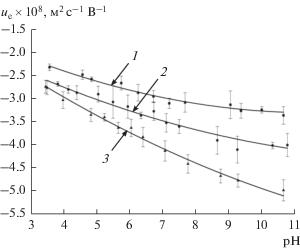
Более интересными с точки зрения влияния размеров оказались зависимости электрофоретической подвижности частиц ue от pH растворов (рис. 7). Наибольший размерный эффект наблюдается в щелочной области, где разница между подвижностями частиц SD-01 (кривая 1) и SD-03 (кривая 3) составляет 50%.
Рис. 7.
Электрофоретическая подвижность частиц ДНА SD-01 (1), SD-02 (2), SD-03 (3) в 0.001 M водном растворе KCl.
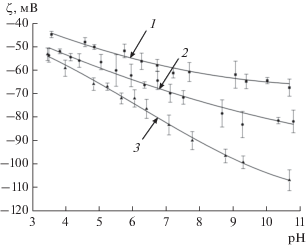
На основе полученных данных об электрофоретической подвижности частиц был произведен расчет значений их электрокинетического потенциала (рис. 8). Для этого была использована модель, предложенная Ошимой [21]. Данная модель применима в случае сферических твердых монолитных частиц при любых значениях параметра κa, где κ – обратная дебаевская длина в растворе, а – радиус сферической частицы. Несмотря на то, что значения поверхностного потенциала частиц всех трех образцов ДНА совпадают в пределах погрешности во всей исследуемой области pH (рис. 6), обнаружены существенные различия в значениях их электрокинетического потенциала (рис. 8). Наблюдается рост абсолютного значения электрокинетического потенциала частиц с уменьшением их размеров.
Рис. 8.
Электрокинетический потенциал частиц ДНА SD-01 (1), SD-02 (2), SD-03 (3) в 0.001 M водном растворе KCl.
Расчет плотности электрокинетического заряда σζ, проведенный по формуле, предложенной в работе [20], показал, что с уменьшением размеров частиц также происходит рост абсолютного значения плотности их электрокинетического заряда (рис. 9).
ЗАКЛЮЧЕНИЕ
1. Уменьшение среднего размера наночастиц ДНА приводит к росту абсолютных значений плотности отрицательного поверхностного заряда.
2. Вычисленные высокие значения поверхностного потенциала указанных образцов ДНА являются независимыми от размера наночастиц.
3. Абсолютные значения плотности электрокинетического заряда, которые на порядок величины меньше по сравнению с поверхностным зарядом, значительно увеличивается с уменьшением размера частиц.
Список литературы
Сычев Д.Ю., Жуков А.Н., Голикова Е.В., Суходолов Н.Г. // Коллоид. журн. 2017. Т. 79. С. 785.
Vul A.Ya., Eidelman E.D., Aleksenskiy A.E., Shvidchenko A.V., Dideikin A.T., Yuferev V.S., Lebedev V.T., Kul’velis Yu.V., Avdeev M.V. // Carbon. 2017. V. 114. P. 242.
Швидченко А.В., Жуков А.Н., Дидейкин А.Т., Байдакова М.В., Шестаков М.С., Шнитов В.В., Вуль A.Я. // Коллоид. журн. 2016. Т. 78. С. 218.
Manning G.S. // J. Phys. Chem. B. 2007. V. 111. P. 8554.
Levin Y., Barbosa M.C., Tamashiro M.N. // Europhys. Lett. 1998. V. 41. P. 123.
Tamashiro M.N., Levin Y., Barbosa M.C. // Physica A. 1998. V. 258. P. 341.
Швидченко А.В., Дидейкин А.Т., Жуков А.Н. // Коллоид. журн. 2017. Т. 79. С. 521.
Vayssieres L., Chaneac C., Tronc E., Jolivet J.P. // J. Colloid Interface Sci. 1998. V. 205. P. 205.
Pottier A., Cassaigon S., Chaneac C., Villan F., Tronc E., Jolivet J.P. // J. Mater. Chem. 2003. V. 13. P. 877.
Ridley M.K., Hackely V.A., Machesky M.L. // Langmuir. 2006. V. 22. P. 10972.
Grassian V.H. // J. Phys. Chem. C. 2008. V. 112. P. 18 303.
Abbas Z., Labbez C., Nordholm S., Ahlberg E. // J. Phys. Chem. C. 2008. V. 112. P. 5715.
Holmberg J.P., Ahlberg E., Bergenholtz J., Hassellov M., Abbas Z. // J. Colloid Interface Sci. 2013. V.407. P. 168.
Sonnefeld J. // J. Colloid Interface Sci. 1993. V. 155. P. 191.
Barisik M., Atalay S., Beskok A., Qian S. // J. Phys. Chem. C. 2014. V. 118. P. 1836.
Brown M.A., Duyckaers N., Redondo A.B., Jordan I., Nolting F., Kleibert A., Ammann M., Wörner H.J., van Bokhoven J.A., Abbas Z. // Langmuir. 2013. V. 29. P. 5023.
Алексенский А.Е. // Детонационные наноалмазы. Технология, структура, свойства и применение / под ред. Вуля А.Я. и Шендеровой О.А. СПб.: Изд-во ФТИ им. А.Ф. Иоффе, 2016.
Aleksenskiy A.E., Eydelman E.D., Vul’ A.Ya. // Nanosci. Nanotechnol. Lett. 2011. V. 3. P. 68.
Алексенский А.Е., Швидченко А.В., Эйдельман Е.Д. // Письма в ЖТФ. 2012. Т. 38. Вып. 23. С. 1.
Ohshima H., Healy T.W., White L.R. // J. Colloid Interface Sci. 1982. V. 90. P. 17.
Ohshima H. // J. Colloid Interface Sci. 2001. V. 239. P. 587.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал