Коллоидный журнал, 2020, T. 82, № 5, стр. 639-643
Адсорбция полилизина на поверхности плавленого кварца
И. П. Сергеева 1, В. Д. Соболев 1, *
1 Институт физической химии и электрохимии им. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, Россия
* E-mail: vsobolev@phiche.ac.ru
Поступила в редакцию 05.03.2020
После доработки 10.03.2020
Принята к публикации 11.03.2020
Аннотация
Методом капиллярной электрокинетики изучена кинетика адсорбции полилизина двух молекулярных масс из водных растворов на поверхности плавленого кварца. Установлено, что адсорбция положительно заряженного полилизина на отрицательно заряженной поверхности кварца приводит к уменьшению абсолютной величины исходного ζ-потенциала, а в случае полилизина большей молекулярной массы происходит и перезарядка поверхности. Времена установления и величины постоянных значений ζ-потенциалов зависят от молекулярной массы полилизина и его концентрации. Скорость изменения ζ-потенциала максимальна в первые минуты контакта поверхности с раствором. Впервые наблюдалось уменьшение электрической проводимости в ходе адсорбции полилизинов, что позволило предположить образование крупных агрегатов на поверхности кварца. Измерение деформируемости слоев показало, что в условиях наших экспериментов образуются плотные и недеформируемые слои. Адсорбция полилизинов на поверхности кварца является необратимой.
ВВЕДЕНИЕ
Адсорбция полипептидов на твердых поверхностях играет важную роль при получении биоматериалов. Одним из наиболее интенсивно используемых полимеров является полилизин (ПЛ), который представляет собой полимер аминокислоты лизина. Благодаря своим свойствам, в том числе гидрофильности, биосовместимости и способности к биологическому разложению, ПЛ широко используется для получения биоматериалов. Одним из таких применений является получение биосовместимых многослойных материалов, особенно, в сочетании с биосовместимыми анионными полиэлектролитами, такими как гиалуроновая кислота [1] и гепарин [2]. Такие покрытия могут как усиливать адгезию клеток, так и противостоять ей, защищая хирургические имплантаты от бактерий. Другим многообещающим применением является использование сополимера ПЛ и полиэтиленгликоля. Сополимер адсорбируется на поверхности, обеспечивая высокую степень закрепления белков и ферментов при их последующей адсорбции. Такая модификация поверхности используется при производстве сенсорных чипов для анализов и биомедицинских устройств, контактирующих с кровью [3–5]. ПЛ может быть использован для увеличения адсорбции ДНК на поверхности предварительно сформированных микропузырьков, покрытых липидом, которые применяются затем в медицине [6]. Наночастицы, покрытые сополимером ПЛ–полиэтиленгликоль–фолат, могут быть применены для направленной доставки терапевтических агентов к раковым клеткам [7].
Перспективностью использования ПЛ объясняется интерес к изучению закономерностей его адсорбции на различных поверхностях. Исследовалась адсорбция ПЛ на модифицированной поверхности золота [8], оксиде кремния [9–11], слюде [12, 13]. Большой интерес представляет исследование взаимодействия ПЛ с поверхностью липидных мембран, которые являются моделью поверхности клеток [14–17]. Адгезия мультислоев полилизина и поли-L-глутаминовой кислоты к поверхности клеток хондросаркомы в зависимости от pH раствора изучалась в работе [18]. Использование комплексов ПЛ–ДНК в генной медицине оказалось эффективным для транспортировки ДНК в клетки-мишени [19].
Несмотря на важность понимания свойств адсорбционных монослоев ПЛ, в литературе недостаточно работ по исследованию электроповерхностных свойств, которые являются определяющими для понимания механизма адсорбции на этих слоях. Электрокинетическое изучение адсорбции ПЛ на слюде проводилось в работах [12, 13]. Целью нашей работы является изучение кинетики адсорбции ПЛ разной молекулярной массы на поверхности оксида кремния и электроповерхностных свойств образующихся слоев.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методы
В работе исследовались синтетические ПЛ (Sigma-Aldrich) с разной длиной цепи: Lys-75, молекула которого состоит из 75 звеньев, и Lys-1435, содержащий 1435 звеньев. Были использованы растворы Lys-75 и Lys-1435 с концентрациями 10–4 и 10–3 г/л. Все растворы готовили на фоне раствора 10–4 М KCl. 10–1 М раствор KCl был приготовлен по фиксаналу с использованием трижды дистиллированной воды с электропроводностью 10–6 Ω–1 см–1 и pH 6.5, затем методом разведения готовились растворы KCl меньших концентраций. Растворы ПЛ получали разведением предварительно взвешенных навесок в 10–4 М растворе KCl. Затем получали растворы меньших концентраций, используя для разведения 10–4 М раствор KCl.
Приготовление всех растворов в фоновом электролите минимизирует влияние примесей, всегда присутствующих даже в трижды дистиллированной воде, так как концентрация электролита превосходит концентрации примесей примерно на два порядка.
Эксперименты проводили на установке, сконструированной в нашей лаборатории [20]. Метод основан на измерении потенциала и тока течения в тонком кварцевом капилляре радиусом 5–10 мкм. В контакте с водными растворами поверхность плавленого кварца заряжена отрицательно, плотность поверхностного заряда в нейтральной среде равна 1–2 мкКл/см2. Измерения проводили в капиллярах, для которых κr > 100 (κ – обратный дебаевский радиус, r – радиус капилляра). Электрокинетический, или ζ-потенциал рассчитывали по уравнению Гельмгольца–Смолуховского
Для экспериментов отбирали капилляры, для которых измеряемый ζ-потенциал в растворе KCl с концентрацией 10–4 М составлял 90–120 мВ и оставался неизменным при изменении давления, то есть не зависел от скорости течения раствора через капилляр.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Существующие методы исследования адсорбции не всегда позволяют произвести прямые измерения величины удельной адсорбции из-за малости самой адсорбции или вследствие невозможности корректного измерения величины адсорбирующей поверхности. В этом случае целесообразно и оправданно применение косвенных методов. Поскольку адсорбция полиэлектролитов существенно влияет на свойства поверхности, изучение изменения этих свойств в ходе адсорбции позволяет делать выводы о закономерностях, количественных характеристиках и механизмах процесса адсорбции. Наиболее чувствительными и распространенными методами косвенного исследования адсорбции являются электрокинетические.
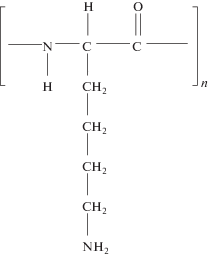
Полилизин относится к слабым полиэлектролитам. Положительный заряд его молекулы генерируется за счет протонирования аминогруппы (рис. 1) и зависит от pH раствора. Свойства растворов ПЛ интенсивно изучались в прошлом. Считается, что молекулы ПЛ полностью протонированы в кислых и нейтральных растворах и депротонируются в области pH 9–11 [9]. Адсорбция положительно заряженных молекул ПЛ на отрицательно заряженной поверхности плавленого кварца приводит к уменьшению ее заряда и, следовательно, к уменьшению измеряемого ζ-потенциала. Метод капиллярной электрокинетики позволяет изучать кинетику адсорбции катионного полиэлектролита по изменению ζ-потенциала с момента первого контакта поверхности капилляра с раствором.
Кинетика адсорбции изучалась при прокачивании через капилляр исследуемого раствора при перепаде давления 10 атм. Поскольку адсорбция была практически необратимой, измерения для каждой концентрации проводились в новом капилляре. Результаты измерений представлены на рис. 2 и 3.
Рис. 2.
Зависимости электрокинетического потенциала от времени адсорбции Lys-75 из растворов с концентрацией 10–4 (1) и 10–3 г/л (2).
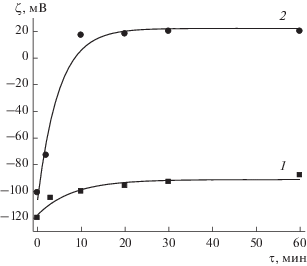
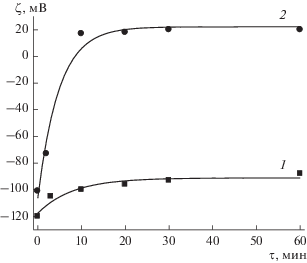
Рис. 3.
Зависимости электрокинетического потенциала от времени адсорбции Lys-1435 из растворов с концентрацией 10–4 (1) и 10–3 г/л (2).
В результате адсорбции Lys-75 из раствора с концентрацией 10–4 г/л (рис. 2, кривая 1) ζ-потенциал изменился на 22 мВ (от –110 до –89 мВ), а при концентрации 10–3 г/л (рис. 2, кривая 2) – на 62 мВ (от –100 до –38 мВ), причем в случае большей концентрации изменения происходили гораздо быстрее. При концентрации 10–3 г/л адсорбция произошла за первые 5 мин контакта поверхности кварца с раствором этого ПЛ, а при 10–4 г/л – за 30 мин. Дальнейший контакт поверхности капилляра с раствором ПЛ в течение суток не привел к существенному изменению потенциала.
Зависимость ζ-потенциала от времени адсорбции Lys-1435 из раствора с концентрацией 10–4 г/л (рис. 3, кривая 1) подобна аналогичной для Lys-75 (рис. 2, кривая 1). Адсорбция происходит медленно, изменение ζ-потенциала равно 35 мВ (от –119 до –84 мВ).
Адсорбция Lys-1435 из раствора с концентрацией 10–3 г/л (рис. 3, кривая 2) приводит к перезарядке поверхности кварцевого капилляра. Электрокинетический потенциал изменяется на 121 мВ (от –101 до +20 мВ). Перезарядка происходит в течение 10 мин с начала адсорбции, и ζ-потенциал достигает постоянного значения за 30 мин. Затем в течение двух часов потенциал не изменяется, но через сутки достигает +40 мВ. Перезарядка поверхности свидетельствует о том, что на первом этапе адсорбция происходит за счет электростатического взаимодействия молекул катионного полиэлектролита с отрицательно заряженной поверхностью, а затем – за счет гидрофобных взаимодействий и энтропийного вклада вследствие выхода противоионов с поверхности. Этот вывод подтвержден результатами теоретического рассмотрения процесса перезарядки в работах [21–23]. Увеличение ζ-потенциала через сутки может быть связано как с ростом адсорбции, так и с изменением структуры слоя ПЛ вследствие конформационных изменений.
Быструю адсорбцию на начальном этапе и последующую медленную стадию наблюдали в работе [9] при изучении адсорбции ПЛ на модифицированной поверхности золота и оксида кремния методом микробаланса кварцевого кристалла. Скорость адсорбции ПЛ на слюде, исследованной методом потенциала течения, также была максимальна в первые минуты контакта с раствором, затем адсорбция достигала постоянных значений и не изменялась в течение нескольких часов [12].
Времена установления и величины постоянных значений ζ-потенциала зависят от молекулярной массы ПЛ и концентрации его раствора. Скорость изменения ζ-потенциала возрастает с увеличением концентрации ПЛ, время установления равновесных значений при этом уменьшается. Изменения ζ-потенциала, а следовательно, величины адсорбции больше для ПЛ большей молекулярной массы.
После установления постоянных значений ζ‑потенциала были проведены измерения при различных значениях давления (от 3 до 30 атм). Такие эксперименты позволяют получить информацию о структуре адсорбционных слоев. Если слой недеформируем, то положение плоскости скольжения при различных значениях напряжения сдвига меняется мало и величина ζ-потенциала не зависит от приложенного давления. Если же слой рыхлый, увеличение скорости потока приведет или к физической деформации слоя, или к проникновению текущей жидкости глубже внутрь слоя, что вызовет изменение положения плоскости скольжения и соответственно значений электрокинетического потенциала. Деформация слоев катионных полиэлектролитов на поверхности кварца наблюдалась нами ранее [24].
Эксперименты показали, что ζ-потенциал слоев, образуемых полилизинами в условиях наших экспериментов, не зависит от величины приложенного давления. Видимо, при таких концентрациях растворов ПЛ толщина слоев невелика и молекулы адсорбируются преимущественно в плоской конформации.
Мы исследовали также десорбцию ПЛ по изменению ζ-потенциала в ходе длительной прокачки через капилляр фонового раствора под давлением 10 атм. Измерения показали, что десорбции ПЛ не происходит в течение суток такой промывки, что свидетельствует о необратимости их адсорбции. Подобное явление наблюдалось и в случае сильных полиэлектролитов [25, 26]. Интересно отметить, что в работе [12] по изучению адсорбции ПЛ на слюде на основе теоретических расчетов был сделан вывод, что слои ПЛ являются более стабильными, чем монослои других катионных полиэлектролитов. Этим объясняют перспективность их применения для иммобилизации белков и в процессах послойной адсорбции для микрокапсулирования.
Особенно интересным результатом является наблюдаемое в ряде экспериментов изменение проводимости при образовании адсорбционных слоев полилизинов (рис. 4). На рисунке приведены зависимости величины α, равной отношению измеренной проводимости раствора в капилляре к объемной, измеренной независимо.
Рис. 4.
Изменение относительной электропроводности раствора в капилляре в ходе адсорбции ПЛ: 1 – Lys-1435, c = 10–4 г/л, 2 – Lys-75, c = 10–3 г/л, 3 – Lys-1435, c = 10–3 г/л.
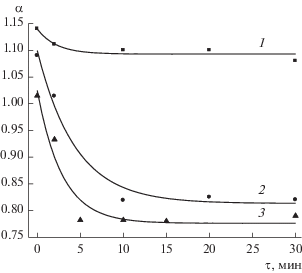
Обычно это отношение при концентрации KCl 10–4 М несколько выше единицы за счет поверхностной проводимости. Ранее в наших экспериментах по изучению адсорбции полиэлектролитов заметных изменений электропроводности не наблюдалось. В результате адсорбции Lys-75 из раствора с концентрацией 10–4 г/л электропроводность не уменьшалась. Адсорбция Lys-1435 при той же концентрации иногда приводила к небольшому падению электропроводности (рис. 4, кривая 1). При концентрации растворов 10–3 г/л для обоих поликатионов в ряде экспериментов адсорбция сопровождалась существенным уменьшением измеренной проводимости (рис. 4, кривые 2 и 3). Такое уменьшение электропроводности могло бы быть связано с уменьшением радиуса капилляра в результате образования плотных адсорбционных слоев. В этом случае можно оценить толщину адсорбционного слоя. Сопротивление капилляра можно рассчитать по формуле
где r – радиус капилляра, R1 – сопротивление капилляра, κ* – электропроводность раствора в капилляре, l – длина капилляра.Тогда сопротивление того же капилляра с адсорбционным слоем толщиной h на стенках будет равно
откудаОценки дают величину h ≈ 0.5 мкм для адсорбционного слоя Lys-75, сформировавшегося из раствора с концентрацией 10–3 г/л (рис. 4, кривая 2). В случае Lys-1435 уже через минуту после начала адсорбции возникает слой толщиной 0.11 мкм, через 30 мин устанавливается значение h ≈ 0.6 мкм (рис. 4, кривая 3).
Такие значения толщины адсорбционных слоев являются физически нереальными. Более вероятной является неравномерная адсорбция ПЛ с образованием “выступов” на поверхности, сужающих радиус капилляра. Причиной образования таких агрегатов может быть наличие атома кислорода в цепи ПЛ, который служит центром адсорбции для других молекул этого полимера. Косвенным подтверждением такого предположения являются данные работы [17] по изучению адсорбции ПЛ различной молекулярной массы на слюде методом атомно-силовой микроскопии. В этой работе отмечается наличие крупных агрегатов при относительно равномерном покрытии слюды. Высота выступов невелика (до 5 нм в случае Lys-1435), но в нашем случае при постоянном потоке раствора ПЛ над поверхностью кварца возможен рост таких агрегатов, так что это начинает сказываться на величине сопротивления капилляра.
Следует отметить, что такое уменьшение электропроводности наблюдалось не во всех экспериментах. В частности, результаты, представленные на рис. 2 и 3, получены при постоянных значениях сопротивления, что свидетельствует об образовании слоев равномерной толщины.
ЗАКЛЮЧЕНИЕ
Методом капиллярной электрокинетики изучена кинетика адсорбции полилизина двух молекулярных масс из водных растворов на поверхности плавленого кварца. Установлено, что адсорбция положительно заряженного ПЛ на отрицательно заряженной поверхности кварца приводит к уменьшению абсолютной величины исходного ζ-потенциала, а в случае ПЛ большей молекулярной массы происходит перезарядка поверхности. Времена установления и величины постоянных значений ζ-потенциала зависят от молекулярной массы ПЛ и концентрации его раствора. Скорость изменения ζ-потенциала возрастает с увеличением концентрации ПЛ, время установления равновесных значений при этом уменьшается. Изменения ζ-потенциала и, следовательно, величины адсорбции больше для ПЛ большей молекулярной массы. Скорость изменения ζ-потенциала максимальна в первые минуты контакта поверхности с раствором. Впервые наблюдалось уменьшение электрической проводимости в ходе адсорбции ПЛ, что позволило предположить образование крупных агрегатов на поверхности кварца. Измерение деформируемости адсорбционных слоев показало, что в условиях наших экспериментов образуются плотные и недеформируемые слои. Адсорбция ПЛ на поверхности кварца является необратимой.
Список литературы
Picart C., Lavalle Ph., Hubert P., Cuisinier F.J.G., Decher G., Schaaf P., Voegel J.-C. // Langmuir. 2001. V. 17. P. 7414.
Barrantes A., Wengenroth J., Arnebrant Th., Haugen H.J. // J. Colloid Interface Sci. 2017. V. 485. P. 288.
Zhen G., Eggli V., Voros J., Zamaretti P., Textor M., Glokshuber R., Kuenneman E. // Langmuir. 2004. V. 20. P. 10 464.
Huang N.-P., Michel R., Voros J., Textor M., Hofer R., Rossi A., Elbert D.L., Hubbet J. A., Spencer N. D. // Langmuir. 2001. V. 17. P. 489.
Lee S., Spencer N.D. // Langmuir. 2008. V. 24. P. 9479.
Borden M.A., Caskey Ch F., Little E., Gilliers R.J., Ferrara K.W. // Langmuir. 2007. V. 23. P. 9401.
Kim S.H., Jeong J.H., Chan K.K., Park T.G. // Langmuir. 2005. V. 21. P. 8852.
Jardan C.E., Frey B.L., Kornguth S., Corn R.M. // Langmuir. 1994. V. 10. P. 3642.
Choi J.-H., Kim S.-Oh, Linardy E., Dreaden E.C., Zdanov V.P., Hammond P.T., Cho N.-J. // J. Phys. Chem. B. 2015. V. 119. P. 10554.
Jiang M., Popa L., Maroni P., Borkovec M. // Colloids Surf. A. 2010. V. 360. P. 20.
Wu J., Liu B., Zhang H., Song B. // Meas. Sci. Technol. 2017. V. 28. P. 115103.
Morga M., Adamczyk Z., Godrich S., Ocwieja M., Papastavrou G. // J. Colloid Interface Sci. 2015. V. 456. P. 116.
Morga M., Adamczyk Z., Kosior D., Kujda-Kruk M // Langmuir. 2019. V. 35. P. 12042.
Марукович Н.И., Нестеренко А.М., Ермаков Ю.А. // Биол. мембраны. 2014. Т. 31. С. 401.
Молотковский Р.Ю., Галимзянов Т.Р., Ермаков Ю.А. // Коллоид. журн. 2019. Т. 81. С. 190.
Kostriskii A.Yu., Kondinskaia D.A., Nesterenko A.M., Gurtovenko A.A. // Langmuir. 2016. V. 33. P. 10402.
Финогеева О.А., Батищев О.В., Ингенбом А.В., Золотаревский В.И., Ермаков Ю.А. // Биол. мембраны. 2009. Т. 26. С. 429.
Richert L., Arntz Y., Shaaf P., Voegel J.-C., Picart C. // Surf. Sci. 2004. V. 570. P. 13.
Ren K., Ji J., Shen J. // Biomaterials. 2006. V. 27. P. 1152.
Churaev N.V., Sergeeva I.P., Sobolev V.D., Derjaguin B.V. // J. Colloid Interface Sci. 1981. V. 84. P. 451.
Messina R., Holm C., Kremer K. // Langmuir. 2003. V. 19. P. 4473.
Messina R. // J. Chem. Phis. 2003. V. 119. P. 8133.
Shafir A., Andellman D. // Phys. Rev. E. 2004. V. 70. 061 804.
Ermakova T.B., Sergeeva I.P., Anuchkina A.D., Sobolev V.D, Churaev N.V. // Progr. Colloid Polym. Sci. 2006. V. 132. P. 95.
Сергеева И.П., Ермаков Т.Б., Семенов Д.А., Соболев В.Д., Киселева О.А., Чураев Н.В. // Коллоид. журн. 2008. Т. 70. С. 656.
Сергеева И.П., Семенов Д.А., Соболев В.Д., Чураев Н.В. // Коллоид. журн. 2008. Т. 70. С. 663.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал