Коллоидный журнал, 2020, T. 82, № 5, стр. 548-552
Устойчивость пересыщенного состояния капсулированных растворов
Е. Е. Бибик 1, И. С. Карабанов 1, Е. В. Сивцов 1, *, И. Ю. Денисюк 2
1 Санкт-Петербургский государственный технологический институт
(технический университет)
190013 Санкт-Петербург, Московский просп., 26, Россия
2 Санкт-Петербургский национальный исследовательский университет
информационных технологий, механики и оптики
197101 Санкт-Петербург, Кронверкский просп., 49, Россия
* E-mail: pjeka@yahoo.fr
Поступила в редакцию 02.04.2020
После доработки 24.04.2020
Принята к публикации 30.04.2020
Аннотация
На примере высококонцентрированных обратных эмульсий, представляющих собой капли пересыщенного водного раствора нитрата аммония, диспергированные в индустриальном масле, показана возможность термодинамически устойчивого состояния, обусловленного ограничением объема частиц дисперсной фазы.
ВВЕДЕНИЕ
Высоконцентрированные эмульсии (объемная концентрация дисперсной фазы более 75%), обратные и прямые, являются особыми объектами коллоидной химии. Они находят широкое применение в различных областях химии и технологии.
В частности, обратные эмульсии, в которых капли концентрированного раствора нитрата аммония распределены в фазе минерального масла, являются фактически незаменимыми в составе эмульсионных взрывчатых веществ для горнодобывающей промышленности [1, 2]. Типичная рецептура таких эмульсий представляет собой следующее: нитрат аммония – 75–80%, вода – 15–20%, жидкое углеводородное топливо – 7–10%. Агрегативную устойчивость обеспечивает маслорастворимое поверхностно-активное вещество (ПАВ) – эмульгатор, который вводится в количестве 0.5–2%. Для стабилизации обратных эмульсий используют сложные эфиры ангидросорбита и высших жирных кислот (так называемые сорбитаны или спаны), производные оксазолинов, соли алкиламинов и другие ПАВ, имеющие коэффициент гидрофильно-липофильного баланса в пределах 3–6.
Наиболее эффективными эмульгаторами на сегодняшний день являются производные полиизобутилен сукцинамида (ПИБСА). Однако вопрос сохранения в течение месяцев фазового состава таких систем остается открытым: за счет чего удается избежать кристаллизации нитрата аммония в каплях после охлаждения насыщенного при 80°C раствора до комнатной температуры? Ответу на этот вопрос посвящена настоящая работа.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Вопросы фазового состояния одно- и многокомпонентных систем обычно рассматриваются вне связи с их геометрическими параметрами, за исключением объема, который является одним из основных параметров состояния газовой фазы [3, 4]. При этом значимым является не его абсолютная величина, а удельная – молярный объем. Вместе с тем, при ограничении протяженности системы даже в одном измерении (в пленках) могут изменяться численные значения основных свойств вещества, например, намагниченность насыщения [5, 6], возникать новые свойства и соответственно расширяться набор параметров, необходимых для полного описания свойств и состояния системы (толщина и расклинивающее давление пленки [7]).
Детальное термодинамическое описание систем, в которых одна из фаз является дисперсной (размер дисперсных частиц ограничен во всех трех измерениях) приведено в монографии [8]. В том числе рассмотрены условия образования конденсированной фазы в метастабильной системе малого размера (объема). На примере образования капель конденсата в пересыщенном паре показано, что пересыщение, удовлетворяющее условию образования устойчивых зародышей новой фазы в системах большого объема, оказывается недостаточным для систем малого объема. Причина в том, что в ограниченном объеме закрытой системы переход части газовой фазы в конденсированное состояние способен понизить остаточное давление пара до величины pr, большей или меньшей упругости пара ps зародыша конденсированной фазы во всем диапазоне размеров зародыша. В первом случае зародыш будет увеличиваться в размере до выравнивания остаточного давления и упругости пара равновесного зародыша. Во втором случае зародыш полностью испарится, и пересыщенное гомогенное состояние газовой фазы станет термодинамически устойчивым.
Возможность реализации и первого и второго варианта изменения фазового состояния метастабильной системы обоснована [8] разным видом зависимостей pr(a) и ps(a) от размера зародыша a – графики этих функций выгнуты в противоположных направлениях относительно оси абсцисс. Основным параметром начального неустойчивого состояния гомогенной системы является пересыщение пара или раствора соответственно. В некотором диапазоне пересыщений графики имеют две точки пересечения и очерчивают замкнутую область значений размера частиц и остаточного давления, при которых фазовое состояние системы стабилизируется с образованием частиц конденсированной фазы устойчивого размера. В системе неограниченного объема отсутствуют факторы, препятствующие неограниченному росту размеров частиц. Количественные оценки не приводятся. Возможно, что это не актуально применительно к практике получения частиц требуемого размера – эта задача успешно решается эмпирически [9].
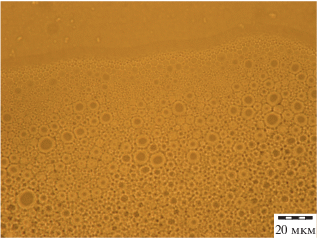
Более актуальна задача определения условий, при которых можно доступными средствами сохранить устойчивость однофазного пересыщенного состояния системы. Практически такое состояние реализовано в водных растворах нитрата аммония [10]: раствор NH4NO3, насыщенный и эмульгированный в неполярном растворителе при 80°C (растворимость 600 мас. ч. NH4NO3 на 100 мас. ч. воды [11]), остается в жидком состоянии после охлаждения эмульсии до нормальной температуры (20°C, растворимость 200 мас. ч. NH4NO3 на 100 мас. ч. воды). Размер капель эмульсии оценивается величиной порядка микрометра (рис. 1). При разрушении эмульсии (слиянии капель) раствор кристаллизуется.
Элементарные соображения дают формулу (1) для остаточной концентрации раствора Mr после образования частицы новой фазы радиусом a в капсуле размером A. Она отличается от приведенной в работе [8] отсутствием в ней неопределенных параметров и формой представления состава системы. В ней в неявном виде фигурирует размер капсулы A, содержащей пересыщенный раствор. В данном случае размер является основным параметром, определяющим начальное состояние системы.
(1)
${{M}_{{\text{r}}}} = {{({{M}_{{\text{x}}}}--\varphi \rho )} \mathord{\left/ {\vphantom {{({{M}_{{\text{x}}}}--\varphi \rho )} {(1--\varphi ).}}} \right. \kern-0em} {(1--\varphi ).}}$(2)
${{C}_{{\text{r}}}} = {{({{C}_{{\text{x}}}}--\varphi )} \mathord{\left/ {\vphantom {{({{C}_{{\text{x}}}}--\varphi )} {(1--\varphi ).}}} \right. \kern-0em} {(1--\varphi ).}}$(3)
${{C}_{{\text{s}}}} = {{C}_{{{\text{st}}}}}{\text{exp}}(2\sigma {{{{V}_{{\text{m}}}}} \mathord{\left/ {\vphantom {{{{V}_{{\text{m}}}}} {aRT}}} \right. \kern-0em} {aRT}}).$Здесь Cs – равновесная с частицами заданного размера a концентрация насыщенного раствора (их растворимость), Cst – справочная растворимость вещества твердой фазы [11], σ – межфазное натяжение на границе твердой фазы с ее насыщенным раствором, Vm = m/ρ – молярный объем и m – молярная масса вещества конденсированной фазы.
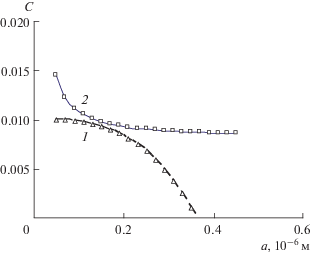
На рис. 2 и 3 представлены в графической форме зависимости остаточной концентрации раствора Cr и растворимости Cs частиц новой фазы от размера a частиц, найденные по формулам (2) и (3) при размерах капсулы, близких к размеру капель эмульсии (порядка 10–6 м).
Рис. 2.
Зависимости остаточной концентрации Cr раствора (1) и растворимости Cs частиц (2) от их размера a в капсуле размером A = 1.94 мкм.
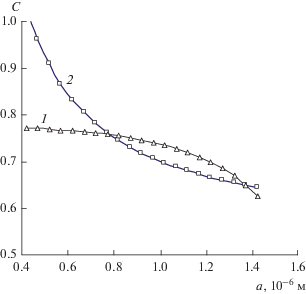
Рис. 3.
Зависимости остаточной концентрации Cr раствора (1) и растворимости Cs частиц (2) от их размера a в капсуле размером A = 1.44 мкм.
Условие образования жизнеспособного зародыша новой фазы очевидно: после его образования раствор должен оставаться пересыщенным, т.е. его остаточная концентрация Cr должна быть больше, чем растворимость зародыша Cs. На графиках рис. 2 в диапазоне размеров зародыша от 0.77 до 1.37 мкм это условие выполняется. При появлении зародыша минимального размера из указанного диапазона он увеличится до максимального – равновесного размера, при котором растворимость и остаточная концентрация равны (нижний правый угол линзообразной области, между двумя кривыми).
При меньшем размере A капсулы с тем же исходным раствором (рис. 3) содержание соли в капсуле меньше, и потому образование зародышей того же размера, что и в первом случае, сильнее обедняет раствор и его концентрация оказывается меньше, чем требуется для сохранения зародышей любого размера. В итоге новая фаза не может образоваться, и пересыщенное состояние раствора будет устойчивым.
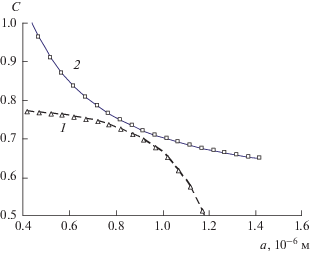
При заданном пересыщении исходного раствора (Cx = 0.63) и растворимости соли (Cs = 0.53 при 20°C) задача заключается в том, чтобы найти величину межфазного натяжения σ и соответствующее ей значение капиллярной постоянной 2σVm/RT формулы Кельвина, позволяющее реализовать оба варианта равновесного фазового состояния системы путем подбора двух разных размеров A капсулы с пересыщенным раствором. Результаты показаны на рис. 2 и 3. Они могут быть реализованы при значении 2σVm/RT = 0.28 × 10–6 м, т.е. межфазном натяжении σ = 7.6 Дж/м2, что выходит за рамки возможных физических значений. При уменьшении межфазного натяжения до правдоподобного для твердых веществ значения 0.8 Дж/м2 оба варианта равновесного состояния раствора становятся возможными при размере капсул 0.8 и 0.52 мкм соответственно (рис. 4 и 5). Размер устойчивых зародышей новой фазы уменьшается при этом до 0.41 мкм, а размер минимальных зародышей – до 0.17 мкм. В пределах этого интервала находится и размер частиц ac = = 0.21 мкм, при котором оба графика на рис. 5 соприкасаются в одной точке, т.е. максимальный и минимальный размеры совпадают. На диаграммах pV фазового состояния простых макросистем этому состоянию соответствует критическая точка – максимум спинодали [8] или точка минимакса на графике зависимости свободной энергии образования частиц ΔF от их размера [4]. Если за исходное состояние принять то, что соответствует графикам на рис. 5, то значение aс = 0.21 мкм достигается при увеличении размера капель раствора от 0.52 до 0.57 мкм или увеличении пересыщения от 0.63 до 0.637 или при уменьшении поверхностного натяжения от 0.8 до 0.74 Дж/м2.
Рис. 4.
Зависимости остаточной концентрации Cr раствора (1) и растворимости Cs частиц (2) от их размера a в капсуле размером A = 0.8 мкм при межфазном натяжении σ = 0.8 Дж/м2.
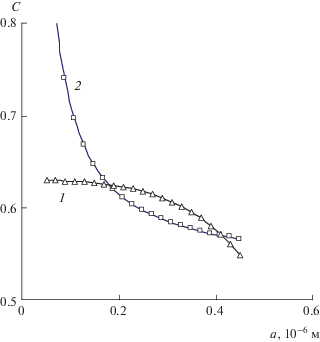
Рис. 5.
Зависимости остаточной концентрации Cr раствора (1) и растворимости Cs частиц (2) от их размера a в капсуле размером A = 0.52 мкм при межфазном натяжении σ = 0.8 Дж/м2.
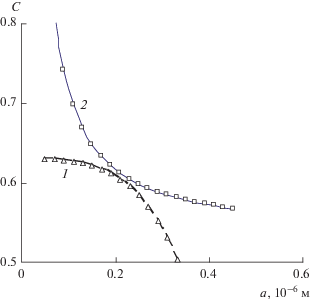
Увеличение числа зародышей твердой фазы действует так же, как уменьшение размера капли. Увеличение в капле размером 0.8 мкм числа зародышей в (0.8/0.52)3 раз вызывает переход к состоянию, соответствующему размеру капель 0.52 мкм. На микрофотографии (рис. 1) капли эмульсии выглядят непрозрачными, что указывает на присутствие в них множества мелких частиц твердой фазы. При этом, судя по сферической форме капель, сохраняется их высокая текучесть.
Экспериментальные данные по межфазному натяжению ограниченно растворимых жидкостей (правило Траубе [12]) показывают, что оно увеличивается с уменьшением взаимной растворимости жидкостей. Можно полагать, что такая же закономерность сохраняется и в насыщенных растворах твердых веществ. В таком случае найденное выше в численном эксперименте значение σ = 0.8 Дж/м2 в большей мере подходит для плохо растворимых веществ. Его неизменность при уменьшении растворимости почти на два порядка (Cx = 0.01 и Cs = 0.008) показывает, что и при малой растворимости сохраняется характерный вид функций Cr(a) и Cs(a) и возможность реализации устойчивых однофазного и двухфазного состояний пересыщенных растворов. Размер капсул при этом может быть увеличен почти до 2 мкм, размер устойчивых зародышей уменьшается до 0.15 мкм (рис. 6), что находится в пределах применимости [12] формулы Кельвина.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все реактивы для приготовления обратной эмульсии представляли собой промышленные образцы, применяемые для производства эмульсионных взрывчатых веществ. Использовали (без предварительной подготовки) нитрат аммония NH4NO3 (марка А, содержание нитрата аммония – не менее 98%) и в качестве углеводородной фазы индустриальное масло марки И-20А (ГОСТ 20 799-88). Эмульгатором служило производное ПИБСА. Состав готовой эмульсии согласно рецептуре (мас. %): нитрат аммония – 75, дистиллированная вода – 18, масло И-20А – 5, ПИБСА – 2%.
Приготовление эмульсии проходило в два этапа. Сначала в конической колбе объемом 400 мл готовился концентрированный раствор окислителя путем растворения нитрата аммония в дистиллированной воде при нагревании до 80°C. В стакане из нержавеющей стали емкостью 400 мл, снабженном механическим миксером, готовилась смесь индустриального масла с эмульгатором и нагревалась до 50°C.
Далее, после полного растворения нитрата аммония, готовили обратную эмульсию. В стакан с маслорастворимой топливной фазой при постоянно работающем миксере (скорость вращения мешалки – около 1200 об./мин) медленно добавляли горячий раствор окислителя. После полного смешения компонентов эмульсию перемешивали в течение 30 с для получения необходимой дисперсности.
Оптическая микроскопия была реализована с использованием многофункционального микроскопа Olympus STM6 имеющего приставки поляризационного и интерференционного контраста. В данной работе использован поляризационный контраст в связи с тем, что поверхность микрокапель эмульсии образована ориентированными молекулами и, следовательно, поляризует проходящий свет, что повышает контраст изображения. Наблюдения проводилось в отраженном свете с объективом апертурой = 0.8.
ВЫВОДЫ
Оценка величины размерных эффектов, вызываемых ограничением объема раствора, показала возможность перехода пересыщенного раствора в термодинамически устойчивое или долгоживущее квазиравновесное состояние при вполне разумных для практической реализации условиях.
Способ заключения растворов в ограниченный объем не имеет значения, поэтому стабилизация пересыщенного состояния возможна в закрытых порах различных веществ, например, в клетках растительных и животных тканей. Данный эффект может иметь отношение к морозостойкости растений, некоторых живых организмов и искусственных материалов.
Список литературы
Соснин В.А., Межерицкий С.Э. // Вестник технологического университета. 2016. Т. 19. № 19. С. 84.
Xu Z.X., Wang Q., Fu X.Q. // J. Hazard. Mater. 2015. V. 300. P. 702.
Ulbricht H., Schmelzer J., Mahnke R., Schweitzer F. Thermodynamics of Finite Systems and the Kinetics of First-Order Phase Transitions. Leipzig: Teubner, 1988.
Schmelzer J., Ulbricht H. // J. Colloid Interface Sci. 1987. V. 117. P. 325.
Andrä W., Schüppel W., Vogler G., Frait Z., Kamberský V., Málek Z., Šuda P., Rösler U., Valent L. // Phys. Status Solidi. 1962. V. 2. P. 99.
Andrä W., Frait Z., Kamberský V., Málek Z., Rösler U., Schüppel W., Šuda P., Valenta L., Vogler G. // Phys. Status Solidi. 1963. V. 3. P. 3.
Дерягин Б.В., Чураев Н.В., Муллер В.М. Поверхностные силы. М.: Наука, 1985.
Русанов А.И. Фазовые равновесия и поверхностные явления. Л.: Химия, 1967.
Практикум по коллоидной химии. / Под ред. Лаврова И.С. М.: Высшая школа, 1983.
Mahadevan E.G. Ammonium Nitrate Explosives for Civil Applications: Slurries, Emulsions and Ammonium Nitrate Fuel Oils. Weinheim: Wiley-VCH, 2013.
Справочник химика: Т. 2. / Под ред. Никольского Б.Н., Рабиновича В.А. М.: Химия, 1964.
Фридрихсберг Д.А. Курс коллоидной химии. Л.: Химия, 1984.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал