Коллоидный журнал, 2020, T. 82, № 5, стр. 523-547
Мезопористые частицы-контейнеры из кремнезема: новые подходы и новые возможности
О. В. Дементьева *
Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, Россия
* E-mail: dema_ol@mail.ru
Поступила в редакцию 23.04.2020
После доработки 30.04.2020
Принята к публикации 06.05.2020
Аннотация
В обзоре проанализированы основные направления исследований, посвященных капсулированию различных функциональных соединений (от лекарственных препаратов до ингибиторов коррозии) с помощью мезопористых частиц-контейнеров (МЧК) из кремнезема. Главное внимание уделено обсуждению новых подходов к созданию таких структур. В первую очередь, − подходов, позволяющих совмещать стадии синтеза МЧК и их загрузки одним или несколькими целевыми веществами. С использованием имеющихся в литературе данных продемонстрированы преимущества таких одностадийных подходов и их перспективность применительно к решению задач, связанных с обеспечением высокой емкости МЧК по капсулируемому веществу и управлением скоростью их разгрузки.
1. ВВЕДЕНИЕ
Задачи, связанные с капсулированием различных функциональных соединений (прежде всего, нерастворимых или ограниченно растворимых в воде), а также с обеспечением их контролируемого высвобождения в ту или иную окружающую среду, весьма актуальны с точки зрения целого ряда практических приложений – от биомедицины до создания защитных покрытий [1–3].
Одним из наиболее перспективных способов решения этих задач является использование в качестве контейнеров частиц кремнезема или органокремнезема. Такие частицы характеризуются низкой токсичностью, а наличие на их поверхности реакционноспособных гидроксильных групп открывает возможность прививки различных молекул (в том числе биологически активных). Кроме того, в процессе золь−гель синтеза в кремнеземную матрицу могут быть включены те или иные активные компоненты (молекулы красителей, квантовые точки, наночастицы металлов и др.), что позволяет говорить о создании многофункциональных структур, представляющих интерес для тераностики опасных заболеваний [4, 5].
Загрузка целевых соединений (ЦС) в кремнеземные частицы-контейнеры может быть осуществлена как в процессе их синтеза, так и post factum. В первом случае для этого применяют подходы, основанные на встраивании ЦС в кремнеземную матрицу за счет их физического “захвата” [6, 7] или участия в химической реакции [8, 9], а также на синтезе SiO2 в эмульсиях или микроэмульсиях [1, 10]. Во втором случае ЦС загружают в мезопористые частицы-контейнеры (МЧК), получаемые на темплатах из мицелл поверхностно-активных веществ (ПАВ) [2, 4, 5, 11–15].
Последний из перечисленных подходов, заслуживает, на наш взгляд, наибольшего внимания, поскольку помимо достоинств, присущих всем SiO2-контейнерам, МЧК обладают еще рядом ценных качеств. Это, во-первых, наличие упорядоченной системы пор с очень узким распределением по размеру и большая удельная поверхность. Диаметр пор можно варьировать в достаточно широких пределах, что позволяет использовать МЧК для доставки различных ЦС (в том числе, с высокой молекулярной массой). При этом существует возможность регулирования процессов сорбции и десорбции загружаемого вещества за счет модификации внутренней и/или внешней поверхности частиц.
Кроме того, в самое последнее время стали появляться работы, свидетельствующие об адъювантных свойствах МЧК [16–18], а также об их способности выступать в качестве своеобразных сенсибилизаторов при ультразвуковой диагностике и терапии опухолей [12, 19–21]. Все это открывает дополнительные возможности для биомедицинского применения таких частиц.
Следует подчеркнуть, что, несмотря на стремительный рост числа публикаций, посвященных синтезу и практическому применению МЧК и более сложных композитных структур на их основе (вот, например, только несколько обзоров и монографий, появившихся за последние 5 лет [2, 4, 5, 9, 11–15, 18, 21, 22]), существует целый ряд принципиально важных проблем, которые до сих пор далеки от своего решения. В первую очередь к ним относятся проблемы, связанные с обеспечением высокого содержания ЦС в частицах-контейнерах, управлением скоростью их разгрузки и регулированием биораспределения и биосовместимости МЧК, а также с возможностью реализации результатов лабораторных исследований на практике.
В данном обзоре будет проведен анализ работ, посвященных решению этих проблем. При этом основное внимание мы уделим обсуждению новых подходов к созданию МЧК. Сразу оговоримся, что речь, как правило, пойдет о кремнеземных МЧК, полученных с использованием в качестве прекурсоров тетраалкоксисиланов; рассмотрению указанных вопросов применительно к органокремнеземным МЧК посвящен появившийся недавно обзор [8] (см. также [9, 15]).
Для получения достаточно полной картины, прежде всего, обратимся к классическим представлениям о закономерностях формирования МЧК.
2. ОБЩИЕ ПРЕДСТАВЛЕНИЯ О ТЕМПЛАТНОМ СИНТЕЗЕ МЧК
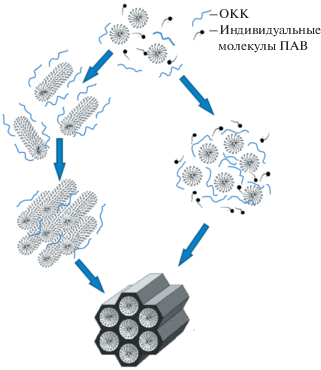
Анализ литературы свидетельствует о том, что темплатный золь−гель синтез является основным способом получения мезопористых материалов различной природы (в том числе, кремнезема) [23, 24]. Он заключается в гидролитической поликонденсации прекурсора (например, тетраэтоксисилана, ТЭОС) в водных или водно-спиртовых растворах ПАВ. При этом взаимодействие олигомеров кремниевой кислоты (ОКК) с ассоциатами ПАВ приводит к формированию упорядоченной мезофазы. Характер этого взаимодействия определяется природой ПАВ. В случае ионогенных ПАВ имеет место электростатическое взаимодействие поверхностно-активных ионов темплата с ОКК, которое может происходить как напрямую, так и за счет введения в систему дополнительных соединений (например, аминосиланов), тогда как для неионогенных ПАВ характерно образование водородных связей [23–26].
В качестве темплатов могут выступать как жидкокристаллические структуры, формируемые молекулами ПАВ в их концентрированных растворах (так называемое жидкокристаллическое темплатирование), так и мицеллы ПАВ [23–25, 27]. При получении блочных материалов, которое подразумевает использование концентрированных растворов ПАВ (10−20 мас. % и более) обычно реализуется первая ситуация.
В то же время синтез МЧК, как правило, проводят в мицеллярных растворах ПАВ11, имеющих значительно более низкую концентрацию. В таких условиях упорядоченная мезофаза, схожая с наблюдаемой в жидких кристаллах, формируется в процессе золь−гель синтеза по механизму кооперативной самосборки, обусловленной взаимодействием ОКК с мицеллами и индивидуальными ионами/молекулами ПАВ. Учитывая имеющиеся в литературе данные, можно предположить, что характер такой самосборки (и соответственно структура и размер частиц) сильно зависит от природы ПАВ, концентрации и соотношения компонентов реакционной системы, наличия тех или иных добавок и других параметров (см., например, [21, 25, 26, 30–36]). Очевидно, именно поэтому результаты работ, направленных на изучение особенностей этого процесса, достаточно противоречивы (рис. 1). Так, по мнению ряда авторов [30, 31, 35] упорядоченная мезофаза образуется уже на начальной стадии синтеза частиц в результате превращения сферических мицелл в цилиндрические и самоорганизации последних. Однако существует и альтернативная точка зрения, согласно которой это происходит в результате фазового разделения в изначально неупорядоченном “композите” SiO2/ПАВ, т.е. ближе к концу процесса [30, 31, 36].
На рис. 2 представлены полученные в просвечивающем электронном микроскопе типичные изображения МЧК, синтезированных темплатным золь−гель методом. Видно, что он открывает широкие возможности с точки зрения регулирования размера, формы и пористой структуры МЧК за счет варьирования природы и концентрации ПАВ, введения в систему органических или неорганических добавок, регулирования скорости гидролитической конденсации прекурсора и т.д. Детальное обсуждение всех этих приемов выходит за рамки данного обзора22. Отметим, что регулировать размер пор МЧК можно и по окончании их синтеза [42–45]. Так, согласно данным [42–44] гидротермальная обработка мезопористого кремнезема в щелочной среде (в том числе в присутствии неорганических солей) приводит к значительному увеличению диаметра пор. В то же время совсем недавно было показано, что увеличение диаметра пор может происходить и в результате эрозии МЧК в водной среде [45]. По мнению авторов, этот эффект представляет существенный интерес с точки зрения доставки с помощью МЧК белковых молекул (например, цитохрома 2).
3. СУЩЕСТВУЮЩИЕ СТРАТЕГИИ ЗАГРУЗКИ И КОНТРОЛИРУЕМОГО ВЫСВОБОЖДЕНИЯ ЦС
3.1. Классическая схема
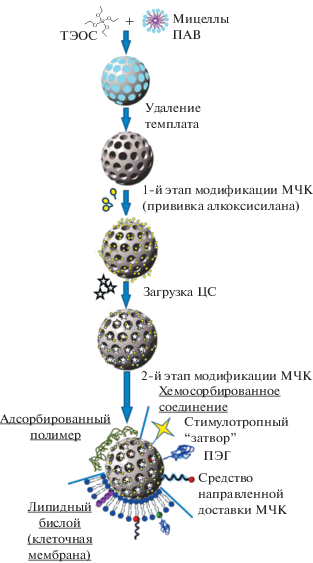
Традиционный синтез МЧК подразумевает использование инертных (т.е. не несущих никакой дополнительной функции, кроме структурообразующей) ПАВ, которые по окончании золь−гель процесса удаляют химическим или термическим способом. Получаемые в результате частицы характеризуются развитой упорядоченной системой пор, диаметр которых определяется размером мицелл ПАВ, и высокой (до 1000 м2/г) удельной поверхностью.
Главные проблемы с точки зрения практического использования таких “исходных” МЧК − низкое сродство SiO2-матрицы к большинству загружаемых ЦС (в первую очередь, гидрофобных) и очень быстрое (“взрывное”) их высвобождение, при котором основная часть содержимого МЧК выходит в окружающую среду за очень короткое время33. Решить эти проблемы призвана модификация внутренней и/или внешней поверхности МЧК (см. схему, приведенную на рис. 3). Кроме того, эта процедура позволяет обеспечить не только совместимость МЧК с той или иной средой (в том числе, биологической), но и их направленную доставку.
Следует подчеркнуть, что львиная доля работ, посвященных модификации МЧК, выполнена с целью их использования в качестве контейнеров для лекарственных препаратов (см., например, [11–21, 33, 34, 46–48]). В самое последнее время стали также появляться публикации, в которых эта проблема рассматривается применительно к капсулированию ингибиторов коррозии и созданию защитных покрытий [22, 49–51], однако их количество пока относительно невелико.
На сегодняшний день существуют три группы подходов к модификации МЧК (рис. 3), основанные на химическом или физическом взаимодействии, а также на использовании клеточных (биомиметических) технологий (в том числе, создании протоклеток).
3.1.1. Модификация МЧК за счет химических взаимодействий. Такая модификация включает подходы, основанные на использовании функционализованных алкоксисиланов, прививка которых на внутреннюю или внешнюю поверхность МЧК происходит за счет образования связей Si−O−Si. Это – исторически наиболее развитое направление, в рамках которого могут быть в той или иной степени решены все задачи, связанные с загрузкой, доставкой (в том числе, направленной) и разгрузкой ЦС (табл. 1).
Таблица 1.
Основные задачи, решаемые путем модификации МЧК
| Основные решаемые задачи | Способ модификации МЧК | ||
|---|---|---|---|
| за счет химических взаимодействий | адсорбция полимеров |
клеточные технологии |
|
| Увеличение содержания ЦС | + | − | − |
| Обеспечение контролируемой разгрузки МЧК | + | + | + |
| Предотвращение агрегирования МЧК (в том числе, в кровотоке) | + | + | + |
| Защита от опсонизации и фагоцитоза | + | + | + |
| Уменьшение гемолитического действия МЧК | + | + | + |
| Обеспечение активной адресной доставки МЧК | + | − | + |
| Обеспечение клеточной интернализации | + | + | + |
| Регулирование гидролитической стабильности МЧК | + | + | + |
Модификацию МЧК можно проводить как на стадии их синтеза, вводя алкоксисилан непосредственно в реакционную систему, так и после завершения этого процесса [23].
В первом случае имеет место соконденсация гидролизованных молекул прекурсора и модификатора, что приводит к достаточно равномерному встраиванию последнего в SiO2-матрицу [23]. Следует, однако, учитывать, что такие добавки сильно снижают степень упорядоченности пористой структуры частиц. Другими недостатками этой схемы являются относительно невысокая поверхностная плотность привитых функциональных групп, а также риск их химической трансформации и/или отщепления в процессе синтеза МЧК или при удалении темплата. Очевидно, именно поэтому область ее применения ограничивается, в основном, задачами, связанными с регулированием химии поверхности МЧК с использованием недорогих соединений (например, γ-аминопропил- или γ-меркаптопропилтриалкоксисилана).
В подавляющем большинстве случаев хемосорбцию модификатора на МЧК проводят уже после удаления из них темплатирующего ПАВ, а иногда и после загрузки ЦС (см., например, работы [21, 22, 34, 49, 50] и приведенные в них ссылки). Главная проблема при этом − затрудненная диффузия молекул модификатора в порах МЧК. Как следствие, их прививка происходит преимущественно на внешней поверхности МЧК и в устьях пор. В этой ситуации нельзя исключить некоторой закупорки пор, что может отрицательным образом сказаться на величине сорбции ЦС. В пользу этого предположения свидетельствуют, в частности, данные работы [49], посвященной созданию самозалечивающихся защитных покрытий на основе МЧК, содержащих ингибитор коррозии. Показано, что в ходе модификации МЧК может наблюдаться существенное уменьшение как диаметра, так и объема пор.
Анализируя влияние модификации МЧК на величину загрузки в них тех или иных ЦС, отметим, что одними из первых возможность регулирования емкости мезопористых кремнеземных материалов за счет прививки на их поверхность тех или иных функциональных органосиланов продемонстрировали Валлет-Реги с соавторами. Полученные ими результаты суммированы в обзоре [48]. Показано, в частности, что наличие специфических взаимодействий между функциональными группами на поверхности МЧК и загружаемым ЦС способствует увеличению сорбции последнего. Так, например, образование ионных связей между карбоксильной группой в молекуле ибупрофена и привитой NH2-группой позволяет загрузить до 33 мас. % этого препарата. Одновременно наблюдается и изменение режима его выхода в окружающую среду: десорбция ибупрофена из аминированных МЧК происходит в диффузионно-контролируемом режиме, тогда как для немодифицированных частиц характерен уже упомянутый “взрывной” механизм. По мнению авторов [48], модификация МЧК гидрофобными органосиланами (например, октадецилтриметоксисиланом) тоже приводит к изменению режима десорбции капсулированного ЦС вследствие ухудшения смачиваемости поверхности пор.
Дальнейшие эксперименты этой и других групп исследователей свидетельствуют о том, что сделанные в [48] выводы справедливы применительно к широкому кругу соединений, включая ингибиторы коррозии [49, 50]. Следует, однако, подчеркнуть, что даже в самой благоприятной ситуации содержание загруженного ЦС, как правило, не превышает 30−40 мас. %. (В то же время, согласно результатам нашей работы [52], посвященной изучению возможностей использования МЧК в качестве контейнеров для фталоцианиновых фотосенсибилизаторов, аналогичные величины загрузки могут быть достигнуты и при использовании немодифицированных частиц).
Модификацию внешней поверхности частиц обычно проводят в несколько этапов. При этом зачастую сначала прививают алкоксисилан с той или иной реакционноспособной группой, а уж затем – одно или несколько функциональных соединений, позволяющих регулировать свойства МЧК.
Использование с этой целью так называемых стимулотропных соединений (в том числе полимерных), а также их конъюгатов с наночастицами разной природы (металлическими, оксидными, полупроводниковыми и др.) открывает дополнительные возможности с точки зрения управления десорбцией ЦС, позволяя обеспечить контролируемое “вскрытие” частиц-контейнеров [47, 53–56]. Это может происходить за счет изменений состава окружающей МЧК среды (например, ее pH или энзиматического статуса), а также в результате того или иного внешнего воздействия (ИК-излучения, ультразвука, магнитного поля и др.). Анализ литературных данных свидетельствует о том, что наибольший интерес такие “умные” МЧК представляют с точки зрения решения биомедицинских задач (см. обзоры [15, 21, 46, 53–56]). При этом подавляющее большинство работ посвящено вопросам направленной доставки противораковых препаратов (таксола, цисплатина, доксорубицина и др.), локальное высвобождение которых может существенно повысить результативность их действия и снизить риск возникновения побочных эффектов.
В то же время очевидно, что эта проблема становится все более актуальной и применительно к капсулированию ингибиторов коррозии и созданию самозалечивающихся защитных покрытий [3, 22, 51, 57–60]. Показано, например [3, 58], что модификация МЧК соединениями, чувствительными к pH среды, позволяет управлять выходом капсулированного в них ингибитора и препятствовать его вымыванию из состава покрытия, что существенно увеличивает срок службы последнего.
На наш взгляд, наиболее перспективными с практической точки зрения являются именно подходы, направленные на создание МЧК, чувствительных к pH среды. Это обусловлено широкой областью применения таких структур, большим набором соединений, способных реагировать на изменение pH, их доступностью и относительной дешевизной, а также обилием путей, позволяющих обеспечить “вскрытие” пор МЧК [3, 46, 54–56]. В кислых средах такое вскрытие может, в частности, происходить в результате гидролиза тех или иных связей (ацетальных, иминных и др.), изменения степени набухания или конформации молекул соединения, блокирующего поры, а также за счет его растворения. Последний эффект имеет место при использовании в качестве “затвора” наночастиц оксидов некоторых металлов или двойных слоистых гидроксидов [46].
Использование МЧК, чувствительных к изменению pH, позволяет решать и проблему управляемого высвобождения лекарственных препаратов при их пероральном или внутривенном введении. Так, известно, что значение pH в здоровых тканях человеческого организма составляет 6.8−7.2, тогда как в опухолях или местах воспалений оно уменьшается вплоть до 5.5 [61] (еще более низкие значения pH регистрируются в лизосомах44 [55]). В желудочно-кишечном тракте значения pH варьируются в более широких пределах: для желудка характерна кислая среда с pH 1.5−2, тогда как для кишечника – слабощелочная (pH 7.2−9). Как свидетельствуют результаты экспериментов (см., например, [54, 55]), попадание МЧК в область с соответствующим значением pH приводит к разрушению затвора, блокирующего поры, и высвобождению содержимого контейнера. При этом дополнительный эффект может оказывать ослабление взаимодействия загруженного ЦС со стенками пор МЧК.
Обратимся теперь к проблеме модификации МЧК с целью повышения их совместимости с той или иной средой. За редким исключением эта проблема рассматривается применительно к использованию частиц в биомедицине. В этой связи наиболее актуальными задачами являются предотвращение агрегирования МЧК в средах с высокой ионной силой и обеспечение их селективного накопления в целевом органе или ткани.
Первую из них традиционно решают за счет дополнительной прививки на поверхность МЧК молекул полиэтиленгликоля (ПЭГ). Это позволяет не только увеличить продолжительность циркуляции частиц в кровотоке, что способствует их накоплению в опухоли по механизму пассивной адресной доставки [33, 54]55, но и существенно уменьшить опсонизацию и фагоцитоз МЧК, а также их гемолитическое действие [64]. Вместе с тем в последнее время появляется все больше работ, свидетельствующих о возможности развития иммунного ответа при многократном введении модифицированных ПЭГ частиц в кровоток [65], что приводит к увеличению скорости их выведения из организма. Как следствие, значительно возросло число работ, направленных на поиск альтернативных способов модификации МЧК (см. ниже).
Активная адресная доставка МЧК обычно осуществляется за счет хемосорбции на их поверхности биологически-активных соединений, способных специфически взаимодействовать с теми или иными рецепторами на поверхности клеток, а в ряде случаев и обеспечивать проникновение частиц через мембрану (см., например, [15, 34, 66–69])66. Так, модификация МЧК фолиевой кислотой способствует их эндоцитозу с участием фолатных рецепторов, экспрессия которых на поверхности раковых клеток значительно повышена по сравнению со здоровыми. В результате имеет место селективное накопление SiO2-контейнеров в клетках опухоли [67–69].
3.1.2. Модификация МЧК путем адсорбции полимеров. Вторая из указанных выше групп включает подходы, основанные на модификации внешней поверхности МЧК путем адсорбции полимеров и направленные на регулирование скорости десорбции ЦС и обеспечение совместимости МЧК с окружающей средой (табл. 1). Главные достоинства этих подходов – сравнительная простота реализации и возможность масштабирования.
Круг соединений, которые могут быть использованы с этой целью, весьма широк и включает как природные, так и синтетические полимеры (в том числе, биоразлагаемые). Во избежание излишней детализации мы не будем обсуждать все многообразие существующих подходов (переадресовав читателя к появившимся в самое последнее время обзорам [55, 56]), а лишь кратко остановимся на основных направлениях.
Один из наиболее распространенных способов − послойная (layer-by-layer) адсорбция на поверхности МЧК противоположно заряженных полиэлектролитов [22, 50, 51, 55, 56, 70–75]. Способность таких полимеров реагировать на изменение pH среды позволяет управлять высвобождение ЦС. Варьируя природу полиэлектролитов, можно достаточно четко задавать “рабочий” диапазон значений pH, а изменяя количество слоев – регулировать скорость десорбции ЦС. Так, например, согласно данным [70] модификация нагруженных доксорубицином МЧК хлоридом полиаллиламина и полистиролсульфонатом способствует преимущественному высвобождению препарата в слабокислой среде. При этом увеличение числа полиэлектролитных слоев приводит не только к уменьшению скорости десорбции ЦС, но и к снижению цитотоксичности частиц (в первую очередь по отношению к клеткам крови). По мнению авторов, полученные ими структуры способствуют селективному накоплению доксорубицина в ядрах клеток, что делает их весьма перспективными в терапии опухолей.
В то же время использование для модификации МЧК гиалуроновой кислоты и хитозана (или его производных) способствует высвобождению ЦС в нейтральной или слабощелочной среде (см., например, [71, 72]). Показано, в частности [72], что при пероральном введении МЧК такая модификация позволяет избежать неконтролируемой десорбции противоракового препарата 5-фторурацила в желудке, обеспечивая его доставку в кишечник. Согласно данным [71] этот прием может быть использован и для управления десорбцией оптического отбеливателя, что весьма существенно при производстве текстиля.
Выбор пары полистиролсульфонат/полиэтиленимин для модификации МЧК, содержащих ингибитор коррозии, также приводит к преимущественной десорбции последнего в щелочной среде, что улучшает защитные свойства покрытия [51].
Отметим, что включение в полиэлектролитную оболочку МЧК тех или иных активных компонентов (лекарственных препаратов, молекул красителей, наночастиц металлов и др.) открывает дополнительные возможности как с точки зрения разработки многофункциональных структур для тераностики опухолей, так и для управления десорбцией ЦС [73–75].
Что касается модификации МЧК индивидуальными полимерами, то в последнее время все большее внимание исследователей привлекает использование с этой целью природного полимера полидопамина (ПДА) [41, 56, 76–82], а также полиэтиленимина (ПЭИ) и его сополимеров [41, 56, 67, 83–89].
Возрастающий интерес к ПДА обусловлен присущими этому полимеру уникальными свойствами и сравнительной простотой его получения. Так, известно [77, 79, 82], что из-за наличия в составе его молекулы катехольных групп ПДА способен не только сильно адсорбироваться на различных поверхностях, получив за это название “молекулярного клея”, но и образовывать комплексы с ионами различных металлов. Кроме того, он может “откликаться” на изменение pH среды и воздействие излучения ближнего ИК-диапазона [79]. Такая многофункциональность представляет интерес с точки зрения самых разных практических приложений.
Окислительную полимеризацию допамина обычно проводят в нейтральной или слабощелочной среде (pH ≈ 8.5) [79]. Введение в реакционную систему МЧК приводит к формированию на поверхности частиц полимерной оболочки заданной толщины [41, 76–81]. В кислой среде проницаемость этой оболочки сильно возрастает. Как следствие, десорбция загруженного ЦС происходит преимущественно в этих условиях [76–78, 81, 82]. При этом координация ПДА с ионами металла или воздействие излучения ближнего ИК-диапазона позволяет более тонко регулировать скорость этого процесса (см., например, [77, 81]).
Отметим, что в подавляющем большинстве случаев МЧК, модифицированные ПДА, применяют для контролируемой доставки лекарственных препаратов или создания устройств биомедицинского назначения [76–81]. В то же время результаты работы [82] свидетельствуют о том, что такие структуры могут быть использованы и для получения самозалечивающихся покрытий. При этом показано, что способность ПДА координировать ионы железа оказывает дополнительное защитное действие.
В свою очередь, главным достоинством ПЭИ, имеющим принципиальное значение с точки зрения биомедицинского использования МЧК, является его способность к специфическому взаимодействию с ДНК. Согласно имеющимся в литературе данным (см., например, [15, 21, 86]) использование ПЭИ для модификации МЧК открывает возможность одновременной доставки в клетку генного материала и того или иного лекарственного препарата, что значительно повышает эффективность действия последнего. Одними из первых такую возможность продемонстрировали авторы работы [83] на примере МЧК, содержащих паклитаксель. Установлено, что адсорбированный на поверхности частиц ПЭИ может не только образовывать достаточно прочные комплексы с молекулами ДНК и малой интерферирующей РНК, но и способствовать проникновению частиц через клеточную мембрану; эта особенность ПЭИ также достаточно широко используется для внутриклеточной доставки ЦС [41, 86, 89]. Высвобождение загруженного ЦС и в этом случае происходит преимущественно в кислой среде в результате десорбции ПЭИ или протонирования аминогрупп, входящих в состав его молекулы [86].
Отметим, что относительно недавно стали появляться работы, свидетельствующие о том, что наличие на поверхности МЧК адсорбционного слоя ПЭИ может приводить к локальному изменению pH в непосредственной близости от частиц77, а также к изменению гидролитической стабильности кремнеземной матрицы [84, 88]. На наш взгляд, эти факты имеют принципиальное значение с точки зрения как управления десорбцией ЦС, так и создания (био)разлагаемых МЧК, а потому заслуживают самого пристального внимания.
3.1.3. Модификация МЧК с использованием клеточных технологий. Третья, самая “молодая” группа подходов к модификации МЧК имеет узкую биомедицинскую направленность. Их активное развитие в значительной мере обусловлено появлением работ, указывающих на возможность возникновения иммунного ответа при многократном введении в организм модифицированных ПЭГ частиц (см. выше).
По мнению ряда авторов [89–103] подходы, основанные на принципах биомиметики и позволяющие не только обеспечить “маскировку” МЧК от иммунной системы (что способствует их длительной циркуляции в кровотоке), но и регулировать процесс клеточной интернализации частиц, могут стать серьезной альтернативой использованию ПЭГ.
В частности, речь идет о создании протоклеток (protocells). Суть этого подхода заключается в формировании на поверхности МЧК бислоя, состоящего из одного или нескольких природных или синтетических липидов и моделирующего клеточную мембрану [90–96]. “Сборка” такого бислоя, как правило, происходит по электростатическому механизму. При этом существует возможность включения в состав бислоя синтетических липидов с привитой цепью ПЭГ, а также биологически активных молекул, обеспечивающих селективное накопление протоклеток в опухоли, и/или стимулотропного затвора, позволяющего управлять десорбцией лекарственного препарата (см. схему на рис. 3). Зачастую в качестве такого затвора выступают сами липиды, способные реагировать на изменение pH среды, температуры или микроокружения протоклетки [91, 96].
Согласно имеющимся в литературе данным использование протоклеток позволяет обеспечить доставку одного или нескольких лекарственных препаратов (в том числе, водонерастворимых) непосредственно внутрь опухолевых клеток, заметно увеличивая эффективность их действия [90–96]. Это особенно важно с точки зрения химиотерапии опухолей с множественной лекарственной устойчивостью [91, 95].
Не меньший интерес, на наш взгляд, представляет подход, основанный на использовании для модификации МЧК различных “живых” мембран [97–101], например мембран эритроцитов [98] или опухолевых клеток [99, 100]. В первом случае [98] такая процедура не только приводит к значительному повышению гемосовместимости МЧК, но и обеспечивает управляемую десорбцию капсулированного ЦС под воздействием лазерного излучения; последний эффект обусловлен разрушением мембраны, покрывающей МЧК. В то же время результаты работ [99, 100] позволяют предположить, что “камуфляж” МЧК с помощью мембран раковых клеток способствует селективному накоплению частиц в опухоли и повышению эффективности химиотерапии.
Отметим, что еще одним многообещающим способом маскировки МЧК от иммунной системы организма является их загрузка в те или иные клетки [89, 101–104]. Наибольший интерес представляют стволовые клетки, характеризующиеся достаточно высокой онкотропностью, т.е. способностью селективно накапливаться в опухоли, проникая вглубь нее по механизму инфильтрации. Эта их способность открывает возможность доставки лекарственных препаратов в центральные области сóлидных опухолей, для которых характерно нарушенное кровообращение [101]. О перспективности этого подхода свидетельствуют результаты работ [89, 102, 103]. Показано, что мезенхимальные стволовые клетки способны обеспечить эффективную транспортировку в опухоль чувствительных к ультразвуковому воздействию МЧК, загруженных тем или иным лекарственным препаратом.
Суммируя сказанное выше, отметим, что на сегодняшний день в рамках классической стратегии создания и использования МЧК предложено огромное количество весьма оригинальных подходов, позволяющих управлять свойствами таких частиц. К сожалению, большинство из них являются очень сложными и трудоемкими (а зачастую и дорогостоящими). В результате неизбежно возникает вопрос о возможности/целесообразности их масштабирования, что является обязательным условием с точки зрения разработки той или иной технологии (хотя бы лабораторной).
Еще более сложная ситуация складывается в области практического использования МЧК для решения биомедицинских задач, в первую очередь, − для терапии опухолей. В этом случае возникает еще ряд вопросов, касающихся токсичности соединений, используемых в качестве стимулотропных затворов88, их функционирования в условиях in vivo, а также распределения МЧК в организме и их последующего выведения. В этой связи отметим, что согласно данным, приведенным в аналитическим обзоре [106], лишь очень небольшая доля введенных в организм частиц-контейнеров достигает целевого органа/ткани.
С учетом сказанного очевидно, что задачи, связанные с увеличением емкости МЧК, а также с разработкой более простых способов их создания, загрузки и управления десорбцией ЦС, являются весьма актуальными. Об этом свидетельствует существенный рост числа работ, посвященных их решению. Остановимся на них подробнее.
3.2. Новые подходы к созданию и загрузке МЧК
Следует подчеркнуть, что в попытке упростить протоколы создания и использования МЧК основное внимание уделяется вопросам, связанным с необходимостью удаления темплата и возможностью совмещения стадий синтеза частиц и их загрузки ЦС.
По мнению ряда авторов [107–111], удаление темплата по окончании синтеза МЧК не является обязательным шагом. Так, его наличие в порах частиц позволяет не только увеличивать их сорбционную способность по отношению к различным гидрофобным соединениям [107, 110] и ионам некоторых металлов [111], но и регулировать скорость их десорбции [108]. При этом показано, что с увеличением длины углеводородного “хвоста” темплатирующего ПАВ емкость кремнеземного сорбента по целевому веществу (гидрофобному антибиотику) возрастает [110].
В свою очередь, результаты работы [109] свидетельствуют о том, что присутствие в порах МЧК темплата – катионов цетилтриметиламмония бромида (ЦТАБ) – не только приводит к сорбции ими неожиданно большого количества NO, но и способствует его преимущественному высвобождению в кислой среде. Этот факт, обусловленный специфическим взаимодействием между молекулами NO и головными группами ПАВ, имеет большое значение как с точки зрения хранения этого газа, так и его использования в лечебных целях.
Из следующих разделов будет ясно, что второй из указанных вопросов привлекает значительно большее внимание исследователей.
3.2.1. Синтез МЧК на “гибридных” темплатах на основе инертных ПАВ. Выше уже упоминалось о том, что большинство ЦС, подлежащих загрузке в МЧК, характеризуются чрезвычайно низкой растворимостью в воде. Одной из особенностей таких соединений является их способность “встраиваться” в мицеллы ПАВ по тому или иному механизму.
Как свидетельствует анализ литературных данных, эта особенность позволяет осуществлять капсулирование ЦС в ходе темплатного золь−гель синтеза [112–131]. Отметим, что, в отличие от описанной выше классической схемы, удаление темплатирующего ПАВ по окончании синтеза в этом случае не является обязательным шагом.
Одними из первых возможность такого совмещения стадий синтеза кремнеземных носителей и их загрузки целевым соединением продемонстрировали авторы [112], используя в качестве темплата смешанные мицеллы триблоксополимера этилен- и пропиленоксида (ПЭО-ППО-ПЭО) и сфинголипида церамида II, обладающего выраженным противоопухолевым действием. Показано, что полученный материал содержит примерно 8 мас. % лекарственного препарата. При этом его терапевтическая эффективность по отношению к клеткам меланомы оказалась более высокой, чем у самого церамида II.
В дальнейшем описанный в [112] прием был использован для загрузки в МЧК различных функциональных соединений (см., например, [113, 114]). На наш взгляд, наибольший интерес в этой связи вызывает работа [114], посвященная синтезу МЧК на смешанных мицеллах ЦТАБ и катионного гемини-ПАВ с привитыми тетрафенилэтеновыми группами. Характерной особенностью соединений, несущих такого рода группы, является многократное усиление флуоресценции при их агрегировании, что представляет значительный интерес для тераностики опухолей и решения других практических задач [132, 133].
В ходе проведенных авторами [114] экспериментов были синтезированы стержневидные МЧК со структурой капсул, флуоресценция которых после удаления инертного ПАВ – ЦТАБ – возрастала в несколько раз. Согласно полученным данным такие МЧК способны не только сорбировать достаточно большое количество противоопухолевого препарата камптотецина, но и обеспечивать его пролонгированное высвобождение.
Способность “классических” гидрофобных соединений солюбилизироваться в мицеллах ПАВ также широко используется для их капсулирования в кремнеземной матрице [115–131]. При этом применение в качестве темплата мицелл неионогенных ПАВ с солюбилизированным в них гидрофобным ЦС (лекарственным препаратом, инсектицидом и др.) за редким исключением [127] приводит к получению блочных материалов [115–121].
Отметим, что по данным ряда работ темплатирующее ПАВ может играть двойную роль, выступая и в качестве стимулотропного затвора. В частности, выбор ПАВ с нижней критической температурой растворения (например, блоксополимера этиленгликоля с N-изопропилакриламидом) обеспечивает преимущественную десорбцию ЦС при повышении температуры [119].
В то же время способность блоксополимеров ПЭО-ППО-ПЭО99 к образованию координационных связей с ионами металлов и/или самим ЦС позволяет управлять десорбцией последнего за счет изменения pH среды [116, 121]; принцип работы такого затвора основан на разрушении координационных связей в кислой среде. Согласно данным [116] и скорость десорбции и доля вышедшего в окружающую среду ЦС существенно зависят от типа иона. Так, затвор на основе ионов цинка Zn2+ характеризуется большей чувствительностью к pH среды по сравнению с получаемыми с использованием ионов Cu2+ и Fe3+. Доля десорбированного ЦС в первом случае также оказывается значительно более высокой [116].
Солюбилизация гидрофобных лекарственных препаратов [122–126, 128, 131] или ингибиторов коррозии [129, 130] в мицеллах ионогенных ПАВ обычно приводит к формированию МЧК с достаточно узким распределением по размеру.
Применительно к биомедицинскому использованию МЧК наибольший интерес представляют результаты работ, посвященных синтезу частиц на мицеллах ЦТАБ с солюбилизированными в них цитостатиками, а также применению таких структур для терапии опухолей с множественной лекарственной устойчивостью [123, 124, 127]. Согласно данным [123] наличие в порах МЧК мицелл темплата существенно влияет на характер десорбции солюбилизированного целевого вещества. Так, в нейтральной среде скорость десорбции загруженного в частицы доксорубицина весьма невелика, поскольку присутствующие в порах МЧК плотно упакованные катионы цетилтриметиламмония препятствуют проникновению в них воды. Понижение pH среды способствует увеличению скорости десорбции этих катионов по механизму протонного обмена [123]. Как следствие, скорость десорбции доксорубицина также увеличивается. Очевидно, что в рамках данного подхода можно обеспечить преимущественное высвобождение препарата в клетках опухоли (напомним, что они характеризуются пониженным значением pH по сравнению с регистрируемым в клетках здоровой ткани) без дополнительной модификации МЧК. По мнению авторов [123, 124, 127], цитотоксичные катионы темплатирующего ПАВ способны оказывать дополнительное противоопухолевое действие.
К аналогичному выводу о дополнительном положительном действии темплатирующего ПАВ пришли и авторы работы [129], посвященной синтезу МЧК на мицеллах ЦТАБ с солюбилизированным в них бензотриазолом, являющимся эффективным ингибитором коррозии. Показано, что самозалечивающиеся покрытия, полученные на основе таких МЧК, обеспечивают эффективную защиту меди от коррозии в нейтральных солевых растворах.
С учетом сказанного выше очевидно, что использование “гибридных” темплатов позволяет значительно упростить загрузку гидрофобных ЦС в кремнеземные частицы-контейнеры. Более того, относительно недавно появилось несколько технических решений [120, 131], свидетельствующих о принципиальной возможности масштабирования соответствующих протоколов синтеза.
Речь идет, в частности, о получении МЧК методом мгновенного осаждения при очень быстром последовательном введении реагентов (в англоязычной литературе он получил название “sequential flash nanoprecipitation”) [131]. Суть его заключается в использовании в качестве реакционного сосуда вортексного миксера с несколькими входными каналами, по которым с высокой скоростью подаются растворы реагентов; такое быстрое смешение способствует увеличению скорости нуклеации частиц. Авторы [131] проводили процесс в двух последовательно соединенных сосудах. В первом из них готовили водно-спиртовой раствор ЦТАБ, пестицида абамектина и аммиачной воды, который затем смешивали с раствором прекурсора, используя для этого второй сосуд. В результате образуются МЧК со структурой капсул, характеризующиеся достаточно узким распределением по размеру. При этом около 90 мас. % введенного в реакционную систему абамектина оказываются включенными в кремнеземную матрицу [131].
Следует, однако, подчеркнуть, что, несмотря на перспективность описанного подхода, у процитированных в этом разделе работ имеется несколько общих “белых пятен”.
Во-первых, их авторы не обсуждают закономерностей солюбилизации ЦС, по-видимому, априори полагая, что, будучи введенным в реакционную систему, оно практически полностью встраивается в мицеллы ПАВ, причем скорость этого процесса весьма велика. В то же время известно (см., например, [134]), что степень такого встраивания определяется целым рядом факторов1010 и сильно зависит от природы ПАВ и солюбилизата, температурно-временных условий эксперимента, а также от присутствия в системе иных добавок. Как следствие, неизбежно возникает целый ряд вопросов, касающихся эффективности и механизма капсулирования того или иного ЦС. В частности, нельзя исключить, что в процессе золь−гель синтеза МЧК может иметь место встраивание некоторого количества ЦС в кремнеземную матрицу по механизму его физического захвата. Это может сильно влиять как на характер десорбции ЦС, так и на степень его высвобождения из кремнеземной матрицы.
Во-вторых, упоминая о влиянии темплатирующего ПАВ на характер десорбции загруженного в частицы ЦС, авторы практически полностью игнорируют вопросы, связанные со скоростью и полнотой перехода в окружающую среду молекул/ионов самого ПАВ, а также с основными факторами, позволяющими регулировать этот процесс. (Учитывая данные [123], эта информация является принципиально важной).
Единственная известная нам попытка была сделана авторами работы [135], посвященной изучению кинетики выхода нескольких темплатирующих ПАВ из кремнеземной матрицы в процессе выдержки частиц при 37°C в фосфатном буферном растворе с pH 7.4. Согласно полученным данным, доля ПАВ, перешедшего в дисперсионную среду в течение 120 ч, весьма невелика. В частности, в случае ЦТАБ она составила около 5 мас. % от его количества в МЧК. Следует, однако, учитывать, что эти эксперименты были проведены в статических условиях, причем авторы вообще не рассматривали возможность изменения (химических превращений) самой SiO2-матрицы в ходе эксперимента (как будет показано ниже, этот фактор может играть определяющую роль).
На наш взгляд, ответ на все эти вопросы имеет принципиальное значение с точки зрения развития данного подхода.
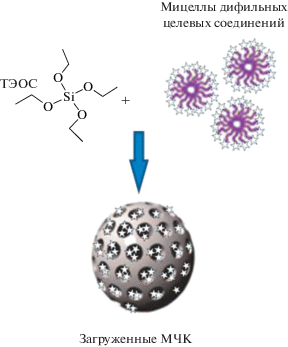
Возвращаясь к проблеме разработки способов совмещения стадий синтеза и загрузки МЧК, подчеркнем, что в этом направлении возможен и следующий логический шаг, заключающийся в использовании в качестве темплатов при синтезе МЧК мицелл (или других ассоциатов) не инертных ПАВ, а дифильных целевых соединений, подлежащих загрузке в частицы-контейнеры. Круг таких дифильных функциональных соединений очень широк и включает различные биологически активные соединения (в том числе, пролекарства), ингибиторы коррозии и др. (см., например, обзоры [136–141] и приведенные в них ссылки).
3.2.2. Синтез МЧК на темплатах ассоциатов загружаемых ЦС. Сравнение схем, приведенных на рис. 3 и 4, свидетельствует о том, что использование в качестве темплата ассоциатов ЦС позволяет совместить стадии синтеза МЧК и их загрузки и, как следствие, существенно упростить процедуру создания наноконтейнеров.
Возможность получения таких структур обсуждалась еще в 2004 г. в работе [142], авторы которой использовали в качестве темплатов мицеллы низкотемпературных ионных жидкостей, обладающих бактерицидным действием. К сожалению, на тот момент эта идея не получила должного развития.
В последние годы интерес к этому подходу существенно возрос, что в значительной мере обусловлено сравнительной простотой его реализации. Показано [143–160], что он применим к различным дифильным соединениям и позволяет не только обеспечить чрезвычайно высокое содержание ЦС в кремнеземном контейнере (табл. 2), но и управлять его пролонгированным высвобождением.
Таблица 2.
Примеры использования дифильных функциональных соединений для синтеза МЧК
| Дифильное функциональное ЦС |
Функция ЦС | Морфология частиц |
Содержание ЦС в матрице*, мас. % | Ссылка |
|---|---|---|---|---|
| Мирамистин | Антибактериальные препараты |
Сферические МЧК | 48.0−50.0 (1.0−1.1) | [145] |
| Декаметоксин | Частицы-капсулы | 30.0 (0.35) | [146] | |
| Хлорид бензалкония | Блочный материал | 36.0 (0.56) | [151] | |
| Дигидрохлорид октенидина | Сферические МЧК | 34.4 | [149] | |
| Ацетат хлоргексидина | Сферические МЧК | 33.7 | [152] | |
| Сферические частицы органокремнезема | 31.8 | |||
| Катионный глицеролипид (иодид rac-N-{4-[(2-этокси-3-октадецилоксипроп-1-ил)оксикарбонил]бутил}-N'-метилимидазолия) | Противоопухолевыe препараты | Частицы-капсулы | – | [153] |
| Сферические МЧК | 5.0−28.0** | |||
| Пролекарства – амиды L-триптофана и солей жирных кислот | Сфероидальные МЧК |
35.0−40.0 | [148] | |
| Бромид 1-гексадецил-3-метилимидазолия | Ингибиторы коррозии |
Сферические МЧК | н. о. (0.24) | [158] |
| ЦТАБ | 45.0 (0.9) | [154, 159] | ||
| Катамин АБ | 40.0−52.0 (0.7−1.1) |
[155] | ||
| Олеилсаркозинат натрия | 25.0−45.0 (0.42−1.1) |
[156] | ||
| Олеат натрия | 27.2−40.2 | [157] | ||
| Частицы-капсулы | 26.0−33.4 |
Так, в ходе наших экспериментов была продемонстрирована возможность создания МЧК на основе различных дифильных ЦС, обладающих ярко выраженным бактерицидным [144–147] и антинеопластическим [153] действием, или способных ингибировать коррозию металлов и их сплавов [154–157].
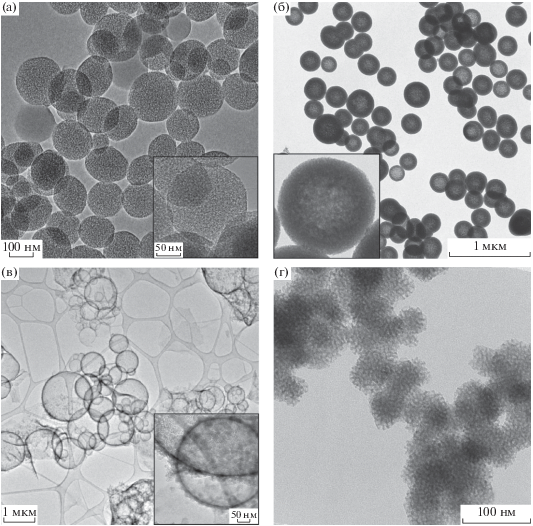
Типичные микрофотографии синтезированных частиц приведены на рис. 5. Как и следовало ожидать, их морфология определяется структурой ассоциатов ЦС и сильно зависит как от его природы, так и от условий синтеза. Например, выбор в качестве темплатирующего агента мицеллообразующего антисептика мирамистина [145, 147] приводит к формированию МЧК с гексагонально-упорядоченной пористой структурой (рис. 5а). В то же время в случае другого антисептика – декаметоксина, образующего в водном растворе везикулы, более характерны МЧК со структурой капсул (рис. 5б) [146, 147].
Наибольший интерес с точки зрения управления морфологией МЧК (и, как следствие, их емкостью) представляют результаты экспериментов, посвященных синтезу частиц с использованием в качестве темплатирующего агента катионного глицеролипида (КГЛ), обладающего противоопухолевым действием, или ингибитора коррозии – олеата натрия, относящегося к классу анионных ПАВ. Так, показано [157], что структура ассоциатов олеата натрия сильно зависит от температуры и содержания этанола в дисперсионной среде. Варьируя эти параметры, можно в широких пределах изменять структуру МЧК, получая как капсулы, так и однородные частицы с различным расположением пор.
В свою очередь, характер ассоциации КГЛ сильно зависит от ионной силы его водных растворов. Так, в деионизованной воде он образует везикулы со средним диаметром 530 нм. В процессе синтеза МЧК в такой системе в основном формируются именно частицы со структурой капсул (рис. 5в) [153]. В то же время основным типом ассоциатов в растворах КГЛ в нейтральном фосфатном буфере являются мицеллы со средним диаметром около 5 нм. Введение в такой раствор предварительно гидролизованного ТЭОС приводит к образованию МЧК со средним диаметром примерно 50 нм (рис. 5г). Особо подчеркнем, что для этого не требуется присутствия какого-либо катализатора. Очевидно, в данном случае конденсация ОКК катализируется имидазольными группами самого КГЛ. Этот результат не вполне тривиален. Действительно, хотя способность аминов катализировать гидролитическую конденсацию алкоксисиланов известна достаточно давно, работы, в которых эта способность обсуждалась бы применительно к имидазолам, нам не встречались.
Содержание темплатирующего ЦС, инкапсулированного в МЧК на стадии их золь−гель синтеза, обычно определяют по потере массы частицами в ходе термогравиметрического анализа. Учитывая плотную упаковку молекул ЦС в мицеллах, очевидно, что оно должно быть достаточно высоким. Действительно, по данным разных работ оно варьируется от примерно 30 до 50% от общей массы МЧК (см. табл. 2) и значительно превышает количество того же ЦС, которое может быть загружено в МЧК путем сорбции из раствора, т.е. по классической схеме [149, 159]. При этом эффективность капсулирования ЦС тоже может быть весьма велика. Об этом свидетельствуют результаты наших экспериментов [144, 145, 159], согласно которым более 90 мас. % введенного в реакционную систему ЦС оказывается встроенным в кремнеземную матрицу. Такие высокие значения вполне закономерны, если учесть, что в формировании жидкокристаллической мезофазы, возникающей на ранних стадиях синтеза, участвуют как мицеллы, так и мономерные молекулы ПАВ [25].
Высвобождение капсулированного ЦС из частиц-контейнеров определяется двумя основными факторами: постепенным набуханием/растворением кремнеземной матрицы под действием проникающей в нее воды и взаимодействием молекул/ионов темплата с поверхностью пор МЧК. Их относительные вклады в кинетику десорбции сильно зависят от pH водной среды. Так, в щелочной среде десорбция ЦС обусловлена, в первую очередь, растворением SiO2-матрицы [145, 159]. С уменьшением pH и переходом его значений в нейтральную, а затем и в кислую область растворимость кремнезема уменьшается. Одновременно происходит частичное протонирование силанольных групп, т.е. вклад второго из упомянутых выше факторов возрастает. При низких значениях pH, близких к точке нулевого заряда частиц SiO2 (pH 2−3 [161]), именно он является определяющим. Таким образом, очевидно, что, варьируя pH среды, можно управлять разгрузкой МЧК без какой-либо дополнительной их модификации.
Такая возможность была, в частности, продемонстрирована в работах [145, 147, 151] на примере катионных антисептиков, относящихся к классу четвертичных аммониевых соединений. Установлено, что понижение pH среды приводит к существенному увеличению скорости выхода капсулированных ЦС. При этом основным механизмом, по-видимому, является ослабление взаимодействия между катионами ЦС и гидроксильными группами на стенках пор МЧК.
В самое последнее время было показано [152], что введение в реакционную систему при синтезе МЧК помимо ТЭОС и второго прекурсора − бис[3-(триэтоксисилил)пропил]тетрасульфида – чувствительного к воздействию глутатиона, также позволяет управлять выходом капсулированного ЦС из объема МЧК в окружающую среду. Скорость этого процесса, обусловленного деструкцией органокремнеземной матрицы в присутствии глутатиона, можно изменять, варьируя концентрацию последнего.
Еще один перспективный способ решения этой задачи – регулирование гидролитической стабильности самого ЦС. В этой связи заслуживает упоминания работа [148], посвященная созданию МЧК на темплатах из ассоциатов дифильных пролекарств из группы амидов жирных кислот. По мнению авторов, переход молекул такого ЦС в окружающую среду происходит в результате ослабления его взаимодействия со стенками пор МЧК. В дальнейшем же имеет место отщепление биологически активного фрагмента от углеводородного “хвоста” в результате гидролиза амидной связи. Мы полагаем, что такой гидролиз может протекать и в порах МЧК, способствуя высвобождению лекарственного препарата.
Следует подчеркнуть, что характер перехода ЦС в окружающую среду критическим образом зависит от содержания в системе кремниевой кислоты и ее олигомеров − продуктов растворения кремнеземной матрицы МЧК [145, 159] (см. также [21, 162]). Это связано с довольно низкой их растворимостью в воде [161]. По достижении предела растворимости этих соединений в дисперсионной среде имеет место их переосаждение на внешней и/или внутренней поверхности МЧК, что приводит к искажению формы пор, а в ряде случаев и к их закупорке; наиболее интенсивно этот процесс протекает в кислой среде (рис. 6)1111. Как следствие, скорость выхода ЦС сильно уменьшается. Такая картина довольно типична для экспериментов, проводимых в статических условиях. (Отметим, что в динамических условиях переосаждения ОКК на частицах не наблюдается и переход ЦС в окружающую среду происходит быстрее и более полно.)
Рис. 6.
Микрофотографии МЧК, синтезированных на темплате из мицелл ЦТАБ, до (а) и после их выдержки в деионизованной воде (б) или в водных растворах с pH ≈ 5 (в) и 9.8 (г) в течение месяца. Изображения (б) и (г) заимствованы из [159], (а) и (в) – наши неопубликованные данные.

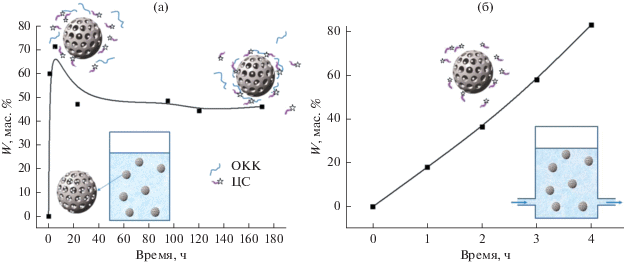
Кроме того, нельзя исключить, что переосаждение ОКК может сопровождаться захватом вышедших в раствор молекул целевого вещества, иными словами, – их “возвратом” в состав МЧК (схематически этот процесс изображен на рис. 7). На правомерность этого предположения указывают результаты наших экспериментов [145, 159], согласно которым кривая десорбции ЦС в статических условиях в ряде случаев проходит через максимум (рис. 7а).
Рис. 7.
Зависимость доли темплатирующего ЦС (W), перешедшего из МЧК в окружающую водную среду в статических (а) и квазидинамических условиях (б), от времени процесса при pH ≈ 5 [145].
Вообще говоря, до сих пор возможность “возврата” десорбировавшегося вещества в состав МЧК в литературе не обсуждалась. Однако такая возможность должна приниматься во внимание, учитывая способность ОКК взаимодействовать с различными соединениями электростатически или по иному механизму. На наш взгляд, это позволит хотя бы частично объяснить противоречия, возникающие при попытках установить взаимосвязь между процессом гидролитической деструкции SiO2 и десорбцией загруженного в МЧК соединения. В частности, речь идет о результатах работы [163], согласно которым доля ЦС, перешедшего из объема МЧК в дисперсионную среду в условиях практически полного растворения кремнеземной матрицы, оказывается совсем небольшой.
Возвращаясь к проблеме перехода темплатирующего ЦС из объема МЧК в окружающую среду, подчеркнем, что в отличие от частиц, загруженных по классической схеме, для таких систем стадия “взрывной” (т.е. очень быстрой) десорбции ЦС на начальном этапе процесса практически отсутствует. В результате обеспечивается пролонгированное высвобождение ЦС, что весьма важно с практической точки зрения. Для описания этого процесса, как правило, используют следующее степенное уравнение (так называемая модель Корсмеера−Пеппаса):
На сегодняшний день в литературе наиболее активно обсуждаются два основных механизма (см., например, [145, 149]), в рамках которых переход ЦС в окружающую среду контролируется его диффузией в порах МЧК (n = 0.5) или проникновением воды в частицы, т.е. набуханием кремнеземной матрицы (n = 1).
Следует, однако, учитывать, что модель Корсмеера−Пеппаса (как и ряд других моделей) предназначена для описания “прямого” перехода ЦС из частиц-контейнеров в жидкую среду. В то же время практическое использование МЧК зачастую подразумевает их введение в ту или иную твердую матрицу (например, полимерную).
Именно такая ситуация рассматривалась в работе [150], посвященной синтезу МЧК на мицеллах бактерицидного препарата и изучению перспектив их использования при создании новых стоматологических адгезивов. Пытаясь описать кинетику выхода ЦС из такого композитного материала, авторы предложили довольно сложную модель, учитывающую переход ЦС из частиц в полимерную матрицу и его последующую диффузию к границе фаз, эрозию адгезива и целый ряд других факторов [150]. Эта модель представляет значительный интерес, однако, по мнению самих авторов, нуждается в доработке.
Пролонгированный выход молекул/ионов темплатирующего ЦС из частиц-контейнеров обуславливает возможность использования таких структур для решения различных практических задач. Так, продемонстрированная в целом ряде работ [142, 147, 149–152] высокая бактерицидная активность МЧК, синтезированных на ассоциатах дифильных антисептиков, делает их весьма привлекательными объектами с точки зрения создания новых стоматологических и перевязочных материалов, костных имплантов и др. изделий биомедицинского назначения.
Не меньший интерес представляет и проблема создания новых защитных покрытий на основе МЧК, загруженных ингибитором коррозии. Отметим, что по нашим данным в качестве такого ингибитора может выступать и ЦТАБ − классическое темплатирующее ПАВ. Частицы, синтезированные на мицеллах ЦТАБ, обеспечивают достаточно эффективную защиту углеродистой стали от сероводородной коррозии [154]. Аналогичный эффект был достигнут при использовании МЧК, полученных на мицеллах катамина АБ1212, также относящегося к классу четвертичных аммониевых соединений [155]. При этом было установлено, что постепенное растворение кремнеземной матрицы МЧК в кислой среде оказывает дополнительное защитное действие, обусловленное адсорбцией на стали кремниевой кислоты и ее олигомеров. Кроме того, можно ожидать, что использование этих МЧК будет препятствовать и биологической коррозии, поскольку указанные соединения являются сильными антисептиками.
Отметим, что этот подход может быть применен и для капсулирования в МЧК соединений, относящихся к группе анионных ПАВ [156, 157]. Известно [166–168], что такие соединения (в частности, соли некоторых карбоновых кислот) являются дешевыми и весьма эффективными ингибиторами коррозии различных металлов и их сплавов. К сожалению, прямое их введение в полимерные покрытия приводит к сильному ухудшению адгезионных характеристик и отверждаемости последних, что сильно затрудняет применение этих соединений на практике.
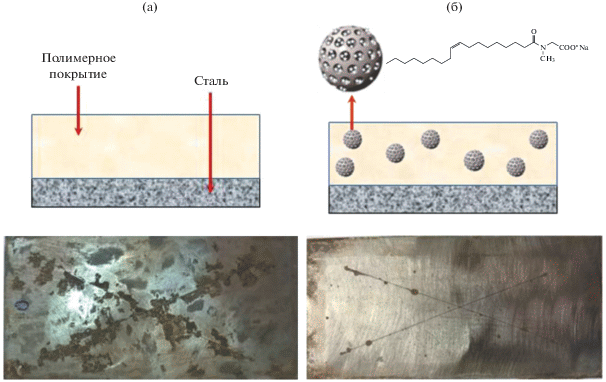
В то же время, как показано на примере олеилсаркозината натрия [156], использование таких ингибиторов в качестве темплатирующих агентов при синтезе МЧК позволяет обеспечить их весьма эффективную загрузку в кремнеземную матрицу и последующее формирование качественного полимерного покрытия. Такое покрытие в течение длительного времени обеспечивает эффективную защиту углеродистой стали даже в жестких условиях нейтрального солевого тумана. В качестве иллюстрации на рис. 8 приведены фотографии образцов стали 3 после их выдержки в камере солевого тумана в течение 500 ч и удаления защитного покрытия.
Рис. 8.
Результаты сравнительных коррозионных испытаний исходного полимерного покрытия (а) и покрытия, содержащего 4 мас. % МЧК с олеилсаркозинатом натрия (б). Пояснения в тексте.
Очевидно, что ассоциаты дифильных ЦС также могут быть использованы для создания гибридных темплатов путем солюбилизации в них второго гидрофобного ЦС (см. п. 3.2.1). Золь−гель синтез с использованием таких темплатов открывает возможность одновременной загрузки в МЧК двух (и более) ЦС и получения многофункциональных частиц-контейнеров, представляющих интерес для решения различных задач (например, борьбы с множественной лекарственной устойчивостью опухолей или микроорганизмов).
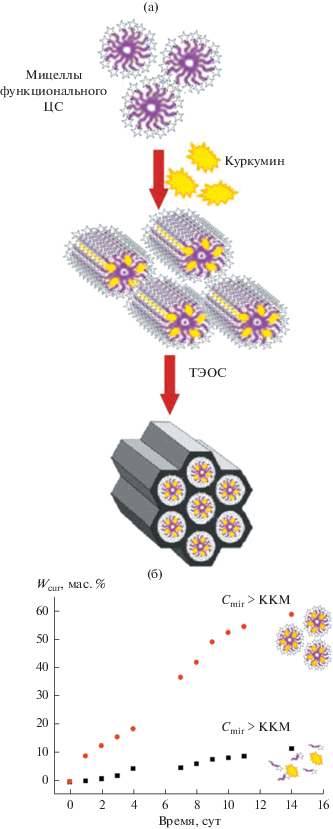
На перспективность такого пути указывают результаты наших работ [169, 170], посвященных разработке способа формирования МЧК на темплатах из мицелл мирамистина с солюбилизированным в них куркумином. Спектр биологической активности этого природного полифенола очень широк [171, 172]. Он является эффективным антиоксидантом, обладает противомикробным, противовоспалительным, противоопухолевым и другим действием. Основным препятствием на пути к активному использованию этого соединения в медицине является его ограниченная биодоступность, обусловленная низкой растворимостью в воде.
Согласно полученным нами данным, солюбилизация куркумина в мицеллах дифильных антисептиков позволяет не только существенно повысить его растворимость в воде [169], но и обеспечить загрузку в МЧК на стадии их синтеза сразу двух биологически активных соединений [170]. Схематически этот процесс изображен на рис. 9а.
Рис. 9.
(а) Схема синтеза МЧК на мицеллах функционального ЦС (мирамистина) с солюбилизированным гидрофобным веществом − куркумином; (б) кинетические кривые выхода куркумина в водную дисперсионную среду с разным содержанием десорбировавшегося мирамистина [170].
Установлено также [170], что скорость перехода обоих инкапсулированных соединений в окружающую водную среду возрастает при уменьшении ее pH; это позволяет говорить о возможности их преимущественного высвобождения в местах воспалений.
Отметим, что выход из МЧК куркумина определяется его растворимостью в водной среде и напрямую зависит от содержания в ней мирамистина [170]. Так, если концентрация вышедшего мирамистина оказывается ниже его критической концентрации мицеллообразования (ККМ), в дисперсионную среду переходит пренебрежимо малое количество куркумина. При увеличении концентрации вышедшего мирамистина до ККМ и выше количество десорбирующегося куркумина значительно возрастает, что обусловлено его солюбилизацией в мицеллах дифильного антисептика (рис. 9б).
Представленные выше данные свидетельствуют о том, что подходы, основанные на совмещении стадий синтеза и загрузки МЧК, открывают широкие перспективы с точки зрения практического применения кремнеземных частиц-контейнеров при решении проблем направленной доставки и контролируемого высвобождения ряда лекарственных препаратов, а также при создании новых материалов и покрытий. При этом, во-первых, в случае необходимости внешнюю поверхность получаемых таким способом МЧК можно дополнительно модифицировать с помощью одного из протоколов, описанных в пунктах 3.1.1−3.1.3. Во-вторых, на наш взгляд, при синтезе подобных МЧК могут применяться не только “классические” прекурсоры, но и специально функционализованные алкоксисиланы (например, с привитым лекарственным препаратом [8, 9]).
Подчеркнем, что, на наш взгляд, наибольший интерес представляет использование в качестве темплатов именно ассоциатов ЦС, подлежащих загрузке в МЧК. Как отмечалось выше, этот подход может быть применен к капсулированию различных ЦС. Речь, в частности, идет о металло-ПАВ, ионных жидкостях, а также комплексах традиционных ПАВ с теми или иными лекарственными препаратами. Такие соединения не только обладают ярко выраженным противомикробным, противоопухолевым и др. действием [139, 141, 173–177], но могут являться и весьма эффективными контрастирующими агентами для магнитной резонансной томографии [174]. Синтез МЧК на таких “активных” темплатах (в том числе, содержащих второе солюбилизированное ЦС) открывает возможность создания многофункциональных структур, имеющих особенное значение для тераностики опасных заболеваний. Например, выбор с этой целью металло-ПАВ на основе Pt(II) может послужить новым способом доставки этих ионов в опухоль.
Не менее актуальными являются и задачи, связанные с капсулированием дифильных пролекарств и флуорофоров (в первую очередь имеются в виду те из них, интенсивность эмиссии которых возрастает при агрегировании [114, 160, 182–184]). Так, выше мы уже упоминали работу [148], согласно которой использование ассоциатов дифильных пролекарств в качестве темплатов позволяет обеспечить не только их загрузку в МЧК в достаточно большом количестве, но и контролируемое высвобождение. Очевидно, что этот прием может быть применен и к другим аналогичным соединениям, круг которых весьма широк [140, 178–181]. Мы полагаем, что полученные в результате МЧК могут составить серьезную альтернативу везикулярным средствам доставки пролекарств.
В свою очередь, МЧК, синтезированные на ассоциатах флуоресцирующих ЦС, могут найти применение как в биомедицине [160, 182, 183], так и при решении других практических задач [184], включая создание светоизлучающих устройств и флуоресцентных сенсоров. О такой возможности свидетельствуют, в частности, результаты работы [160]. Авторами показано, что использование в качестве темплатирующего агента гемини-ПАВ с привитыми флуорофорными группами приводит к получению мезопористых частиц SiO2, эмиссия которых сильно зависит от температуры и pH среды.
Отмеченная выше способность кремнеземной матрицы МЧК к постепенному растворению в водной среде позволяет говорить о возможности создания разлагаемых частиц-контейнеров. Наибольший интерес такие структуры представляют с точки зрения биомедицины. Действительно, известно, что одним из основных факторов, препятствующих широкому применению неорганических частиц (квантовых точек, плазмонных НЧ и др.) в клинической практике, является их способность накапливаться в организме или образовывать в процессе деградации токсичные “метаболиты” [185]. В случае (био)разлагаемых МЧК это ограничение “автоматически” снимается, поскольку продукты растворения SiO2-матрицы (кремниевая кислота и ее олигомеры) практически нетоксичны [162, 186]. Более того, в ряде случаев эти соединения способны выполнять полезную дополнительную функцию. На это указывают как полученные нами данные (см. выше), так и результаты работы [186], согласно которым кремниевая кислота, образующаяся в результате растворения частиц SiO2, способствует заживлению ран.
С учетом сказанного вполне закономерен рост количества работ, направленных на поиск путей регулирования гидролитической стабильности кремнеземной матрицы с целью управления биосовместимостью частиц-контейнеров и кинетикой перехода ЦС из их объема в окружающую среду. Обсуждению этих вопросов посвящены несколько появившихся в самое последнее время обзоров [162, 187, 188] и глава в сборнике [189], а потому мы лишь кратко остановимся на некоторых основных моментах.
3.3. Регулирование стабильности кремнеземной матрицы как способ управления разгрузкой МЧК
Вообще говоря, исследованием закономерностей растворения SiO2 в различных средах (в том числе, в биологических жидкостях) занимаются достаточно давно [161, 190, 191]. По мнению большинства авторов, деградация SiO2 в водной среде происходит в несколько стадий, включающих проникновение воды внутрь сетки силоксановых связей, гидролиз этих связей и выход продуктов гидролиза в окружающую среду. Скорость каждого из этих процессов в большей или меньшей степени зависит от химии поверхности, концентрации и морфологии (т.е. размера, формы и удельной поверхности) МЧК, плотности сетки силоксановых связей, состава и pH дисперсионной среды, а также от температуры. Эти вопросы достаточно подробно рассмотрены в обзоре [162]. Представленные в нем данные убедительно свидетельствуют о том, что, варьируя условия синтеза МЧК и/или их последующей обработки, можно достаточно тонко регулировать их устойчивость в той или иной среде.
Так, согласно [162], увеличение размера МЧК или модификация их поверхности ПЭГ или соединениями, препятствующими проникновению воды внутрь частиц, позволяет уменьшить скорость растворения последних (см. также [192, 193]).
Показано также [162, 194], что введение в реакционную систему ионов некоторых металлов (например, кальция [194]) приводит к существенному снижению гидролитической стабильности формирующихся МЧК. Это обусловлено способностью ионов Ca2+ вытеснять протоны силанольных групп с образованием связей Si−O−Ca−O−Si, что приводит к “разрыхлению” сетки силоксановых связей. В то же время использование солей циркония или алюминия способствует увеличению плотности сшивки этой сетки вследствие изоморфного замещения атомов кремния на Al или Zr [162, 195]. (Аналогичное “упрочнение” сетки обеспечивается и за счет повышения температуры золь−гель синтеза или путем гидротермальной обработки полученных частиц [162, 196].)
Введение в реакционную систему функционализованных алкоксисиланов также позволяет регулировать гидролитическую стабильность кремнеземной матрицы [187]. Так, использование с этой целью алкоксисиланов с гидрофобными группами (например, производных куркумина [93, 187]) приводит к уменьшению скорости растворения МЧК вследствие затрудненного проникновения воды в матрицу. В случае же алкоксисиланов с гидрофильными или реакционноспособными группами скорость и глубина деструкции МЧК возрастает [152, 187, 197]. Об этом свидетельствуют, в частности, результаты работы [197], посвященной изучению особенностей растворения МЧК, полученных с использованием в качестве прекурсоров алкоксисиланов, конъюгированных с аминокислотами.
С учетом данных, представленных в предыдущем разделе, очевидно, что, регулируя скорость растворения матрицы МЧК, можно управлять и скоростью их разгрузки; это подтверждают и результаты, полученные в [187–189]. Следует, однако, отметить, что работ, в которых предпринималась бы попытка установить взаимосвязь между процессом гидролитической деструкции SiO2 и десорбцией загруженного в МЧК соединения, до сих пор крайне мало. Помимо упомянутой выше работы [163] нам известна только одна публикация [198], в которой этот вопрос обсуждается применительно к внутриклеточной десорбции загруженных в МЧК гидрофобных соединений разной природы. Мы полагаем, что количество исследований, посвященных этой актуальной проблеме, в ближайшее время может существенно возрасти.
ЗАКЛЮЧЕНИЕ
Проведенный анализ литературных данных позволяет сделать несколько основных выводов.
1. На сегодняшний день в рамках классической стратегии создания и использования МЧК разработано множество весьма оригинальных подходов к регулированию емкости МЧК и скорости их разгрузки. Однако эти подходы в большинстве своем подразумевают использование сложных и трудоемких (а зачастую и дорогостоящих) протоколов. При этом достигаемый эффект часто оказывается небольшим.
Все это является серьезным препятствием с точки зрения применения тех или иных разработок на практике, поскольку в этом случае принцип “чем проще, тем лучше” является одним из основных.
2. Одностадийные подходы, основанные на совмещении стадий синтеза и загрузки МЧК, позволяют не только существенно упростить процедуру их создания, но и обеспечить управляемый переход ЦС в окружающую среду без какой-либо дополнительной модификации частиц. Это свидетельствует о практической значимости таких подходов при решении проблем капсулирования и контролируемого высвобождения различных ЦС с целью создания средств их доставки, а также получения новых материалов и покрытий. Сделанный вывод подтверждается растущим интересом исследователей к этой проблеме и, в первую очередь, к изучению возможности использования в качестве темплатирующих агентов самих ЦС, подлежащих загрузке в МЧК.
3. Способность кремнеземной матрицы МЧК к постепенному растворению в воде и биологических средах представляет значительный интерес не только с точки зрения формирования (био)разлагаемых МЧК, но и применительно к регулированию кинетики перехода капсулированного ЦС в окружающую среду.
В основе такого регулирования лежит изменение гидролитической стабильности SiO2 под действием “внутренних” факторов (pH среды, ионной силы и др.). В результате появляется возможность создания “умных” МЧК, контролируемое вскрытие которых может быть осуществлено без дополнительной прививки стимулотропных затворов той или иной природы.
Список литературы
Ciriminna R., Sciortino M., Alonzo G., de Schrijver A., Pagliaro M. // Chem. Rev. 2011. V. 111. P. 765.
Fan W., Yung B., Huang P., Chen X. // Chem. Rev. 2017. V. 117. P. 13 566.
Saji V.S. // Corros. Rev. 2019. V. 37. P. 187.
Caltagirone C., Bettoschi A., Garau A., Montis R. // Chem. Soc. Rev. 2015. V. 44. P. 4645.
Mekaru H., Lu J., Tamanoi F. // Adv. Drug Deliv. Rev. 2015. V. 95. P. 40.
Shah K.W. // PhD Thesis. National University of Singapore, 2011.
Zhao S., Zhang S., Ma J., Fan L., Yin C., Lin G., Li Q. // Nanoscale. 2015. V. 7. P. 16 389.
Croissant J.G., Cattoën X., Durand J.-O., Man M.W.C., Khashab N.M. // Nanoscale. 2016. V. 8. P. 19 945.
Hesemann P., Nguyen T.P., El Hankari S. // Materials. 2014. V. 7. P. 2978.
Maia F., Tedim J., Lisenkov A.D., Salak A.N., Zheludkevich M.L., Ferreira M.G.S. // Nanoscale. 2012. V. 4. P. 1287.
Chakraborty I., Mascharak P.K. // Micropor. Mesopor. Mat. 2016. V. 234. P. 409.
Castillo R.R., Colilla M., Vallet-Regí M. // Exp. Opin. Drug Deliv. 2017. V. 14. P. 229.
Maleki A., Kettiger H., Schoubben A., Rosenholm J.M., Ambrogi V., Hamidi M. // J. Control. Release. 2017. V. 262. P. 329.
Li X., Wang X., Ito A. // Chem. Soc. Rev. 2018. V. 47. P. 4954.
Croissant J.G., Fatieiev Y., Almalik A., Khashab N.M. // Adv. Healthcare Mater. 2018. V. 7. 1700831.
Wang X., Li X., Ito A., Sogo Y., Watanabe Y., Tsuji N., Ohno T. // ACS Appl. Mater. Interfaces. 2017. V. 9. P. 43 538.
Virginio V.G., Bandeira N.C., dos Anjos Leal F.M., Lancellotti M., Zaha A., Ferreira H.B. // Heliyon. 2017. V. 3. e00225.
Nguyen T.L., Choi Y., Kim J. // Adv. Mater. 2019. V. 31. 1 803 953.
Milgroom A., Intrator M., Madhavan K., Mazzaro L., Shandas R., Liu B., Park D. // Colloids Surf. B. 2014. V. 116. P. 652.
Kempen P.J., Greasley S., Parker K.A., Campbell J.L., Chang H.-Y., Jones J.R., Sinclair R., Gambhir S.S., Jokerst J.V. // Theranostics. 2015. V. 5. P. 631.
Mesoporous Silica-Based Nanomaterials and Biomedical Applications / Ed. by Tamanoi F. Amsterdam: Elsevier, 2019.
Smart Nanocontainers / Ed. by Nguyen-Tri P., Do T.-O., Nguyen T.A. Amsterdam: Elsevier, 2020.
Ying J.Y., Mehnert C.P., Wong M.S. // Angew. Chem. Int. Ed. 1999. V. 38. P. 56.
Hoffmann F., Cornelius M., Morell J., Fröba M. // Angew. Chem. Int. Ed. 2006. V. 45. P. 3216.
Wan Y., Zhao D. // Chem. Rev. 2007. V. 107. P. 2821.
Han L., Che S. // Chem. Soc. Rev. 2013. V. 42. P. 3740.
Huo Q., Margolese D.I., Ciesla U., Demuth D.G., Feng P., Gier T.E., Sieger P., Firouzi A., Chmelka B.F., Schuth F., Stucky G.D. // Chem. Mater. 1994. V. 6. P. 1176.
Zhang Y., Hsu B.Y.W., Ren C., Li X., Wang J. // Chem. Soc. Rev. 2015. V. 44. P. 315.
Dong R., Liu W., Hao J. // Acc. Chem. Res. 2012. V. 45. P. 504.
Edler K.J. // Aust. J. Chem. 2005. V. 58. P. 627.
Blin J.L., Impéror-Clerc M. // Chem. Soc. Rev. 2013. V. 42. P. 4071.
Tan B., Rankin S.E. // J. Phys. Chem. B. 2004. V. 108. P. 20122.
Rosenholm J.M., Sahlgren C., Lindén M. // Nanoscale. 2010. V. 2. P. 1870.
Yamamoto E., Kuroda K. // Bull. Chem. Soc. Jpn. 2016. V. 89. P. 501.
Beurroies I., Agren P., Buchel G., Rosenholm J.B., Amenitsch H., Denoyel R., Linden M. // J. Phys. Chem. B. 2006. V. 110. P. 16254.
Hollamby M.J., Borisova D., Brown P., Eastoe J., Grillo I., Shchukin D. // Langmuir. 2012. V. 28. P. 4425.
Sun B., Zhou G., Zhang H. // Prog. Solid State Chem. 2016. V. 44. P. 1.
Wang Y., Du X., Liu Z., Shi S., Lv H. // J. Mater. Chem. A. 2019. V. 7. P. 5111.
Yamada H., Urata C., Ujiie H., Yamauchi Y., Kuroda K. // Nanoscale. 2013. V. 5. P. 6145.
Huang M., Liu L., Wang S., Zhu H., Wu D., Yu Z., Zhou S. // Langmuir. 2017. V. 33. P. 519.
Pada A.-K., Desai D., Sun K., Govardhanam N.P., Törnquist K., Zhang J., Rosenholm J.M. // Int. J. Mol. Sci. 2019. V. 20. P. 3408.
Widenmeyer M., Anwander R. // Chem. Mater. 2002. V. 14. P. 1827.
Lin H.-P., Mou C.-Y. // Acc. Chem. Res. 2002. V. 35. P. 927.
Lin H.-P., Mou C.-Y. // Micropor. Mesopor. Mat. 2002. V. 55. P. 69.
Choi E., Lim D.-K., Kim S. // J. Colloid Interface Sci. 2020. V. 560. P. 416.
Wen J., Yang K., Liu F., Li H., Xu Y., Sun S. // Chem. Soc. Rev. 2017. V. 46. P. 6024.
Zhang L., Bei H.P., Piao Y., Wang Y., Yang M., Zhao X. // ChemPhysChem. 2018. V. 19. P. 1956.
Vallet-Regí M., Balas F., Arcos D. // Angew. Chem. Int. Ed. 2007. V. 46. P. 7548.
Zheng Z., Schenderlein M., Huang X., Brownbill N.J., Blanc F., Shchukin D. // ACS Appl. Mater. Interfaces. 2015. V. 7. P. 22756.
Kermannezhad K., Chermahini A.N., Momeni M.M., Rezaei B. // Chem. Eng. J. 2016. V. 306. P. 849.
Siva T., Sunder M., Sreejakumari S.S., Sathiyanarayanan S. // RSC Adv. 2015. V. 5. P. 39278.
Дементьева О.В., Филиппенко М.А., Виноградова М.М., Огарев В.А., Меерович Г.А., Каршиева С.Ш., Белов М.С., Лукьянец Е.А., Рудой В.М. // Российские нанотехнологии. 2014. Т. 9. № 3−4. С. 25.
Song N., Yang Y.-W. // Chem. Soc. Rev. 2015. V. 44. P. 3474.
Yang K.-N., Zhang C.-Q., Wang W., Wang P.C., Zhou J.-P., Liang X.-J. // Cancer Biol. Med. 2014. V. 11. P. 34.
Gisbert-Garzarán M., Manzano M., Vallet-Regí M. // Bioengineering. 2017. V. 4. P. 3.
Bansal K.K., Mishra D.K., Rosling A., Rosenholm J.M. // Appl. Sci. 2020. V. 10. P. 289.
Saremi M., Yeganeh M. // Corrosion Sci. 2014. V. 86. P. 159.
Qian B., Michailidis M., Bilton M., Hobson T., Zheng Z., Shchukin D. // Electrochim. Acta. 2019. V. 297. P. 1035.
Jain P., Patidar B., Bhawsar J. // J. Bio. Tribo. Corros. 2020. V. 6. P. 43.
Castaldo R., Salzano de Luna M., Siviello C., Gentile G., Lavorgna M., Amendola E., Cocca M. // J. Cult. Herit. 2020. (в пeчaти). https://www.sciencedirect.com/science/article/abs/pii/S1296207419306314.
Tannock I.F., Rotin D. // Cancer Res. 1989. V. 49. P. 4373.
Fang J., Nakamura H., Maeda H. // Adv. Drug Deliv. Rev. 2011. V. 63. P. 136.
Attia M.F., Anton N., Wallyn J., Omran Z., Vandamme T.F. // J. Pharm. Pharmacol. 2019. V. 71. P. 1185.
He Q., Zhang J., Shi J., Zhu Z., Zhang L., Bu W., Guo L., Chen Y. // Biomaterials. 2010. V. 31. P. 1085.
Suk J.S., Xu Q., Kim N., Hanes J., Ensign L.M. // Adv. Drug Deliv. Rev. 2016. V. 99. P. 28.
Vivero-Escoto J.L., Slowing I.I., Trewyn B.G., Lin V.S.-Y. // Small. V. 2010. V. 6. P. 1952.
Zhou X., Chen L., Nie W., Wang W., Qin M., Mo X., Wang H., He C. // J. Phys. Chem. C. 2016. V. 120. P. 22 375.
Qu W., Meng B., Yu Y., Wang S. // Int. J. Nanomed. 2018. V. 13. P. 4379.
Li Y., Wang S., Song F.X., Zhang L., Yang W., Wang H.X., Chen Q.L. // Colloids Surf. A. 2020. V. 590. P. 124 470.
Feng W., Zhou X., He C., Qiu K., Nie W., Chen L., Wang H., Mo X., Zhang Y. // J. Mater. Chem. B. 2013. V. 1. P. 5886.
Yilmaz M.D. // Carbohydr. Polym. 2016. V. 146. P. 174.
Anirudhan T.S., Vasantha C.S., Sasidharan A.V. // Eur. Polym. J. 2017. V. 93. P. 572.
Sarode A., Annapragada A., Guo J., Mitragotri S. // Biomaterials. 2020. V. 242. 119929.
Skorb E.V., Skirtach A.G., Sviridov D.V., Shchukin D.G., Möhwald H. // ACS Nano. 2009. V. 3. P. 1753.
Wan X., Zhang G., Liu S. // Macromol. Rapid Commun. 2011. V. 32. P. 1082.
Zheng Q., Lin T., Wu H., Guo L., Ye P., Hao Y., Guo Q., Jiang J., Fu F., Chen G. // Int. J. Pharm. 2014. V. 463. P. 22.
Zheng X., Zhang J., Wang J., Qi X., Rosenholm J.M., Cai K. // J. Phys. Chem. C. 2015. V. 119. P. 24512.
Chang D., Gao Y., Wang L., Liu G., Chen Y., Wang T., Tao W., Mei L., Huang L., Zeng X. // J. Colloid Interface Sci. 2016. V. 463. P. 279.
Wang Z., Duan Y., Duan Y. // J. Control. Release. 2018. V. 290. P. 56.
Guan H., Wang L., Zhang J., Xing Y., Cai K. // Part. Part. Syst. Char. 2018. V. 35. P. 1800011.
Lei W., Sun C., Jiang T., Gao Y., Yang Y., Zhao Q., Wang S. // Mater. Sci. Eng. C. 2019. V. 105. 110103.
Qian B., Zheng Z., Michailids M., Fleck N., Bilton M., Song Y., Li G., Shchukin D. // ACS Appl. Mater. Interfaces. 2019. V. 11. P. 10283.
Xia T., Kovochich M., Liong M., Meng H., Kabehie S., George S., Zink J.I., Nel A.E. // ACS Nano. 2009. V. 3. P. 3273.
Chen K., Zhang J., Gu H. // J. Mater. Chem. 2012. V. 22. P. 22 005.
Wang X., Masse S., Laurent G., Hélary C., Coradin T. // Langmuir. 2015. V. 31. P. 11078.
Wang X., Niu D., Hu C., Li P. // Curr. Pharm. Des. 2015. V. 21. P. 6140.
Varache M., Bezverkhyy I., Weber G., Saviot L., Chassagnon R., Baras F., Bouyer F. // Langmuir. 2019. V. 35. P. 8984.
Choi E., Kim S. // J. Colloid Interface Sci. 2019. V. 533. P. 463.
Paris J.L., de la Torre P., Cabañas M.V., Manzano M., Grau M., Flores A.I., Vallet-Regí M. // Nanoscale. 2017. V. 9. P. 5528.
Liu J., Stace-Naughton A., Jiang X., Brinker C.J. // J. Am. Chem. Soc. 2009. V. 131. P. 1354.
Butler K.S., Durfee P.N., Theron C., Ashley C.E., Carnes E.C., Brinker C.J. // Small. 2016. V. 12. P. 2173.
Dengler E.C., Liu J., Kerwin A., Torres S., Olcott C.M., Bowman B.N., Armijo L., Gentry K., Wilkerson J., Wallace J., Jiang X., Carnes E.C., Brinker C.J., Milligan E.D. // J. Control. Release. 2013. V. 168. P. 209.
Datz S., Engelke H., Schirnding C.V., Nguyen L., Bein T. // Micropor. Mesopor. Mat. 2016. V. 225. P. 371.
Gonzalez Porras M.A., Durfee P., Giambini S., Sieck G.C., Brinker C.J., Mantilla C.B. // Nanomed.: Nanotechnol. Biol. Medicine. 2018. V. 14. P. 661.
Zhang X., Li F., Guo S., Chen X., Wang X., Li J., Gan Y. // Biomaterials. 2014. V. 35. P. 3650.
Zhang Q., Chen X., Shi H., Dong G., Zhou M., Wang T., Xin H. // Colloids Surf. B. 2017. V. 160. P. 527.
Liu Y., Luo J., Chen X., Liu W., Chen T. // Nano-Micro Lett. 2019. V. 11. P. 100.
Su J., Sun H., Meng Q., Zhang P., Yin Q., Li Y. // Theranostics. 2017. V. 7. P. 523.
Liu C.-M., Chen G.-B., Chen H.-H., Zhang J.-B., Li H.-Z., Sheng M.-X., Weng W.-B., Guo S.-M. // Colloids Surf. B. 2019. V. 175. P. 477.
Xie W., Deng W.W., Zan M., Rao L., Yu G.T., Zhu D.M., Wu W.T., Chen B., Ji L.W., Chen L., Liu K., Guo S.S., Huang H.M., Zhang W.F., Zhao X., Yuan Y., Dong W., Sun Z.J., Liu W. // ACS Nano. 2019. V. 13. P. 2849.
de la Torre P., Pérez-Lorenzo M.J., Alcázar-Garrido Á., Flores A.I. // Molecules. 2020. V. 25. P. 715.
Paris J.L., de la Torre P., Manzano M., Cabañas M.V., Flores A.I., Vallet-Regí M. // Acta Biomater. 2016. V. 33. P. 275.
Paris J.L., de la Torre P., Cabañas M.V., Manzano M., Flores A.I., Vallet-Regí M. // Acta Biomater. 2019. V. 83. P. 372.
Chen Z.-A., Wu S.-H., Chen P., Chen Y.-P., Mou C.-Y. // ACS Appl. Mater. Interfaces. 2019. V. 11. P. 4790.
https://www.accessdata.fda.gov/scripts/cder/iig/ index.Cfm?event=BasicSearch.page
Wilhelm S., Tavares A.J., Dai Q., Ohta S., Audet J., Dvorak H.F., Chan W.C.W. // Nat. Rev. Mater. 2016. V. 1. 16 014.
Tourné-Péteilh C., Lerner D.A., Charnay C., Nicole L., Bégu S., Devoisselle J.M. // ChemPhysChem. 2003. V. 4. P. 281.
Tsai C.-H., Vivero-Escoto J.L., Slowing I.I., Fang I-J., Trewyn B.G., Lin V.S.-Y. // Biomaterials 2011. V. 32. P. 6234.
Lin W.G., Wei F., Hou Q., Zhang T.Y., Wang Y.K., Zhu J.H. // Micropor. Mesopor. Mat. 2012. V. 156. P. 233.
Liang Z., Zhao Z., Sun T., Shi W., Cui F. // J. Hazard. Mater. 2016. V. 305. P. 8.
Liang Z., Shi W., Zhao Z., Sun T., Cui F. // J. Colloid Interface Sci. 2017. V. 496. P. 382.
Son Y.-H., Park M., Choy Y.B., Choi H.R., Kim D.S., Park K.C., Choy J.-H. // Chem. Commun. 2007. 2799.
Hao N., Chen X., Jayawardana K.W., Wu B., Sundhoro M., Yan M. // Biomater. Sci. 2016. V. 4. P. 87.
Yan S., Gao Z., Xia Y., Liao X., Chen Y., Han J., Pan C., Zhang Y. // Inorg. Chem. 2018. V. 57. P. 13653.
Park M., Choo H.Y. // J. Mater. Chem. 2009. V. 19. P. 7273.
Zheng H., Gao C., Peng B., Shu M., Che S. // J. Phys. Chem. C. 2011. V. 115. P. 7230.
Botella P., Corma A., Quesada M. // J. Mater. Chem. 2012. V. 22. P. 6394.
Tourne-Peteilh C., Begu S., Lerner D.A., Galarneau A., Lafont U., Devoisselle J.-M. // J. Sol-Gel Sci. Technol. 2012. V. 61. P. 455.
Bathfield M., Reboul J., Cacciaguerra T., Lacroix-Desmazes P., Gérardin C. // Chem. Mater. 2016. V. 28. P. 3374.
Wan M.M., Li Y.Y., Yang T., Zhang T., Sun X.D., Zhu J.H. // Chem. Eur. J. 2016. V. 22. P. 6294.
Chen H., Hu J., Zhou H., Zhou X., Xu H. // J. Macromol. Sci. A. 2019. V. 56. P. 34.
Clifford N.W., Iyer K.S., Raston C.L. // J. Mater. Chem. 2008. V. 18. P. 162.
He Q., Gao Y., Zhang L., Zhang Z., Gao F., Ji X., Li Y., Shi J. // Biomaterials. 2011. V. 32. P. 7711.
He Q.J., Gao Y., Zhang L.X., Bu W.B., Chen H.R., Li Y.P., Shi J.L. // J. Mater. Chem. 2011. V. 21. P. 15 190.
Zhang X., Zhang X., Wang S., Liu M., Zhang Y., Tao L., Wei Y. // ACS Appl. Mater. Interfaces. 2013. V. 5. P. 1943.
Jia L., Li Z., Shen J., Zheng D., Tian X., Guo H., Chang P. // Int. J. Pharm. 2015. V. 489. P. 318.
Kerkhofs S., Saïdi F., Vandervoort N., Van den Mooter G., Martineau C., Taulelle F., Martens J.A. // J. Mater. Chem. B. 2015. V. 3. P. 3054.
Yildirim A., Turkaydin M., Garipcan B., Bayindir M. // RSC Adv. 2016. V. 6. P. 32060.
Xu J.-B., Cao Y.-Q., Fang L., Hu J.-M. // Corrosion Sci. 2018. V. 140. P. 349.
Ruggiero L., Di Bartolomeo E., Gasperi T., Luisetto I., Talone A., Zurlo F., Peddis D., Ricci M.A., Sodo A. // J. Alloy Compd. 2019. V. 798. P. 144.
Fu Z., Li L., Wang Y., Chen Q., Zhao F., Dai L., Chen Z., Liu D., Guo X. // Chem. Eng. J. 2020. V. 382. 122 905.
Mei J., Leung N.L.C., Kwok R.T.K., Lam J.W.Y., Tang B.Z. // Chem. Rev. 2015. V. 115. P. 11 718.
Feng G., Liu B. // Small. 2016. V. 12. P. 6528.
Rosen M.J. Surfactants and Interfacial Phenomena. Hoboken: Wiley-Interscience, 2004. P. 178.
He Q., Shi J., Chen F., Zhu M., Zhang L. // Biomaterials. 2010. V. 31. P. 3335.
Schreier S., Malheiros S.V.P., de Paula E. // Biochim. Biophys. Acta. 2000. V. 1508. P. 210.
Pinazo A., Manresa M.A., Marques A.M., Bustelo M., Espuny M.J., Pérez L. // Adv. Colloid Interface Sci. 2016. V. 228. P. 17.
Raja P.B., Ismail M., Ghoreishiamiri S., Mirza J., Ismail M.C., Kakooei S., Rahim A.A. // Chem. Eng. Commun. 2016. V. 203. P. 1145.
Egorova K.S., Gordeev E.G., Ananikov V.P. // Chem. Rev. 2017. V. 117. P. 7132.
Cheetham A.G., Chakroun R.W., Ma W., Cui H. // Chem. Soc. Rev. 2017. 46. P. 6638.
Schattschneider C., Kettenmann S.D., Hinojosa S., Heinrich J., Kulak N. // Coord. Chem. Rev. 2019. V. 385. P. 191.
Trewyn B.G., Whitman C.M., Lin V.S.-Y. // Nano Lett. 2004. V. 4. P. 2139.
Qu F., Zhu G., Lin H., Sun J., Zhang D., Li S., Qiu S. // Eur. J. Inorg. Chem. 2006. V. 2006. P. 3943.
Dement'eva O.V., Rudoy V.M. // RSC Adv. 2016. V. 6. P. 36207.
Дементьева О.В., Сенчихин И.Н., Карцева М.Е., Огарев В.А., Зайцева А.В., Матушкина Н.Н., Рудой В.М. // Коллоид. журн. 2016. Т. 78. С. 539.
Дементьева О.В., Наумова К.А., Сенчихин И.Н., Румянцева Т.Б., Рудой В.М. // Коллоид. журн. 2017. Т. 79. С. 402.
Dement’eva O.V., Naumova K.A., Zhigletsova S.K., Klykova M.V., Somov A.N., Dunaytsev I.A., Senchikhin I.N., Volkov V.V., Rudoy V.M. // Colloids Surf. B. 2020. V. 185. 110577.
Morales V., Gutiérrez-Salmerón M., Balabasquer M., Ortiz-Bustos J., Chocarro-Calvo A., García-Jiménez C., García-Muñoz R.A. // Adv. Funct. Mater. 2016. V. 26. P. 7291.
Stewart C.A., Finer Y., Hatton B.D. // Sci. Rep. 2018. V. 8. P. 895.
Stewart C.A., Hong J.H., Hatton B.D., Finer Y. // Acta Biomater. 2018. V. 76. P. 283.
Dubovoy V., Ganti A., Zhang T., Al-Tameemi H., Cerezo J.D., Boyd J.M., Asefa T. // J. Am. Chem. Soc. 2018. V. 140. P. 13534.
He Y., Zhang Y., Sun M., Yang C., Zheng X., Shi C., Chang Z., Wang Z., Chen J., Pei S., Dong W.-F., Shao D., She J. // Colloids Surf. B. 2020. V. 187. 110 653.
Дементьева О.В., Румянцева Т.Б., Рудой В.М. // Коллоид. журн. 2016. Т. 78. С. 265.
Дементьева О.В., Виноградова М.М., Фролова Л.В., Огарев В.А., Кузнецов Ю.И., Рудой В.М. // Коллоид. журн. 2014. Т. 76. С. 22.
Дементьева О.В., Фролова Л.В., Рудой В.М., Кузнецов Ю.И. // Коллоид. журн. 2016. Т. 78. С. 550.
Дементьева О.В., Семилетов А.М., Чиркунов А.А., Рудой В.М., Кузнецов Ю.И. // Коллоид. журн. 2018. Т. 80. С. 498.
Дементьева О.В., Сенчихин И.Н., Рудой В.М. // Коллоид. журн. 2020. Т. 82. С. 302.
Liang Y., Wang M.D., Wang C., Feng J., Li J.S., Wang L.J., Fu J.J. // Nanoscale Res. Lett. 2016. V. 11. P. 231.
Дементьева О.В., Сенчихин И.Н., Седых Э.М., Громяк И.Н., Огарев В.А., Рудой В.М. // Коллоид. журн. 2016. Т. 78. С. 35.
Yan S., Gao Z., Han J., Zhang Z., Niu F., Zhang Y. // J. Mater. Chem. C. 2019. V. 7. P. 12588.
Айлер Р. Химия кремнезема. Т. 1. М.: Мир, 1982.
Croissant J.G., Fatieiev Y., Khashab N.M. // Adv. Mater. 2017. V. 29. 1604634.
Choi E., Kim S. // Langmuir. 2017. V. 33. P. 4974.
Ritger P.L., Peppas N.A. // J. Control. Release. 1987. V. 5. P. 37.
Siepmann J., Göpferich A. // Adv. Drug Deliv. Rev. 2001. V. 48. P. 229.
Агафонкина М.О., Семилетов А.М., Кузнецов Ю.И., Андреева Н.П., Чиркунов А.А. // Коррозия: материалы, защита. 2016. № 5. С. 15.
Семилетов А.М. Кузнецов Ю.И., Чиркунов А.А. // Коррозия: материалы, защита. 2017. № 10. С. 16.
Огородникова В.А., Кузнецов Ю.И., Андреева Н.П., Чиркунов А.А. // Коррозия: материалы, защита. 2018. № 5. С. 27.
Наумова К.А., Дементьева О.В., Зайцева А.В., Рудой В.М. // Коллоид. журн. 2019. Т. 81. С. 478.
Наумова К.А., Дементьева О.В., Сенчихин И.Н., Рудой В.М. // Неопубликованные результаты.
Karimi A., Ghodsi R., Kooshki F., Karimi M., Asghariazar V., Tarighat-Esfanjani A. // Phytother. Res. 2019. V. 33. P. 2798.
Farhood B., Mortezaee K., Goradel N.H., Khanlarkhani N., Salehi E., Nashtaei M.S., Najafi M., Sahebkar A. // J. Cell. Physiol. 2019. V. 234. P. 5728.
Qamar S., Brown P., Ferguson S., Khan R.A., Ismail B., Khan A.R., Sayed M., Khan A.M. // J. Colloid Interface Sci. 2016. V. 481. P. 117.
Gehlot P.S., Gupta H., Kumar A. // Colloid Interface Sci. Commun. 2018. V. 26. P. 14.
Sharma N.K., Singh M., Bhattarai A. // RSC Adv. 2016. V. 6. P. 90607.
Kaur G., Garg P., Chaudhary G.R. // RSC Adv. 2016. V. 6. P. 7066.
Akram M., Anwar S., Bhat I.A., Kabir-ud-Din // Colloids Surf. A. 2018. V. 555. P. 121.
Duhem N., Danhier F., Pourcelle V., Schumers J.-M., Bertrand O., Le Duff C.S., Hoeppener S., Schubert U.S., Gohy J.-F., Marchand-Brynaert J., Préat V. // Bioconjugate Chem. 2014. V. 25. P. 72.
Kapoor B., Gupta R., Singh S.K., Gulati M., Singh S. // Adv. Colloid Interface Sci. 2018. V. 253. P. 35.
Luo C., Sun J., Sun B., He Z. // Trends Pharm. Sci. 2014. V. 35. P. 556.
Ma W., Su H., Cheetham A.G., Zhang W., Wang Y., Kan Q.C., Cui H. // J. Control. Release. 2017. V. 263. P. 102.
Li H., Chang J., Hou T., Li F. // J. Mater. Chem. B. 2016. V. 4. P. 198.
Li D. // Inorg. Chem. Front. 2019. V. 6. P. 1613.
Guan W., Wang S., Lu C., Tang B.Z. // Nat. Commun. 2016. 11811.
Soenen S.J., Parak W.J., Rejman J., Manshian B. // Chem. Rev. 2015. V. 115. P. 2109.
Quignard S., Coradin T., Powell J.J., Jugdaohsingh R. // Colloids Surf. B. 2017. V. 155. P. 530.
Li X., Gao F., Dong Y., Li X. // Nano: Brief Rep. Rev. 2019. V. 14. 1930008.
Zhou H., Ge J., Miao Q., Zhu R., Wen L., Zeng J., Gao M. // Bioconjugate Chem. 2020. V. 31. P. 315.
Croissant J.G., Brinker C.J. // Mesoporous Silica-based Nanomaterials and Biomedical Applications / Ed. by Tamanoi F. Amsterdam: Elsevier, 2019. P. 181.
Brinker C.J. // J. Non-Cryst. Solids. 1988. V. 100. P. 31.
Bunker B.C. // J. Non-Cryst. Solids. 1994. V. 179. P. 300.
Cauda V., Schlossbauer A., Bein T. // Micropor. Mesopor. Mat. 2010. V. 132. P. 60.
Izquierdo-Barba I., Colilla M., Manzano M., Vallet-Regí M. // Micropor. Mesopor. Mat. 2010. V. 132. P. 442.
Li X., Zhang L., Dong X., Liang J., Shi J. // Micropor. Mesopor. Mat. 2007. V. 102. P. 151.
Bass J.D., Grosso D., Boissiere C., Belamie E., Coradin T., Sanchez C. // Chem. Mater. 2007. V. 19. P. 4349.
Landau M.V., Varkey S.P., Herskowitz M., Regev O., Pevzner S., Sen T., Luz Z. // Micropor. Mesopor. Mat. 1999. V. 33. P. 149.
Ratirotjanakul W., Suteewong T., Polpanich D., Tangboriboonrat P. // Micropor. Mesopor. Mat. 2019. V. 282. P. 243.
von Haartman E., Lindberg D., Prabhakar N., Rosenholm J.M. // Eur. J. Pharm. Sci. 2016. V. 95. P. 17.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал