Коллоидный журнал, 2020, T. 82, № 5, стр. 604-610
К термодинамике обратных мицелл: влияние воды на мицеллообразование
А. И. Русанов *
Менделеевский центр, Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7, Россия
* E-mail: rusanov32@list.ru
Поступила в редакцию 18.02.2020
После доработки 28.02.2020
Принята к публикации 04.03.2020
Аннотация
Участие воды в образовании обратной мицеллы может осуществляться в форме либо гидратной оболочки, либо солюбилизата. Оба случая проанализированы в рамках теории, основанной на законе действия масс и определении критической концентрации мицеллообразования (ККМ) через его константу. В первом случае поверхностно-активное вещество (ПАВ) считается исходно гидратированным, и вода автоматически входит в состав ПАВ. Ее количество находится из объема гидратного ядра мицеллы, а число агрегации ПАВ рассчитывается из условий упаковки для сферических, цилиндрических и пластинчатых мицелл. В свою очередь, ККМ определяется по ее зависимости от числа агрегации, устанавливаемой общей теорией. Во втором случае вода учитывается как отдельный компонент мицеллы, но только в форме солюбилизата (гидратная вода по-прежнему входит в химическую формулу ПАВ). Здесь ККМ оказывается зависящей не только от брутто-концентрации воды (без учета ее гидратационной формы), но и от значения критической степени мицеллизации воды. Влияние воды на мицеллообразование проанализировано как при заданном химическом потенциале воды, так и при ее постоянном количестве. Во всех вариантах теория приводит к выводу о понижении ККМ с увеличением содержания воды, что подтверждает предсказание Айке и Христена (Eicke H-F., Christen H. // Helv. Chim. Acta. 1978. V. 61. P. 2258).
ВВЕДЕНИЕ
Отличие обратных мицелл от прямых мицелл существенно во многих аспектах (см., например, обзор [1]). Прежде всего, различен механизм мицеллообразования. Если в обратных мицеллах молекулы поверхностно-активного вещества (ПАВ) притягиваются друг к другу, то в воде они объединяются в прямые мицеллы потому, что вода выталкивает из себя их неполярные части. Отсюда и название – “гидрофобный эффект” (“лиофобный эффект” в случае других полярных растворителей). Само это название свидетельствует об исключительной роли воды в образовании прямых мицелл, когда она является средой. Но, оказывается, особая роль принадлежит воде и при мицеллообразовании в неполярных средах. Еще в работе [2] на основе экспериментальных данных указывалось, что вода – непременный участник образования обратных мицелл хотя бы потому, что она неистребима. Вода всегда имеется в ПАВ, как бы их ни высушивали (прокаливать нельзя ввиду опасности их разложения). Вода всегда присутствует в окружающей среде (мы знаем, что одна из важнейших характеристик воздуха – влажность). Поэтому следы воды в обратных мицеллах всегда найдутся. Тогда можно спросить: не вода ли и есть движущая сила образования обратных мицелл и возможно ли их образование без воды? Так возникла и обсуждается в литературе проблема “сухих” обратных мицелл [3].
Однако данная проблема не вполне логична. Вода – не ПАВ и может принимать непосредственное участие в образовании мицелл только в виде гидрата ПАВ. Другое дело, что для обратных мицелл вода – идеальный солюбилизат. В этом качестве она способствует мицеллообразованию, и именно данный факт представляет интерес для теории. Конкретная задача состоит в том, чтобы установить зависимость критической концентрации мицеллообразования (ККМ) от содержания воды в обратной мицелле. Напомним, что солюбилизация широко исследовалась для мицелл любого типа. При этом был даже разработан метод измерения ККМ по солюбилизации, но с оговоркой, что он вносит некоторую погрешность, ибо сам смещает величину ККМ [4–6]. Вот об этом-то смещении на примере воды как раз и идет речь. Первое рассмотрение данной проблемы было проведено в работе [2], и в данном сообщении мы попытаемся его развить. Но сначала попробуем разобраться, как была сформулирована первоначальная теория.
ТЕОРИЯ АЙКЕ–ХРИСТЕНА
Чтобы подступиться к ККМ, нужно сначала понять, что это такое. Как известно, на практике мицеллообразование характеризуется целой (хоть и узкой) концентрационной областью. Однако в теорию желательно ввести ККМ как некоторую точно определенную концентрацию внутри этой области. Для этого есть множество способов [4–6]. Но Гиббс когда-то записал: “One of the principal objects of theoretical research in any department of knowledge is to find the point of view from which the subject appears in its greatest simplicity” [7]. Руководствуясь этим критерием, мы, несомненно, назовем лучшим определение ККМ через константу закона действия масс [1, 8]. Последний в случае однокомпонентных мицелл и малых концентраций записывается как
где ${{c}_{\operatorname{M} }}$ – концентрация мицелл в растворе ПАВ, $K$ – константа закона действия масс, ${{c}_{1}}$ – концентрация мономеров ПАВ и $n$ – число агрегации. Формулу (1) можно переписать в виде где α – степень мицеллизации ПАВ (c – брутто-концентрация ПАВ):(3)
$\alpha \equiv \frac{{n{{c}_{\operatorname{M} }}}}{c},\,\,\,\,1 - \alpha = \frac{{{{c}_{1}}}}{c}.$Обратимся теперь к работе [2]. Она посвящена, в основном, эксперименту. Теоретический фрагмент в ней слишком лаконичен, а потому дается ниже в понимании автора (по этой же причине данный раздел статьи вынесен из введения). Рассматривается трехкомпонентная система – раствор ПАВ в неполярном растворителе, содержащем небольшое количество воды. В образовании мицелл принимают участие ПАВ (условный химический символ S) и вода (W) с числами агрегации n и z соответственно. Процесс моделируется двумя стадиями. Первая – образование “ядра” мицеллы (условный химический символ N) путем (надо полагать, последовательного) прибавления к молекуле ПАВ z молекул воды. Результат суммируется химическим уравнением
(8)
$\operatorname{S} \,\, + z\operatorname{W} = \operatorname{S} {{\operatorname{W} }_{z}} \equiv \operatorname{N} .$Вторая стадия – формирование собственно мицеллы путем прибавления к ядру n – 1 молекул ПАВ:
(10)
$(n - 1)\operatorname{S} \,\, + \operatorname{N} = {{\operatorname{S} }_{n}}{{\operatorname{W} }_{z}} \equiv \operatorname{M} .$(13)
${{с}_{\operatorname{S} }} = {{с}_{{\operatorname{S} 1}}} + {{c}_{\operatorname{N} }} + n{{c}_{\operatorname{M} }},$(14)
${{c}_{\operatorname{W} }} = {{c}_{{\operatorname{W} 1}}} + z{{c}_{\operatorname{N} }} + z{{c}_{\operatorname{M} }},$(16)
${{c}_{\operatorname{m} }} = {{\left( {\frac{1}{{{{K}_{1}}{{K}_{2}}c_{\operatorname{W} }^{z}}}} \right)}^{{\frac{1}{{n - 1}}}}},$откуда и следует, что с увеличением содержания воды в неполярном растворителе ККМ ПАВ снижается. Формула (16) дает зависимость ${{c}_{\operatorname{m} }}$ от ${{c}_{\operatorname{W} }}$ в явном виде. Но, поскольку сама формула (16) сугубо приближенная, важнее качественный результат. В [2] отмечается, что в данном подходе не учитывается наличие гидратной воды, а что касается грубых приближений, то точное решение уравнений (11)–(14) было достигнуто путем итераций. Результат представлен графиком зависимости ККМ от $\lg {{c}_{\operatorname{W} }}$ при наличии минимума около $\lg {{c}_{\operatorname{W} }}$ = –3.
ТЕОРИЯ НА ОСНОВЕ ГИДРАТНОЙ МОДЕЛИ
Рассматривая ту же систему, что и выше, мы представим здесь противоположный подход. Теперь, наоборот, солюбилизированная вода не учитывается отдельно, а вся вода в мицелле трактуется наподобие гидратной. Иными словами, каждая молекула ПАВ, входя в мицеллу, “прихватывает” с собой определенное количество воды. Как отдельный компонент вода формально отсутствует в мицелле, и, чтобы описать этот случай, достаточно однокомпонентной теории с формулами (1)–(7). Уточненный вариант этой теории для обратных мицелл [12] использует (5) в виде
(17)
${\kern 1pt} \frac{\alpha }{{{{{(1 - \alpha )}}^{n}}}} = {{(\bar {K}c{{n}^{{\frac{1}{{n - 1}}}}})}^{{n - 1}}}$(18)
$\bar {K}{{c}_{\operatorname{m} }}{{n}^{{\frac{1}{{n - 1}}}}} = 1,\,\,\,\,Kn = c_{\operatorname{m} }^{{1 - n}}.$(19)
$\frac{{{{\alpha }_{\operatorname{m} }}}}{{{{{(1 - {{\alpha }_{\operatorname{m} }})}}^{n}}}} = 1.$(20)
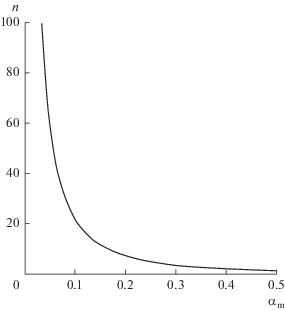
$n = \frac{{\ln {{\alpha }_{\operatorname{m} }}}}{{\ln (1 - {{\alpha }_{\operatorname{m} }})}}.$Рис. 1.
Функция $n({{\alpha }_{\operatorname{m} }})$ согласно формуле (20). Нижняя точка графика n = 1 и ${{\alpha }_{\operatorname{m} }}$ = 0.5, верхняя точка n = 100 и ${{\alpha }_{\operatorname{m} }} \approx $ 0.0334.
Итак, мы определили, как КСМ зависит от числа агрегации. Теперь нужно вспомнить, что наши мицеллы содержат еще и воду и что число молекул воды в мицелле также должно быть связано с числом агрегации. Эту связь установим из условия упаковки для различных геометрических форм мицеллы.
Сферическая мицелла
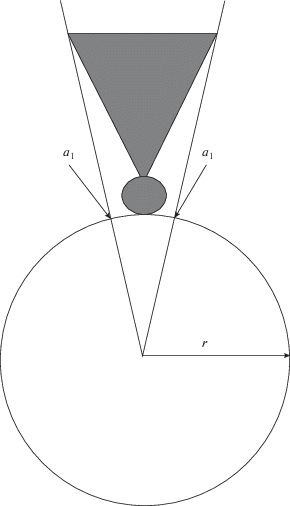
Предположим, что z молекул воды образуют сферическое ядро мицеллы радиуса r (рис. 2). Если ${{{v}}_{2}}$ (индекс 2 отнесем к воде, 1 – к ПАВ) – объем одной молекулы воды, то при плотной упаковке объем ядра V дается выражениями
Соответственно площадь поверхности ядра A можно выразить через z как(22)
$A = 4\pi {{r}^{2}} = {{(36\pi )}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}{{(z{{{v}}_{2}})}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}}.$(23)
$n = \frac{A}{{{{a}_{1}}}} = {{k}_{\operatorname{s} }}{{z}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}},\,\,\,\,{{k}_{\operatorname{s} }} \equiv {{(36\pi )}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}\frac{{{v}_{2}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}}}{{{{a}_{1}}}}.$Цилиндрическая мицелла
Величины n и z сохраняют свой смысл, а r – теперь радиус цилиндрического гидратного ядра мицеллы (рис. 2 годится и для этого случая). В продольном направлении (перпендикулярно плоскости рисунка) цилиндр гидратного ядра мицеллы имеет длину l, а торцевыми частями мицеллы пока пренебрегаем. Вместо (21)–(23) теперь имеем
(25)
$A = 2\pi rl = 2{{(\pi z{{{v}}_{2}}l)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}.$(26)
$n = \frac{A}{{{{a}_{1}}}} = {{k}_{\operatorname{c} }}{{z}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},\,\,\,\,{{k}_{\operatorname{c} }} \equiv \frac{{2{{{(\pi {{{v}}_{2}}l)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}}{{{{a}_{1}}}}.$Пластинчатая дисковая мицелла
Диск – это тот же цилиндр, но такой короткий, что на первый план выходят две торцевые поверхности. Если площадь их велика и все расчеты ведутся на единицу площади в пренебрежении боковой поверхностью диска, то связь между n и z исчезает. Ведь n определяется только площадью торцевой поверхности диска, а z зависит еще и от толщины диска, которая может изменяться независимо от торцевой поверхности. Однако для реальной пластинчатой мицеллы связь между n и z восстанавливается с учетом боковой поверхности. Она может быть цилиндрической, и тогда работает формула (26), но эффект будет слабым ввиду скромной роли боковой поверхности пластинчатой мицеллы.
Итак, изложенная теория на основе гидратной модели приводит к выводу о том, что КСМ и ККМ ПАВ снижаются с увеличением концентрации воды в системе. Эффект зависит от геометрической формы мицелл и наиболее выражен для сферических мицелл.
ОБЩАЯ ТЕОРИЯ В РАМКАХ ЗАКОНА ДЕЙСТВИЯ МАСС
Мы возвращаемся теперь на позиции общей теории, когда вода считается отдельным компонентом независимо от наличия гидратной воды у молекул ПАВ. Это значит, что учитывается солюбилизация воды в мицеллах и именно солюбилизированная вода входит в формулы со своим числом агрегации z. Теперь это число значительно меньше, чем в предыдущем разделе, потому что гидратная вода автоматически учитывается вместе с ПАВ и не входит в z. Если число гидратации есть m, то общее число гидратных молекул воды в одной мицелле составит nm. Число же солюбилизированных молекул не может быть большим в сферических или цилиндрических (на единицу длины) мицеллах. Иначе внутри мицеллы образуется объемная фаза воды, и тогда лапласово давление будет выталкивать воду из мицеллы.
Закон действия масс теперь записывается в виде
где первый индекс 1 относится к ПАВ и 2 – к воде, а дополнительный индекс 1 указывает на принадлежность величины к мономерам. Вводя степень мицеллизации ПАВ ${{\alpha }_{1}}$ согласно (3), перепишем (27) как где ${{с}_{1}}$ – брутто-концентрация ПАВ в растворе. Посмотрим теперь, как меняется это выражение при добавлении ПАВ. Обычно в термодинамике многокомпонентных систем изменение содержания одного компонента рассматривается при постоянстве или массы или химических потенциалов других компонентов. Начнем с постоянства химического потенциала.Случай постоянства химического потенциала воды
Это условие достигается подключением к системе мощного резервуара воды. В принципе достаточно контакта с воздухом заданной влажности. Но наиболее практично наличие достаточно массивного слоя воды, находящегося в равновесии со слоем неполярной жидкости, в котором и разыгрывается процесс мицеллообразования. При добавлении ПАВ к системе, естественно, будут расти брутто-концентрация ПАВ ${{с}_{1}}$ и число мицелл с данными числами агрегации n и z. Постоянство же химического потенциала воды обеспечит постоянство концентрации ${{с}_{{21}}},$ и единственной переменной в правой части (28) остается ${{с}_{1}}$. Тогда ККМ определяется из условия
(29)
${{c}_{\operatorname{m} }} = {{\left( {\frac{1}{{nKc_{{21}}^{z}}}} \right)}^{{\frac{1}{{n - 1}}}}}.$Случай постоянства количества воды
Ввиду малости всех концентраций и преобладания массы неполярного растворителя, можно пренебречь изменением объема раствора при прибавлении ПАВ. Тогда можно принять, что постоянство количества воды практически эквивалентно постоянству ее брутто-концентрации ${{с}_{2}}.$ Баланс массы воды теперь имеет вид (сравните с (14))
Из (28) и (30) находим(31)
$\frac{{{{\alpha }_{1}}}}{{{{{(1 - {{\alpha }_{1}})}}^{n}}}} = nKc_{1}^{{n - 1}}{{({{с}_{2}} - z{{c}_{\operatorname{M} }})}^{z}}$(32)
$\begin{gathered} \frac{{{{\alpha }_{1}}}}{{{{{(1 - {{\alpha }_{1}})}}^{n}}}} = {{\left[ {{{{(nK)}}^{{\frac{1}{{n - 1}}}}}{{{({{с}_{2}} - z{{c}_{\operatorname{M} }})}}^{{\frac{z}{{n - 1}}}}}{{c}_{1}}} \right]}^{{n - 1}}} = \\ = {{\left[ {{{{(nKс_{2}^{z})}}^{{\frac{1}{{n - 1}}}}}{{{(1 - {{\alpha }_{2}})}}^{{\frac{z}{{n - 1}}}}}{{c}_{1}}} \right]}^{{n - 1}}}, \\ \end{gathered} $(35)
${{\lambda }_{\operatorname{m} }} \equiv {{с}_{{1\operatorname{m} }}}{{(1 - {{\alpha }_{{2\operatorname{m} }}})}^{{\frac{z}{{n - 1}}}}}.$(37)
${{с}_{{1\operatorname{m} }}} = \frac{1}{{{{{(nK)}}^{{\frac{1}{{n - 1}}}}}{{{\left[ {{{с}_{2}}(1 - {{\alpha }_{{2\operatorname{m} }}})} \right]}}^{{\frac{z}{{n - 1}}}}}}}.$(38)
${{\alpha }_{{2\operatorname{m} }}} = \frac{{z{{c}_{{\operatorname{M} \operatorname{m} }}}}}{{{{c}_{2}}}} \ll 1,$По поводу степеней z и n – 1 можно заметить следующее. Из теории и практики солюбилизации [4–6] известно, что число солюбилизированных молекул в сферической мицелле не может быть большим, как это уже отмечалось выше. Следовательно, если говорить о сферических мицеллах, в нашем случае число солюбилизированных молекул воды z невелико. Но будет ли оно меньше числа агрегации ПАВ? Если бы речь шла о прямых мицеллах, мы, конечно, положили бы z ⪡ n – 1. Но ведь числа агрегации обратных мицелл обычно меньше. Встречается даже n = 2, однако для обычных (не полимерных) ПАВ это не наш случай: во-первых, для образования солюбилизационной полости требуется несколько молекул ПАВ, во-вторых, сама солюбилизация приводит к дополнительному увеличению числа агрегации ПАВ [4–6]. Поэтому случай, когда $z < n - 1$, не выглядит невозможным для обратных мицелл. В таком случае показатель z/(n – 1) при $1 - {{\alpha }_{{2\operatorname{m} }}}$ означает извлечение кратного корня. Эта операция приближает множитель ${{(1 - {{\alpha }_{{2\operatorname{m} }}})}^{{{z \mathord{\left/ {\vphantom {z {(n - 1)}}} \right. \kern-0em} {(n - 1)}}}}}$ к единице, а саму формулу (37) к виду
что соответствует подходу Айке–Христена.ЗАКЛЮЧЕНИЕ
В своих разных вариантах приведенная теория подтверждает вывод Айке–Христена о том, что добавление воды вызывает понижение ККМ в неполярных средах. При этом возможны ситуации, когда именно вода, казалось бы, и вызывает мицеллообразование. Представим себе, что в отсутствие воды мы имеем раствор ПАВ в неполярной среде с концентрацией немного ниже ККМ. Тогда концентрация мицелл так мала, что обнаружить их невозможно. Теперь добавим воду, и, поскольку она снизит ККМ, система окажется в состоянии выше ККМ. Итак, мицелл не было, а мы прибавили воду, и мицеллы налицо. “Так разве не вода их создала?” скажет эмпирик. Нет, не вода, и приведенная теория, в дополнение к классическим трудам Айке, хорошо поясняет, как все надо понимать.
Правда, данная теория, основанная на определении ККМ через константу закона действия масс, хорошо работает при достаточно больших числах агрегации. В обратных же мицеллах числа агрегации бывают малыми. Тогда, как указывалось выше, механизм солюбилизации может быть нарушен. В общей теории последнего раздела только солюбилизированная вода трактовалась как отдельный компонент мицеллы. Если такой воды нет, то и теория теряет силу, и нужно вернуться к предыдущему разделу, где рассматривалась только гидратационная вода. Наконец, нужно отметить, что, хотя рассуждения велись на примере воды, теория имеет общий характер и применима к любым сольватам и солюбилизатам.
Список литературы
Eicke H.-F. // In: Topics in Current Chemistry. V. 87. Micelles / Ed. by Boschke F.L. Berlin: Springer, 1980. p. 85.
Eicke H.-F., Christen H. // Helv. Chim. Acta. 1978. V. 61. P. 2258.
Urano R., Pantelopulos G.A., Straub J.E. // J. Phys. Chem. B. 2019. V. 123. P. 2546.
Русанов А.И. Мицеллообразование в растворах поверхностно-активных веществ. СПб.: Химия, 1992.
Rusanov A.I. Chemistry Reviews / Ed. by Vol’pin M.E. V. 22. Part 1. Reading: Harwood Academic Publ., 1996.
Русанов А.И., Щёкин А.К. Мицеллообразование в растворах поверхностно-активных веществ, 2-е изд., доп. СПб.: Лань, 2016.
Gibbs J.W. // Proc. Amer. Acad. 1881. V. 16. P. 420.
Lindman B., Wennerström H. // In: Topics in Current Chemistry. V. 87. Micelles / Ed. by Boschke F.L. Berlin: Springer, 1980. p. 1.
Rusanov A.I. // Langmuir. 2014. V. 30. P. 14443.
Русанов А.И. // Коллоид. журн. 2016. Т. 78. С. 358.
Русанов А.И. // Коллоид. журн. 2016. Т. 78. С. 613.
Русанов А.И. // Коллоид. журн. 2020. Т. 82. С. 463.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал