Коллоидный журнал, 2020, T. 82, № 6, стр. 733-739
Золотые наностержни с органокремнеземной оболочкой как платформа для создания многофункциональных наноструктур
Н. А. Салаватов 1, О. В. Дементьева 1, *, В. М. Рудой 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва,
Ленинский просп., 31, Россия
* E-mail: dema_ol@mail.ru
Поступила в редакцию 23.06.2020
После доработки 01.07.2020
Принята к публикации 06.07.2020
Аннотация
В работе проанализированы перспективы использования γ-меркаптопропилтриметоксисилана в качестве прекурсора при конструировании многофункциональных композитных наночастиц (КНЧ) со стержневидным золотым ядром и органокремнеземной оболочкой. Показано, что наличие в составе оболочки тиольных групп, способных специфически взаимодействовать с ионами и атомами металлов, позволяет “напрямую” (т.е. без какой-либо дополнительной модификации) загружать в нее достаточно большое количество противоракового препарата цисплатина. Кроме того, получены предварительные данные, свидетельствующие о возможности нитрозирования SH-групп оболочки, что весьма существенно с точки зрения создания КНЧ-контейнеров для NO, позволяющих обеспечить не только его доставку в опухоль, но и контролируемое высвобождение под действием лазерного излучения.
ВВЕДЕНИЕ
Композитные наночастицы (КНЧ) с металлическим (Au, Ag) ядром и диэлектрической оболочкой представляют значительный интерес для решения различных прикладных задач, включая тераностику опухолей и создание сверхъярких источников излучения (в том числе, когерентного) или метаматериалов [1–3].
В основе такого интереса лежит присущий наночастицам металлов эффект локализованного поверхностного плазмонного резонанса (ЛППР), обуславливающий их способность к многократному усилению электромагнитного поля вблизи своей поверхности, а также к резонансному рассеянию и поглощению излучения строго определенной длины волны [4]. Этот эффект, в частности, приводит к изменению излучательных свойств молекул, находящихся в непосредственной близости от частиц [1, 2, 5], а также позволяет трансформировать поглощаемое излучение в тепло [2, 6].
Создание на поверхности плазмонных частиц-ядер диэлектрической (как правило, кремнеземной) оболочки и последующая загрузка в нее тех или иных функциональных соединений (флуорофоров, лекарственных препаратов и др.) открывает ряд дополнительных возможностей. Так, например, загрузка в оболочку КНЧ лекарственного препарата позволяет обеспечить его контролируемое высвобождение под действием лазерного излучения [2].
Наибольшее внимание исследователей привлекают КНЧ на основе золотых наностержней (ЗНСт), поскольку для таких структур возможна настройка ЛППР в широком диапазоне длин волн (видимой и ближней ИК-области спектра) за счет изменения отношения длины частиц к их диаметру [7]. Это весьма существенно для целого ряда приложений. В частности, ЗНСт, ЛППР которых находится в диапазоне, отвечающем первому или второму окну прозрачности биологических тканей, существенно более эффективны при использовании оптических методов диагностики и терапии опухолей [2].
Для формирования кремнеземной оболочки на поверхности частиц-ядер в подавляющем большинстве случаев используют тетраалкоксисиланы и, в первую очередь, − тетраэтоксисилан (ТЭОС) [2, 8, 9]. При этом для обеспечения сродства между оболочкой и металлической наночастицей требуется предварительная модификация ее поверхности функционализованными алкоксисиланами. Как правило, это – амино- или меркаптоалкоксисиланы, способные не только специфически взаимодействовать с золотом (например, за счет образования связи S−Au), но и участвовать в формировании сетки связей Si−O−Si [8, 9].
Отметим, что одним из основных условий с точки зрения загрузки в кремнеземную оболочку КНЧ тех или иных функциональных соединений является наличие в оболочке развитой системы пор (т.е. ее высокая удельная поверхность). В то же время симметричное строение молекулы ТЭОС способствует образованию достаточно совершенной сетки силоксановых связей. Как следствие, получаемая оболочка характеризуется низкой пористостью. Для решения этой проблемы в процессе синтеза оболочки в реакционную систему дополнительно вводят поверхностно-активное вещество (как правило, цетилтриметиламмония бромид − ЦТАБ), способствующее образованию пор [2]. Следует, однако, учитывать, что способность катионов ЦТАБ взаимодействовать с олигомерами кремниевой кислоты может приводить к увеличению вероятности нуклеации частиц кремнезема, что крайне затрудняет управление процессом формирования оболочки [10]. Кроме того, ЦТАБ является достаточно токсичным соединением [11]. Как следствие, по окончании синтеза его желательно удалять и лишь после этого загружать в оболочку целевое соединение.
На наш взгляд, замена ТЭОС на несимметричный триалкоксисилан, несущий ту или иную функциональную группу, позволит обеспечить формирование достаточно пористой оболочки без использования поверхностно-активного вещества. Кроме того, введение в состав оболочки функциональной группы может расширить спектр присущих КНЧ свойств и/или способствовать загрузке целевого соединения.
Наибольший интерес в этой связи представляет 3-меркаптопропилтриметоксисилан (МПТМС). Действительно, известно, что тиолы характеризуются высокой реакционной способностью [12], могут координировать ионы различных металлов [13, 14] и проявляют ярко выраженные мукоадгезивные свойства [15].
Показано, в частности, что органокремнеземные частицы на основе МПТМС могут служить весьма эффективными средствами доставки в опухоль противоракового препарата цисплатина [13]. Кроме того, последнее время способность тиольных групп МПТМС вступать в реакцию нитрозирования активно используется для создания органокремнеземных частиц и покрытий, способных высвобождать оксид азота(II), характеризующийся вазодилатирующим, противоопухолевым, бактерицидным и др. действием (см., например, работы [16, 17] и приведенные в них ссылки).
С учетом сказанного очевидно, что использование МПТМС в качестве прекурсора при синтезе оболочки открывает возможность создания многофункциональных КНЧ биомедицинского назначения. Оценка перспектив этого подхода и является целью данной работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и методы исследования
В работе использовали следующие реактивы: тригидрат золотохлористоводородной кислоты с содержанием основного вещества ≥99% (Acros Organics), соляную кислоту марки “х. ч.” (Компонент-Реактив), а также ЦТАБ (≥96%), гидрохинон (≥99.5%), нитрат серебра (99.9999%), борогидрид натрия (99%), МПТМС (95%), цисплатин (99%), нитрит натрия (99%), диэтилентриаминпентауксусную кислоту (ДЭТАПУК, 98%) и 28–30%-ный раствор аммиака (99.99%) производства Sigma-Aldrich.
Растворителями служили свежеперегнанный этанол и дистиллированная вода, дополнительно деионизированная на установке Arium 611 (Sartorius, Германия).
Для осаждения частиц на разных стадиях эксперимента использовали центрифугу 320R (Hettich, Германия); их редиспергирование проводили в ультразвуковой ванне.
Размеры, структуру и элементный состав частиц анализировали с помощью просвечивающего электронного микроскопа высокого разрешения (ПЭМВР) Technai G2 30 S-TWIN (FEI, Голландия), укомплектованного приставкой для энергодисперсионного анализа TEAM™ EDS SYSTEM. Для этого каплю водной дисперсии частиц помещали на медную сеточку, покрытую формваром, выдерживали ее в течение 1 мин, а затем удаляли фильтровальной бумагой. Изображения получали при ускоряющем напряжении 200 кВ.
В ряде случаев толщину органокремнеземной оболочки КНЧ предварительно оценивали с помощью атомно-силового микроскопа Multimode V (Veeco, США). Образцы готовили, помещая каплю дисперсии КНЧ на стеклянную подложку и высушивая ее на воздухе при комнатной температуре.
Спектры экстинкции исследуемых растворов регистрировали с помощью двухлучевого спектрофотометра Evolution 300 (Thermo Electron Corp., США) в диапазоне длин волн от 190 до 1100 нм в полистирольных или кварцевых кюветах с длиной оптического пути 10 мм; в луч сравнения помещали кювету с дистиллированной водой.
ИК-фурье-спектры КНЧ (как исходных, так и с загруженным в оболочку функциональным соединением) записывали на спектрометре Nicolet 380 (Thermo Electron Corp., США). Измерения проводили в режиме диффузного отражения в диапазоне волновых чисел 400–4000 см–1; число сканов составляло от 64 до 512.
Синтез КНЧ и функционализация органокремнеземной оболочки
ЗНСт получали беззатравочным способом по разработанному ранее протоколу [18]. В колбу объемом 300 мл вносили 10 г ЦТАБ, добавляли 250 мл воды и смесь интенсивно перемешивали на водяной бане при 30°C. После полного растворения ЦТАБ в раствор с интервалами в 5 мин последовательно вводили растворы HAuCl4, AgNO3, гидрохинона и NaBH4 в количествах, необходимых для получения ЗНСт, максимум продольного ЛППР которых находится вблизи 800 нм. Спустя 30 с после введения NaBH4 перемешивание прекращали и реакционную смесь оставляли на сутки на водяной бане при температуре 30°C.
Для формирования на поверхности ЗНСт органокремнеземной (SH-SiO1.5) оболочки в пластиковую пробирку объемом 50 мл вносили 10 мл дисперсии ЗНСт, предварительно отмытых от избытка ЦТАБ по описанной в [18] схеме и сконцентрированных в 4 раза, а затем добавляли 40 мкл этанольного раствора МПТМС с концентрацией 5 об. %. Полученную смесь выдерживали в ультразвуковой ванне в течение 1 мин и оставляли перемешиваться на шейкере в течение суток. После этого в систему вводили 20 мкл 28–30%-ного раствора аммиака, а затем с интервалами в 30 мин − 19 дополнительных порций этанольного раствора МПТМС объемом 40 мкл каждая (после каждого такого добавления золь выдерживали в УЗ-ванне в течение 1 мин). Полученную дисперсию выдерживали в течение 7 сут. По окончании синтеза КНЧ осаждали центрифугированием (20 мин, 7000 об./мин). Надосадочную жидкость отбирали, а осадок редиспергировали сначала в этаноле, а затем в воде, доводя концентрацию КНЧ до исходной концентрации ЗНСт.
Загрузку цисплатина в органокремнеземную оболочку КНЧ проводили следующим образом. В пластиковую пробирку объемом 2 мл вносили 1 мл дисперсии КНЧ, 0.5 мл деионизованной воды и 0.5 мл свежеприготовленного раствора цисплатина концентрацией 2 мг/мл и оставляли перемешиваться на шейкере в течение 18 ч. После этого частицы осаждали центрифугированием (20 мин, 7000 об./мин). Надосадочную жидкость отбирали и регистрировали спектр ее поглощения. Осадок разделяли на две части. Одну из них редиспергировали в воде, а вторую сушили в вакуумном шкафу и использовали для регистрации ИК-фурье-спектров. Количество сорбированного оболочкой цисплатина определяли по его убыли в надосадочной жидкости с помощью предварительно построенной калибровочной зависимости.
При нитрозировании тиольных групп органокремнеземной оболочки КНЧ опирались на схему, описанную в работе [19], модифицировав ее с учетом особенностей нашей системы. Для этого к охлажденной примерно до 4°C порции водной или спиртовой дисперсии КНЧ объемом 2 мл добавляли 50 мкл раствора соляной кислоты (37 мас. %), а затем 360 мкл смешанного водного раствора, содержащего нитрит натрия (0.5 М) и ДЭТАПУК (0.25 мМ). По окончании реакции КНЧ осаждали центрифугированием. Надосадочную жидкость отбирали, а осадок разделяли на две части. Одну из них высушивали для последующего анализа методом ИК-фурье-спектроскопии, а вторую редиспергировали в воде.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Согласно данным ПЭМВР (рис. 1), использованный нами протокол позволяет получать ЗНСт высокого качества (их средние длина и диаметр составляют 60.9 ± 7.7 и 14.0 ± 1.0 нм соответственно). Это подтверждают и результаты электронной спектроскопии поглощения (рис. 2, кривая 1), а именно − высокое отношение интенсивностей продольного и поперечного ЛППР, указывающее на то, что основным продуктом реакции являются именно ЗНСт. Максимум продольного ЛППР таких частиц находится вблизи 850 нм, т.е. в первом окне прозрачности биологических тканей.
Рис. 2.
Нормированные спектры экстинкции ЗНСт (1) и КНЧ Au/SH-SiO1.5 на их основе (2, 3) до (2) и после загрузки в органокремнеземную оболочку цисплатина (3).
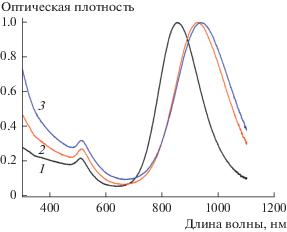
Формирование на поверхности ЗНСт органокремнеземной оболочки приводит к уширению пика продольного ЛППР и его батохромному сдвигу, обусловленному изменением диэлектрической проницаемости среды вблизи поверхности ЗНСт (рис. 2, кривая 2). Величина этого сдвига зависит от толщины оболочки (h). В условиях нашего эксперимента он составляет примерно 75 нм при h ≈ 13 нм.
Смешение дисперсии КНЧ с раствором цисплатина сопровождается незначительным дополнительным сдвигом продольного ЛППР (рис. 2, кривая 3), что косвенным образом свидетельствует о проникновении лекарственного препарата внутрь оболочки. Этот вывод подтверждают и данные ИК-спектроскопии: сорбция цисплатина приводит к появлению в спектре КНЧ полосы поглощения с максимумом вблизи 524 см–1, характерной для связи Pt−N [20]. В то же время полоса вблизи 2560 см–1, отвечающая валентным колебаниям группы –SH [21] полностью исчезает. Последний факт хорошо согласуется с высказанным в [13] предположением о том, что загрузка лекарственного препарата в органокремнеземные частицы происходит за счет специфического взаимодействия между тиольной группой и ионом Pt в составе молекулы цисплатина.
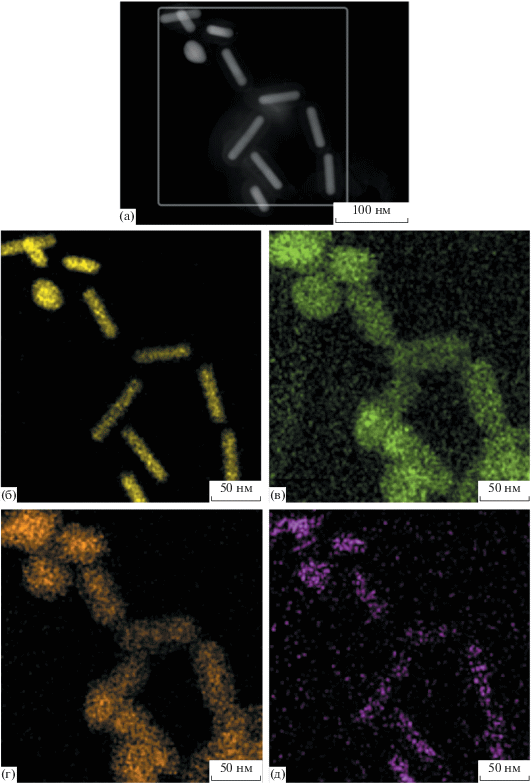
Согласно предварительной оценке величина сорбции цисплатина может быть весьма большой. Так, результаты элементного картирования КНЧ спустя 18 ч их выдержки в растворе цисплатина (рис. 3) указывают на высокое содержание платины в составе оболочки (рис. 3д). Атомные доли золота, кремния, серы и платины соотносятся как 9/17/11/1. При таком соотношении серы к платине величина сорбции цисплатина составляет примерно 0.6 г в расчете на 1 см3 оболочки11.
Рис. 3.
Результаты элементного анализа КНЧ с загруженным в оболочку цисплатином: полученное в темном поле ПЭМВР-изображение анализируемого участка (а) и карты распределения по нему золота (б), кремния (в), серы (г) и платины (д).
Анализ КНЧ методом ПЭМВР (рис. 4) показал, что в органокремнеземной оболочке регистрируются области повышенной контрастности диаметром ≤1 нм (на рисунке они отмечены стрелками). Аналогичную картину наблюдали и в работе [13]. По мнению авторов [13] это − ультрамалые кристаллы цисплатина, образование которых также свидетельствует о его высоком содержании в оболочке.
Рис. 4.
Полученные с разным увеличением ПЭМВР-изображения КНЧ с загруженным в оболочку цисплатином (пояснения в тексте).

Видно также, что полученная из МПТМС органокремнеземная оболочка имеет достаточно рыхлую структуру. Как следствие, можно ожидать, что такие КНЧ будут сорбировать не только цисплатин, но и другиe функциональные соединения.
Таким образом, очевидно, что анизотропные КНЧ со структурой Au-ядро/SH-SiO1.5-оболочка могут служить достаточно эффективными контейнерами для различных лекарственных препаратов, способными в перспективе обеспечить не только направленную доставку этих препаратов, но и их контролируемое высвобождение под действием лазерного излучения. Последний факт позволяет говорить о возможности совмещения фототермической и химиотерапии, что весьма существенно с точки зрения борьбы с опухолями, устойчивыми к воздействию лекарств.
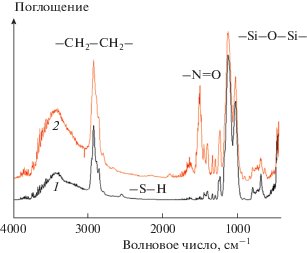
Кроме того, как показали результаты наших дальнейших экспериментов, обработка КНЧ раствором нитрита натрия в кислой среде приводит к практически мгновенной трансформации тиольных групп оболочки в нитрозотиольные (−S−N=O). Об этом свидетельствует, в частности, появление в ИК-фурье-спектре соответствующего порошка КНЧ (кривая 2 на рис. 5) интенсивной полосы с максимумом вблизи 1500 см–1, соответствующей колебаниям группы −N=O [21]. В то же время полоса, характерная для тиольной группы, полностью пропадает (сравните кривые 1 и 2 на рис. 5).
Рис. 5.
ИК-фурье-спектры порошка КНЧ до (1) и после (2) нитрозирования тиольных групп органокремнеземной оболочки.
Следует подчеркнуть, что способность нитрозосоединений (в том числе, нитрозотиолов) разлагаться с выделением терапевтически важного оксида азота(II) представляет интерес для целого ряда биомедицинских приложений. При этом одной из наиболее актуальных задач является обеспечение локального и контролируемого высвобождения NO.
Мы полагаем, что синтезированные нами КНЧ могут послужить перспективным инструментом для решения этой задачи, учитывая способность частиц такого типа накапливаться в опухоли по механизму пассивной или активной адресной доставки [2], а также возможность управления отщеплением NO за счет воздействия лазерного излучения.
Справедливость этого предположения подтверждают результаты появившейся в самое последнее время работы [22]. Ее авторы использовали в экспериментах КНЧ, полученные стандартным способом (т.е. на основе ТЭОС), поверхность которых была затем модифицирована МПТМС, и показали, что нитрозирование таких частиц позволяет повысить эффективность их противоопухолевого действия.
ЗАКЛЮЧЕНИЕ
На примере 3-меркаптопропилтриметоксисилана показано, что использование при синтезе композитных наночастиц со структурой металлическое ядро/диэлектрическая оболочка прекурсора, содержащего функциональную группу, позволяет решить две задачи. Во-первых, это облегчает загрузку в оболочку различных целевых соединений, а во-вторых, значительно расширяет спектр присущих таким композитным частицам свойств.
Список литературы
Климов В.В. Наноплазмоника. М.: Физматлит, 2009.
Hanske C., Sanz-Ortiz M.N., Liz-Marzan L.M. // Adv. Mater. 2018. V. 30. 1707003.
Wang Z., Meng X., Kildishev A.V., Boltasseva A., Shalaev V.M. // Laser Photonics Rev. 2017. V. 11. 1 700 212.
Ролдугин В.И. // Успехи химии. 2000. Т. 69. С. 899.
Румянцева Т.Б., Дементьева О.В., Проценко И.Е., Зайцева А.В., Сухов В.М., Рудой В.М. // Коллоид. журн. 2019. Т. 81. С. 759.
Webb J.A., Bardhan R. // Nanoscale. 2014. V. 6. P. 2502.
Алексеева А.В., Богатырев В.А., Хлебцов Б.Н., Мельников А.Г., Дыкман Л.А., Хлебцов Н.Г. // Коллоид. журн. 2006. Т. 68. С. 661.
Obare S.O., Jana N.R., Murphy C.J. // Nano Lett. 2001. V. 1. P. 601.
Murphy C.J., Sau T.K., Gole A.M., Orendorff C.J., Gao J., Gou L., Hunyadi S.E., Li T. // J. Phys. Chem. B. 2005. V. 109. P. 13857.
Yoon S., Lee B., Kim C., Lee J.H. // Cryst. Growth Des. 2018. V. 18. P. 4731.
Khlebtsov N., Dykman L. // Chem. Soc. Rev. 2011. V. 40. P. 1647.
Коваль И.В. // Журн. орг. химии. 2007. Т. 43. С. 327.
Varache M., Bezverkhyy I., Weber G., Saviot L., Chassagnon R., Baras F., Bouyer F. // Langmuir. 2019. V. 35. P. 8984.
Shaffer T.M., Harmsen S., Khwaja E., Kircher M.F., Drain C.M., Grimm J. // Nano Lett. 2016. V. 16. P. 5601.
Irmukhametova G.S., Mun G.A., Khutoryanskiy V.V. // Langmuir. 2011. V. 27. P. 9551.
Riccio D.A., Nugent J.L., Schoenfisch M.H. // Chem. Mater. 2011. V. 23. P. 1727.
Malone-Povolny M.J., Schoenfisch M.H. // ACS Appl. Mater. Interfaces. 2019. V. 11. P. 12216.
Салаватов Н.А., Дементьева О.В., Михайличенко А.И., Рудой В.М. // Коллоид. журн. 2018. Т. 80. С. 571.
Lo C.-H., Hu T.-M. // Soft Matter. 2017. V. 13. P. 5950.
Torres M., Khan S., Duplanty M., Lozano H.C., Morris T.J., Nguyen T., Rostovtsev Y.V., De Yonker, N.J., Mirsaleh-Kohan N. // J. Phys. Chem. A. 2018. V. 122. P. 6934.
Беллами Л. Инфракрасные спектры сложных молекул. М.: Изд-во иностранной литературы, 1963.
Liu P., Wang Y., Liu Y., Tan F., Li J., Li N. // Theranostics. 2020. V. 10. P. 6774.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал



