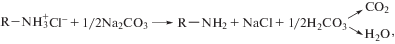Коллоидный журнал, 2021, T. 83, № 1, стр. 114-122
Формирование наночастиц серебра в водных растворах олигохитозанов
О. Я. Урюпина 1, *, Е. К. Уродкова 1, 2, В. Е. Тихонов 3, Е. С. Жаворонок 2, И. Н. Сенчихин 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, Россия
2 РТУ МИРЭА (ИТХТ им. М.В. Ломоносова)
119571 Москва, просп. Вернадского, 86, Россия
3 Институт элементоорганических соединений им А.Н. Несмеянова РАН
119991 Москва, ул. Вавилова, 28, Россия
* E-mail: urupina635@mail.ru
Поступила в редакцию 19.06.2020
После доработки 07.09.2020
Принята к публикации 10.09.2020
Аннотация
Изучен процесс формирования устойчивых дисперсий серебра с мономодальным распределением наночастиц по размеру в водных растворах олигохитозанов различной молекулярной массы. Выявлен характер взаимодействия олигохитозанов с ионами и наночастицами серебра. Спектральные исследования показали участие гидроксильных и аминогрупп олигохитозана в формировании и стабилизации водных дисперсий с наночастицами металла размером 45–90 нм, перспективных для биомедицинского применения.
ВВЕДЕНИЕ
Одним из активно развивающихся направлений современных исследований является синтез наночастиц (НЧ) благородных металлов в среде хитозана (ХТЗ) и его производных [1–6]. Хитозан – природный полиаминосахарид, обладающий уникальным комплексом физико-химических свойств, а также высокой антимикробной активностью и нетоксичностью по отношению к клеткам теплокровных.
Ранее нами [7] была показана возможность синтеза в водных растворах высокомолекулярного ХТЗ (Мw = 311 ± 54 кДа) относительно крупных (около 65 нм) серебряных НЧ с узким распределением по размеру. Частицы такого размера находят применение в медицине – в частности, в импульсной лазерной гипертермии [8–12]. Однако поскольку высокомолекулярный ХТЗ хорошо растворим лишь в кислых водных средах, в то время как восстановление ионов серебра происходит при pH > 7, формирование дисперсий серебра с достаточно узким распределением НЧ по размеру ограничивается диапазоном значений pH, соответствующим растворимости этого полимера.
Следует отметить, что в последние годы в исследованиях медицинского профиля значительное внимание уделяется олигохитозанам (ОХТ) – высшим олигомерам [13, 14] с Мw от 2 до 16 кДа. По сравнению с высокомолекулярными ХТЗ они обладают рядом преимуществ, среди которых повышенная растворимость в воде, меньшая вязкость растворов, а также более высокая антимикробная активность [15]. Это может способствовать расширению оптимального диапазона условий получения нанодисперсий серебра. В связи с этим, в настоящей работе проведено исследование процесса формирования НЧ серебра с узким распределением по размеру в присутствии ОХТ. Для этого проведена серия экспериментов по определению таких оптимальных условий синтеза НЧ серебра в растворах ОХТ, при которых ионы Ag+ уже начинают восстанавливаться, а ОХТ, выступающий в роли не только стабилизатора, но и восстановителя, еще не осаждается.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
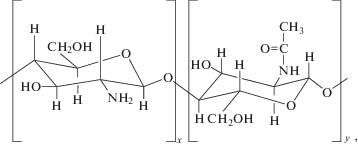
Для исследования были взяты олигохитозаны с разными значениями молекулярной массы и содержания остаточных ацетильных групп – степени ацетилирования (СА), приведенные в табл. 1: ОХТ-6/5, OXT-12/5 и OXT-12/24. В отличие от нативного хитозана ОХТ-12/24 остальные олигомеры представляли собой гидрохлориды. Все ОХТ синтезированы по методикам [16, 17] и соответствуют общей структурной формуле
где x > y.Таблица 1.
Характеристики использованных олигохитозанов
| Параметр | ОХТ- 6/5 | ОХТ-12/5 | ОХТ-12/24 |
|---|---|---|---|
| Mw, кДа | 6 | 12 | 12 |
| СА, % | 5 | 5 | 24 |
В качестве прекурсора был использован нитрат серебра (99.9%, Aldrich). Растворы для синтеза, за исключением растворов ОХТ, готовили в день синтеза при 22 ± 2°С в свежеперегнанном водном бидистилляте, деионизированном на установке Milli-Q Synthesis (Mullipore Corp., США) и имевшем удельное сопротивление 18.4 мОм/см. Растворы ОХТ готовили таким же образом за сутки до синтеза.
Синтез осуществляли следующим образом: в объем бидистиллята, указанный в табл. 2, при перемешивании вводили определенный объем раствора ОХТ. Реакционную смесь интенсивно перемешивали магнитной мешалкой, нагревали до 75°С в течение 10 мин и добавляли последовательно через определенные интервалы времени растворы азотнокислого серебра и углекислого натрия в количествах, также указанных в табл. 2. Время реакции варьировали от 50 мин для реакционной смеси с pH 6 до 15 мин для систем с pH 7.8–8.1. За это время первоначально бесцветный раствор приобретал желтую окраску, после чего постепенно становился красновато-коричневым.
Таблица 2.
Условия синтеза и зависимость среднего размера НЧ серебра, определенного методом ДРС, от соотношения компонентов в реакционной системе при использовании олигохитозана с разной молекулярной массой
| Номер образца | Условия синтеза | Характеристики размера НЧ | |||||
|---|---|---|---|---|---|---|---|
| объем
раствора AgNO3 (0.17 мас. %), мл |
объем раствора ОХТ (0.05 мас. %), мл | объем H2O, мл | объем раствора Na2CO3 (0.5 мас. %), мл | pH | диаметр dn, нм | коэффициент вариации, % | |
| ОХТ-6/5 | |||||||
| 1 | 4 | 10 | 29.7 | 0.3 | 6.6 | 59 | 5.6 |
| 2 | 4 | 10 | 29.5 | 0.5 | 7.1 | 62 | 3.3 |
| 3 | 4 | 10 | 29.1 | 0.9 | 8.1 | 72 | 18.3 |
| 4 | 8 | 10 | 25.7 | 0.3 | 6.1 | 72 | 4.1 |
| 5 | 8 | 10 | 25.5 | 0.5 | 7.3 | 55 | 6.7 |
| 6 | 8 | 10 | 25.1 | 0.9 | 7.7 | 43 | 8.1 |
| 7 | 8 | 20 | 15.2 | 0.8 | 7.5 | 49 | 5.9 |
| ОХТ-12/5 | |||||||
| 8 | 4 | 10 | 29.7 | 0.3 | 7.0 | 107 | 4.7 |
| 9 | 4 | 10 | 29.5 | 0.5 | 7.2 | 65 | 6.6 |
| 10 | 4 | 10 | 29.1 | 0.9 | 7.6 | 70 | 8.1 |
| 11 | 8 | 10 | 25.7 | 0.3 | 7.0 | 61 | 5.0 |
| 12 | 8 | 10 | 25.5 | 0.5 | 7.2 | 65 | 6.9 |
| 13 | 8 | 10 | 25.1 | 0.9 | 8.0 | 59 | 4.5 |
| 14 | 8 | 20 | 15.2 | 0.8 | 7.6 | 56 | 6.4 |
| ОХТ-12/24 | |||||||
| 15 | 4 | 10 | 29.7 | 0.3 | 7.3 | 119 | 3.9 |
| 16 | 4 | 10 | 29.5 | 0.5 | 7.7 | 90 | 3.3 |
| 17 | 4 | 10 | 29.1 | 0.9 | 8.3 | 77 | 1.1 |
| 18 | 8 | 10 | 25.7 | 0.3 | 6.8 | 74 | 1.8 |
| 19 | 8 | 10 | 25.5 | 0.5 | 7.5 | 68 | 2.0 |
| 20 | 8 | 10 | 25.1 | 0.9 | 7.9 | 77 | 4.2 |
| 21 | 8 | 20 | 15.2 | 0.8 | 7.7 | 82 | 2.4 |
Средний размер НЧ серебра в полученных дисперсиях определяли методом динамического рассеяния света (ДРС) на приборе Zetasizer Nano ZS (Malvern, Великобритания). Данные ДРС, полученные после предварительного термостатирования образцов при 25°C, усредняли по пяти последовательным циклам измерений, каждый из которых, в свою очередь, был результатом автоматической обработки 10–15 “прогонов”. Обработку результатов и расчет среднего диаметра НЧ проводили с помощью программного обеспечения прибора (Zetasizer Software 6.20). Коэффициент вариации Kv, характеризующий разброс НЧ по размерам, рассчитывали по формуле [18]
где σ – среднеквадратичное отклонение, $\bar {X}$ – среднее арифметическое.Показатель pH реакционных систем измеряли с помощью титратора МРТ-2, который является дополнительным модулем анализатора Zetasizer Nano ZS. Электрокинетический потенциал НЧ определяли с помощью того же прибора, используя метод M3-PALS. Обработку результатов проводили в программе Zetasizer Software 6.20.
ИК-спектры измеряли в режиме нарушенного полного внутреннего отражения (НПВО) на спектрометре Nicolet 6700 (Thermo Fisher Scientific, США), используя кристалл ZnSe, в диапазоне волновых чисел 550–4000 см–1 с разрешением 4 см–1 и усреднением 64 сканирований; эксперименты проводили на воздухе при 25°C. Для приготовления образцов в чашку Петри помещали необходимый объем нанодисперсии или раствора Na2CO3 и высушивали до постоянной массы (при анализе спектров учитывали возможное присутствие микропримесей воды, поглощающих на частотах 3500 и 1640 см–1). Полученный осадок помещали на кристалл ZnSe, прижимали штатным прессом и проводили измерения. Спектры интерпретировали, используя литературные данные [19]; регистрируемый сигнал нормировали на интенсивность полос колебаний в области 2800–3000 см–1, соответствующей валентным колебаниям С–Н (внутренний стандарт).
Спектры экстинкции нанодисперсий серебра в ультрафиолетовой и видимой областях спектра регистрировали с помощью спектрофотометра Evolution 300 (Thermo Electron Corp., США).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез НЧ серебра в водных растворах ОХТ оказался более сложной задачей, чем в растворах высокомолекулярного ХТЗ [7]. На этапе отработки синтеза НЧ в растворах высокомолекулярного ХТЗ, при строгом контроле всех параметров воспроизводились все эксперименты, однако синтез в растворах гидрохлоридов ОХТ-6/5 и ОХТ-12/5 воспроизводился недостаточно хорошо. Так, только в пяти–шести опытах из десяти был достигнут высокий выход НЧ с мономодальным распределением по размеру.
Для выяснения причин ограниченной воспроизводимости экспериментов были измерены ИК-фурье-спектры двух видов образцов: 1) исходных порошков ОХТ и 2) пленок, сформированных из растворов ОХТ, содержащих карбонат натрия, обеспечивающий требуемое значение рН при синтезе НЧ (рис. 1).
Рис. 1.
Типичные ИК-спектры олигохитозанов: (1) порошок ОХТ-12/5, (2) образец, полученный из раствора ОХТ-12/5, содержащего Na2CO3.
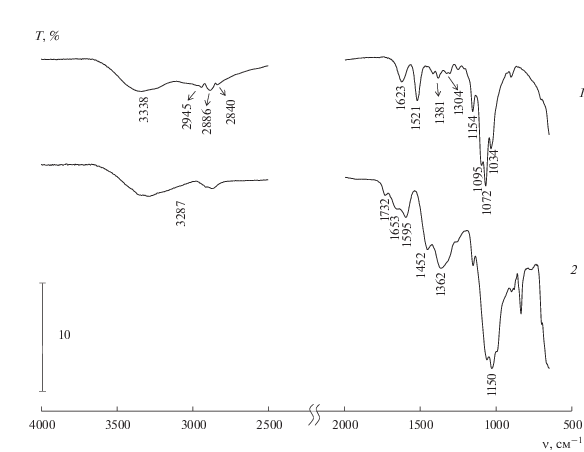
Ранее нами было показано [7], что при добавлении Na2CO3 в раствор высокомолекулярного ХТЗ на спектре не наблюдается значительных изменений по сравнению со спектром исходного раствора полимера. Однако при сравнении спектров порошка ОХТ-12/5 (рис. 1, кривая 1) и пленки из этого ОХТ, полученной в присутствии Na2CO3 (рис. 1, кривая 2), видны существенные различия. В ИК-спектре второго образца, по сравнению со спектром исходного ОХТ, в области 1750–1200 см–1 зафиксирован не только сдвиг полос амид I и амид II [19] в область более высоких частот (1623 → 1653 см–1, 1521 → 1595 см–1), но и появление новых, достаточно интенсивных широких полос поглощения при 1452 и 1362 см–1. Кроме того, появляется новая полоса и в низкочастотной области спектра (с максимумом вблизи 835 см–1), а также заметное плечо при 1732 см–1 на полосе амида I, соответствующее валентным колебаниям неионизированной карбоксильной группы. Все эти данные указывают на взаимодействие протонированных групп гидрохлорида ОХТ с Na2CO3. С высокой долей вероятности можно предположить, что при добавлении в водный раствор ОХТ карбоната натрия происходит частичное отщепление хлористого водорода с образованием свободного основания хитозана и неустойчивой угольной кислоты. Последняя может протонировать хитозан-основание с образованием гидрокарбоната хитозана. Находящиеся в растворе ионы натрия также могут взаимодействовать с угольной кислотой, образуя гидрокарбонат натрия. Соответствующие реакции приведены ниже.
Именно эти соли проявляются в спектре образца ОХТ–Na2CO3, и именно их присутствие способно повлиять на результаты синтеза НЧ серебра в растворах гидрохлоридов ОХТ.
Для предотвращения появления таких соединений, а также во избежание образования нерастворимого карбоната серебра протокол синтеза, разработанный в [7] для случая высокомолекулярного ХТЗ, потребовал изменений. Если в реакциях получения НЧ в растворах ХТЗ с Мw = = 311 кДа карбонат натрия вводили сразу после раствора прекурсора, то в случае ОХТ был выдержан экспериментально подобранный десятиминутный интервал между добавлением в реакционную смесь азотнокислого серебра и Na2CO3, чтобы дать время для образования промежуточных комплексов Ag+ с функциональными группами молекулы ОХТ. В этих условиях воспроизводились все эксперименты по синтезу НЧ серебра в водной среде, содержащей ОХТ-12/5 или ОХТ-6/5.
Образование НЧ серебра в растворах ОХТ было подтверждено методом ДРС. При этом получены мономодальные распределения числа частиц по размеру (рис. 2). В пользу образования именно НЧ серебра свидетельствует также наличие на спектре экстинкции (рис. 3) пика с максимумом вблизи 425 нм, характерного для плазмонного резонанса НЧ этого металла [20–22]. Согласно литературным данным [22, 23], наблюдаемый для полученной дисперсии максимум поглощения на длине волны λ = 428 нм соответствует плазмонному резонансу сферических НЧ Ag cо средним диаметром d около 50 нм, что находится в соответствии с данными ДРС.
Рис. 2.
Типичные распределения числа НЧ Аg по размеру в дисперсиях, синтезированных в растворах (а) ОХТ-6/5, (б) ОХТ-12/5 и (в) ОХТ-12/24, по данным ДРС.

Результаты экспериментов, выполненных при разных соотношениях реагентов, представлены в табл. 2, в которой приведены среднечисловые диаметры dn частиц и соответствующие коэффициенты вариации именно для таких размеров. Кроме того, при анализе полученных дисперсий учитывали и характер распределений по интенсивности и объему. Таким образом, достаточно узкие мономодальные распределения НЧ по всем трем указанным параметрам имели следующие дисперсии: в случае ОХТ-6/5 – №№ 2 и 4, в случае ОХТ-12/5 – №№ 11, 12 и 13, а в случае ОХТ-12/24 – все, кроме образца № 15. Относительно воспроизводимости экспериментов стоит упомянуть, что отклонения результатов разных опытов от среднего находятся в пределах 10–15%.
Важными характеристиками нанодисперсий серебра являются их стабильность, средний размер НЧ и их разброс по размерам. Анализируя результаты табл. 2, можно выделить области концентраций реагентов, отвечающие формированию стабильных (электрокинетический потенциал НЧ – не менее 30 мВ) коллоидных растворов, содержащих практически монодисперсные НЧ серебра требуемого размера (45–90 нм).
Следует отметить, что результаты, полученные с использованием разных образцов ОХТ, несколько различаются. Для систем с гидрохлоридом ОХТ-6/5 (табл. 2) в образцах с низким содержанием прекурсора (№№ 1–3) при увеличении pH реакционной смеси от 6.6 до 8.1 наблюдается заметный рост dn, от 59 до 72 нм. При этом образец № 2 (с 0.5 мл раствора Na2CO3) имеет самое узкое распределение НЧ по размеру – значение Kv, рассчитанного по формуле (1), составило всего 3.3%. Однако даже незначительное повышение pH реакционной системы (образец № 3) приводит к получению дисперсии с очень широким распределением НЧ по размерам: Kv = 18.3%. При увеличении концентрации прекурсора в два раза (образцы №№ 4–6) при подобном варьировании рН реакционной смеси наблюдается обратная тенденция к уменьшению среднего размера частиц от 72 до 43 нм. В данных опытах минимальный Kv (4.1%) наблюдается для образца с самым низким значением pH; по мере роста pH значение Kv также возрастает (до 6.7 и 8.1%), но не столь сильно, как для образца № 3. Повышение содержания ОХТ в системе в 2 раза по сравнению с предыдущим опытом приводит к очень незначительному увеличению среднего размера НЧ.
При получении НЧ серебра в среде, содержащей гидрохлорид ОХТ-12/5, наблюдаются две явно выраженные тенденции (табл. 2). Средний размер синтезируемых частиц уменьшается как при увеличении концентрации прекурсора, так и с ростом pH реакционной среды. При этом в случае образца с низким содержанием азотнокислого серебра и низким pH наблюдается самый большой средний размер частиц (107 нм), в то же время значения dn НЧ в остальных образцах находятся в интервале 60–70 нм. Необходимо отметить, что уменьшение dn при увеличении рН реакционной смеси имело место и в серии опытов с высокомолекулярным ХТЗ [7]. При этом повышение концентрации ОХТ в реакционной системе практически не влияет на размер НЧ (56 нм).
Для дисперсий серебра, получаемых в среде ОХТ-12/24 с большей степенью ацетилирования, но с той же молекулярной массой, что и у ОХТ-12/5, при наименьших концентрациях прекурсора c повышением pH реакционной среды наблюдается уменьшение среднего размера частиц: dn равен 119, 90 и 77 нм (табл. 2). Аналогичная тенденция имела место и при использовании ОХТ-12/5: dn = 107, 65 и 70 нм. Однако при повышении концентрации прекурсора в этих системах в два раза заметной зависимости размера частиц от pH реакционной смеси уже не наблюдалось (dn = 74, 68 и 77 нм соответственно). Интересно, что увеличение концентрации этого ОХТ в реакционной смеси приводит, в отличие от двух предыдущих серий экспериментов, к заметному увеличению размеров НЧ (до 82 нм).
Таким образом, мономодальные распределения НЧ серебра в исследованных системах зафиксированы в достаточно узких диапазонах концентраций реагентов. Дисперсии с наиболее узкими распределениями НЧ по размеру получены при мольном соотношении ОХТ : AgNO3 : Na2CO3, равном 1 : 48 : 29 в случае использования ОХТ-6/5 и 1 : 192 : 58 в случае ОХТ-12/5 и ОХТ-12/24 (образцы №№ 2, 12 и 19 соответственно). При этом нанодисперсии на основе ОХТ-12/24 характеризуются меньшими коэффициентами вариации, чем образцы на основе других ОХТ (табл. 2), и более высокими (по модулю) значениями электрокинетического потенциала. Так, в случае ОХТ-12/24 Kv составляет от 1 до 4%, тогда как для систем с ОХТ-12/5 и ОХТ-6/5 – от 4.5 до 8% и от 3.3 до 18% соответственно. Визуальные наблюдения показали, что нанодисперсии на основе ОХТ-12/24 устойчивы в течение не менее 6 месяцев, в то время как в некоторых образцах на основе гидрохлоридов ОХТ за это время образуется осадок.
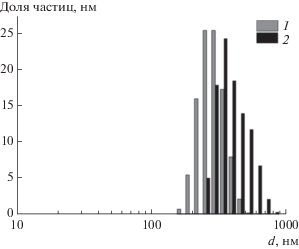
Выявленные зависимости размера НЧ серебра и Kv от состава и рН реакционных систем, вероятно, связаны с молекулярной структурой (содержанием ацилированных аминогрупп) и надмолекулярной организацией ОХТ в растворах. В связи с этим нами были исследованы методом ДРС растворы двух образцов ОХТ с одинаковой молекулярной массой (Мw = 12 кДа) – OXT-12/5 и OXT-12/24. Концентрации этих растворов ОХТ и значения их pH соответствовали параметрам соответствующих дисперсий серебра. В результате были получены растворы с мономодальным распределением числа полимерных частиц по размеру (рис. 4).
Рис. 4.
Распределение числа частиц по размеру в разбавленных растворах ОХТ-12/5 (1) и ОХТ-12/24 (2).
Несмотря на то, что за последние десятилетия накоплен значительный объем экспериментальных и теоретических данных о свойствах растворов ХТЗ (см., например, [24–26]), вопросу о его надмолекулярной организации в растворах уделяется большое внимание [27]. Так, известно, что в разбавленных растворах высокомолекулярного ХТЗ его макромолекулы находятся в виде агрегатов, размеры и плотность упаковки которых зависят как от рН и ионной силы раствора, так и от степени деацетилирования полимера [28–32]. Вместе с тем, сведения о надмолекулярной организации олигомерных ХТЗ в растворах отсутствуют. Можно предположить, что регистрируемые методом ДРС рассеивающие свет частицы также представляют собой агрегаты макромолекул ОХТ.
Из приведенных на рис. 4 данных следует, что средний размер частиц в растворе ОХТ-12/24 (примерно 350 нм) существенно больше, чем в растворе ОХТ-12/5 (250–270 нм). Такое отличие, вероятно, связано с тем, что молекулы ОХТ-12/24, содержащие большее число достаточно объемных ацетильных групп, склонны к образованию более рыхлых агрегатов в растворе, чем молекулы ОХТ-12/5. При этом различие в размерах агрегатов хитозана и образующихся в его растворе НЧ серебра может быть обусловлено изменением конформации молекул ОХТ в процессе синтеза НЧ.
Ранее [7] нами было показано, что при формировании нанодисперсий серебра в растворах высокомолекулярного ХТЗ этот полимер выполняет функции как восстановителя ионов серебра, так и стабилизатора образующихся НЧ. При этом главную роль играют амино- и гидроксильные группы высокомолекулярного ХТЗ. В настоящей работе, для выявления особенностей поведения ОХТ, были проведены аналогичные исследования методом ИК-спектроскопии.
На рис. 5 и 6 приведены спектры пленок, сформированных из растворов ОХТ-12/5 и ОХТ-12/24 (кривые 1) и из полученных в этих растворах нанодисперсий серебра (кривые 2). Видно, что спектры таких нанодисперсий значительно отличаются от спектров исходных ОХТ, причем изменение полос колебаний гидроксильных групп в спектрах обоих образцов практически одинаково. Так, на обеих кривых 2 составная полоса валентных колебаний гидроксильных и аминогрупп (согласно [19]) с максимумами при 3338 cм–1 (ОХТ-12/5) и 3279 см–1 (ОХТ-12/24) становится менее интенсивной и сдвигается в сторону бóльших значений длин волн. Интенсивность полос поглощений, относящихся к ν(С–О) гидроксильных групп, также сильно уменьшается. Отношение интенсивностей полосы деформационных колебаний С–О гидроксильных групп и полосы валентных колебаний С–Н (I1058/I2867), являющейся внутренним стандартом, в спектре ОХТ-12/5 равно 8.5, в спектре ОХТ-12/24 – 10, а в спектрах дисперсий серебра на их основе оно составляет соответственно 4.5 и 5.0. Другими словами, концентрация гидроксильных групп ОХТ в нанодисперсиях серебра становится примерно в два раза ниже, чем в исходном ОХТ. Это однозначно свидетельствует об участии ОН-групп обоих олигохитозанов в формировании НЧ.
Рис. 5.
ИК-фурье-спектры систем на основе ОХТ-12/5: 1 – спектр пленки из исходного раствора ОХТ-12/5, 2 – спектр пленки из нанодисперсии серебра в растворе ОХТ-12/5.

Рис. 6.
ИК-фурье-спектры систем на основе ОХТ-12/24: 1 – спектр пленки из исходного раствора ОХТ-12/24, 2 – спектр пленки нанодисперсии серебра в растворе ОХТ-12/24.
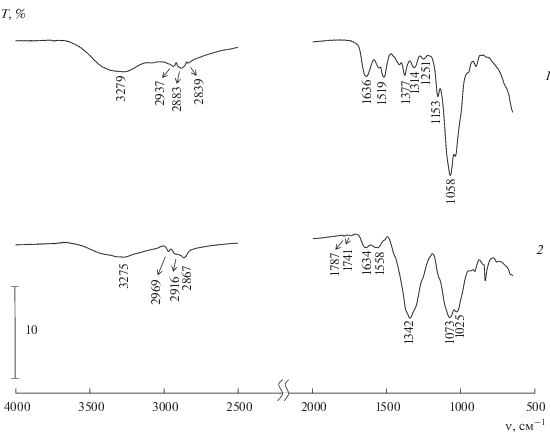
Что касается проявлений колебаний амидных и аминных групп в спектрах, то здесь ситуация более сложная. В спектре гидрохлорида ОХТ присутствуют две полосы поглощения – при 1623 и 1521 см–1. Необходимо помнить, что у этого ОХТ CА = 5%, т.е. амидных групп в молекуле очень мало. Если первая полоса однозначно относится к колебаниям С=О амидной группы [19], то вторая, более интенсивная, несомненно, является суммой колебаний NH аминных и амидных групп. В спектре системы НЧ–гидрохлорид ОХТ в этой области наблюдается лишь одна достаточно размытая полоса низкой интенсивности. Последнее обстоятельство свидетельствует не только об участии групп NH2 в формировании НЧ серебра в растворе ОХТ, но и о серьезных изменениях конфигурации ацетамидных групп в молекулах олигохитозана в процессе синтеза НЧ в его растворе.
В спектре исходного ОХТ-12/24 в области 1700–1500 см–1 также присутствуют полоса амид I (1635 см–1) и сложная полоса с максимумом на 1519 см–1 и плечом при 1568 см–1, которая относится к колебаниям как NH амидной группы, так и аминных групп ОХТ. В спектре дисперсии Ag, полученной с использованием ОХТ-12/24, в отличие от предыдущего образца, видны 2 четкие полосы поглощения, причем положение полосы, отвечающей колебаниям С=О амидной группы полимера, практически не изменяется (1635 → → 1634 см–1). Плечо на полосе 1519 см–1 ОХТ становится максимумом полосы поглощения в случае дисперсии НЧ, а полоса 1519 см–1 исчезает. Подобные эффекты были отмечены нами ранее [7] и могут быть связаны с комплексообразованием между первичными аминогруппами ХТЗ и катионами серебра, а также с образованием ионных пар этими аминогруппами и анионами ${\text{NO}}_{3}^{ - }$ прекурсора. Так как СА данного ОХТ-12/24 составляет 24%, т.е. ацетамидных групп в молекуле ОХТ много, то большая их часть остается практически в неизмененной конфигурации.
Таким образом, согласно полученным результатам, в восстановлении ионов серебра из нитрата и стабилизации НЧ как в случае высокомолекулярного ХТЗ [7], так и в олигохитозанах, участвуют и аминогруппы, и гидроксильные группы молекул.
Проведенные эксперименты показали возможность синтеза достаточно крупных монодисперсных НЧ серебра. Предложен протокол, позволяющий получать (в определенных узких диапазонах значений pH и температуры) устойчивые дисперсии серебра с мономодальным распределением НЧ по размеру при их среднем размере от 45 до 90 нм.
Список литературы
Tiwari A.D., Mishra F. K., Arotiba O.A., Mamba B.B. // Int. J. Biol. Macromol. 2011. V. 48. P. 682.
Di Carlo G., Curulli A., Toro R.G. // Langmuir. 2012. V. 28. P. 5471.
Александрова В.А., Широкова Л.Н., Бондаренко Г.Н., Петросян А.С. // Высокомолек. соед. А. 2013. Т. 55. С. 176.
Широкова Л.Н., Александрова В.А. // Докл. АН. 2015. Т. 464. С. 440.
Wei D., Qian W. // Colloids Surf. B. 2008. V. 62. P. 136.
Чащин И.С., Григорьев Т.Е., Абрамчук С.С. // Докл. АН. 2016. Т. 469. С. 437.
Урюпина О.Я., Уродкова Е.К., Жаворонок Е.С., Высоцкий В.В., Сенчихин И.Н. // Коллоид. журн. 2019. Т. 81. С. 263.
Boca S.C., Potara M., Gabudean A.-M., Juhem A., Baldeck P.L., Astilean S. // Cancer Lett. 2011. V. 311. P. 131.
Nombona N., Maduray K., Antunes E., Karsten A., Nyokong T. // J. Photochem. Photobiol. B. 2012. V. 107. P. 35.
Дементьева О.В., Мальковский А.В., Филиппенко М.А., Рудой В.М. // Коллоид. журн. 2008. Т. 70. С. 607.
Дементьева О.В., Филиппенко М.А., Карцева М.Е., Рудой В.М. // Коллоид. журн. 2009. Т. 71. С. 569.
Карцева М.Е., Дементьева О.В., Филиппенко М.А., Рудой В.М. // Коллоид. журн. 2011. Т. 73. С. 334.
Тихонов В.Е. // Современные перспективы в исследовании хитина и хитозана. Материалы Девятой международной конференции, 2008. С. 42.
Тихонов В.Е. // Хитозан. Под. ред. Скрябина К.Г., Михайлова С.Н., Варламова В.П. М.: Центр “Биоинженерия” РАН, 2013. С. 49.
Хайруллин Р.З., Филиппова Ю.А., Шакирова Д.Р., Куликов С.Н. // Инфекция и иммунитет. 2012. Т. 2. № 1–2. С. 335.
Blagodatskikh I.V., Kulikov S.N., Vyshivannaya O.V., Bezrodnykh E.A., Tikhonov V.E. // Biomacromolecules. 2017. V. 18. P. 1491.
Kulikov S.N., Tikhonov V.E., Blagodatskikh I.V., Bezrodnykh E.A., Lopatin S.A., Kharullin R., Philippova Y.E., Abramchuk S.S. // Carbohydr. Polym. 2012. V. 87. P. 545.
Кириллов А.В., Глазунова Е.З. Статистика. Часть 1. Общая теория статистики. Самара: Изд-во СГАУ, 2012.
Беллами Л. Инфракрасные спектры сложных молекул. М.: Изд-во иностранной литературы, 1963.
Kerker M. // J. Colloid Interface Sci. 1985. V. 105. P. 297.
Ролдугин В.И. // Успехи химии. 2000. Т. 69. С. 899.
Paramelle D., Sadovoy A., Gorelik S., Free P., Hobley J., Fernig D.G. // Analyst. 2014. V. 139. P. 4855.
Kalenskii A.V., Zvekov A.A., Nikitin A.P., Anan’eva M.V., Aduev B.P // Opt. Spectrosc. 2015. V. 118. P. 978.
Philippova O.E., Korchagina E.V. // Polymer Sci. A. 2012. 54. P. 552.
Вихорева Г.А., Тюкова И.С. // Хитозан. Под ред. Скрябина К.Г., Михайлова С.Н., Варламова В.П. М.: Центр “Биоинженерия” РАН, 2013. С. 162.
Morris G.A., Castile J., Smith A., Adams G.G., Harding S.E. // Carbohydr. Polym. 2009. V. 76. P. 616.
Давыдова В.Н., Ермак И.М. // Биофизика. 2018. Т. 63. С. 648.
Апрятина К.В. Полимерные композиции на основе хитозана медико-биологического назначения. Дис. … канд. хим. наук. Нижний Новгород: Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского, 2018.
Anthonsen M.W., Vårum K.M., Hermansson A.M., Smidsrød O., Brant D.A. // Carbohydr. Polym. 1994. V. 25. P. 13.
Tsaih M.L., Chen R.H. // J. App. Polym. Sci. 1999. V. 73. P. 2041.
Popa-Nita S., Alcouffe P., Rochas C., David L., Domard A. // Biomacromolecules. 2010. V. 11. P. 6.
Korchagina E.V., Philippova O.E. // Biomacromolecules. 2010. V. 11. P. 3457.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал