Коллоидный журнал, 2021, T. 83, № 2, стр. 205-213
К теории мономеризации фталоцианинов в водных растворах ПАВ
А. И. Русанов *
Менделеевский центр, Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
* E-mail: rusanov32@list.ru
Поступила в редакцию 28.10.2020
После доработки 03.11.2020
Принята к публикации 06.11.2020
Аннотация
Сформулированная термодинамическая теория обосновывает целый ряд новых явлений коллоидной науки ПАВ, недавно установленных в эксперименте. Описано образование мицелл особого типа путем адсорбции ПАВ на ядре, роль которого играют мономеры и димеры фталоцианинов. Соответственно возникают мицеллы и протомицеллы ПАВ с солюбилизированными мономерами и димерами, причем их постепенное формирование (заполнение поверхности ядер молекулами или ионами ПАВ) при добавлении ПАВ к системе заканчивается еще до достижения критической концентрации мицеллообразования данного ПАВ. В терминах химических потенциалов и концентраций выведены уравнения, описывающие влияние ПАВ на состояние мономеров и димеров фталоцианинов в водном растворе. Установлено, что концентрация обеих частиц растет с концентрацией ПАВ. Проанализировано, как меняется распределение димеров по их структурным формам с концентрацией ПАВ. Показано, что с увеличением содержания ПАВ в растворе распределение димеров сдвигается в сторону лабильных структур с неизбежным распадом димеров фталоцианинов на мономеры. Найдено уравнение, определяющее новый физический параметр – концентрацию мономеризации, который отмечает переход от димерного (характерного для фталоцианинов в чистой воде или слабых растворах ПАВ) к мономерному состоянию в растворах ПАВ. Даны уравнения для химических потенциалов мицелл (с солюбилизированным мономером фталоцианина) и протомицелл (с солюбилизированным димером). Последние практически исчезают с повышением концентрации ПАВ и подходе к критической концентрации мицеллообразования.
ВВЕДЕНИЕ
Имея широкие применения в технике и медицине, фталоцианины многократно интересны и в химическом аспекте. Основу молекул фталоцианинов составляет плоский макроцикл (рис. 1), к которому можно присоединять всевозможные функциональные группы. Подобно ПАВ существуют катионные и анионные фталоцианины, и их совместное с ПАВ исследование просто напрашивается. Работы такого плана возникли еще в прошлом веке и даже включали мицеллярные системы [1–3], но имели чисто химическую направленность (ближе к фотохимии и мицеллярному катализу). Интерес к физикохимии ПАВ и коллоидной науке открылся лишь на изломе столетий [4, 5], когда выяснилось, что ПАВ могут быть эффективным средством мономеризации фталоцианинов. Явление мономеризации составляет для фталоцианинов большую проблему, и мы ее поясним.
Как известно, нерастворимых веществ не бывает. Когда в химическом справочнике пишут “в воде не растворимо”, это значит, что вещество очень плохо растворимо в воде. Именно к таким веществам относится большинство фталоцианинов (их растворимость исчисляется в мкМ). Причина такого положения та же, что и причина низкой растворимости в воде углеводородов – гидрофобный эффект. Внедрение неполярной частицы с гидрофобной поверхностью в толщу воды разрушает ее структуру и требует большой работы. Чем крупнее частица (диаметр макроцикла составляет 3 нм) и больше площадь гидрофобного контакта, тем сильнее этот фактор. Однако, если два макроцикла слипаются, указанная работа (в расчете на молекулу) снижается почти вдвое. Этим и объясняется тот факт, что фталоцианины в растворенной форме находятся в воде преимущественно в виде димеров (при столь малых концентрациях образование молекулярных агрегатов более высокого порядка практически исключено). При этом димеризация отрицательно сказывается на функциональных (хромофорных) свойствах фталоцианинов: снижается квантовый выход флуоресценции, уменьшается время жизни возбужденного состояния и т.п. Отсюда и возникает столь важная для практики проблема мономеризации фталоцианинов.
Заметим, что димеризация фталоцианинов – следствие не их малой растворимости, а большой гидрофобной площади макроцикла. Поэтому, если прибавить к макроциклу функциональные группы, обеспечивающие приличную растворимость фталоцианина, то ничего не изменится. Это было наглядно продемонстрировано в работе [4], где для опыта был взят фталоцианин с дендритными ветвями, буквально усыпанными ионами натрия, что превращало его в анионный полиэлектролит. Подобно муравьям, полианионы своим коллективным усилием втягивали молекулы фталоцианина в воду, а дальше …. А дальше макроциклы слипались в димеры! Для борьбы с ними авторы работы [4], имея анионный фталоцианин, применили катионное ПАВ (бромид гексадецилтриметиламмония). Его прибавление плавно уменьшало содержание димеров и увеличивало содержание мономеров. К сожалению, интерпретация результатов работы [4] опиралась лишь на межионные электростатические взаимодействия, хотя роль гидрофобного эффекта несравненно важнее (это следует хотя бы из того, насколько он легко преодолевает взаимное отталкивание одноименно заряженных ионов при образовании прямых мицелл ионных ПАВ). Эта оплошность была исправлена в работе [5], где была отмечена роль гидрофобного эффекта в процессах агрегации. Там же была продемонстрирована возможность использования обратных мицелл для мономеризации фталоцианинов.
Спустя десятилетие подобные исследования были продолжены в России и разрослись в целое направление, которое развивается до сих пор [6–19]. Усилился и коллоидно-химический аспект интерпретации результатов, появился термин “солюбилизация”. Простейший подход к интерпретации выглядит следующим образом. Мономеризация фталоцианинов происходит путем солюбилизации мономеров в мицеллах ПАВ. Поэтому до критической концентрации мицеллообразования (ККМ) в растворе существуют только димеры, а выше ККМ – только мономеры фталоцианинов. Однако в работах [17–19] было показано, что связанный с присутствием ПАВ процесс мономеризации фталоцианинов начинается задолго до достижения ККМ. Собственно говоря, это было ясно уже из работы [4]. Но здесь имеется один нюанс. Когда мы говорим “ниже ККМ” или “выше ККМ”, мы имеем в виду ту ККМ, которая была у ПАВ в отсутствие солюбилизата. Из теории же солюбилизации (см., например, [20–23]) известно, что наличие солюбилизата всегда понижает реальную ККМ. Но это понижение обычно невелико, и в [17–19] оно оценивалось из эксперимента. Подтвердилось, что мономеризация фталоцианинов под влиянием ПАВ развивается гораздо ниже и этого, измененного значения ККМ.
По сравнению с [4] в [17–19] было сделано еще одно интересное наблюдение.
В [4] утверждалось, что при добавлении ПАВ число димеров фталоцианина все время уменьшается, а мономеров – возрастает. Однако, согласно спектрофотометрическим данным работ [17–19], при малых концентрациях ПАВ (когда димеров еще много, и за ними легко наблюдать) добавление ПАВ приводит к некоторому увеличению концентрации димеров. Это значит, что ПАВ приводят к увеличению растворимости фталоцианинов независимо от того, в какой агрегативной форме фталоцианины находятся (если бы димеры были устойчивы, то при прибавлении ПАВ растворимость фталоцианинов все равно бы возрастала).
Сделанное вступление обнажает целый ряд вопросов, которые требуют теоретического осмысления. По фталоцианинам собран большой материал, и пора переходить от гипотез и объяснений “на пальцах” к математическим формулам. Казалось бы, для этого проще всего использовать развитый аппарат физикохимии ПАВ [20–22]. Однако он основан, главным образом, на законе действия масс, а последний теряет силу в нашем сложном случае сочетания ПАВ и фталоцианинов (константа закона действия масс перестает быть постоянной). Очевидно, нужно исходить из более общих соотношений, и это побуждает нас обратиться к основной величине химической термодинамики – химическому потенциалу.
ХИМИЧЕСКИЕ ПОТЕНЦИАЛЫ ФТАЛОЦИАНИНОВ, ПАВ И МИЦЕЛЛ
Статистическая механика дает следующее выражение (в расчете на одну молекулу) для химического потенциала ${{\mu }_{i}}$ компонента i многокомпонентной жидкой среды
(1)
${{\mu }_{i}} = \mu _{i}^{\operatorname{v} } + {{w}_{i}} + kT\ln ({{c}_{i}}{{f}_{i}}\Lambda _{i}^{3}),$(2)
${{\Lambda }_{i}} \equiv \frac{h}{{{{{(2\pi {{m}_{i}}kT)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}},$В термодинамике растворов коэффициент активности ${{f}_{i}}$ отражает взаимодействие только между растворенными молекулами (взаимодействие с растворителем в него не входит). При бесконечном разбавлении такого взаимодействия нет, и раствор становится идеальным при ${{f}_{i}} = 1.$ Концентрации, которые характерны для водных растворов фталоцианинов, так малы, что, казалось бы, и здесь нет никаких взаимодействий. Но как же тогда образуются димеры? Действительно, если бы гидрофобного эффекта не было, димеры могли бы возникнуть только в результате взаимного притяжения мономеров. Но у нас другой случай. Неполярные частицы взаимодействуют друг с другом обезличенными дисперсионные силами, но точно также они взаимодействуют и с водой, а потому эффективного притяжения между ними быть не может. Не они взаимно притягиваются, а вода силой гидрофобного эффекта “припечатывает” их друг к другу, образуя димер. Величина этой силы впечатляет, если вспомнить вышеупомянутый пример из работы [4], где сила слипания двух макроциклов фталоцианина преодолевает взаимное электростатическое отталкивание двух многозарядных полианионов. Учитывая сказанное, мы можем теперь положить ${{f}_{i}} \approx 1$ и исключить коэффициент активности ${{f}_{i}}$ из выражения (1). Тогда оно принимает вид
где все, что явно связано с гидрофобным эффектом, содержится в работе ${{w}_{i}}$.В соответствии с традициями физикохимии ПАВ [20–22] припишем номер i = 1 ПАВ как потенциальному солюбилизатору, а i = 2 – фталоцианину как потенциальному солюбилизату. Учитывая, что в растворе могут одновременно находиться мономеры и димеры фталоцианина, запишем выражение (3) для фталоцианина в двух вариантах:
(4)
${{\mu }_{{21}}} = \mu _{{21}}^{\operatorname{v} } + {{w}_{{21}}} + kT\ln ({{c}_{{21}}}\Lambda _{{21}}^{3}),$(5)
${{\mu }_{{22}}} = \mu _{{22}}^{\operatorname{v} } + {{w}_{{22}}} + kT\ln ({{c}_{{22}}}\Lambda _{{22}}^{3}),$Приведенных формул достаточно для решения целого ряда задач, связанных с мономеризацией фталоцианинов под влиянием ПАВ. В качестве первой задачи рассмотрим установление взаимосвязи между количественными характеристиками ПАВ в растворе и концентрацией мономеров фталоцианина.
Влияние ПАВ на концентрацию мономеров фталоцианина
Пусть в чистую воду помещается кристалл фталоцианина достаточно большой, чтобы после установления равновесной концентрации $с_{2}^{0}$ (она называется растворимостью) он оставался в контакте с раствором. При равновесии химический потенциал фталоцианина в твердой и жидкой фазах одинаков, причем в твердой фазе он зависит только от температуры и давления. Это значит, что при постоянстве температуры и давления химический потенциал фталоцианина и в растворе будет поддерживаться постоянным независимо от любых химических процессов и изменения химического состава раствора. А теперь представим, что к насыщенному раствору фталоцианина прибавляется ПАВ (именно так ставились опыты в [17–19]). Тогда концентрация ПАВ в растворе будет расти, но химический потенциал фталоцианина будет оставаться неизменным, как и химический потенциал мономеров в формуле (4) $({{\mu }_{2}} = {{\mu }_{{21}}}).$ При постоянстве температуры все величины в правой части (4), кроме ${{w}_{{21}}}$ и ${{c}_{{21}}}$, постоянны, и мы можем записать
где ${{С}_{1}}$ – некоторая постоянная (постоянная величина $\Lambda _{{21}}^{3}$ временно оставлена в левой части (6) по той простой причине, что под знаком логарифма могут стоять только безразмерные величины).Обратимся к величине ${{w}_{{21}}},$ которая представляет собой работу переноса одной молекулы фталоцианина из вакуума в фиксированную точку в чистом растворителе. Слово “чистый” подразумевает полное отсутствие в растворителе других молекул фталоцианина. Если ПАВ в растворе нет, то “чистый растворитель” – это вода, а если есть – то водный раствор ПАВ. В первом случае внедрение молекулы фталоцианина в воду требует большой работы (обозначим ее $w_{{21}}^{0}),$ а во втором работа снижается благодаря тому, что к гидрофобной поверхности молекулы фталоцианина прилипают углеводородные хвосты молекул или ионов ПАВ. Если в расчете на одну молекулу ПАВ выигрыш в работе составляет u (работа отрыва молекулы ПАВ от гидрофобной поверхности фталоцианина, величина положительная), то выполняется соотношение
где n – число молекул ПАВ, прилипших к одной молекуле фталоцианина. Подстановка (7) в (6) дает(8)
${{c}_{{21}}}\Lambda _{{21}}^{3} = \exp \left( {\frac{{{{С}_{1}} - w_{{21}}^{0} + un}}{{kT}}} \right).$(9)
$c_{{21}}^{0}\Lambda _{{21}}^{3} = \exp \left( {\frac{{{{С}_{1}} - w_{{21}}^{0}}}{{kT}}} \right),$(10)
${{c}_{{21}}} = c_{{21}}^{0}\exp \left( {\frac{{un}}{{kT}}} \right) = c_{{21}}^{0}\exp (\tilde {u}n),$Очевидно, что число n связано с концентрацией ПАВ ${{с}_{1}}$ в растворе и что обе величины изменяются симбатно. Если рассматривать прилипание молекул ПАВ к мономеру фталоцианина как начало процесса формирования мицеллы с солюбилизированным мономером, то величину n можно назвать числом агрегации. Но ведь число агрегации часто (например, в законе действия масс) считается величиной постоянной (в теории мицеллообразования это называется квазихимическим приближением). Да, это так, но только для полностью сформировавшихся мицелл. В последнее время разрабатывается общая теория мицелл с переменными числами агрегации [25, 26]. Она включает в себя и концентрационную область, внутри которой число агрегации, естественно, является переменным. Разница состоит в том, что для обычных мицелл эта область узкая и незаметная, а в нашем случае мицеллы с солюбилизированным мономером она растянута и более доступна для изучения. В работе [25] отмечалась аналогия между числом агрегации в мицелле и адсорбцией монослоя ПАВ по Ленгмюру (любая мицелла – это замкнутый монослой ПАВ, но только искривленный). В нашем случае эта аналогия также, несомненно, присутствует, причем она намного сильнее. Во-первых, у нас есть готовые частицы “адсорбентов” – это мономеры и димеры фталоцианина, причем число посадочных мест для молекул ПАВ у них ограничено (пусть для мономера это будет предельное число агрегации ${{n}_{\infty }}).$ Во-вторых, в рассматриваемой области формирования мицеллы процесс агрегации ПАВ еще не развит, и можно считать, что концентрация мономеров ПАВ ${{с}_{{11}}}$ совпадает с брутто-концентрацией ПАВ ${{с}_{1}}$. Уравнение Ленгмюра тогда принимает вид
Подстановка (11) в (10) приводит ко второму результату этого раздела(12)
${{c}_{{21}}} = c_{{21}}^{0}\exp \left( {\tilde {u}{{n}_{\infty }}\frac{{b{{c}_{1}}}}{{1 + b{{c}_{1}}}}} \right),$Димеры фталоцианина
Как известно, димер – это ассоциат двух мономеров, и, хотя связывающие их силы (в нашем случае – гидрофобные) намного слабее химических (скажем, в Н2 или О2), все-таки димер ведет себя как единое целое, и его можно рассматривать наподобие молекулы (выше мы это уже делали, приписав димеру химический потенциал). Если F – химический символ мономера, а D$( \equiv {\kern 1pt} {{\operatorname{F} }_{2}})$ – димера, то уравнение реакции димеризации записывается как
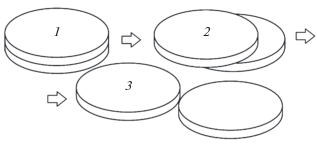
В химической термодинамике Гиббса для записи условия равновесия химической реакции используется следующее правило: нужно в уравнении реакции заменить символы веществ их химическими потенциалами. Тогда, в соответствии с нашими обозначениями, условие равновесия реакции (14) предстает в виде где мы использовали указанное ранее условие, что химический потенциал мономера отождествляется с химическим потенциалом вещества вообще (напомним, что фталоцианин идет у нас под номером 2).Равенства (14) и (15) отражают лишь тот факт, что в димере две молекулы. Для малых молекул-шариков совершенно неважно, как они соединяются в димер. Но для макроциклов фталоцианина это не праздный вопрос. Богатая статистическая картина микроструктур раствора содержит самые разные виды контактов мономеров фталоцианинов, но, исходя из энергетики, можно считать, что преобладают кофациальные слипания мономеров как следствие плоской структуры макроциклов. Примеры таких слипаний разной степени схематически показаны на рис. 2. Положение 1 отвечает наиболее компактной форме димера с минимальной поверхностью. Постепенно сдвигая верхний диск по отношению к нижнему (положение 2), мы, в конце концов, приходим к предельному положению 3, где два мономера эфемерно связаны друг с другом точкой касания. По существу, в положении 3 димер уже расслоился на два мономера. Каждый из димеров в этой цепочке имеет свою вероятность существования, а всю картину можно охарактеризовать равновесной кривой распределения. Ее можно получить из условия равенства химических потенциалов димеров всех типов. Тогда формула (5) дает
(16)
${{c}_{{22}}} = \Lambda _{{22}}^{{ - 3}}\exp \frac{{{{\mu }_{{22}}} - \mu _{{22}}^{\operatorname{v} } - {{w}_{{22}}}}}{{kT}}.$(17)
$\mu _{{22}}^{\operatorname{v} } = \mu _{{22}}^{{\operatorname{v} с}} + \Delta \mu _{{22}}^{\operatorname{v} },$(18)
${{c}_{{22}}} = \Lambda _{{22}}^{{ - 3}}\exp \frac{{{{\mu }_{{22}}} - \mu _{{22}}^{{\operatorname{v} \operatorname{c} }} - \Delta \mu _{{22}}^{\operatorname{v} } - {{w}_{{22}}}}}{{kT}}.$(20)
$c_{{22}}^{с} = \Lambda _{{22}}^{{ - 3}}\exp \frac{{{{\mu }_{{22}}} - \mu _{{22}}^{{\operatorname{v} \operatorname{c} }} - w_{{22}}^{с}}}{{kT}},$(21)
${{c}_{{22}}} = c_{{22}}^{с}\exp \left( { - \frac{{\Delta \mu _{{22}}^{\operatorname{v} } + \Delta {{w}_{{22}}}}}{{kT}}} \right).$Появление в растворе молекул ПАВ меняет картину, но, конечно, не сразу. Молекулы ПАВ садятся, как бы адсорбируясь, на гидрофобную поверхность фталоцианина, и, поскольку химический потенциал ПАВ также должен быть одним и тем же на поверхности димеров всех видов, плотность посадки (поверхностная концентрация) и степень покрытия поверхности будут для них тоже одинаковыми. Если, скажем, свободная поверхность димеров всех типов уменьшится на 30%, то все равно она будет больше там, где она и была больше. Распределение (16) будет качественно таким же, как в чистой воде, но вероятность компактных димеров будет уже менее выражена.
По аналогии с (7) можем написать
где $w_{{22}}^{0}$ относится к воде без ПАВ. Подставив (22) в (16), получаем распределение димеров фталоцианина в водном растворе ПАВ в виде(23)
${{c}_{{22}}} = \Lambda _{{22}}^{{ - 3}}\exp \frac{{{{\mu }_{{22}}} - \mu _{{22}}^{\operatorname{v} } - w_{{22}}^{0} + un}}{{kT}}.$(24)
$c_{{22}}^{с} = \Lambda _{{22}}^{{ - 3}}\exp \frac{{{{\mu }_{{22}}} - \mu _{{22}}^{{\operatorname{v} \operatorname{c} }} - w_{{22}}^{{0с}} + u{{n}_{\operatorname{c} }}}}{{kT}}.$(25)
${{c}_{{22}}} = c_{{22}}^{с}\exp \left( { - \frac{{\Delta \mu _{{22}}^{\operatorname{v} } + \Delta w_{{22}}^{0} - u\Delta n}}{{kT}}} \right),$Посмотрим внимательно на показатель степени экспоненты в (25). Все три величины, стоящие в числителе, пропорциональны свободной площади димера. Поэтому, говоря о конкретном димере в последовательности на рис. 2, мы говорим и обо всей последовательности в целом. Из указанных трех величин третья (связанная с присутствием ПАВ) имеет другой знак, чем две остальные. Сам этот факт открывает возможность того, что присутствие ПАВ может изменить тип распределения димеров на противоположный. Посмотрим, как это происходит. Если добавка ПАВ незначительна, то как n, так и Δn малы, и знак показателя экспоненты (минус) в (25) не меняется: мы и в присутствии ПАВ наблюдаем преобладание компактных димеров. (Заметим, что наличие димеров фталоцианинов не только в чисто водном растворе, но и в растворах ПАВ малой концентрации было экспериментально установлено в работах [17–19].) Если же обратиться к другому крайнему случаю, когда поверхность димера полностью покрыта молекулами или ионами ПАВ (следуя методу Ленгмюра, заменяем тогда n на ${{n}_{\infty }}),$ то знак изменится, и мы будем иметь
(26)
$ - \Delta \mu _{{22}}^{\operatorname{v} } - \Delta w_{{22}}^{0} + u\Delta {{n}_{\infty }} > 0.$Граничное состояние определяется условием
Концентрацию ПАВ $с_{1}^{*},$ отвечающую решению уравнения (27) при заданной функции $\Delta n(с_{1}^{*})$, можно назвать концентрацией мономеризации фталоцианина. В частности, при использовании уравнения Ленгмюра уравнение (27) для отыскания $с_{1}^{*}$ принимает форму(29)
$ - \Delta \mu _{{22}}^{\operatorname{v} } - \Delta w_{{22}}^{0} + u\Delta {{n}_{\infty }}\frac{{bс_{1}^{*}}}{{1 + bс_{1}^{*}}} = 0.$Влияние ПАВ на концентрацию димеров фталоцианина
Выше мы рассмотрели распределение разных видов димеров. Теперь же будем рассматривать димер, как он выглядит в среднем (в наиболее вероятной форме). Используя равенство первой и третьей величин в (15), можем сказать, что закрепление химического потенциала фталоцианина в условиях агрегативного равновесия означает и постоянство химического потенциала димера ${{\mu }_{{22}}}$. Тогда, исходя из формулы (5), по аналогии с (6) имеем
При переносе одного димера из вакуума в раствор ПАВ его поверхность, так же как и в случае мономера, в какой-то степени покрывают молекулы или ионы ПАВ. Поэтому по аналогии с (7) можем записать где n – число прилепившихся молекул ПАВ (число агрегации). Очевидно, работа отрыва одной молекулы ПАВ u в формулах (7) и (31) одна и та же. Подстановка (31) в (30) дает(32)
${{c}_{{22}}}\Lambda _{{22}}^{3} = \exp \left( {\frac{{{{С}_{2}} - w_{{22}}^{0} + un}}{{kT}}} \right).$(33)
$c_{{22}}^{0}\Lambda _{{22}}^{3} = \exp \left( {\frac{{{{С}_{2}} - w_{{22}}^{0}}}{{kT}}} \right),$(34)
${{c}_{{22}}} = c_{{22}}^{0}\exp \left( {\frac{{un}}{{kT}}} \right) = c_{{22}}^{0}\exp (\tilde {u}n),$Если теперь попытаться совершить переход от числа агрегации к концентрации ПАВ опять при помощи уравнения Ленгмюра (11), то в случае димеров мы сталкиваемся с рядом осложнений. Как было показано выше, структура и свободная площадь среднего димера зависят от концентрации ПАВ. При подходе с позиций теории адсорбции, где растворенный фталоцианин играет роль адсорбента по отношению к ПАВ, мы имеем уникальный случай: пока димеры существуют, реальная площадь адсорбента и число посадочных мест адсорбата (ПАВ) зависят от концентрации ПАВ в растворе. В таких условиях уравнение Ленгмюра, естественно, не работает, и необходимо построение новой теории с учетом указанной функциональной зависимости. Пока она неизвестна, нам остается рассмотреть лишь область сильно разбавленного раствора ПАВ, в котором реализуется положение 1 на рис. 2. Тогда, принимая bc1$ \ll $ 1 в уравнении Ленгмюра, приходим, по аналогии с (13), к соотношению
где $c_{{22}}^{0}$ – концентрация димеров фталоцианина в чисто водном растворе. Из соотношения (35) следует, что в разбавленном растворе ПАВ в равновесии с твердой фазой фталоцианина концентрация димеров фталоцианина экспоненциально возрастает с содержанием ПАВ в растворе. Сам факт такого возрастания уже обнаружен экспериментально [17–19].Мицеллы и протомицеллы ПАВ при солюбилизации фталоцианинов
Когда молекулы или ионы ПАВ заполняют всю поверхность молекулы фталоцианина в водном растворе, вся эта конструкция выглядит как прямая мицелла ПАВ с одной солюбилизированной молекулой фталоцианина. В классической коллоидной науке порядок событий при прибавлении ПАВ к раствору таков: сначала мицеллообразование, затем солюбилизация (так, например, осуществляется моющее действие детергентов). У нас же все наоборот: сначала в растворе существует частица (мономер или димер) фталоцианина, которая становится центром мицеллообразования и, обрастая молекулами или ионами ПАВ, превращается в мицеллу с солюбилизатом. Этот процесс никак не связан с обычным мицеллообразованием (в отсутствие солюбилизата) и, как уже отмечалось в [17–19], может происходить и при концентрациях ниже ККМ данного ПАВ.
Очевидно, не только мономеры фталоцианина, но и димеры, если они имеются в растворе, будут также покрываться молекулами или ионами ПАВ, образуя мицеллы еще бόльшего размера. Поскольку димеры предшествуют мономерам, такого рода мицеллы могли бы также предшествовать обычным мицеллам с мономерами фталоцианина, и потому их можно назвать протомицеллами [17]. Но мы знаем, что при увеличении концентрации ПАВ в распределении димеров по формам все более преобладают димеры типа 3 на рис. 2. Они на волоске от распада на мономеры, и их время жизни чрезвычайно мало, а потому и протомицеллы являются эфемерными агрегативными структурами. Однако они занимают свою скромную нишу в равновесных распределениях, и к ним вполне применима термодинамика.
Реакции образования мицеллы (химический символ М) ПАВ (химический символ молекулы или иона ПАВ S) и протомицеллы (P) в растворе фталоцианина можно записать как
где, напоминаем, F – символ мономера фталоцианина, D – символ димера, и n – число агрегации ПАВ (естественно, с различными значениями в (36) и (37), отмеченными индексами F и D). В соответствии с указанным выше правилом, условия равновесия для этих реакций суть Напомним, что в мицеллярных системах химический потенциал ПАВ совпадает с химическим потенциалом мономеров: ${{\mu }_{{11}}} \equiv {{\mu }_{1}}$ [20–22], а для фталоцианинов ${{\mu }_{{21}}} \equiv {{\mu }_{2}}.$ При закреплении химического потенциала фталоцианина ${{\mu }_{2}}$ (в этих условиях проводились опыты в [17–19]) не только ${{\mu }_{{21}}}$, но, согласно (15), и ${{\mu }_{{22}}}$ являются постоянными. Тогда из (38) и (39) получаем(40)
$\frac{{d{{\mu }_{\operatorname{M} }}}}{{d{{\mu }_{1}}}} = {{n}_{\operatorname{F} }} + {{\mu }_{1}}\frac{{d{{n}_{\operatorname{F} }}}}{{d{{\mu }_{1}}}},$(41)
$\frac{{d{{\mu }_{\operatorname{P} }}}}{{d{{\mu }_{1}}}} = {{n}_{\operatorname{D} }} + {{\mu }_{1}}\frac{{d{{n}_{\operatorname{D} }}}}{{d{{\mu }_{1}}}}.$ЗАКЛЮЧЕНИЕ
Явление мономеризации фталоцианинов в растворах ПАВ настолько интересно для коллоидной науки, что, несомненно, заслуживает создания специальной теории. Это и сделано в настоящем сообщении. Теория обосновывает целый ряд новых явлений, недавно выявленных в эксперименте [17–19]. Это, прежде всего, образование мицелл особого типа путем адсорбции ПАВ на ядре, роль которого играют мономеры и димеры фталоцианинов. Соответственно возникают мицеллы и протомицеллы ПАВ с солюбилизированными мономерами и димерами, причем их постепенное формирование (заполнение поверхности ядер молекулами или ионами ПАВ) при добавлении ПАВ к системе заканчивается еще до достижения ККМ данного ПАВ. Движущей силой такого процесса является гидрофобный эффект, и в ходе процесса концентрация протомицелл уменьшается до ничтожных значений, что и составляет суть явления мономеризации фталоцианинов (в форме мицелл с солюбилизатом, каждая из которых содержит только одну молекулу фталоцианина).
В ходе обсуждения экспериментальных данных по исследованию фталоцианинов в растворах ПАВ [17–19] было высказано предположение о существовании (по аналогии с ККМ) концентрации мономеризации, т.е. такой концентрации ПАВ, при которой происходит переход от димеров (в виде которых фталоцианины находятся в чистой воде и очень слабых растворах ПАВ) к мономерной форме существования фталоцианинов. Из теории следует, что такой физический параметр действительно есть и определяется специальным уравнением (условием (27)), сам факт наличия которого принципиально важен. Пока будут разрабатываться способы математического решения уравнения, перед экспериментаторами стоит свой вызов – нахождение надежного метода прямого определения этой величины из опыта.
Список литературы
Darwent J.R. // J. Chem. Soc., Chem. Commun. 1980. P. 805.
Daraio M.E., Aramendía P.F., San Román E.A., Braslavsky S.E. // Photochem. Photobiol. 1991. V. 54. P. 367.
Howe L., Zhang J.Z. // Photochem. Photobiol. 1998. V. 67. P. 90.
Li X.Y., He X., Ng A.C.H., Wu C., Ng D.K.P. // Macromolecules. 2000. V. 33. P. 2119.
Chen Z.J., Li X.Y., Ngai T., Wu C., Ng D.K.P. // Langmuir. 2001. V. 17. P. 7957.
Гольдшлегер Н.Ф., Калашникова И.П., Баулин В.Е., Цивадзе А.Ю. // Физикохимия поверхности и защита материалов. 2011. Т. 47. С. 392.
Гольдшлегер Н.Ф., Черняк А.В., Калашникова И.П., Баулин В.Е., Цивадзе А.Ю. // Журн. общей химии. 2012. Т. 82. С. 856.
Гольдшлегер Н.Ф., Лобач А.С., Гак В.Ю., Калашникова И.П., Баулин В.Е., Цивадзе А.Ю. // Физикохимия поверхности и защита материалов. 2014. Т. 50. С. 496.
Гольдшлегер Н.Ф., Черняк А.В., Лобач А.С., Калашникова И.П., Баулин В.Е., Цивадзе А.Ю. // Физикохимия поверхности и защита материалов. 2015. Т. 51. С. 160.
Гольдшлегер Н.Ф., Гак В.Ю., Калашникова И.П., Баулин В.Е., Иванчихина А.В., Смирнов В.А., Ширяев А.А., Цивадзе А.Ю. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 4S. С. 3.
Гольдшлегер Н.Ф., Калашникова И.П., Горбунова Ю.Г., Мартынов А.Г., Баулин В.Е., Цивадзе А.Ю. // Физикохимия поверхности и защита материалов. 2018. Т. 54. С. 38.
Гольдшлегер Н. Ф., Гак В. Ю., Лапшина М. А., Баулин В. Е., Ширяев А.А., Цивадзе А.Ю. // Изв. АН. Сер. хим. 2018. № 12. С. 2205.
Мовчан Т.Г., Аверин А.А., Баулин Д.В., Плотникова Е.В., Баулин В.Е., Цивадзе А.Ю. // Коллоид. журн. 2018. Т. 80. С. 528.
Мовчан Т.Г., Чернядьев А.Ю., Плотникова Е.В., Аверин А.А., Цивадзе А.Ю., Баулин В.Е. // Коллоид. журн. 2018. Т. 80. С. 694.
Мовчан Т.Г., Чернядьев А.Ю., Плотникова Е.В., Цивадзе А.Ю., Баулин В.Е. // Коллоид. журн. 2019. Т. 81. С. 750.
Мовчан Т.Г., Чернядьев А.Ю., Плотникова Е.В., Цивадзе А.Ю., Баулин В.Е. // Коллоид. журн. 2020. Т. 82. С. 26.
Русанов А.И., Мовчан Т.Г., Плотникова Е.В. // ДАН. Химия. 2020. Т. 495. С. 53.
Мовчан Т.Г., Русанов А.И., Плотникова Е.В. // Коллоид. журн. 2021. Т. 83. С. 75.
Мовчан Т.Г., Русанов А.И., Плотникова Е.В. // Коллоид. журн. 2021. Т. 83. (в печати).
Русанов А.И. Мицеллообразование в растворах поверхностно-активных веществ. СПб.: Химия, 1992.
Rusanov A.I. Micellization in Surfactant Solutions. Chemistry Reviews, Vol’pin, M.E., Ed.; Vol. 22, Part 1. Reading: Harwood Academic Publishers, 1996. ISBN 90-5702-297-4.
Русанов А.И., Щёкин А.К. Мицеллообразование в растворах поверхностно-активных веществ, 2-е изд., доп. СПб.: Лань, 2016.
Русанов А.И. // Коллоид. журн. 2021. Т. 83. С. 98.
Куни Ф.М. Статистическая физика и термодинамика. М.: Наука, 1981.
Русанов А.И. // Коллоид. журн. 2017. Т. 79. С. 613.
Русанов А.И. // Коллоид. журн. 2018. Т. 80. С. 86.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал