Координационная химия, 2019, T. 45, № 1, стр. 43-47
Полиморфизм двойного комплексного соединения гекса(изотиоцианато)хромата(III) окта(ε-капролактам)европия(III)А. В. Вировец, Е. В. Пересыпкина, Е. В. Черкасова, Т. Г. Черкасова
А. В. Вировец 1, 2, Е. В. Пересыпкина 1, 2, Е. В. Черкасова 3, Т. Г. Черкасова 3, *
1 Институт неорганической химии им. А.В. Николаева СО РАН
, Новосибирск, Россия
2 Новосибирский национальный исследовательский государственный университет
, Россия
3 Кузбасский государственный технический университет им. Т.Ф. Горбачева
, Кемерово, Россия
* E-mail: ctg.htnv@kuzstu.ru
Поступила в редакцию 15.03.2018
После доработки 15.06.2018
Принята к публикации 11.05.2018
Аннотация
Из смеси твердых продуктов взаимодействия EuCl3, K3[Cr(NCS)6] и ε-капролактама (ε-C6H11NO) в водном растворе получена новая структурная модификация соединения состава [Eu(ε-C6H11NO)8] [Cr(NCS)6]. Кристаллы триклинные, пр. гр. P$\bar {1}$, Z = 2, a = 14.2320(4), b = 145298(4), c = 17.0014(5) Å, α = 92.4190(10)°, β = 91.0880(10)°, γ = 108.4850(10)°, V = 3329.39 Å3, ρ(выч.) = 1.454 г/см3, R1 = 0.0419. (CIF file ССDС № 1827162).
Соединение состава [Eu(ε-C6H11NO)8][Cr(NCS)6] (I) относится к классу двойных комплексных соединений (ДКС), представляющих интерес в качестве прекурсоров для получения функциональных, в частности термочувствительных материалов [1–8]. На протяжении более десяти лет мы проводили систематические исследования ДКС с ε-капролактамом (Cpl) в качестве органического лиганда. Структурные типы гекса(изотиоцианато)хроматов(III) комплексов лантанидов(III) с Cpl рассмотрены нами ранее [9–11]. Установлены три структурных типа: триклинный, моноклинный и тетрагональный (для комплекса [Eu(ε-C6H11NO)8] [Cr(NCS)6] (Iа)). При изучении влияния температурного фактора на кристаллическую структуру комплекса Iа был обнаружен фазовый переход с обратимым двойникованием [11].
Настоящая работа связана с получением и РСА монокристаллов триклинной модификации cоединения Iб.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез выполняли в соответствии с общей методикой, приведенной в [11], смешиванием умеренно концентрированных водных растворов 0.59 г (0.001 моль) комплексной соли K3[Cr(NCS)6] · 4H2O и 0.37 г (0.001 моль) гексагидрата хлорида европия(III) в интервале pH 4–6 c последующим добавлением водного раствора 0.090 г (0.008 моль) Cpl. Полученный раствор отфильтровывали и подвергали медленной кристаллизации на воздухе при стандартных условиях. Выход смеси модификаций Iа и Iб 70%.
Химический анализ и ИК-спектр соединений I представлены в [11].
РСА. Дифракционные данные для монокристалла Iб размером 0.206 × 0.112 × 0.025 мм получены при 90 K на автоматическом четырехкружном дифрактометре Bruker X8Apex, оснащенном двухкоординатным CCD детектором. Кристаллы триклинные, пр. гр. P–1, Z = 2, a = 14.2320(4), b = = 145 298(4), c = 17.0014(5) Å, α = 92.4190(10)°, β = = 91.0880(10)°, γ = 108.4850(10)°, V = 3329.39 Å3, F(000) = 1514, ρ(выч.) = 1.454 г/см3. Всего измерено 41 225 рефлексов (17 876 независимых, 13 671 с Fo ≥ 4σ(F)) до 2θ = 63°. Поглощение учтено усреднением эквивалентных рефлексов по программе SADABS, Tmin = 0.769, Tmax = 0.967. Для уточнения структурной модели использованы координаты атомов из Nd-содержащего аналога [9]. Уточнение проведено в полноматричном анизотропном приближении по F 2. Атомы водорода уточнены геометрически по модели наездника. Окончательные значения факторов расходимости: R1 = = 0.0419 для Fo ≥ 4σ(F), wR2 = 0.0854, GООF = 1.043 для всех независимых рефлексов (табл. 1). Структурные данные депонированы в Кембриджском банке структурных данных (ССDС № 1827162); www.ccdc.cam.ac.uk/data_reguest/cif).
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структуры Iб
| Параметр | Значение |
|---|---|
| Формула | C48H88N8O8Eu · C6CrN6S6 |
| М | 1457.70 |
| Температура, К | 90.0(2) |
| Излучение (λ, Å) | MoKα (0.71073) |
| Сингония | Триклинная |
| Пр. гр. | P1 |
| Z | 2 |
| a, Å | 14.2320(4) |
| b, Å | 14.5298(4) |
| c, Å | 17.0014(5) |
| α, град | 92.419(1) |
| β, град | 91.088(1) |
| γ, град | 108.485(1) |
| V, Å3 | 3329.38(16) |
| ρ(выч.), г/см3 | 1.454 |
| μ, мм–1 | 1.35 |
| F(000) | 1514 |
| Размеры кристалла, мм | 0.21 × 0.11 × 0.03 |
| Область сбора данных по θ, град | 1.51–31.54 |
| Интервалы индексов отражений | –19 ≤ h ≤ 20, –17 ≤ k ≤ 20, –18 ≤ l ≤ 24 |
| Измерено отражений | 41 225 |
| Независимых отражений (Rint) | 17 876 |
| Отражений с I > 2σ(I) | 13 671 (0.042) |
| Число уточняемых параметров | 757 |
| R1 (I > 2σ(I)) | 0.042 |
| wR2 (все отражения) | 0.085 |
| GOOF (все отражения) | 1.04 |
| Остаточная электронная плотность (min/max), e/Å3 | –0.72/1.05 |
Таблица 2.
Основные длины связей и величины валентных углов в структуре Iб
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Cr(1)–N(1) | 1.989(3) | Eu(1)–O(12) | 2.346(2) |
| Cr(1)–N(6) | 1.993(3) | Eu(1)–O(13) | 2.399(2) |
| Cr(1)–N(4) | 1.997(3) | Eu(1)–O(14) | 2.328(2) |
| Cr(1)–N(3) | 2.001(3) | Eu(1)–O(15) | 2.507(2) |
| Cr(1)–N(2) | 2.005(3) | Eu(1)–O(16) | 2.410(2) |
| Cr(1)–N(5) | 2.007(3) | Eu(1)–O(17) | 2.435(2) |
| Eu(1)–O(11) | 2.431(2) | Eu(1)–O(18) | 2.367(2) |
| Угол | ω, град | Угол | ω, град |
| N(1)Cr(1)N(2) | 90.15(11) | O(12)Eu(1)O(11) | 71.41(7) |
| N(1)Cr(1)N(3) | 89.85(11) | O(12)Eu(1)O(15) | 72.82(7) |
| N(1)Cr(1)N(4) | 88.94(11) | O(12)Eu(1)O(16) | 80.46(7) |
| N(1)Cr(1)N(5) | 88.25(11) | O(12)Eu(1)O(17) | 91.62(7) |
| N(2)Cr(1)N(5) | 90.51(11) | O(13)Eu(1)O(15) | 68.64(7) |
| N(3)Cr(1)N(5) | 89.94(11) | O(13)Eu(1)O(17) | 74.81(7) |
| N(4)Cr(1)N(2) | 90.06(10) | O(14)Eu(1)O(11) | 80.26(8) |
| N(4)Cr(1)N(3) | 89.49(10) | O(14)Eu(1)O(16) | 72.04(7) |
| N(6)Cr(1)N(2) | 91.20(11) | O(16)Eu(1)O(11) | 72.12(7) |
| N(6)Cr(1)N(3) | 88.80(11) | O(16)Eu(1)O(17) | 73.54(7) |
| N(6)Cr(1)N(4) | 90.61(11) | O(17)Eu(1)O(15) | 75.66(7) |
| N(6)Cr(1)N(5) | 92.19(11) | O(18)Eu(1)O(11) | 72.97(7) |
| O(18)Eu(1)O(15) | 74.01(7) |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В результате кристаллизации смесей водных растворов исходных компонентов получены бледно-сиреневые кристаллы, плохо растворимые в воде, ацетоне, толуоле, этиловом спирте, хорошо растворимые в ДМСО и ДМФА.
ИК-спектроскопические данные (см–1): 2928.8 ν(CN), 825.0 ν(CS), 481.3 σ(NCS) характеризуют изотиоцианатную группу. Смещение полосы валентных колебаний карбонильной группы Cpl (1665 см–1) в низкочастотную область на 38.3 см–1 указывает на образование координационной связи Cpl с ионами европия(III) через атомы кислорода [12, 13].
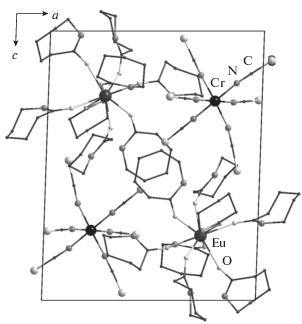
Строение Iб (рис. 1) установлено методом РСА. Кристаллы Iб изоструктурны кристаллам раннее исследованного [Nd(Cpl)8][Cr(NCS)6] [9, 11]. Квадратно-антипризматическая и октаэдрическая координация атомов европия и хрома сохраняются, как и упаковка в кристалле по мотиву NaCl (рис. 2). Главное отличие строения Iб от тетрагональной модификации того же соединения (Iа, [11]) состоит в том, что в Iб конформационно-гибкие лиганды Cpl полностью упорядочены при температуре дифракционного эксперимента, равной 90 K. В структуре Iа они претерпевают серьезное разупорядочение, не позволяющее локализовать NH-группы (рис. 3). При этом “заморозить” разупорядочение в Iа, снижая температуру, не удается, так как кристалл претерпевает фазовый переход [11]. Поскольку химический состав Iа и Iб одинаков, мы имеем дело с полиморфизмом, причем тетрагональная полиморфная модификация Iа при охлаждении не переходит в триклинную Iб. Направленное получение определенной полиморфной модификации Iа или Iб во многом остается делом случая, как это часто бывает с другими полиморфными модификациями [14, 15]. К сожалению, выяснить, какая полиморфная модификация более стабильна, сравнив величины рентгеновской плотности, также не удается, так как кристаллографические данные получены при сильно (практически на 200°) различных температурах.
Рис. 1.
Строение катиона (а) и аниона (б), эллипсоиды атомных смещений с 50%-ной вероятностью. Атомы водорода, за исключением NH-групп, не показаны.
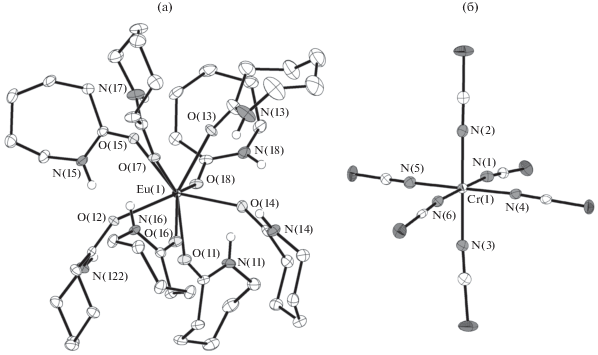
Рис. 3.
Строение катиона в Iа по данным [11]. Альтернативные конформации Cpl-лигандов показаны пунктиром.
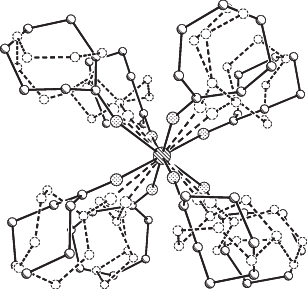
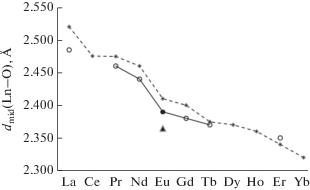
В связи с разупорядочением ранее определенной тетрагональной структуры, положение атомoв азота в семичленном капролактамовом цикле, а также длины связей в структуре Iа определены ненадежно. Для Iб положение атомов азота найдено по длинам связей, укороченным по сравнению с одинарными связями С–С. Длины связей Eu–O в квадратной антипризме EuO8 варьируют в интервале 2.328(2)–2.507(2) Å (тaбл. 2) и согласуются (рис. 4) с наблюдаемой тенденцией изменения длин связей в ряду лантанидов [11]. Таким образом, существование триклинной модификации для соединения I закрывает вопрос об аномальном поведении европия в обсуждаемом ряду.
Рис. 4.
Зависимость ионного радиуса Ln3+ (для КЧ 8, пунктирная линия) [16], средних расстояний Ln–O (кружки) в комплексных катионах в структуре комплексов [Ln(ε-C6H11NO)8][Cr(NCS)6] от порядкового номера лантанида Ln. Черным треугольником обозначено значение, отвечающее Iа, черным кружком – новое значение для Iб.
Список литературы
Печенюк С.И., Домонов Д.Р. // Журн. структур. химии. 2011. Т. 2. № 1. С. 19.
Третьяков Ю.Д. // Успехи химии. 2004. Т.7 3. № 9. С. 831.
Smekal Z., Brrezina F., Sindela Z. et al. // Transition Met. Chem. 2010. V. 22. № 3. P. 299.
Wrzeszcz G., Dobrzanska L., Wojtczac A., Grodzicki A. // Dalton Trans. 2002. P. 2862.
Dobrzanska L., Wrzeszcz G., Grodzicki A., Rozploch F. // Polish J. Chem. 2000. V. 74. P. 1071.
Третьяков Ю.Д. // Успехи химии. 2004. Т. 73. № 9. С. 899.
Помогайло А.Д., Розенберг А.С., Джардимашева Г.И. // Рос. хим. журн. 2009. Т. 53. № 1. С. 140.
Черкасова Е.В., Патраков Ю.Ф., Трясунов Б.Г. и др. // Журн. неорган. химии. 2009. Т. 54. № 10. С. 1700 (Cherkasova E.V., Patrakov Yu.F., Tryasunov B.G. et al. // Russ. J. Inorg. Chem. 2009. V. 54. № 10. P. 1625. doi 10.1134/S0036023609100192).
Cherkasova E.V., Virovets A.V., Peresypkina E.V. et al. // Inorg. Chem. Commun. 2006. V. 9. № 1. P. 4.
Cherkasova E.V., Peresypkina E.V., Virovets A.V. et al. // Acta Crystallogr. C. 2007. V. 63. P. m195.
Вировец А.В., Пересыпкина Е.В., Черкасова Е.В. и др. // Журн. структур. химии. 2009. Т. 50. № 1. С. 144. (Virovets A.V., Peresypkina E.V., Cherkasova E.V. et al. // J. Struct. Chem. 2009. V. 50. P. 137. doi 0022-4766/ 09/5001-0137).
Накамото К. ИК спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991. 536 с.
Костромина Н.А., Кумок В.Н., Скорик Н.А. // Химия координационных соединений. М.: Высш. шк., 1990. 432 с.
Dunitz J.D., Bernstein J. // Acc. Chem. Res. 1995. V. 28. P. 193.
Bučar D.-K., Lancaster R.W., Bernstein J. // Angew. Chem. Int. Ed. 2015. V. 54. P. 6972.
Shannon R.D., Prewitt C.T. // Acta Crystallogr. B. 1969. V. 56. P. 925.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия