Координационная химия, 2019, T. 45, № 10, стр. 627-634
Водорастворимый хиральный металламакроциклический фенилаланингидроксиматный комплекс Y(III)–Cu(II)
М. А. Каткова 1, *, Г. С. Забродина 1, Г. Ю. Жигулин 1, Р. В. Румянцев 1, С. Ю. Кетков 1
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
* E-mail: marina@iomc.ras.ru
Поступила в редакцию 27.03.2019
После доработки 12.04.2019
Принята к публикации 22.04.2019
Аннотация
На основе L-фенилаланингидроксиматных лигандов синтезирован хиральный металламакроциклический комплекс Y(III)–Cu(II). Хиральность исходных L-аминогидроксиматных лигандов определяет одностороннюю ориентацию R-заместителя относительно внутреннего фрагмента O–Cu–N–O. Молекулярное и электронное строение синтезированного комплекса исследовано методами РСА (CIF file CCDC № 1903232) и квантовой химии.
Современные тенденции развития мировой фармацевтической промышленности свидетельствуют о растущей актуальности использования хиральных соединений в оптически чистой форме, что обусловлено различными биологическими и фармакологическими свойствами индивидуальных энантиомеров [1, 2]. В настоящее время развивается перспективное направление по изучению комплексов металлов с хиральными лигандами, полученными путем модифицирования органических природных веществ, фрагменты которых входят в состав белков и нуклеиновых кислот [3]. Ион металла в таких соединениях обычно координирован донорными атомами азота, кислорода и серы аминокислотных белковых фрагментов, моделирующих окружение металла в природных соединениях.
α-Аминокислоты являются хелатирующими лигандами N,O-типа благодаря наличию донорных карбоксильных и аминогрупп. Замена карбоксильной группы на гидроксамовую приводит к более эффективной координации N,N- и O,O-типа без изменения хиральности молекулы. С точки зрения координационной химии, перспективы использования аминогидроксамовых кислот обусловлены возможностью получения полиядерных гетерометаллических соединений, содержащих одновременно ионы меди и редкоземельных элементов [4–8]. Один из самых интересных классов таких соединений – металламакроциклические комплексы 15-MC-5, основу которых составляет практически плоский циклический фрагмент, состоящий из пяти ионов Cu2+ с пятью аминогидроксиматными лигандами, и центральный ион лантанида(III), координационно связанный с пятью атомами кислорода металламакроцикла [9]. В настоящее время популярность комплексов Ln(III)–Cu(II) 15-MC-5 во многом обусловлена их богатой координационной химией, разнообразными свойствами и простотой синтеза [10–13].
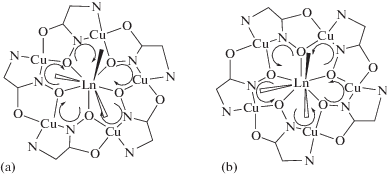
Ранее мы разработали оригинальный синтетический подход к аквакомплексам Ln(III)–Cu(II) на основе глицингидроксамовой кислоты Ln(H2O)3[15-MCCu(II)Glyha-5](Cl)3 [14–16]. Глицин, простейшая аминокислота, содержит в качестве боковой цепи атом водорода. Соответственно, по данным РСА глицингидроксиматного комплекса, было установлено наличие двух типов молекул в кристалле, содержащих (+) и (–) хиральные фрагменты –ONCuO– (а) и –OCuNO– (б) (схема 1 ).
Схема 1 .
С точки зрения хиральных особенностей строения комплексов Ln(III)–Cu(II) 15-MC-5 представляет интерес экспериментальное и теоретическое изучение соединений на основе оптически активных лигандов, например L-фенилаланингидроксимата (Phalaha). L-Фенилаланин – протеиногенная аминокислота, входящая в состав белков всех известных живых организмов. Ранее было показано, что на основе Phalaha могут быть получены водорастворимые металлакрауны 15-MC-5, содержащие ионы ряда лантанидов [17–20]. В то же время очень мало данных об аквакомплексах 15-MC-5 с центральным ионом иттрия. Следует отметить, что ввиду сложного состава и строения получаемых соединений, недостаточного качества монокристаллических образцов экспериментальное исследование методом РСА представляет собой сложную и трудоемкую задачу. Немалую трудность представляет расшифровка структур, имеющих большое количество “тяжелых” атомов и особенно уточнение позиций молекул растворителя (воды), представленные в значительном количестве в исследуемых соединениях. Именно поэтому актуальным является привлечение методов квантово-химического моделирования для исследования особенностей пространственного строения таких соединений. С точки зрения электронного строения, существенный интерес представляет влияние бензильных заместителей Phalaha-лигандов на орбитальную структуру и зарядовое распределение металламакроциклического комплекса. Системы Y(III)–Cu(II)–15-MC-5 удобно использовать в качестве модельных соединений для квантово-химических исследований. Ранее мы провели DFT-исследования процессов формирования глицингидроксиматных комплексов Cu(II)–Y(III) 15-MC-5 [21]. По своим свойствам иттрий(III), входящий в группу редкоземельных элементов, является оптимальным аналогом для моделирования соединений лантанидов в квантово-химических расчетах, обеспечивая приемлемую ресурсоемкость вычислений.
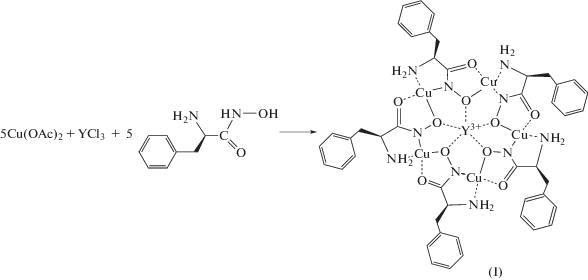
В настоящей работе мы поставили задачу синтеза аквакомплекса Y(III)–Cu(II) 15-MC-5 с L‑фенилаланингидроксиматными лигандами (Phalaha) и комбинированного исследования его строения и спектральных свойств с помощью экспериментальных методов и квантово-химических расчетов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали коммерчески доступные моногидрат ацетата меди, гексагидрат хлорида иттрия (Aldrich). Синтез L,α-фенилаланингидроксамовой кислоты с выходом 92% проводили из L,α-фенилаланина в соответствии с методикой [20].
Синтез Y(H2O)3[15-MCCu(II)Phalaha-5](Cl)3 ∙ 11.5H2O (I). К раствору 0.06 г (0.2 ммоль) YCl3 ∙ 6H2O и 0.2 г (1 ммоль) Cu(OAc)2 ∙ H2O в 30 мл бидистиллированной воды при интенсивном перемешивании добавляли 0.18 г (1 ммоль) L-α-фенилаланингидроксамовой кислоты. Через 1.5 ч раствор приобретал насыщенный сине-фиолетовый цвет. Смесь перемешивали 48 ч при 20°C и отфильтровывали. Темно-синие игольчатые кристаллы получали медленным испарением водного фильтрата при 40°C и дважды перекристаллизовывали из воды. Выход 0.28 г (85%).
| Найдено, %: | С 32.49; | H 4.73; | N 8.39. |
| Для C45H79N10O24.5Cl3Cu5Y | |||
| вычислено, %: | С 32.46; | H 4.78; | N 8.41. |
ИК-спектр (ν, см–1): 3321 сл, 1598 с, 1579 с, 1496 ср, 1405 ср, 1344 ср, 1302 ср, 1211 сл, 1181 сл, 1156 сл, 1120 сл, 1081 сл, 1073 ср, 1026 с, 974 сл, 935 ср, 866 сл, 847 сл, 832 сл, 756 сл, 742 ср, 703 с, 617 сл, 573 сл, 488 ср. УФ-спектр (293 K, H2O): λ = 575 нм.
ИК-спектры регистрировали на ИК Фурье спектрометре ФСМ 1201. Образцы готовили по стандартной методике в вазелиновом масле. ЭСП снимали на спектрометре Perkin Elmer Lambda 25. Элементный анализ выполняли с использованием C,H,N-анализатора Euro EA 3000.
РСА монокристаллов комплекса I проведен при 100 К на дифрактометре BrukerD8 Quest (графитовый монохроматор, MoKα-излучение, λ = = 0.71073 Å). Интегрирование экспериментальных интенсивностей проведено при помощи программы SAINT [22]. Программа SADABS [23] использована для учета поглощения. Структура I решена с помощью программы SHELXT [24] и уточнена полноматричным МНК по F 2 в анизотропном приближении для всех неводородных атомов c использованием программы SHELXTL [25]. Атомы водорода помещены в геометрически рассчитанные положения и уточнены в модели наездника (Uизо(H) = 1.2Uэкв(C, N)). В кристаллической ячейке I на каждую молекулу комплекса приходится восемь сольватных молекул воды. Атомы водорода молекул воды не были локализованы.
Измерено 72 391 отражений, из которых 34 223 (Rint = 0.0558) независимых с I > 2σ(I). Параметры ячейки монокристаллов: a = 14.7137(7), b = = 32.7696(15), c = 15.4541(7) Å, β = 117.800(2)°, V = = 6591.3(5) Å3. Пр. гр. P21, Z = 2, ρ(выч.) = 1.678 г/см3, размер кристалла 0.24 × 0.17 × 0.12 мм, µ = = 2.657 мм–1 , F(000) = 3400, 2.01° ≤ θ ≤ 29.00°, R1 = 0.0803, wR2 = 0.1979 (I > 2σ(I)), R1 = 0.0904, wR2 = 0.2021 (по всем данным), S(F 2) = 1.072, ρmax/ρmin 1.635/–1.480 e Å–3, flack-параметр 0.112(3).
Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDC № 1903232; https://www.ccdc.cam.ac.uk/structures/).
DFT исследование медьсодержащих ионных 15-MC-5 реализовано при помощи программного пакета Gaussian09 [26]. Полная оптимизация структур выполнена для комплексов состава {Y(H2O)3[15-MCCu(II)Phalaha-5]}3+ и {Y(H2O)3[15-MCCu(II)Glyha-5]}3+ с применением функционала B3LYP [27–29] и дважды валентно-расщепленного базисного набора DGDZVP с поляризационными функциями [30, 31]. Последующий анализ гармонических колебаний не выявил мнимых частот, что указывает на соответствие полученных в ходе оптимизаций структур минимумам на поверхности потенциальной энергии. При расчете каждого из комплексов задавалось значение общего заряда +3. Во избежание проблем в DFT, связанных с примесью высокоспиновых состояний к низкоспиновому, комплексы смоделированы как высокоспиновые системы с мультиплетностью 6. Применение такого подхода для описания 15-MC-5 обосновано нами ранее [21]. Карты функции локализации электронов (Electron Localization Function, ELF) получены с использованием программы Multiwfn версии 3.3.9 [32]. Расчеты в рамках квантовой теории атомов в молекулах (Quantum Theory of Atoms in Molecules, QTAIM) [33, 34] выполнены в программе AIMAll [35].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
L-Фенилаланингидроксамовая кислота получена из L-фенилаланина согласно методике [20]. При взаимодействии ацетата меди, хлорида иттрия и L-фенилаланингидроксамовой кислоты образуется с высоким выходом водорастворимый полиядерный металламакроциклический комплекс Y(III)–Cu(II) I (схема 2 ).
Схема 2 .
Молекулярное строение комплекса I показано на рис. 1. Строение комплекса I хорошо согласуется с геометрией глицингидроксиматного 15-МС-5 комплекса Y(III) [16]. Значения избранных длин связей и углов комплекса I и Y(OAc)(H2O)[15-MCCu(II)Glyha-5](NO3)2 [16] (для сравнения) приведены в табл. 1. Координационная сфера Y(III) в комплексе I, кроме пяти оксимовых атомов O, включает три атома кислорода молекул воды в аксиальных положениях. В отличие от глицингидроксиматного комплекса [16] в независимой области кристаллической ячейки находятся две молекулы комплекса I, имеющие схожее строение. Основное различие между строением независимых молекул комплекса I заключается в координированных атомами меди молекулах воды. Одна из молекул (A) дополнительно координирует четыре молекулы H2O, в то время как вторая (B) – только одну молекулу. Металламакроциклы независимых молекул A и B в значительной степени неплоские. Среднее отклонение от плоскости составляет 0.286 и 0.291 Å (с максимальным отклонением 0.799 и 0.772 Å) в A и B соответственно. Как показано на рис. 1 все PhCH2-заместители расположены с одной стороны плоскости металламакроцикла. Хиральность исходных L-аминогидроксиматных лигандов определяет одностороннюю ориентацию R-заместителя относительно внутреннего фрагмента O–Cu–N–O.
Рис. 1.
Строение комплекса I. Тепловые эллипсоиды показаны с 30%-ной вероятностью. Атомы водорода, ионы Cl– и некоординированные молекулы H2O не показаны.
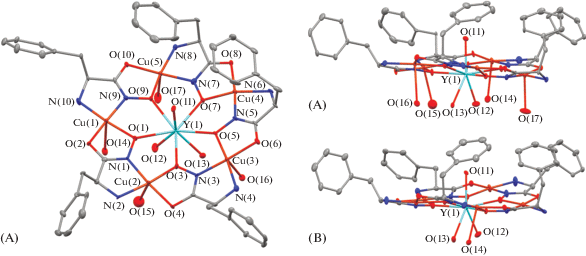
Таблица 1.
Отдельные длины связей (Å) и углы (град) в комплексах I и Y(OAc)(H2O)[15-MCCu(II)Glyha-5](NO3)2 по данным РСА и расчетные геометрические параметры для иона {Y(H2O)3[15-MCCu(II)Phalaha-5]}3+
| Связь | I (РСА) |
{Y(H2O)3[15-
MCCu(II)Phalaha-5]}3+ (DFT) |
Y(OAc)(H2O)[15-MCCu(II)Glyha-5](NO3)2 [16] |
|---|---|---|---|
| d, Å | |||
| Y–Ooxime | 2.365(8)–2.434(8) | 2.375–2.477 | 2.370(2)–2.410(2) |
| Y–Oaq | 2.309(8)–2.422(9) | 2.416–2.551 | 2.369(3) |
| Cu–Ooxime | 1.905(9)–1.946(8) | 1.975–1.984 | 1.936(2)–1.975(3) |
| Cu–Ocarbonyl | 1.895(9)–1.964(8) | 1.944–1.951 | 1.928(3)–1.965(3) |
| Cu–Oaq | 2.393(12)–2.642(11) | 2.298(3)–2.479(3) | |
| Cu–Nimine | 1.859(10)–1.923(8) | 1.906–1.926 | 1.898(3)–1.912(3) |
| Cu–Namine | 1.990(11)–2.017(12) | 2.049–2.053 | 2.008(3)–2.042(3) |
| Угол | ω, град | ||
| OoximeCuNimine | 89.0(4)–91.4(4) | 90.2–92.3 | 88.45(11)–91.40(12) |
| OoximeYOoxime | 70.2(3)–72.8(3) | 72.1–73.6 | 70.59(9)–74.05(9) |
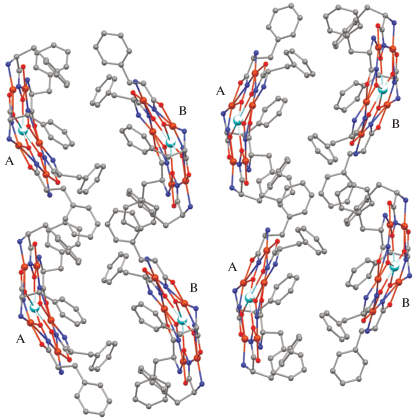
Интересно отметить, что молекулы синтезированного нами ранее аквакомплекса церия с фенилаланингидроксиматными лигандами формируют сэндвич-структуры челюстного типа благодаря мостиковому µ-Cl аниону [36]. В отличие от комплекса Ce(III) молекулы комплекса I не формируют димерных фрагментов. Расстояние между атомами иттрия в ближайших соседних молекулах A и B увеличивается до 9.133 Å по сравнению с 6.925 Å между атомами церия [36], а сами металламакроциклы значительно смещены друг относительно друга (рис. 2).
Рис. 2.
Фрагмент кристаллической упаковки комплекса I. Атомы водорода, ионы Cl– и молекулы H2O не показаны.
Оптимизированная в рамках DFT геометрия иона {Y(H2O)3[15-MCCu(II)Phalaha-5]}3+ хорошо согласуется со структурой комплекса I, полученной с помощью РСА (табл. 1). Расчеты воспроизводят заметное увеличение расстояний Cu–N при переходе от Nimine к Namine. DFT-расчеты частот нормальных колебаний и соответствующих им интенсивностей в ИК-спектре {Y(H2O)3[15-MCCu(II)Phalaha-5]}3+ указывают на присутствие сильных полос валентных колебаний CN в области 1580–1630 cм–1, что хорошо согласуется с экспериментальными значениями частот 1579 и 1598 см–1. Орбитальный анализ (рис. 3) предсказывает энергетическую щель 2.38 эВ между β-НВМО и наиболее высокой по энергии занятой МО, содержащей вклады 3d-орбиталей меди (β-ВЗМО-10). Близкая величина (2.34 эВ) была получена для глицингидроксиматного аналога {Y(H2O)3[15-MCCu(II)Glyha-5]}3+, где она отвечает разности энергий β-НВМО и β‑ВЗМО. Такая энергетическая щель хорошо согласуется с положением полосы d–d-поглощения при 575 нм (2.16 эВ) в электронных спектрах I и {Y(H2O)3[15-MCCu(II)Glyha-5]}3+. Близкие по энергии α- и β-орбитали {Y(H2O)3[15-MCCu(II)Phalaha-5]}3+, расположенные между ВЗМО и ВЗМО-10, локализованы на бензильных заместителях. Введение групп PhCH2– в глицингидроксиматные лиганды приводит к росту энергии занятых и свободных орбиталей металламакроциклического кольца (рис. 3), что свидетельствует о донорном влиянии заместителей. Соответственно, вычисления в рамках QTAIM указывают на увеличение отрицательных и уменьшение положительных зарядов на атомах Cu, Namine и Ocarbonyl при переходе от {Y(H2O)3[15-MCCu(II)Glyha-5]}3+ к {Y(H2O)3[15-MCCu(II)Phalaha-5]}3+ (табл. 2). При этом заряды на атомах Nimine и Ooxime, расположенных ближе к иону Y(III), остаются практически неизменными.
Рис. 3.
Изоповерхности при значении 0.03 и энергии (эВ) МО комплексов {Y(H2O)3[15-MCCu(II)Glyha-5]}3+ и {Y(H2O)3[15-MCCu(II)Phalaha-5]}3+, рассчитанные на уровне B3LYP/DGDZVP.
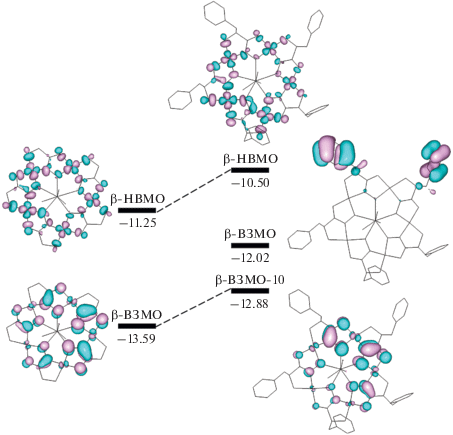
Таблица 2.
Средние значения зарядов на атомах металламакроциклического кольца в ионных Y(III)–Cu(II) 15‑MC-5, расcчитанные в рамках QTAIM
| Атом | {Y(H2O)3[15-MCCu(II)Phalaha-5]}3+ | {Y(H2O)3[15-MCCu(II)Glyha-5]}3+ |
|---|---|---|
| Cu | 1.0148 | 1.0200 |
| Ooxime | –0.7808 | –0.7768 |
| Ocarbonyl | –1.1132 | –1.1046 |
| Nimine | –0.6798 | –0.6790 |
| Namine | –0.9792 | –0.9698 |
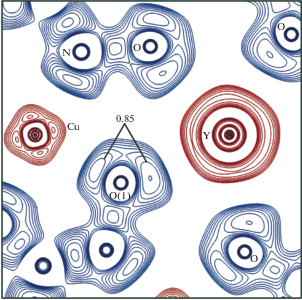
Топология функции локализации электронов (ELF) иона {Y(H2O)3[15-MCCu(II)Phalaha-5]}3+ (рис. 4) выявляет домены, соответствующие неподеленным парам азота и кислорода координационных связей фенилаланингидроксиматного лиганда с катионами Cu2+ и Y3+. Карта ELF в плоскости CuOoximeY показывает увеличение области локализации электронной пары и значения функции для Ooxime в направлении иона Y3+ по сравнению с направлением на Cu2+. Характер распределения ELF в области металламакроцикла при переходе к глицингидроксиматному аналогу не изменяется, что согласуется с незначительным влиянием бензильных фрагментов на распределение зарядов и электронной плотности в области атомов Nimine и Ooxime.
Рис. 4.
Карта функции локализации электронов (ELF), построенная в плоскости атомов Cu, O(1), Y для комплекса {Y(H2O)3[15-MCCu(II)Phalaha-5]}3+, остальные указанные атомы выходят из плоскости не более чем на 0.05 Å. Изолинии от 0.5 а. е. с шагом 0.05 а. е.
Таким образом, полученные результаты показали возможность синтеза хирального водорастворимого аквакомплекса Y(III)–Cu(II) на основе оптически активной L-фенилаланингидроксамовой кислоты. Молекулярное и электронное строение синтезированного комплекса исследовано методами РСА и квантовой химии. Хиральность исходных лигандов определяет одностороннюю ориентацию бензильных заместителей относительно металламакроцикла. Бензильные заместители повышают энергии граничных орбиталей и принимают участие в формировании верхних занятых МО иона {Y(H2O)3[15-MCCu(II)Phalaha-5]}3+. Электронодонорные свойства PhCH2-групп влияют на распределение зарядов атомов внешней части металламакроцикла (Cu, Namine, Ocarbonyl), не затрагивая внутренние Nimine и Ooxime, что подтверждается исследованием топологии ELF. Благодаря хиральному строению, полученное соединение представляет повышенный интерес для дальнейшего изучения его биологической активности.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Silva B., Fernandes C., de Pinho P.G., Remiao F. // J. Anal. Toxicol. 2018. V. 42. P. 17.
Tverdislov V. A. // Biophysics. 2013. V. 58. P. 128.
Liu M., Zhang L., Wang T. // Chem. Rev. 2015. V. 115. P. 7304.
Gupta S.P. // Chem. Rev. 2015. V. 115. P. 6427.
Ford P. // Chem. Sci. 2016. V. 7. P. 2964.
Mezei G., Zaleski C.M., Pecoraro V.L. // Chem. Rev. 2007. V. 107. P. 4933.
Tegoni M., Remelli M. // Coord. Chem. Rev. 2012. V. 256. P. 289.
Bodwin J.J., Cutland A.D., Malkani R.G. et al. // Coord. Chem. Rev. 2001. V. 216–217. P. 489.
Lah M.S., Pecoraro V.L. // J. Am. Chem. Soc. 1989. V. 111. P. 7258.
Ostrowska M., Fritsky I.O., Gumienna-Kontecka E. et al. // Coord. Chem. Rev. 2016. V. 327–328. P. 304.
Pavlishchuk A.V., Kolotilov S.V., Zeller M. et al. // Eur. J. Inorg. Chem. 2018. V. 30. P. 3504.
Alhassanat A., Gamer C., Rauguth A. et al. // Phys. Rev. B. 2018. V. 98. P. 064428.
Wang Y., Wu W.S., Huang M.L. // Chin. Chem. Lett. 2016. V. 27. P. 423.
Katkova M.A. // Russ. J. Coord. Chem. 2018. V. 44. P. 284.
Katkova M.A., Zabrodina G.S., Muravyeva M.S. et al. // Inorg. Chem. Commun. 2015. V. 52. P. 31.
Katkova M.A., Zabrodina G.S., Muravyeva M.S. et al. // Eur. J. Inorg. Chem. 2015. V. 2015. P. 5202.
Zabrodina G.S., Katkova M.A., Samsonov M.A. et al. // Z. Anorg. Allg. Chem. 2018. V. 644. P. 907.
Katkova M.A., Zabrodina G.S., Baranov E.V. et al. // Appl. Organomet. Chem. 2018. V. 32. e4389.
Katkova M.A., Kremlev K.V., Zabrodina G.S. et al. // Eur. J. Inorg. Chem. 2019. V. 2019. P. 1002.
Zaleski C.M., Lim C.S., Cutland-Van Noord A.D. et al. // Inorg. Chem. 2011. V. 50. P. 7707.
Zhigulin G.Yu., Zabrodina G.S., Katkova M.A. et al. // Russ. Chem. Bull. 2018. V. 67. P. 1173.
SAINT. Data Reduction and Correction Program. Version 8.37A. Madison (WI, USA): Bruker AXS, 2012.
Krause L., Herbst-Irmer R., Sheldrick G.M. et al. // J. Appl. Cryst. 2015. V. 48. P. 3.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian 09, Revision B.01. Wallingford (CT, USA): Gaussian, Inc., 2010.
Becke A.D. // J. Chem. Phys. 1993. V. 98. P. 5648.
Lee C., Yang W., Parr R.G. // Phys. Rev. B. 1988. V. 37. P. 785.
Stephens P.J., Devlin F.J., Chabalowski C.F. et al. // J. Phys. Chem. 1994. V. 98. P. 11623.
Godbout N., Salahub D.R., Andzelm J. et al. // Can. J. Chem. 1992. V. 70. P. 560.
Sosa C., Andzelm J., Elkin B.C. et al. // J. Phys. Chem. 1992. V. 96. P. 6630.
Lu T., Chen F. // J. Comp. Chem. 2012. V. 33. P. 580.
Bader R.F.W. Atoms in Molecules: A Quantum Theory. Oxford: Oxford Univ. Press, 1990. 456 p.
Cortes-Guzman F., Bader R.F.W. // Coord. Chem. Rev. 2005. V. 249. P. 633.
Keith T.A. AIMAll. Version 10.05.04. Overland Park: TK Gristmill Software, 2010. URL: http://aim.tkgristmill.com.
Katkova M.A., Zabrodina G.S., Kremlev K.V. et al. // Mendeleev Commun. 2017. V. 27. P. 402.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия