Координационная химия, 2019, T. 45, № 11, стр. 691-694
Спейсерированный комплекс меди(II) на основе бис(2-пиридил-1,2,4-триазол-3-ил)бутана и 1-аминоэтан-1,1-дифосфоновой кислоты
В. Ф. Шульгин 1, *, Н. С. Певзнер 1, М. А. Кискин 2, Е. А. Уголкова 2, В. В. Минин 2
1 Крымский федеральный университет им. В.И. Вернадского
г. Симферополь, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: shulvic@gmail.com
Поступила в редакцию 13.05.2019
После доработки 23.05.2019
Принята к публикации 03.06.2019
Аннотация
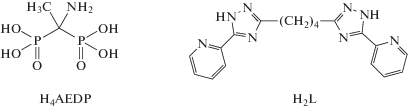
В результате реакции CuSO4 с бис(2-пиридил-1,2,4-триазол-3-ил)бутаном (Н2L) и 1-аминоэтан-1,1-дифосфоновой кислотой (H4AEDP) получен новый комплекс состава [Cu4L2(H2AEDP)2(H2O)4] · 34H2O, структура которого установлена методом РСА (CIF file CCDC № 1913117). Комплекс имеет строение спейсерированного димера, в котором две димерные субъединицы, организованные с участием дианионов дифосфоновой кислоты, связаны между собой за счет двух дважды депротонированных бис(пиридил)триазолов. Мостиковый дифосфонат-анион находится в форме цвиттер-иона, бис(триазолил)бутан координирован через атомы азота пиридильного фрагмента и депротонированного триазольного кольца. Анализ спектра ЭПР поликристаллического образца указывает на слабые обменные взаимодействия в димерных фрагментах.
Известно, что дифосфонатные лиганды способны реализовывать различные способы связывания с катионами металлов, что в сочетании с разнообразием геометрии координационных полиэдров создает предпосылки для синтеза координационных соединений с оригинальными молекулярными и супрамолекулярными структурами [1–5]. Большинство дифосфонатов имеют слоистое кристаллическое строение с различной топологией слоев и расположением органических радикалов в межслоевых пространствах. Введение дополнительных функциональных групп и органических экстралигандов создает дополнительные возможности для управления архитектурой кристаллов и конструирования необычных малоразмерных кластеров [6, 7]. В то же время спейсерированные 2-пиридил-1,2,4-триазолы – удобные матрицы для сборки координационных соединений различной ядерности и топологии [8–10]. Можно предположить, что использование возможностей лигандов двух типов позволит конструировать новые комплексы, в которых полиядерные фрагменты будут связаны дополнительными органическими мостиками.
Цель настоящей работы – изучение взаимодействия сульфата меди(II) с 1-аминоэтан-1,1-дифосфоновой кислотой (H4AEDP) и бис(2-пиридил-1,2,4-триазол-3-ил)бутаном (Н2L).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали бис(2-пиридил-1,2,4-триазол-3-ил)бутан и 1-аминоэтан-1,1-дифосфоновую кислоту, полученных по методикам, описанным в [11, 12], а также дистиллированную воду и CuSO4 · 5H2O (“х. ч.”).
Синтез [Cu4L2(H2AEDP)2(H2O)4] · 34H2O (I). К суспензии, содержащей 0.519 г Н2L в 30 мл воды, добавляли 0.615 г (3 ммоль) H4AEDP и перемешивали при температуре 70–80°С в течение 20 мин до полного растворения реагентов. К полученному раствору добавляли раствор 3 ммоль CuSO4 в 5 мл воды и охлаждали при перемешивании, после медленно по каплям добавляли 6 мл 1 М раствора гидроксида натрия до рН 6–7. Полученный раствор голубого цвета отфильтровывали и выдерживали несколько суток при комнатной температуре. Выделившиеся синие кристаллы отделяли от маточного раствора фильтрованием и высушивали между листами фильтровальной бумаги. Выход составил 0.56 г (38% в расчете на Н2L). По данным элементного и термического анализа, состав комплекса отвечает формуле Cu4L2(H2AEDP)2 · 34H2O (I).
По данным термогравиметрического (ТГ) анализа удаление молекул воды, входящих в состав комплекса I, происходит в два этапа с потерей 31% массы образца и сопровождается минимумами на кривой ДТ при 120 и 160°C. На воздухе кристаллы быстро разрушаются и переходят в кристаллогидрат состава Cu4L2(H2AEDP)2 · 20H2O (II). Дегидратация комплекса II начинается при 120°С и сопровождается минимумами на кривой ДТ при 125 и 180°С.
В ИК-спектрах поглощения комплекса II, наряду с полосами поглощения спейсерированного 2-пиридил-1,2,4-триазола (1615, 1600, 1565, 1508, 1482, 1455, 1403, 1350, 1285 см–1), наблюдаются широкие полосы с максимумами поглощения при 1139, 1093, 1062, 1005 и 923 cм–1, обусловленные валентными колебаниями связей фосфор–кислород [13]. В области 3500–3000 см–1 наблюдается широкая огибающая, включающая полосы валентных колебаний воды и групп $--{\text{NH}}_{{\text{3}}}^{ + },$ деформационные колебания которых наблюдаются в виде слабой полосы с максимумом при 1645 см–1.
РСА монокристаллов I проведен при температуре 100 K на дифрактометре Bruker Smart APEX II, оборудованном CCD-детектором и источником монохроматического излучения (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) с использованием стандартной процедуры [14]. Структура расшифрована прямым методом и уточнена в полноматричном анизотропном приближении для всех неводородных атомов. Расчеты проведены с использованием программы SHELXL2014 [15]. Атомы водорода генерированы геометрически и уточнены в модели жесткого тела. Вследствие разупорядоченности части сольватных молекул воды, рентгеноструктурные данные скорректированы с помощью процедуры Squeeze программы PLATON [16].
Кристаллографические параметры и детали уточнения структур для I: C40H114Cu4N18O46P4, М = 1961.53, размер кристалла 0.15 × 0.05 × 0.05 мм, синие кристаллы, T = 100(2) K, триклинная сингония, пр. гр. P¯1, a = 12.2506(7), b = 13.5754(6), c = 14.9293(7) Å, α = 74.903(2)°, β = 68.189(2)°, γ = = 71.066(2)°, V = 2152.54(19) Å3, Z = 1, ρ = 1.513 г/см3, μ = 1.149 мм–1, θ = 1.98°–26.39°, –15 ≤ h ≤ 15, –16 ≤ ≤ k ≤ 16, –18 ≤ l ≤ 16; всего 20 023 отражений, независимых 8757, отражений с I ≥ 2σ(I) 6429, Rint = = 0.041, Tmin/Tmax = 0.846/0.945, S = 1.04, R1 = = 0.100, wR2 = 0.223 (для всех данных), R1 = 0.075, wR2 = 0.203 (для I ≥ 2σ(I)), Δρmin/Δρmax = = ‒1.040/2.546 е Å–3.
Координаты атомов и другие параметры структуры I депонированы в Кембриджском банке структурных данных (CCDC № 1913117); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
Элементный анализ выполняли на автоматическом анализаторе EURO Vector 3000A. Термогравиграммы изучали на термическом анализаторе Термоскан-2. ИК-спектры записывали на ИК-спектрометре с Фурье-преобразованием Spectrum Two, снабженном приставкой нарушенного полного внутреннего отражения (Perkin Elmer).
Спектры ЭПР регистрировали на спектрометре Spinscan Х (ADANI). Параметры спинового гамильтониана (СГ) находили методом наилучшего приближения между экспериментальным и теоретическим спектром. Теоретический спектр строили способом, описанным в [17]. В качестве функции формы линии использовали сумму функций Лоренца и Гаусса [18]. В ходе минимизации варьировали значения g-фактора, параметры ширины и формы линий, а также параметры тензора тонкого взаимодействия.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
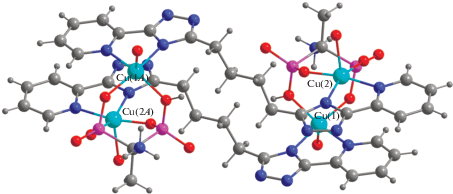
В результате реакции Н2L, H4AEDP и CuSO4 (в соотношении 1 : 2 : 2) в воде при добавлении раствора NaOH до рН 6–7 были выделены кристаллы комплекса состава Cu4L2(H2AEDP)2 · 34H2O (I) (сольватный состав определен на основании данных элементного анализа и данных ТГ анализа). Структура I была установлена методом РСА. Показано, что комплекс кристаллизуется в виде кристаллогидрата с 30 молекулами воды и представляет собой тетраядерную центросимметричную молекулу (рис. 1). В полиядерном комплексе можно выделить два биядерных фрагмента {Cu2(H2AEDP)(H2O)2} (Cu(1)···Cu(2) 3.60(1) Å), связанных между собой парой мостиковых анионов H2AEDP2–, центр инверсии располагается между этим димерами (Cu(1)···Cu(2a) 9.69(1) Å).
Каждый фосфонатный фрагмент аниона H2AEDP2– образует с двумя катионами меди(II) шестичленные хелатные циклы в конформации, приближенной к форме “кресло” (рис. 2). Одна фосфонатная группа связывает катионы меди(II) за счет двух атомов O депротонированных гидроксильных групп. Второй фосфонатный фрагмент депротонирован частично и одна гидроксильная группа связана с катионом меди(II) в протонированном состоянии. Связь медь–протонированный кислород (1.970(4) Å) несколько удлинена по сравнению со связями катионов меди(II) с атомами кислорода депротонированных фосфорильных групп (1.936(4)–1.951(4) Å). Один протон переходит к аминогруппе, в результате чего бифосфонатный лиганд принимает цвиттер-ионное строение и суммарный заряд –2.
Рис. 2.
Димерный фрагмент комплекса I. Длины связей в пределах координационных полиэдров: Cu(1)–O(1) 1.939(4), Cu(1)–O(4) 1.970(4), Cu(1)–N(2) 2.002(5), Cu(1)–N(1) 2.056(5), Cu(1)–O(8) 2.212(5), Cu(2)–O(3) 1.936(4), Cu(2)–O(6) 1.951(4), Cu(2)–N(5) 2.009(5), Cu(2)–N(8) 2.058(5), Cu(2)–O(7) 2.204(4) Å.
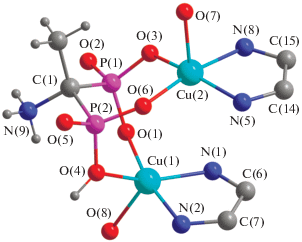
Компенсация остаточного положительного заряда катиона меди происходит за счет отщепления атома водорода от NH-группы триазольного кольца, в результате чего бис-триазольный лиганд выступает в качестве дианиона, координируясь к двум катионам меди(II) двух димеров атомами азота пиридильного фрагмента и триазолат-аниона. При этом связи Cu(II) с триазолатным фрагментом (2.003(5)–2.009(5) Å) несколько короче по сравнению со связями с атомами азота пиридильного фрагмента (2.056(4)–2.059(4) Å). Связи азот–углерод в пределах триазолат-анионов выравнены (1.318(5) и 1.313(5) Å для N(3) и N(4); 1.338(5) и 1.354(5) Å для N(2)), что свидетельствует о делокализации отрицательного заряда в пределах триазольного кольца. Длины связей и валентные углы в пределах лигандов имеют величины, близкие к обычным [19].
Геометрия координационного полиэдра катиона меди отвечает слегка искаженной тетрагональной пирамиде с параметром Эдисона τ ≈ 0.15 [20]. Основание пирамиды образовано двумя атомами кислорода бинуклеирующего дифосфонат-аниона и двумя атомами азота спейсерированного бис(2-пиридил-1,2,4-триазола). Вершина пирамиды занята координированной молекулой воды, атом кислорода которой расположен на расстоянии 2.213(4) или 2.205(4) Å от атома Cu(1) или Сu(2) соответственно. Катион меди(II) выходит из основания пирамиды, его отклонение от среднеквадратичной плоскости N2O2 составляет 0.286 и 0.204 Å для Cu(1) или Сu(2) соответственно.
Гидратные молекулы воды заполняют полости кристаллической решетки и участвуют в образовании сложной системы водородных связей с участием аммонийных и гетероциклических атомов азота (N···O 2.76–3.17Å), а также атомов кислорода фосфорильных групп (O···O 2.66–2.93 Å) и координированных молекул воды (O···O 2.71–2.85 Å).
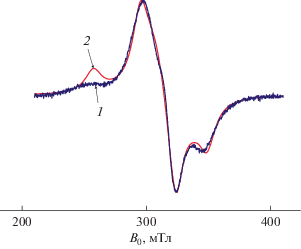
Спектр ЭПР частично дегидратированного комплекса I (соединение II – Cu4L2(H2AEDP)2 · · 20H2O) был записан для твердого образца при 77 и 300 K (рис. 3). Симуляция спектров проведена с помощью спинового гамильтониана (1) с тонкой структурой для спина S = 1.
(1)
$\begin{gathered} \hat {H} = \beta ({{g}_{x}}{{S}_{x}}{{H}_{x}} + {{g}_{y}}{{S}_{y}}{{H}_{y}} + {{g}_{z}}{{H}_{z}}{{S}_{z}}) + \\ + \,\,D\left( {S_{z}^{2} - {{S(S + 1)} \mathord{\left/ {\vphantom {{S(S + 1)} 3}} \right. \kern-0em} 3}} \right) + E\left( {S_{x}^{2} - S_{y}^{2}} \right), \\ \end{gathered} $Несмотря на наличие димерных фрагментов, сигнал запрещенного перехода в области слабого поля [17] не наблюдается, что указывает на реализацию слабых обменных взаимодействий между катионами меди(II).
Таким образом, показано, что использование дианиона 1-аминоэтан-1,1-дифосфоновой кислоты, способствующего формированию полиядерных структур, в присутствии дитопного спейсерированного бис(2-пиридил-1,2,4-триазолил)бутана в реакции с ионами меди(II) приводит к образованию димерных фрагментов, связанных между собой двумя алифатическими спейсерами.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Maeda K. // Microporous Mesoporous Mater. 2004. V. 73. P. 47.
Matczak-Jon E., Videnova-Adrabinska V. // Coord. Chem. Rev. 2005. V. 249. P. 2458.
Fu R., Hu S., Wu. X. // Cryst. Growth Des. 2014. V. 14. P. 6197.
Mao J.-G. // Coord.Chem. Rev. 2007. V. 251. P. 1493.
Bao S.-S., Zheng L.-M. // Coord. Chem. Rev. 2016. V. 316. P. 63.
Pan L., Yuan Y., Xiao Y. et al. // J. Mol. Struct. 2008. V. 892. P. 272.
Bouhsina S., Buglyo P., AbiAad E. et al. // Inorg. Chim. Acta. 2004. V. 357. P. 305.
Klingele M.H., Brooker S. //Coord. Chem. Rev. 2003. V. 241. P. 119.
Гусев А.Н., Шульгин В.Ф., Кискин М.А. // Журн. стуктур. химии. 2019. Т. 60. № 3. С. 353.
Gusev A.N., Shul’gin V.F., Ryush I.O. et al. // Eur. J. Inorg. Chem. 2017. № 3. P. 704.
Gusev A.N., Shul’gin V.F., Meshkova S.B. et al. // Inorg. Chim. Acta. 2012. V. 387. P.321.
Кабак Л.В., Кузьмина Н.Е., Худенко А.В. и др. // Журн. общ. химии. 2006. Т. 76. № 10. С. 1745.
Pan Ling-ling, Yuan Yi-xuan, Xiao Y. et al. // J. Mol. Struct. 2008. V. 892. P. 272.
SMART (control) and SAINT (integration) Sofware. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. № 1. P. 112.
Spek A.L. // Acta Crystallogr. D. 2009. V. 65. № 2. P. 148.
Ракитин Ю.В., Ларин Г.М., Минин В.В. Интерпретация спектров ЭПР координационных соединений. М.: Наука, 1993. 339 с.
Лебедев Я.С., Муромцев В.И. ЭПР и релаксация стабилизированных радикалов. М.: Химия, 1972. С. 25.
Allen F.H., Kennard O., Watson D.G. et al. // Perkin Trans. 2. 1987. V. 12. P. 1.
Addison A.W., Rao T.N. // Dalton Trans. 1984. P. 1349.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия