Координационная химия, 2019, T. 45, № 11, стр. 678-683
Синтез и строение циклометаллированных комплексов Ni(II) и Pd(II) азометиновых соединений
А. С. Бурлов 1, *, С. А. Мащенко 1, В. Г. Власенко 2, М. А. Кискин 3, С. А. Николаевский 3, Е. В. Коршунова 1
1 НИИ физической и органической химии Южного федерального университета
Ростов-на-Дону, Россия
2 НИИ физики Южного федерального университета
Ростов-на-Дону, Россия
3 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: anatoly.burlov@yandex.ru
Поступила в редакцию 03.05.2019
После доработки 22.05.2019
Принята к публикации 03.06.2019
Аннотация
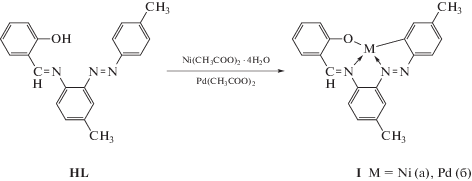
Синтезированы новые комплексы Ni(II) и Pd(II) на основе азометинового соединения 2-[(E)-[4-метил-2-[(Z)-п-толилазо]фенил]иминометил]-фенола (Ia, Iб). Строение и свойства комплексов охарактеризованы методами ИК-, ЯМР 1Н-спектроскопии, РСА (СIF files CCDC № 1899223 (Ia) и 1899224 (Iб)). Установлено, что при комплексообразовании образуются циклометаллированные хелаты. По данным РСА, кристаллы Ni(II) и Pd(II) изоструктурны с квадратной геометрией координационного узла (MCN2O, M = Ni, Pd) и реализацией двух, пяти и одного шестичленного металлоциклов.
Азометиновые лиганды – важные объекты современной химии координационных соединений. Данному классу соединений посвящен ряд монографий и обзоров [1–5]. Металлокомплексы азометиновых лигандов обладают рядом полезных свойств, что позволяет создавать на их основе многофункциональные материалы. К последним следует отнести магнитоактивные [6–8], люминесцирующие [9] комплексы, хемосенсоры [10–12]. Комплексные соединения азометиновых лигандов широко представлены среди биокоординационных систем [13, 14]. Также комплексные соединения азометиновых лигандов обладают хорошей каталитической активностью в различных реакциях при высокой (>100°С) температуре и в присутствии влаги [15, 16].
Важное место в исследованиях молекулярных магнитных материалов и систем, проявляющих термо- и фотоиндуцируемый кроссовер-эффект [17, 18], занимает изучение координационных соединений азометинов, содержащих не участвующий в координации азобензольный фрагмент [19, 20]. Его способность к индуцируемой светом E/Z-изомеризации имеет большое значение для создания координационных соединений со свойствами молекулярных переключателей [21].
В настоящей работе мы получили новые координационные соединения Ni(II) (Iа) и Pd(II) (Iб) с азометиновым соединением – 2-[(E)-[4-метил-2-[(Z)-п-толилазо]фенил]иминометил]фенолом (HL).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали коммерчески доступные (Alfa Aesar) салициловый альдегид и 6-амино-4,4'-диметилазобензол, ацетат палладия, тетрагидрат ацетата никеля (“ч. д. а.”).
Синтез HL. К раствору 3.05 г (2.5 ммоль) салицилового альдегида в 10 мл изопропилового спирта прибавляли 5.63 г (2.5 ммоль) 6-амино-4,4'-диметилазобензола в 40 мл изопропилового спирта и кипятили с обратным холодильником в течение 2 ч. Выпавший по охлаждению осадок от фильтровывали и перекристаллизовывали из смеси хлороформ–метанол (1 : 2) и сушили в вакуум-сушильном шкафу. Выход красных кристаллов 7.68 г (96%). Тпл = 88–89°С.
ИК-спектр (ν, см–1): 1616 (CH=N), 1284 (Ph–O).
Спектр ЯМР 1Н (DMSO-d6; δ, м.д.): 2.40 (с., 6Н, CH3), 6.98–7.83 (м., 11H, CAr–H), 9.05 (с., 1Н, CH=N), 13.92 (c., 1H, OH).
Синтез металлокомплексов Iа, Iб. К суспензии 0.33 г (1 ммоль) HL в 30 мл метанола приливали раствор 0.054 г (1 ммоль) метилата натрия в 5 мл метанола. Смесь кипятили до полного растворения азометина. К полученному раствору прибавляли 0.25 г (1 ммоль) тетрагидрата ацетата никеля в 10 мл метанола или 0.23 г (1 ммоль) ацетата палладия в 10 мл ацетона. Смесь кипятили в течение 2 ч. Выпавшие осадки комплексов отфильтровывали, промывали 2 раза по 5 мл кипящим метанолом, перекристаллизовывали из смеси хлористый метилен–метанол (2 : 1) и сушили в вакуум-сушильном шкафу.
(2-[(Е)-[4-метил-2-[(Z)-п-толилазо]фенил]-иминометил]фенолато)никель(II) (Iа): зеленые кристаллы. Выход 0.38 г (99%). Тпл > 250°С.
| Найдено, %: | С 65.28; | H 4.39; | N 10.91; | Ni 15.87. |
| Для С21Н17N3ONi | ||||
| вычислено, %: | С 65.34; | H 4.44; | N 10.88; | Ni 15.20. |
ИК-спектр (ν, см–1): 1611 (CH=N), 1322 (Ph–O).
Комплекс диамагнитен, практически нерастворим в органических растворителях, вследствие чего не удалось снять спектр ЯМР 1Н.
(2-[(Е)-[4-метил-2-[(Z)-п-толилазо]фенил]иминометил]фенолато)палладий(II) (Iб): коричневые кристаллы. Выход 0.38 г (87%). Тпл > 250°С.
| Найдено %: | С 58.21; | H 4.02; | N 9.72; | Pd 24.53. |
| Для С21Н17N3PdO | ||||
| вычислено, %: | С 58.14; | H 3.95; | N 9.69; | Pd 24.53. |
ИК-спектр (ν, см–1): 1609 (CH=N), 1319 (Ph–O).
Спектр ЯМР 1Н (DMSO-d6; δ, м.д.): 2.36 (с., 6Н, CH3), 6.55–7.93 (м., 10H, CAr–H), 9.01 (с., 1Н, CH=N).
С, H, N элементный анализ выполняли на приборе Carlo Erba Instruments TCM 480. Анализ на металл проводили весовым методом.
ИК-спектры снимали на приборе Varian Еxcalibur-3100 FT–IR в порошках методом нарушенного полного внутреннего отражения (НПВО). Спектры ЯМР 1Н измеряли на приборе Varian Unity-300 (300 МГц) в режиме внутренней стабилизации полярно-резонансной линии 2Н в CDCl3.
РCA монокристаллов комплексов NiL и PdL выполнен на дифрактометре Bruker Apex II (CCD-детектор, MoKα, λ = 0.71073 Å, графитовый монохроматор) [22]. Введена полуэмпирическая поправка на поглощение [23]. Структуры расшифрованы прямыми методами и уточнены в полноматричном анизотропном приближении для всех неводородных атомов. Атомы водорода при атомах углерода органических лигандов генерированы геометрически и уточнены в модели “наездника”. Расчеты проведены по комплексу программ SHELX-2014/7 [24]. Кристаллографические параметры NiL и PdL приведены в табл. 1.
Таблица 1.
Кристаллографические параметры и детали уточнения структур Ia и Iб
| Параметр | Значение | |
|---|---|---|
| Ia | Iб | |
| М | 386.09 | 433.78 |
| Т, K | 173(2) | 120(2) |
| Сингония | Моноклинная | |
| Пр. гр. | P21/n | |
| a, Å | 11.9303(14) | 11.6714(11) |
| b, Å | 7.3913(9) | 7.5075(7) |
| c, Å | 18.661(2) | 19.288(2) |
| β, град | 90.388(2) | 90.347(1) |
| V, Å3 | 1645.5(3) | 1690.1(3) |
| Z | 4 | |
| ρ(выч.), г см3 | 1.558 | 1.705 |
| μ, мм–1 | 1.19 | 1.11 |
| θmax, град | 26.96 | 29.18 |
| Tmin/Tmax | 0.465/0.746 | 0.632/0.746 |
| Число измеренных рефлексов | 7736 | 11 122 |
| Число независимых рефлексов | 3484 | 4510 |
| Число рефлексов с I > 2σ(I) | 2491 | 3614 |
| Rint | 0.055 | 0.036 |
| Число уточняемых параметров | 235 | 235 |
| GOOF | 0.96 | 0.98 |
| R1 (I > 2σ(I)) | 0.050 | 0.033 |
| wR2 (I > 2σ(I)) | 0.116 | 0.081 |
Полный набор рентгеноструктурных данных депонирован в Кембриджском банке структурных данных (№ 1899223 (Ia) и 1899224 (Iб); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Строение азо-азометина HL установлено методами элементного анализа, ИК- и ЯМР 1Н-спектроскопии. В ИК-спектре HL наблюдаются полосы поглощения при 1616 см–1 ν(CH=N) и 1284 см–1 ν(Ph–O). В спектре ЯМР 1Н соединения найдены сигналы всех протонов в соответствии с брутто-формулой. Сигналы протонов CH=N регистрируются при 9.05 м.д. и сигналы протонов ОН-групп – при 13.92 м.д.
Ранее мы получили комплексы металлов азометиновых соединений, производных 2-гидрокси- и 2-тозиламинобензальдегидов, 1-фенил-3-метил-4-формил-5-пиразолона (тиона), содержащих азогруппу в орто-положении аминного фрагмента состава ML2, в которых азогруппа аминного фрагмента в зависимости от природы лиганда и металла участвует или не участвует в координации к иону металла [25–32].
Полученные на основе HL комплексы металлов Iа, Iб, согласно данным элементного анализа, в отличие от описанных ранее, имеют состав ML. В ИК-спектрах комплексов Iа, Iб полосы поглощения валентных колебаний 1619 см–1 ν(CH=N) лиганда при комплексообразовании смещаются на 8–10 см–1 в длинноволновую область, а полосы валентных колебаний ν(Ph–O) лигандов при 1284 см–1 смещаются на 35–38 см–1 в коротковолновую область. Такие ИК-спектральные изменения характерны при комплексообразовании хелатных структур [33]. Комплексы Iа, Iб диамагнитны.
В литературе описаны комплексы металлов азометиновых лигандов, в которых реализуются циклометаллированные структуры состава ML [34–40]. Выполненный РСА полученных комплексов Iа, Iб также свидетельствует об образовании циклометаллированных комплексов никеля и палладия.
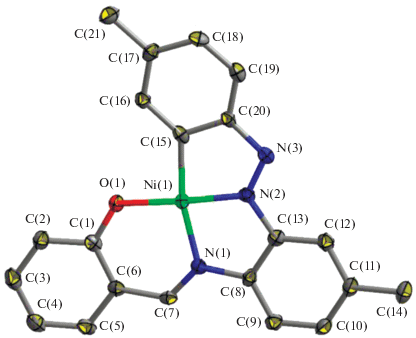
Кристаллы комплексов Ia и Iб изоструктурны. В обоих соединениях дианион L2– координирован к атомам металлов и их окружение (MCN2O, M = Ni, Pd) соответствует искаженной квадратной геометрии (рис. 1). Молекулы Ia и Iб плоские, отклонение атомов от среднеквадратичной плоскости составляет 0.067 и 0.085 Å соответственно.
Основные длины связей и углы в молекулах Ia и Iб приведены в табл. 2 (нумерация атомов N, C и O в обеих структурах совпадает).
Таблица 2.
Основные значения длин связей и валентных углов в комплексах Ia и Iб
| Длина связи, Å | Ia | Iб | Угол, град | Ia | Iб |
|---|---|---|---|---|---|
| M–N(1) | 1.899(3) | 2.030(2) | O(1)M(1)N(1) | 97.59(11) | 95.59(9) |
| M–N(2) | 1.806(3) | 1.920(2) | O(1)M(1)N(2) | 176.65(12) | 179.28(9) |
| M–O(1) | 1.820(2) | 1.993(2) | O(1)M(1)C(15) | 94.75(12) | 100.72(10) |
| M–C(15) | 1.877(3) | 1.983(3) | N(1)M(1)N(2) | 85.76(12) | 83.93(10) |
| O(1)–C(1) | 1.314(4) | 1.308(3) | C(15)M(1)N(1) | 167.39(12) | 163.65(10) |
| N(2)–N(3) | 1.278(4) | 1.273(3) | C(15)M(1)N(2) | 81.90(13) | 79.76(10) |
| N(1)–C(7) | 1.294(4) | 1.295(4) | M(1)(C15)C(16) | 132.4(2) | 133.2(2) |
| N(1)–C(8) | 1.422(4) | 1.425(3) | M(1)(C15)C(20) | 110.4(3) | 109.4(2) |
| N(2)–C(13) | 1.413(4) | 1.418(4) | M(1)O(1)C(1) | 124.6(2) | 122.0(2) |
| N(3)–C(20) | 1.399(4) | 1.407(3) | M(1)N(1)C(7) | 125.0(2) | 123.9(2) |
| C(1)–C(6) | 1.422(5) | 1.440(4) | M(1)N(1)C(8) | 111.6(2) | 110.3(2) |
| C(8)–C(13) | 1.397(5) | 1.417(4) | M(1)N(2)C(13) | 115.9(2) | 114.7(2) |
| C(15)–C(20) | 1.415(4) | 1.425(4) | M(1)N(2)N(3) | 123.7(2) | 123.2(2) |
| N(3)N(2)C(13) | 120.5(3) | 122.1(2) | |||
| N(2)N(3)C(20) | 108.0(3) | 109.2(2) |
В комплексе Ia длины связей Ni–N(азо) 1.806 Å и Ni–N(имин) 1.899 Е различаются в результате более сильного транс-влияния арильного углерода, чем фенольного кислорода [34]. Длина связи Ni–C (1.877 Å) сравнима с аналогичной для орто-металлированных комплексов Ni(II) с азобензолом [35]. Длина связи Ni–O (1.820 Å) близка к длинам связей Ni–O в квадратных комплексах никеля(II) с N,N'-бис(салицилиден)этилендиамином [36, 37].
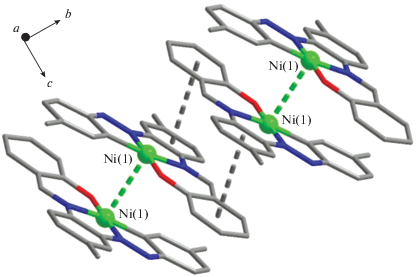
Анализ упаковки молекул комплекса в кристалле выявил образование димеров {Ni2} из соседних молекул, в которых расстояние Ni···Ni составляет 3.182 Å. Димеры {Ni2} также взаимодействуют с соседними димерами за счет π–π-стекинг-взаимодействий между фенильными фрагментами С(1)–С(6) и C(8)–C(13), расстояние между центроидами ароматических колец составляет 3.632 Å (рис. 2). В результате таких межмолекулярных взаимодействий формируется супрамолекулярная цепочка (рис. 2), в которой межатомное расстояние Ni···Ni между двумя димерами {Ni2} составляет 4.876 Å.
Рис. 2.
Фрагмент упаковки молекул комплекса Ia в кристалле вдоль оси b. Атомы водорода не показаны, пунктирами показаны контакты между атомами Ni и между центроидами ароматических фрагментов C6 соседних молекул.
В комплексе Iб длины связей Pd–N(азо) 2.030 Å и Pd–N(имин) 1.920 Å, как и в Iа, различаются в результате более сильного транс-влияния арильного углерода, чем фенольного кислорода [38]. Длины связей Pd–C 1.983 Å и Pd–O 1.993 Å сравнимы со значениями аналогичных длин связей для известных комплексов Pd(II) [38–40]. Анализ упаковки молекул комплекса в кристалле выявил образование димеров {Pd2} из соседних молекул, в которых расстояние Pd···Pd составляет 3.274 Å. Димеры {Pd2} взаимодействуют с соседними димерами за счет π–π-стекинг-взаимодействий между фенильными фрагментами С(1)–С(6) и C(8)–C(13), расстояние между центроидами ароматических колец составляет 3.646 Å. В сформированной супрамолекулярной цепочке межатомное расстояние Pd···Pd между двумя димерами {Pd2} составляет 5.057 Å.
Таким образом, на основе азометинового соединения 2-[(E)-[4-метил-2-[(Z)-п-толилазо]фенил]иминометил]фенола получены новые комплексы Ni(II) и Pd(II). Показано, что при комплексообразовании образуются изоструктурные циклометаллированные хелаты с квадратной геометрией координационного узла и участием в координации к металлу атомов азота азометиновой и азо-группы с реализацией двух пятичленных и шестичленного металлоциклов.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Nejati K., Rezvani Z., Massoumi B. // Dyes Pigments. 2007. V. 75. № 3. P. 653.
Vigato P.A., Tamburini S., Bertelo L. // Coord. Chem. Rev. 2007. V. 251. № 11–12. P. 1311.
Vigato P.A., Tamburini S. // Coord. Chem. Rev. 2004. V. 248. № 17–20. P. 1717.
Коган В.А., Щербаков И.Н. // Рос. хим. журн. 2004. Т. 48. № 1. С. 69.
Гарновский А.Д., Васильченко И.С. // Успехи химии. 2005. Т. 74. № 3. С. 211 (Garnovskii A.D., Vasil’chenko I.S. // Russ. Chem. Rev. 2005. V. 74. № 3. Р. 193.).https://doi.org/10.1070/RC2005v074n03ABEH001164
Garnovskii A.D., Vasilchenko I.S., Garnovskii D.A., Kharisov I.S. // J. Coord. Chem. 2009. V. 62. № 2. P. 151.
Gatteschi D., Sessoli R., Cornia A. // Comprehensive Coordination Chemistry II / Ed. Lever A.B.P. Amsterdam–Oxford–New York: Elsevier-Pergamon Press, 2003. V. 2. P. 393.
Tompson K.L. // Coord. Chem. Rev. 2005. V. 249. № 23. P. 2549.
Organic Light-Emmiting Devices / Eds. Mueller K., Schert U. Weinheim–New York: Wiley-VCH., 2006. P. 94.
Burdette S.C., Lippard S.J. // Coord. Chem. Rev. 2001. V. 216–217. P. 333.
Брень В.А. // Успехи химии. 2001. Т. 70. № 12. С. 1152 (Bren V.A. // Russ. Chem. Rev. 2001. V. 70. Р. 1017.).https://doi.org/10.1070/RC2001v070n12ABEH000667
Ушаков Е.Н., Алфимов М.В., Громов С.П. // Успехи химии. 2008. Т. 77. № 1. С. 39 (Ushakov E.N., Alfimov M.V., Gromov S.P. // Russ. Chem. Rev. 2008. V. 77. P. 39.).https://doi.org/10.1070/RC2008v077n01ABEH003757
Halcrow M.A. // Comprehensive Coordination Chemistry II / Eds. Que L., Tolman W.B., New York: Elsevier-Pergamon Press, 2003. V. 8. P. 395.
Бионеорганическая химия // Рос. хим. журн. 2004. Т. 48. № 4. 176 с.
Garnovskii A.D., Vasilchenko I.S., Garnovskii D.A., Kharisov I.S. // J. Coord. Chem. 2009. V. 62. № 2. P. 151.
Naeimi H., Safari J., Heidarnezhad A. // Dyes Pigments. 2007. V. 73. № 2. P. 251.
Spin Crossover in Transition Metal Compounds / Eds. Gütlich P., Goodwin H.A. Topics in Current Chemistry. Berlin: Springer-Verlag, 2004. V. 233−235.
Sato O., Tao J., Zhang Y.-Z. // Angew. Chem. Int. Ed. 2007. V. 46. P. 2152.
Nihei M., Shiga T., Maeda Y., Oshio H. // Chem. Rev. 2007. V. 251. P. 2606.
Weber B. // Coord. Chem. Rev. 2009. V. 253. P. 2432.
Gütlich P., Garcia Y., Woike T. // Coord. Chem. Rev. 2001. V. 219–221. P. 839.
SMART (control) and SAINT (integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
Sheldrick G.M. SADABS. Program for Scanning and Correction of Area Detector Data. Göttinngen (Germany): Univ. of Göttingen, 2004.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Бурлов А.С., Николаевский С.А., Богомяков А.С. и др. // Коорд. химия. 2009. Т. 35. № 7. С. 495 (Burlov A.S., Nikolaevskii S.A., Vasil’chenko I.S. et al. // Russ. J. Coord. Chem. 2009. V. 35. № 7. P. 486).https://doi.org/10.1134/S1070328409070045
Гарновский А.Д., Бурлов А.С., Стариков А.Г. и др.// Коорд. химия. 2010. Т. 36. № 7. С. 483 (Garnovskii A.D., Burlov A.S., Metelitsa A.V. et al. // Russ. J. Coord. Chem. 2010. V. 36. № 7. P. 479.).https://doi.org/10.1134/S1070328410070018
Бурлов А.С., Мащенко С.А., Анцышкина А.С. и др. // Коорд. химия. 2013. Т. 39. № 12. С. 707 (Burlov A.S., Mashchenko S.A., Nikolaevskii S.A. et al. // Russ. J. Coord. Chem. 2013. V. 39. № 12. P. 813.).https://doi.org/10.7868/S0132344X13120013
Burlov A.S., Mashchenko S.A., Vlasenko V.G. et al. // J. Mol. Struct. 2014. V. 1061. P. 47.
Бурлов А.С., Мащенко С.А., Власенко В.Г. и др. // Журн. общ. химии. 2015. Т. 85. № 10. С. 1708 (Burlov A.S., Mashchenko S.A., Vlasenko V.G. et al. // Russ. J. Gen. Chem. 2015. V. 85. № 10. P. 2338.).https://doi.org/10.1134/S1070363215100199
Бурлов А.С., Мащенко С.А., Власенко В.Г. и др. // Коорд. химия. 2015. Т. 41. № 6. С. 346 (Burlov A.S., Mashchenko S.A., Vlasenko V.G. et al. // Russ. J. Coord. Chem. 2015. V. 41. № 6. P. 376.).https://doi.org/10.1134/S1070328415060019
Бурлов А.С., Власенко В.Г., Левченков С.И. и др. // Коорд. химия. 2017. Т. 43. № 11. С. 684 (Burlov A.S., Vlasenko V.G, Levchenkov S.I. // Russ. J. Coord. Chem. 2017. V. 43. № 11. P. 753.).https://doi.org/10.1134/S1070328417110021
Бурлов А.С., Мащенко С.А., Власенко В.Г. и др. // Журн. общ. химии. 2018. Т. 88. № 2. С. 285 (Burlov A.S., Mashchenko S.A., Vlasenko V.G. et al. // Russ. J. Gen. Chem. 2018. V. 88. № 2. P. 262.).https://doi.org/10.1134/S1070363218020123
Алексанян Д.В., Козлов В.А., Одинец И.Л. и др. // Изв. АН. Сер. хим. 2007. № 9. С. 1827 (Aleksanyan D.V., Kozlov V.A., Odinets I.L. et al. // Russ. Chem. Bull. 2007. V. 56. № 9. P. 1891.).https://doi.org/10.1007/s11172-007-0291-x
Pattanayak P., Pratihar J.L., Patra D. et al. // Eur. J. Inorg. Chem. 2007. P. 4263.
Chien T.C., Dias L.G., Arantes G.M. et al. // J. Photochem. Photobiol. A. 2008. V. 194. P. 37.
Kawamoto T., KushiBull Y. // Chem. Soc. Jpn. 2004. V. 77. P. 289.
Giaser T., Heidemeier M., Lügger T. // Dalton Trans. 2003. P. 2381.
Pattanayak P., Pratihar J.L., Patra D. et al. // Polyhedron. 2008. V. 27. P. 2209.
Neogi D.N., Biswas A.N., Das P. // Inorg. Chim. Acta. 2007. V. 360. P. 2181.
Chattopadhyay S., Sinha C., Basu P. // Organometallics. 1991. V. 10. P. 1135.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия