Координационная химия, 2019, T. 45, № 11, стр. 695-699
Синтез и строение комплексов лантанидов на основе 1,3-диметилимидазолий-4-карбоксилата
С. С. Шаповалов 1, *, О. Г. Тихонова 1, М. О. Григорьева 1, И. В. Скабицкий 1, Н. П. Симоненко 1
1 Институт общей и неорганический химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: schss@yandex.ru
Поступила в редакцию 05.05.2019
После доработки 31.05.2019
Принята к публикации 03.06.2019
Аннотация
При взаимодействии цвиттериона норзооанемонина – 1,3-диметилимидазолий-4-карбоксилата (L) – с хлоридами празеодима(III), самария(III) и европия(III) образуются два типа кристаллов: изоструктурные биядерные комплексы [Ln2(μ-C6H8N2O2)4(HOCH3)4(H2O)4]Cl6 (Ln = Pr(III) (I), Eu(III) (II)) и димерный комплекс самария [Sm2(μ-C6H8N2O2)4(C6H8N2O2)2(H2O)5(OCH3)]Cl5 (III), которые охарактеризаваны методами РСА и ИК-спектроскопии. В комплексах I–III (CIF files CCDC № 1912829 (I), 1912830 (II), 1912831 (III)) атомы металла связаны четырьмя мостиковыми молекулами L без образования связи металл–металл (расстояния M···M составляют 4.595 Å в I, 4.4637 Å в II, 4.584 Å в III).
Комплексы лантанидов, содержащие в качестве лиганда цвиттерион, широко описаны в литературе. В частности, известно большое количество комплексов глицина, бетаина и других аминокислот – мономерные Nd2(Gly)6(ClO4) · 9H2O [1] [Ln(Bet)2(NO3)3(H2O)2], где Ln = La и Sm [2], и [Eu(L-proline)3(H2O)3](ClO4)3 [3], димерные со структурой китайского фонарика [Tb2(L-alanine)4(H2O)8](ClO4)6 [4], [Ln2(Bet)8(H2O)4](ClO4)6, где Ln = Eu и Tb, [Eu2(Bet)4(H2O)8]Cl6 · 6H2O [5], [Sm2(C6H13NO2)4(H2O)8](ClO4)6 [6], четырехядрные гетерометаллические комплексы Cu(II)–Ln(III) с мостиковыми карбоксилатами [Cu2Ln2(Bet)10 (H2O)8]- (ClO4)10 · H2O (Ln = La, Ce, Gd ) и [Cu2Ln2(Bet)12-(ClO4)2](ClO4)8, где Ln = Gd, Sm [7]. Были получены также димерные комплексы cамария(III) с короткими петитами [Sm2(Gly-Val)4(H2O)8](ClO4)6 [8]. Известны координационные полимеры лантанидов с цвиттерионными лигандами {[Ln(N-(4-карбоксибензил)-(3,5-дикарбоксил)Рy) · 3H2O]Cl · · xH2O}, где Ln = Tb, Eu, Dy) [9] и {[Eu(1,3-бис(пиридинио-4-карбоксилато)-пропан)(NO3)(H2O)3] · · 3.5H2O} [10]. Координационные соединения 135Sm были успешно использовали в качестве радиотерапевтических средств, что способствовало развитию химии координационных соединений этого элемента [11]. Комплексообразование Sm(III) с пептидами (диглицин, триглицин, аланилглицин, пролилглицин и др.) проиллюстрировано на примере образования димерного комплекса с глицилвалином (Gly-Val) [Sm2(Gly-Val)4(H2O)8](ClO4)6 [12], в котором четыре молекулы координированных пептидов находятся в форме внутренней соли и выступают в роли нейтрального мостикового лиганда, а остальные координационные места заняты молекулами воды. Расстояние Sm···Sm составляет 4.04(1) Å. В случае хлоридного комплекса неодима(III) с диглицином атомы металла вместо одной молекулы воды координируют по одному атому галогена с образованием биядерного тетракатиона [Nd2(HGl)4(H2O)6Cl2]4+ [13]. Комплексы лантанидов с амидоксимсодержащими лигандами можно использовать в высокоселективных сорбционных агентах для поглощения уранила [14]. Комплексы Eu(III) получили значительное внимание в связи с несколькими факторами: биологически приемлемые длины волн излучения в видимой области; длительные люминесцентные времена жизни в миллисекундном диапазоне и более высокие интенсивности излучения по сравнению с комплексами Sm(III) и Dy(III) [15, 16].
В настоящей работе изучено взаимодействие бетаина норзооанемонина – 1,3-диметилимидазолий-4-карбоксилата (L) – с хлоридами празеодима(III), самария(III) и европия(III).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Химические реактивы и растворители получали из коммерческого источника и использовали без дальнейшей очистки. Лиганд L получали по по методике [17]. Для химического анализа использовали CHNS-анализатор ЕА3000 фирмы EuroVector. ИК-спектры снимали на ИК-Фурье-спектрометре Bruker Alpha с приставкой Platinum ATR для получения спектров нарушенного полного внутреннего отражения (НПВО).
Синтез [Pr2(μ-C6H8N2O2)4(HOCH3)4(H2O)4]Cl6 · · 4HOCH3 (I). К бледно-зеленому раствору 0.177 г (0.47 ммоль) PrCl3 · 7H2O в 2 мл MeOH добавляли раствор 0.200 г (1.43 ммоль) L в 2 мл MeOH. При медленной конденсации паров Et2O в полученный зеленый раствор образовались светло-зеленые кристаллы. Выход 0.116 г (35%).
| Найдено, %: | C 28.07, | H 4.83, | N 7.98. |
| Для C32H72N8O20Cl6Pr2 (М = 1384) сольват с 4CH3OH | |||
| вычислено, %: | C 27.78, | H 5.25, | N 8.10. |
ИК-спектр (ν, cм–1): 3306 ср.ш, 3077 ср.ш, 1668 ср, 1555 ср, 1467 ср, 1447 ср, 1420 с.ш, 1390 ср, 1331 о.с, 1244 сл, 1155 ср, 1089 сл, 1026 сл, 880 сл, 827 сл, 783 ср, 737 сл, 616 с, 557 с.ш, 432 о.с.
Синтез [Sm2(μ-C6H8N2O2)4(C6H8N2O2)2(H2O)5-(OCH3)]Cl5 (II). К бесцветному раствору 0.176 г (0.47 ммоль) SmCl3 · 6H2O в MeOH (2 мл) при перемешивании добавляли раствор 0.200 г (1.43 ммоль) L в MeOH (2 мл). При медленной конденсации паров Et2O в полученный бесцветный раствор образовались светло-желтые кристаллы. Выход 0.18 г (36%).
| Найдено, %: | C 30.84; | H 4.13; | N 11.53. |
| Для C37H61N12O18Cl5Sm2 (М = 1440) | |||
| вычислено, %: | C 30.86; | H 4.26; | N 11.67. |
ИК-спектр (ν, cм–1): 3294 сp.ш, 3076 сp.ш, 1676 ср, 1608 ср.ш, 1555 ср, 1447 ср, 1420 с.ш, 1389 ср, 1332 с, 1245 сл, 1155 ср, 1088 сл, 1025 сл, 882 сл, 827 сл, 784 ср, 738 ср, 613 с, 558 с.ш, 433 о.с, 407 с.
Синтез [Eu2(μ-C6H8N2O2)4(HOCH3)4(H2O)4]Cl6 · · 4HOCH3 (III). К розовому раствору 0.175 г (0.47 ммоль) EuCl3 · 6H2O в 2 мл MeOH добавляли раствор 0.200 г (0.143 ммоль) L в 2 мл MeOH и перемешивали в течение 30 мин. При медленной конденсации паров Et2O в полученный розовый раствор образовались бледно-желтые кристаллы. Выход 0.16 г (52%).
| Найдено, %: | C 27.55, | H 4.72, | N 7.63. |
| Для C32H72N8O20Cl6Eu2 (М = 1406) сольват с 4CH3OH | |||
| вычислено, %: | C 27.34, | H 5.16, | N 7.97. |
ИК-спектр (ν, cм–1): 3296 сp.ш, 3076 сp.ш, 2958 ср, 2828 сл, 1667 ср, 1558 ср, 1450 ср, 1425 ср, 1336 ср, 1247 сл, 1158 ср, 1093 сл, 1021 сл, 880 сл, 829 сл, 780 ср, 737. ср, 620 с, 568 с.ш, 422 о.с.
РСА выполнен на дифрактометре Bruker APEX II CCD. Поглощение учтено методом множественного измерения эквивалентных отражений по программе SADABS [18]. Структуры I–III определены с помощью программы SHELXT [19] и уточнены методом наименьших квадратов относительно F 2 в анизотропном приближении неводородных атомов с использованием пакетов программ SHELX-2014 [19] и OLEX2 [20]. Положения атомов водорода в координированных молекулах воды уточнены с ограничением расстояний O–H 0.82 Å и изотропных тепловых параметров 1.5Uизо(O). Положения остальных атомов Н рассчитаны геометрически. Кристаллографические данные и параметры уточнения структуры I–III приведены в табл. 1, основные длины связей и валентные углы – в подписях к рис. 1, 2. Структурный вклад разупорядоченых молекул сольватного растворителя в кристалле I л удален с помощью процедуры SQUEEZE, реализованной в программе PLATON [21]. Координаты разупорядоченных атомов лиганда в комплексе II уточнены с использованием ограничений для расстояний и тепловых параметров (инструкции SAME и DELU).
Таблица 1.
Кристаллографические данные и параметры уточнения структуры комплексов I–III
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III | |
| M | 1407.44 | 1439.92 | 1405.6 |
| Излучение (λ, Å) | MoKα (λ = 0.71073) | ||
| Температура, K | 150(2) | 150(2) | 150(2) |
| Сингония | Моноклинная | Триклинная | Моноклинная |
| Пр. гр. | P21/n | P1 | P21/n |
| а, Å | 11.4701(3) | 10.7250(2) | 11.3451(2) |
| b, Å | 14.3642(4) | 12.8478(2) | 14.2460(3) |
| c, Å | 17.2225(4) | 14.2666(2) | 17.0971(3) |
| α, град | 90 | 114.611(1) | 90 |
| β, град | 97.441(1) | 91.946(1) | 97.631(1) |
| γ, град | 90 | 111.207(1) | 90 |
| V, Å3 | 2813.66(13) | 1626.21(5) | 2738.80(9) |
| Z | 2 | 1 | 2 |
| ρ(выч.), г/cм–3 | 1.661 | 1.470 | 1.704 |
| μ, мм–1 | 2.066 | 2.058 | 2.635 |
| F(000) | 1408.0 | 720.0 | 1416.0 |
| Область θ, град сканирования, град | 4.038–65.59 | 4.682–65.684 | 4.606–65.538 |
| Тип сканирования | ω | ||
| Независимых отражений (N1) | 8948 (Rint = 0.0381) | 9707 (Rint = 0.0316) | 8484 (Rint = 0.0425) |
| Отражений с I >2σ(I) (N2) | 7992 | 8816 | 7439 |
| Число уточняемых параметров | 326 | 476 | 340 |
| GOОF (F2) | 1.163 | 1.067 | 1.104 |
| R1 для N2 | 0.0311 | 0.0281 | 0.0377 |
| wR2 для N1 | 0.0677 | 0.0627 | 0.0794 |
| Δρmax/Δρmin, e Å–3 | 0.89/–0.97 | 0.84/–0.72 | 1.50/–1.49 |
Рис. 1.
Молекулярная структура катионов I и III (изоструктурны). Атомы водорода опущены для ясности. Некоторые длины связей и валентные углы (I): Pr(1)–O(1) 2.3961(16), Pr(1)–O(2) 2.4369(16), Pr(1)–O(3) 2.4080(15), Pr(1)–O(4) 2.4295(16), Pr(1)–O(5) 2.5102(16), Pr(1)–O(6) 2.5185(17), Pr(1)–O(7) 2.5284(18), Pr(1)–O(8) 2.5169(17) Å и O(1)Pr(1)O(2) 119.20(6)°, O(1)Pr(1)O(3) 75.56(6)°, O(1)Pr(1)O(4) 75.08(6)°, O(1)Pr(1)O(5) 76.09(6)°, O(1)Pr(1)O(6) 77.55(6)°, O(1)Pr(1)O(7) 143.88(6)°, O(1)Pr(1)O(8) 142.31(6)°, O(2)Pr(1)O(5) 146.98(5)°, O(2)Pr(1)O(6) 139.89(6)°; (III): Eu(1)–O(4) 2.313(3), Eu(1)–O(5) 2.393(3), Eu(1)–O(2) 2.319(2), Eu(1)–O(1) 2.280(3), Eu(1)–O(3) 2.298(2), Eu(1)–O(8) 2.394(3), Eu(1)–O(6) 2.404(3), Eu(1)–O(7) 2.393(3) Å, O(4)Eu(1)Eu(1) 63.69(6)°, O(4)Eu(1)O(5) 139.19(9)°, O(4)Eu(1)O(2) 73.96(9)°, O(4)Eu(1)O(8) 141.49(9)°, O(4)Eu(1)O(6) 76.98(10)°, O(4)Eu(1)O(7) 78.58(10)°, O(4)Eu(1)C(7) 69.58(9)°.
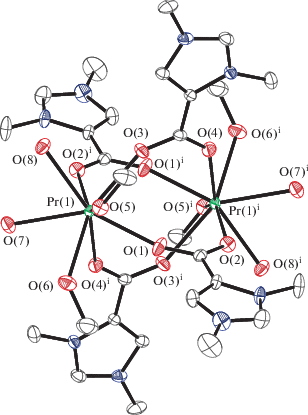
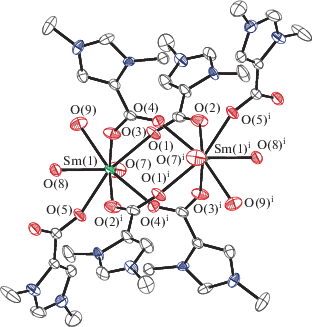
Рис. 2.
Молекулярная структура II. Атомы водорода опущены для ясности. Некоторые длины связей и валентные углы: Sm(1)–O(1) 2.3854(16), Sm(1)–O(2) 2.4201(17), Sm(1)–O(3) 2.3599(16), Sm(1)–O(4) 2.3858(17), Sm(1)–O(5) 2.3912(15), Sm(1)–O(7) 2.4665(19), Sm(1)–O(8) 2.4465(17), Sm(1)–O(9) 2.4544(18) Å и O(1)Sm(1)O(2) 120.15(7)°, O(1)Sm(1)O(4) 77.83(6)°, O(1)Sm(1)O(5) 142.85(6)°, O(1)Sm(1)O(7) 74.30(7)°, O(1)Sm(1)O(8) 140.17(6)°, O(1)Sm(1)O(9) 80.35(7)°, O(2)Sm(1)O(7) 139.59(7)°, O(2)Sm(1)O(8) 73.08(7)°, O(2)Sm(1)O(9) 144.61(7)°.
Координаты атомов и другие параметры структур депонированы в Кембриджском банке структурных данных (CCDC № 1912829 (I), 1912830 (II), 1912831 (III); http://www.ccdc.cam.ac.uk/ data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При взаимодействии цвитериона L с хлоридом празеодима(III) в метаноле образуется биядерный комплекс I, в котором, по данным РСА (рис. 1), четыре несимметричных молекулы бетаина L выступают мостиковыми лигандами между двумя атомами лантанидов, образуя центр инверсии в молекуле I. Расстояние Pr....Pr 4.595 Å свидетельствует об отсутствии связи металл–металл. В димерных карбоксилатах празеодима это значение обычно меньше из-за наличия троесвязанных карбоксилатных анионов: 3.975 Å в пропионатном комплексе Pr2(μ-EtCOO)4(Phen)2(NO3)2 (Phen = = фенантралин) [22], 4.023 Å в цимантренкарбоксилатном комплексе Pr2(μ-OOСCym)4(Glyme)2-(NO3)2 (Glyme = CH3OCH2CH2OCH3) [23]. В бетаиновом комплексе неодима [Nd2(Gly)6](ClO4)6 · · 9H2O [1] две молекулы глицина – монодентантые лиганды, две связаны с атомами металла как μ2-мостиковые заместители и две образуют три связи Nd–O. Координационный полиэдр атома металла – квадратная антипризма. Длины связей Pr–O c координированным L находятся в пределах 2.3961(16)–2.5185(17) Å, Pr–O(H2O) 2.5284(18) и 2.5169(17), Pr–O(HOCH3) 2.5102(16) и 2.5185(17) Å. В ИК-спектре I частота ассиметрического колебания координированной карбоксильной группы (1668 см–1) смещается относительно исходного бетаина (1610 см–1) в высокочастотную область.
При взаимодействии L с хлоридом самария(III) образуется димерный комплекс II, в котором, кроме четырех мостиковых, присутствуют монодентантно связанные молекулы бетаина (по одной у каждого атома самария). Одна молекула метанола депротонирована с образованием координированного алкоголятного лиганда. Молекулы воды достраивают координационный полиэдр лантанидов до квадратной антипризмы (рис. 2). Расстояние Sm···Sm 4.584 Å в II также свидетельствует об отсутствии связи металл–металл. Длины связей Sm–O c координированными мостиковыми молкулами L находятся в пределах 2.360–2.420(17) Å: для монодентантного лиганда Sm–O составляет 2.391 Å, Sm–O(H2O) 2.446(18) и 2.466(17), Sm–O(HOCH3) 2.454(16) Å. В ИК-спектре II частота ассиметрического колебания координированного лиганда смещается сильнее в высокочастотную область, в связи с наличием монодентантно координированного лиганда (до 1676 см–1).
При взаимодействии L с хлоридом европия(III) в метаноле образуется биядерный комплекс III, изоструктурный комплексу I. Pасстояние Eu…Eu составляет 4.4637 Å. В ИК-спектре III частота ассиметрического колебания карбоксильной группы координированного бетаина также смещается в высокочастотную область (до 1667 см–1).
Во всех полученных соединениях I–III молекула бетаина L выступает в роли нейтрального мостикового лиганда между атомами лантанидов, образуя катионные комплексы, которые можно использовать как остов для создания гетерометаллических соединений.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Legendziewicz J., Huskowska E., Waskowska A. et al. // Inorg. Chim. Acta. 1984. V. 92. P. 151.
Chen X.-M., Wu Y.-L., Wang R.-J. et al. // Polyhedron. 1996. V. 15. P. 739.
Huskowska E., Turowska-Tyrk I., Legendziewicz J. et al. // J. Alloy. Compd. 1998. V. 275. P. 852.
Mohamed M.E., Chopra D., Venugopal K.N. et al. // Acta Crystallogr. E. 2010. V. 66. P. e28.
Yang G., Chen H.-A., Zhou Z.-Y. et al. // J. Chem. Crystallogr. 1999. V. 29. P. 309.
Wang J., Niu C., Hu N. et al. // Acta Crystallogr. E. 2004. V. 60. P. m32.
Chen X.-M., Wu Y.-L., Yang Y.-Y. et al. // Inorg. Chem. 1998. V. 37. P. 6186.
Torres J., Kremer C., Kremer E. et al. // Inorg. Chim. Acta. 2003. V. 355. P. 442.
Ma Y.-L., Du L., Zhao Q.-H. // Inorg. Chem. Commun. 2017. V. 77. P. 1.
Mao J.-G., Mak T.C.W., Zhang H.-J. et al. // J. Coord. Chem. 1999. V. 47. P. 145.
Volkert W.A., Hoffman T.J. // Chem. Rev. 1999. V. 99. P. 2269.
Torres J., Kremer C., Kremer E. et al. // Inorg. Chim. Acta. 2003. V. 355. P. 442.
Panyushkin V.T., Bukov N.N., Abramov D.E. // Polyhedron. 2003. V. 22. P. 271.
Kelley S.P., Rogers R.D. // Supramolecular Chem. 2018. V. 30. P. 411.
Ziessel R., Ulrich G., Asfari Z. et al. // Pure Appl. Chem. 1995. V. 67. P. 135.
Werts M.H.V., Jukes R.T.F., Verhoeven J.W. // Phys. Chem. Chem. Phys. 2002. V. 4. P. 1542.
Voutchkova A.M., Feliz M., Clot E. et al. // J. Am. Chem. Soc. 2007. V. 129. P. 12834
Sheldrick G.M. SADABS (2016/2). Göttingen (Germany): Univ. of Göttingen, 2016.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Ap-pl. Cryst. 2009. V. 42. P. 339.
Spek A.L. // Acta Crystallogr. D. 2009. V. 65. P. 148.
Zhu L.-G., Yu Q.-S., Xiu X.-P. // Chin. J. Inorg. Chem. 1999. V. 15. P. 319
Koroteev P., Dobrokhotova Z., Ilyukhin A. et al. // Polyhedron. 2013. V. 65. P. 110.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


