Координационная химия, 2019, T. 45, № 11, стр. 684-690
Галогенные и водородные связи в сокристаллических солях ферроцений-органотеллургалогенидов
Ю. В. Торубаев 1, *, К. А. Лысенко 2, А. Е. Попова 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: torubaev@igic.ras.ru
Поступила в редакцию 08.04.2019
После доработки 16.05.2019
Принята к публикации 20.05.2019
Аннотация
При взаимодействии ферроцена и декаметилферроцена с винильным трихлортеллуридом Ph(Cl)C=C(Ph)TeCl3 образуются необычные солевые сокристаллы [Cp2Fe]+Cl–Ph(Cl)C=C(Ph)TeCl2OH) (I) и [(C5Me5)2Fe]+Cl–(Ph(Cl)C=C(Ph)TeCl2OH) (II). Молекула Ph(Cl)C=C(Ph)TeCl2OH в них нейтральна и образует лишь нековалентные (водородные и халькогенные) связи с хлорид-ионом. Гидролитическое замещение атома хлора в Ph(Cl)C=C(Ph)TeCl3, не участвующего в 3-центровой-4-электронной связи Cl–Te–Cl, происходит вследствие общей чувствительности органических теллурхлоридов к влаге, и сопутствующая реакция окисления ферроцена не является необходимым условием образования Ph(Cl)C=C(Ph)TeCl2OH (III) (CCDC № 1908530 (I), 1908531 (II), 1908532 (III).
Интенсивное изучение галогенных связей [1], родственных им халькогенных [2] и прочих так называемых σ-дырочных взаимодействий [3] в последнее десятилетие привело к бурному росту числа исследований фундаментальных и прикладных аспектов нековалентных межмолекулярных взаимодействий (называемых также вторичными, невалентными). Это, в свою очередь, дало новые инструменты для дизайна кристаллов и функциональных материалов [4, 5] и привлекло значительное внимание и ресурсы к инженерии сокристаллов [6, 7]. Большое разнообразие, необычность сочетаний компонентов в сокристаллах, в частности их растущая роль в современной фармацевтике, привело к необходимости уточнения и пересмотра номенклатуры и классификации бинарных (и более) кристаллических систем [8, 9].
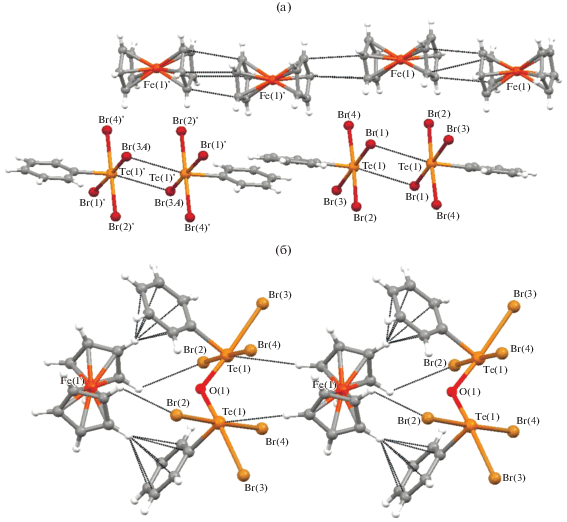
В описанных нами ранее продуктах взаимодействия ферроцена с PhTeBr3 наблюдается два типа структур: 1) Cp2Fe+[PhTeBr4]–, компактная, с четким разделением компонентов на димерные анионы  и стопки катионов Cp2Fe+, образующихся за счет π–π-стекинга между Ср-кольцми ферроцения, 2) частично гидролизованный
оксо-хлоротелурофенолят ферроцения [Cp2Fe+[(PhTeBr3)2(µ-O)]–, в котором катионы Fe+ располагаются между анионами [(PhTeBr3)2(µ-O)]– и связаны с ними за счет C–H···Te и С–H···πPh водородных связей (рис. 1) [10].
и стопки катионов Cp2Fe+, образующихся за счет π–π-стекинга между Ср-кольцми ферроцения, 2) частично гидролизованный
оксо-хлоротелурофенолят ферроцения [Cp2Fe+[(PhTeBr3)2(µ-O)]–, в котором катионы Fe+ располагаются между анионами [(PhTeBr3)2(µ-O)]– и связаны с ними за счет C–H···Te и С–H···πPh водородных связей (рис. 1) [10].
Рис. 1.
Фрагменты цепочечных структур в кристаллической упаковке Cp2Fe+[PhTeBr4]– (а) и [Cp2Fe]+[(PhTeBr3)2(µ-O)]– (б) [10].
В продолжение этих исследований и с целью изучения подходов к направленному дизайну гибридных сокристаллов, содержащих металлокомплексные и элементоорганические компоненты, мы изучили образование и строение продуктов сокристаллизации ферроценов с инильным трихлортеллуридом Ph(Cl)C=C(Ph)TeCl3.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Коммерческие (C5H5)2Fe и (C5Me5)2Fe перекристаллизовывали перед использованием. Ph(Cl)C=C(Ph)TeCl3 получали по методике [11]. Органические растворители осушали по стандартным методикам.
Синтез [Cp2Fe]+Cl–Ph(Cl)C=C(Ph)TeCl2OH) (I). Желто-оранжевый раствор 9 мг (0.05 ммоль) ферроцена в 0.1 мл CH2Cl2 помещали в пробирку (внутренний диаметр 5 мм) и осторожно, по каплям прибавляли бесцветный раствор 22 мг (0.05 ммоль) Ph(Cl)C=C(Ph)TeCl3 в 0.1 мл CH2Cl2. Область соприкосновения растворов окрашивалась в зеленый цвет, характерный для катиона ферроцения, и в области контакта растворов наблюдалось образование черно-зеленых твердых частиц. Пробирку продували аргоном, запечатывали несколькими слоями парафильма и оставляли при комнатной температуре в темном месте. Через 2 сут растворитель практически полностью испарялся и на стенках ампулы образовывались однородные зеленые призматические кристаллы, пригодные для РСА.
Синтез [(C5Me5)2Fe]+Cl–(Ph(Cl)C=C(Ph)TeCl2OH) (II). Желто-оранжевый раствор 16 мг (0.05 ммоль) декаметилферроцена в 0.1 мл CH2Cl2 помещали в пробирку (внутренний диаметр 5 мм) и осторожно, по каплям прибавляли бесцветный раствор 22 мг (0.05 ммоль) Ph(Cl)C=C(Ph)TeCl3 в 0.2 мл CH2Cl2. Область соприкосновения растворов окрашивалась в зеленый цвет, характерный для катиона ферроцения, но выпадения осадка или образования твердых частиц в области контакта растворов не наблюдалось. Пробирку продували аргоном, запечатывали несколькими слоями парафильма и оставляли при комнатной температуре в темном месте. Через 5 сут растворитель практически полностью испарялся и на стенках образовывались однородные зеленые призматические кристаллы, пригодные для РСА.
Синтез Ph(Cl)C=C(Ph)TeCl2OH (III). Раствор 22 мг (0.05 ммоль) Ph(Cl)C=C(Ph)TeCl3 в 0.1 мл ДМСО помещали в пробирку (внутренний диаметр 5 мм), закрывали ватной заглушкой и оставляли в защищенном от света и пыли месте при комнатной температуре. Через 2 нед. на дне пробирки под слоем растворителя образовывались однородные бесцветные призматические кристаллы, пригодные для РСА.
РСА выполнен на дифрактометре Bruker APEX II CCD (II, III) и Agilent Oxford (I). Поглощение учтено методом множественного измерения эквивалентных отражений с использованием программы SADABS [12]. Структура I–III определена прямым методом и уточнена методом наименьших квадратов относительно F 2 в анизотропном приближении неводородных атомов с использованием пакета программ SHELXTL [13]. Положения атомов Н рассчитаны геометрически. Параметры рентгеноструктурного эксперимента и уточнения для структуры I–III приведены в табл. 1, основные расстояния и углы – в подписях к рис. 2–4.
Таблица 1.
Кристаллографические данные и параметры уточнения структур I–III
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III | |
| Брутто-формула | C38H32O2Cl7Fe1Te2 | C48H52O2Cl7FeTe2 | C12H16O2SCl3Te |
| М | 1080.77 | 1220.93 | 458.26 |
| Излучение (λ, Å) | CuKα (1.54184) | MoKα (0.71073) | MoKα (0.71073) |
| T, K | 293 | 150 | 150 |
| Сингония | Моноклинная | Моноклинная | Моноклинная |
| Пр. гр. | P21/c | C2/c | Pc |
| Z | 4 | 8 | 8 |
| a, Å | 17.4427(3) | 30.1203(19) | 12.5710(11) |
| b, Å | 15.5567(3) | 9.8261(6) | 12.4019(11) |
| c, Å | 14.8766(3) | 21.636(2) | 19.3794(17) |
| α, град | 90 | 90 | 90 |
| β, град | 100.7562(18) | 128.9990(10) | 106.986(2) |
| γ, град | 90 | 90 | 90 |
| V, Å3 | 3965.85(13) | 4976.5(7) | 2889.5(4) |
| ρ(выч.), г/см3 | 1.809 | 1.628 | 2.107 |
| μ, см–1 | 190.35 | 18.65 | 27.52 |
| F(000) | 2100 | 2420 | 1784 |
| 2θmax, град | 135 | 50 | 50 |
| Число измеренных отражений | 15 834 | 29 609 | 35 020 |
| Число независимых отражений | 7521 | 6634 | 15 226 |
| Число отражений с I > 2σ(I) | 5420 | 5691 | 11 370 |
| Количество уточняемых параметров | 459 | 278 | 623 |
| R1 | 0.0497 | 0.0253 | 0.0630 |
| wR2 | 0.1330 | 0.0635 | 0.1784 |
| GOОF | 1.030 | 1.047 | 0.977 |
| Остаточная электронная плотность (min/max), e Å–3 | 1.348/–0.833 | 0.626/–0.369 | 2.603/–1.364 |
Рис. 2.
Фрагмент кристаллической упаковки I: внутримолекулярные расстояния – Te(1)–Cl(3) 2.521(2), Te(1)–Cl(2) 2.495(2), Te(1)–O(1) 1.909(4), Te(1A)–Cl(3A) 2.454(2), Te(1A)–Cl(2A) 2.533(2), Te(1A)–O(1A) 1.908(4) Å; межмолекулярные расстояния – H(1A)–Cl(1) 2.286, H(1)–Cl(1) 2.362, Te(1A)–Cl(2) 3.601(2), Te(1)–Cl(1) 3.271(2) Å; вутримолекулярные углы – Cl(3)Te(1)Cl(2) 174.54(6)°, C(1)Te(1)O(1) 94.3(2)°, C(1A)Te(1A)O(1A) 94.2(2)°; межмолекулярные углы – Cl(3A)Te(1A)Cl(2A) 174.56(7)°, C(1)Te(1)Cl(1) 166.0(2)°, C(1A)Te(1A)Cl(2) 173.1(2)°.
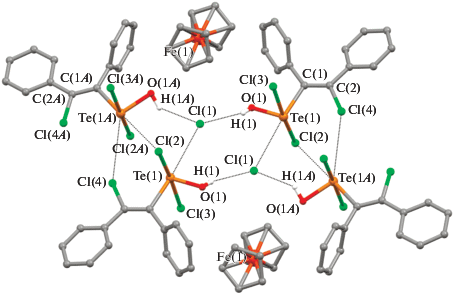
Рис. 3.
Фрагмент кристаллической упаковки II: внутримолекулярные расстояния – Te(1)–Cl(1) 2.5224(6), Te(1)–Cl(2) 2.4825(6), Te(1)–O(1) 1.926(2) Å; межмолекулярные расстояния – H(1O)– Cl(4) 2.3569; Te(1)–Cl(4) 3.1464; Te(1)–Cl(1) 3.654(1) Å; внутримолекулярные углы – Cl(2)Te(1)Cl(1) 173.02(3)°; межмолекулярные углы – C(1)Te(1)Cl(4) 162.57°, O(1)Te(1)Cl(1) 144.94(6)°.
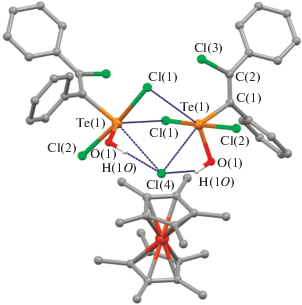
Рис. 4.
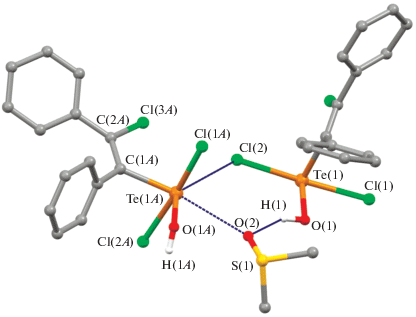
Фрагмент кристаллической упаковки IIIа: внутримолекулярные расстояния – Te(1)–Cl(2) 2.502(4), Te(1)–Cl(1) 2.488(4), Te(1)–O(1) 1.906(9), Te(1A)–Cl(1A) 2.469(4), Te(1A)–Cl(2A) 2.516(4) Å; межмолекулярные расстояния – H(1)–O(2) 1.88, Te(1A)–O(2) 2.93(1), Te(1A)–Cl(2) 3.476(4) Å; внутримолекулярные углы – Cl(2)Te(1)Cl(1) 173.1(1)°, Cl(1A)Te(1A)Cl(2A) 173.2(1)°; межмолекулярные углы – Cl(1A)Te(1A)O(2) 172.2(4)°, O(1A)Te(1A)Cl(2) 142.8(3)°.
Координаты атомов и другие параметры структуры I–III депонированы в Кембриджском банке структурных данных (CCDC № 1908530 (I), 1908531 (II), 1908532 (III); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При замене PhTeBr3 на Ph(Cl)C=C(Ph)TeCl3 в реакции с ферроценом также наблюдается окисление ферроцена до монокатиона Cp2Fe+ и частичный гидролиз Ph(Cl)C=C(Ph)TeCl3 до Ph(Cl)C=C(Ph)TeCl2OH, образующего водородные (O–H···Cl ~2.5 Å) и халькогенные (Te···Cl ~3.3 Å) связи с хлорид-анионом. В кристалле I на один катион ферроцения приходится один хлоридный анион и две молекулы Ph(Cl)C=C(Ph)TeCl2OH. В отличие от PhTeBr3, образующего анион ${\text{PhTeBr}}_{4}^{ - },$ четвертое положение в экваториальной плоскости теллура в Ph(Cl)C=C(Ph)TeCl3 экранировано винильным атомом хлора, поэтому гидроксильная группа замещает один из трех атомов хлора при теллуре. Важно отметить, что это хлор, не участвующий в 3-центровой-4-электронной связи Cl(2)–Te(1)–Cl(3).
В отличие от 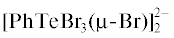 и [Cp2Fe]+[(PhTeBr3)2(µ-O)]–, классифицирующихся как соли (а не сокристаллы), комплекс I – несольватированный
солевой сокристалл (“nonsolvated salt cocrystal”), так как его часть Ph(Cl)C=C(Ph)TeCl2OH, скорее, нейтральная, образующая лишь нековалентные (водородные и халькогенные)
связи с хлорид-ионом. Окружение центрального атома теллура представляет собой искаженный
Ψ-октаэдр с 3-центровой-4-электронной системой Cl–Te–Cl и двумя халькогенными связями:
Te···Cl(1) (3.271(2) Å) c хлорид-анионом и Te···Cl(1А) (3.601(2) Å) с атомом хлора фрагмента Cl–Te–Cl соседней молекулы (рис. 2).
и [Cp2Fe]+[(PhTeBr3)2(µ-O)]–, классифицирующихся как соли (а не сокристаллы), комплекс I – несольватированный
солевой сокристалл (“nonsolvated salt cocrystal”), так как его часть Ph(Cl)C=C(Ph)TeCl2OH, скорее, нейтральная, образующая лишь нековалентные (водородные и халькогенные)
связи с хлорид-ионом. Окружение центрального атома теллура представляет собой искаженный
Ψ-октаэдр с 3-центровой-4-электронной системой Cl–Te–Cl и двумя халькогенными связями:
Te···Cl(1) (3.271(2) Å) c хлорид-анионом и Te···Cl(1А) (3.601(2) Å) с атомом хлора фрагмента Cl–Te–Cl соседней молекулы (рис. 2).
Похожая сокристаллическая соль II образуется в аналогичных условиях для декаметилферроцена. При этом не наблюдалось выпадения осадка или образования твердых частиц, как в случае I, что можно объяснить лучшей растворимостью солей декаметилферроцения (C5Me5)2Fe+ по сравнению с ферроцением (C5H5)2Fe+. В кристалле II на один катион декаметилферроцения приходится один хлорид-анион и так же, как и в I, две молекулы Ph(Cl)C=C(Ph)TeCl2OH, образующие водородные O–H···Cl (H···Cl ~2.36 Å) и халькогенные связи с хлорид-анионом (Te(1)···Cl(4) ~3.15 Å) и с атомом хлора фрагмента Cl–Te–Cl соседней молекулы (Te(1)···Cl(1) ~3.65Å) (рис. 3).
Образование гидроксильного производного Ph(Cl)C=C(Ph)TeCl2OH в I и II, несмотря на использование сухих растворителей, является несомненным проявлением известной склонности органотеллурхлоридов к гидролизу [14]. Тем не менее было интересно проверить, насколько окислительно-восстановительные условия в данном случае необходимы для гидролиза. Для этого растворы Ph(Cl)C=C(Ph)TeCl3 в СH2Сl2 и в DМSO оставляли в неплотно закрытых пробирках в защищенном от света и пыли месте при комнатной температуре. В пробирке с раствором в хлористом метилене через 48 ч были обнаружены лишь кристаллы исходного Ph(Cl)C=C(Ph)TeCl3. Во второй пробирке, гигроскопичный DМSО в течение 2 нед. поглощал из воздуха влагу, которая одновременно вызывала гидролиз Ph(Cl)C=C(Ph)TeCl3 и осаждение нерастворимого в воде кристаллосольвата Ph(Cl)C=C(Ph)TeCl2OH ∙ DMSO (IIIa, рис. 4). Таким образом, показано, что сопутствующая реакция окисления ферроцена не является необходимым условием образования Ph(Cl)C=C(Ph)TeCl2OH, но в присутствии ферроцена протекает существенно быстрее.
Геометрия молекул Ph(Cl)C=C(Ph)TeCl2OH в кристаллосольвате IIIа незначительно отличается от таковой в I и II, только углом поворота фенильных колец относительно плоскости Te–C=C–Cl, но окружение атомов теллура практически идентично (см. подписи к рис. 2–4). Это сходство косвенно подтверждает предположение о нейтральности молекулы Ph(Cl)C=C(Ph)TeCl2OH в I и II. В кристаллической решетке IIIа четко прослеживаются полимерные цепочки [Ph(Cl)C=C(Ph)TeCl2OH···DMSO]n, в которых сольватная молекула DMSO выступает акцептором межмолекулярной водородной О–Н···О=S (Н···О ~1.88 Å) и халькогенной (Те···О=S ~2.93 Å) связи, и дополнительно связывает таким образом две молекулы Ph(Cl)C=C(Ph)TeCl2OH, ассоциированные за счет халькогенной связи Te···Cl(2) (~3.48 Å, рис. 4).
Как в I, II и других известных структурах органических оксо- и гидроксо-теллурдигалогенидов, замещенным на кислород оказывается атом галогена, лежащий в экваториальной плоскости относительно гипервалентной группировки X–Te–X (X = Cl, Br; схема 1 ).
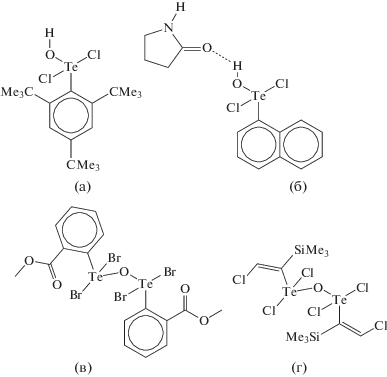
Схема 1 . Органические оксо- и гидроксотеллурдигалогениды по данным Кембриджской базы структурных данных [12]: (a) (CIDKIK) – дихлоро-гидрокси-(2,4,6-три-трет-бутилфенил)-теллурид(IV) [15], (б) (ECAXEN) – дихлоро-(1-нафтил)-гидрокси-теллурид(IV) пирролидин-2-он [16], (в) (MEGVUR) – (µ2-оксо)-бис(2-(метоксикарбонил)фенил)-тетрабромодителлурид [17], (г) (RUFQEP) – (µ2-оксо)-бис((Z)-2-хлоро-1-триметилсилилвинил)-тетрахлоро-дителлурид(IV) [18].
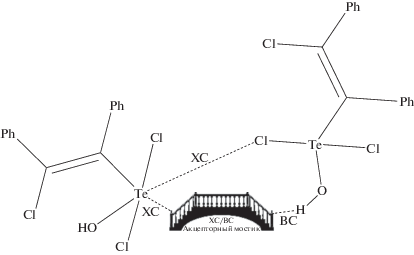
Таким образом, показано, что окисление ферроцена и его производных под действием 1,2-дифенилвинилтрихлортеллуридов сопровождается частичным гидролизом Ph(Cl)C= C(Ph)TeCl3 с образованием сокристаллических солей Fc+Cl–(Ph(Cl)C=C(Ph)TeCl2OH)2, стабилизированных за счет системы водородных и халькогенных связей. Общий структурный мотив в сокристаллах I–IIIа показан на схеме 2 .
ХС/ВС – акцепторный мостик: Cl– (I, II), DMSO (IIIа), где ХС – халькогенная связь, ВС – водородная связь
Схема 2 .
Во всех структурах I–IIIа наблюдается общий структурный мотив – димерный ассоциат (Ph(Cl)C=C(Ph)TeCl2OH)2, образующийся за счет халькогенной связи Te···Cl–Te и дополнительно стабилизированый хлор-анионным (в I, II) или DMSO “мостиком” за счет галогенной (Te···Cl в I, II и Te···O в IIIа) и водородной (О–Н···Cl в I, II и O–H···O в IIIа) связи (схема 2 ).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Cavallo G., Metrangolo P., Milani R. et al. // Chem. Rev. 2016 V. 116. P. 2478.
Vogel L., Wonner P., Huber S.M. // Angew. Chem. Int. Ed. 2019. V. 58. P. 1849. https://doi.org/10.1002/anie.201809432
Tiekink E.R.T. // Coord. Chem. Rev. 2017. V. 345. P. 209.
Priimagi A., Cavallo G., Metrangolo P., Resnati G. // Acc. Chem. Res. 2013. V. 46. P. 2686.
Adonin S.A., Udalova L.I., Abramov P.A. // Chem. Eur. J. 2018. V. 24. P. 14707.
Metrangolo P., Resnati G., Pilati T., Biella S. // Halogen Bonding Fundamentals and Applications, Halogen bonding in crystalengineering. 2008. V. 126. P. 105.
Mukherjee A., Tothadi S., Desiraju G.R. // Acc. Chem. Res. 2014. V. 47. № 8. P. 2514.
Aitipamula S., Banerjee R., Bansal A.K. et al. // Cryst. Growth Des. 2012. V. 12. P. 2147.
Zhang C., Xiong Y., Jiao F. et al. // Cryst. Growth Des. 2019. V. 19. № 3. P. 1471. https://doi.org/10.1021/acs.cgd.8b01537
Torubaev Yu.V., Pavlova A.V., Pasynskii A.A. et al. // Russ. J. Coord. Chem. 2015. V. 41. P. 638. https://doi.org/10.1134/S1070328415100085
Zukerman-Schpector J., Camillo R.L., Comasseto J.V. // Acta Crystallogr. C. 1999. V. 55. P. 1577.
Groom C.R., Bruno I.J., Lightfoot M.P., Ward S.C. // Acta Crystallogr. B. 2016. V. 72. P. 171. https://doi.org/10.1107/S2052520616003954a
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Petragnani N., Stefani H.A. Telluriumin Organic Synthesis. Elsevier: AcademicPress, 2007. https://doi.org/10.1016/B978-0-08-045310-1.X5000-X
Beckmann J., Heitz S., Hesse M. // Inorg. Chem. 2007. V. 46. P. 3275.
Misra S., Chauhan A.K.S., Srivastava R.C. et al. // RSC Adv. 2011. V. 1. P. 808.
Rakesh P., Singh H.B., Butcher R.J. // Dalton Trans. 2012. V. 41. P.0707.
Martynov A.V., Amosova S.V. // Russ. J. Gen. Chem. 2008. V. 78. P. 2067. https://doi.org/10.1134/S1070363208110145
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия