Координационная химия, 2019, T. 45, № 11, стр. 700-704
Синтез и кристаллическая структура новых комплексов Сu(II) и Co(II) с 2-бензоилпиридином
А. А. Витиу 1, 2, Э. Б. Коропчану 2, 3, П. Н. Боурош 1, *
1 Институт прикладной физики
Кишинев, Республика Молдова
2 Институт химии
Кишинев, Республика Молдова
3 Тираспольский государственный университет
Кишинев, Республика Молдова
* E-mail: bourosh.xray@phys.asm.md
Поступила в редакцию 10.04.2019
После доработки 28.05.2019
Принята к публикации 03.06.2019
Аннотация
По реакции 2-бензоилпиридина (Bzpy) с солями меди(II) и кобальта(II) получены два новых моноядерных комплексных соединения [Cu(Bzpy)2(Cl)2] (I) и [Cо(Bzpy)2(H2O)2](BF4)2 (II). Mетодом РСА (CIF files CCDC № 1908081 (I), 1908080 (II)) установлено, что комплекс I молекулярный, II – ионного типа. В обоих комплексах к атомам комплексообразователя координируются два нейтральных бидентатно-хелатных N,O-лиганда Bzpy. Дополняют до октаэдрических координационные полиэдры в I анионы Cl–, в II – молекулы воды. Анионы [BF4]– в II, компенсирующие положительный заряд комплексных катионов, связаны с ними, помимо электростатических взаимодействий, межмолекулярными водородными связями О–H···F.
В поисках селективных реагентов для экстракции ионов переходных металлов, изучая влияние различных заместителей на координационные свойства пиридинкарбоновых кислот и стереохимию полученных комплексов, была получена информация о координационной геометрии комплексов, образованных ионами переходных металлов первого ряда с 2-бензоилпиридином (2-Bzpy), основанная на спектроскопических данных. Далее комплексные соединения переходных металлов первого ряда с пиридином и их производными были очень интенсивно изучены методом РСА [1]. 2-Вzpy является хорошим хелатирующим лигандом, в котором ацильный заместитель в положении 2 пиридинового кольца увеличивает возможности способа связывания с ионами металлов. Способ координации 2-Bzpy к центральному атому зависит как от используемого иона металла, так и от анионов и растворителей. Структурные исследования показали, что более распространенным способом является бидентатно-хелатный, в котором карбонильный кислород координируется к центральному иону металла вместе с азотом пиридинового фрагмента, образовывая пятичленный металлоцикл, как в [2–7], и лишь в трех случаях найден монодентатный способ, при котором для координирования используется только атом азота [8–10]. В результате использования N,O-кординированного лиганда 2-Bzpy были получены как моно- [3, 4, 6, 7, 11–13] и биядерные [2, 5, 13–16], так полиядерные комплексы [5, 16–18], включая координационные полимеры [12, 19–21]. Однако все полиядерные соединения получены с вовлечением дополнительных лигандов, при этом комплексы Cu(II) c Bzpy изучены в большей степени, комплексы Co(II) мало изучены [7, 17, 18, 22, 23].
В настоящей работе представлены два новых моноядерных комплексных соединения, полученные при реакции Bzpy с солями меди(II) и кобальта(II): молекулярный комплекс Сu(II) и комплекс Со(II) ионного типа – [Cu(Bzpy)2(Cl)2] (I) и [Cо(Bzpy)2(H2O)2](BF4)2 (II). При этом, в [1] обнаружено соединение Cu(II) того же состава [Cu(Bzpy)2(Cl)2] [3], которое является полиморфом соединения I.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза использовали коммерческие химические соединения, в том числе растворители, без предвaрительной очистки.
Синтез I. К Bzpy (0.18 г, 1 ммоль), CuF2 · 2H2O (0.36 г, 1 ммоль) добавляли воду (3 мл), метанол (3 мл), диметилформамид (0.5 мл), герметизировали в реакторе (V = 8 мл) с футеровкой из тефлона и нагревали в автоклаве при 120°C в течение 72 ч. Затем автоклав медленно охлаждали до комнатной температуры. Кристаллы растворимы в метаноле, этаноле, ДМФ и нерастворимы в эфире. Выход 21%.
ИК (ν, cм–1): 3274 ср, 3061 с, 2988 ср, 1659 с, 1580 с, 1445 ср, 1316 с, 1175 сл, 946 ср, 823 с, 780 сл, 758 с, 656 ср.
Синтез II. Bzpy (0.18 г, 1 ммоль), Co(BF4)2 · · 6H2O (0.36 г, 1 ммоль), воду (3 мл), метанол (3 мл), диметилформамид (0.5 мл) герметизировали в 8 мл реакторе с футеровкой из тефлона и нагревали в автоклаве при 120°C в течение 48 ч. Затем автоклав медленно охлаждали до комнатной температуры. Кристаллы растворимы в метаноле, этаноле, ДМФ и нерастворимы в эфире. Выход 25%.
ИК (ν, cм-1): 3380 ср, 2935 с, 2924 ср, 1659 с, 1555 с, 1448 ср, 1370 с, 1080 сл, 943 ср, 761 сл, 660 с 524 сл.
ИК-спектры снимали на спектрометре FT-IR Perkin-Elmer Spectrum 100 в вазелиновом масле в области 4000–400 см–1 и ATР в области 4000–650 cм–1.
РСА кристаллов I и II проведен на дифрактометре Xcalibur Е с детектором CCD при комнатной температуре (MoKα-излучение). Параметры элементарной ячейки уточненны по всему массиву, остальные экспериментальные данные получены, используя комплекс программ CrysAlis Oxford Diffraction [24]. Структура определена прямыми методами, координаты неводородных атомов уточнены методом наименьших квадратов в анизотропном варианте (SHELX-97) [25]. Позиции атомов водорода, связанных с углеродом или кислородом, определены геометрически и уточнены изотропно в модели жесткого тела (BH = 1.2UX или 1.5UX (X = C, O). Основные характеристики эксперимента, решения и уточнения структуры I и II приведены в табл. 1, основные межатомные расстояния и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические данные и характеристики эксперимента для структуры I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| М | 500.84 | 634.99 |
| Сингония | Триклинная | Моноклинная |
| Пр. гр. | P1 | P21/n |
| а, Å | 7.3015(7) | 9.0790(5) |
| b, Å | 8.2013(8) | 11.6909(5) |
| с, Å | 10.8395(11) | 12.8702(5) |
| α, град | 107.777(9) | 90 |
| β, град | 95.380(8) | 92.493(5) |
| γ, град | 113.191(9) | 90 |
| V, Å3 | 550.91(9) | 1364.77(10) |
| Z | 1 | 2 |
| ρ(выч.), г/см3 | 1.510 | 1.545 |
| μ, мм–1 | 1.257 | 0.717 |
| F(000) | 255 | 642 |
| Размеры кристалла, мм | 0.22 × 0.21 × 0.18 | 0.36 × 0.34 × 0.12 |
| Область θ, град | 2.91–25.03 | 3.17–25.03 |
| Интервалы индексов отражений | –7 ≤ h ≤ 8, –9 ≤ k ≤ 8, –12 ≤ l ≤ 12 |
–6 ≤ h ≤10, –13 ≤ k ≤ 9, –13 ≤ l ≤ 15 |
| Число измеренных/независимых рефлексов (Rint) | 2910/1943 (0.0210) | 4450/2399 (0.0224) |
| Заполнение, % | 99.7 | 99.3 |
| Число рефлексов с I > 2σ(I) | 1677 | 1717 |
| Число уточняемых параметров | 142 | 187 |
| GOOF | 1.004 | 1.006 |
| R факторы (I > 2σ(I)) | R1 = 0.0363, wR2 = 0.0910 | R1 = 0.0920, wR2 = 0.2952 |
| R факторы (по всему массиву) | R1 = 0.0440, wR2 = 0.0980 | R1 = 0.1171, wR2 = 0.3287 |
| Δρmax/Δρmin, e Å–3 | 0.437/–0.328 | 0.795/–0.549 |
Таблица 2.
Межатомные расстояния и валентные углы в координационных полиэдрах Cu(II) и Co(III) в I и II
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| I | |||
| Cu(1)–N(1) | 1.977(2) | N(1)Cu(1)O(1) | 73.7(8) |
| Cu(1)–O(1) | 2.4572(6) | N(1)Cu(1)Cl(1) | 90.94(7) |
| Cu(1)–Cl(1) | 2.3184(8) | O(1)Cu(1)Cl(1) | 94.2(7) |
| II | |||
| Co(1)–N(1) | 2.072(4) | N(1)Co(1)O(1) | 78.3(2) |
| Co(1)–O(1) | 2.089(4) | N(1)Co(1)O(1w) | 89.2(2) |
| Co(1)–O(1w) | 2.094(4) | O(1)Co(1)O(1w) | 88.3(2) |
Позиции и тепловые параметры для I и II депонированы в Кембриджском банке структурных данных (CCDC № 1908081 и 1908080 соответственно; www.ccdc.cam.ac.uk/conts/retrieving. html или deposit@ccdc.ca.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Методом ИК-спектроскопии в диапазоне 4000–400 см–1 определяется молекула 2-Bzpy как некоординированная, так и в комплексах. Полоса при 1659–1580 см–1 спектра, характерная для карбонильной группы ν(C=O), указывает на координацию лиганда 2-Bzpy к центральному иону металла карбонильным кислородом. Полоса при 1592–1570 см–1 соответствует вибрации νas(C=N), а 1285–1287 см–1 – νs(C=N) пиридиновой группы и подтверждает координацию атома азота пиридинового фрагмента лиганда к ионам металла. В области 3274–3380 см–1 комплекс II проявляет широкую полосу средней интенсивности, что можно объяснить колебаниями растяжения групп ОН молекул воды. В комплексе II расположение ионов [BF4]– во внешней сфере комплексов подтверждается присутствием полос при 1084 νas(BF4), 761 νs(BF4), 524 cм–1 δ(F–B–F).
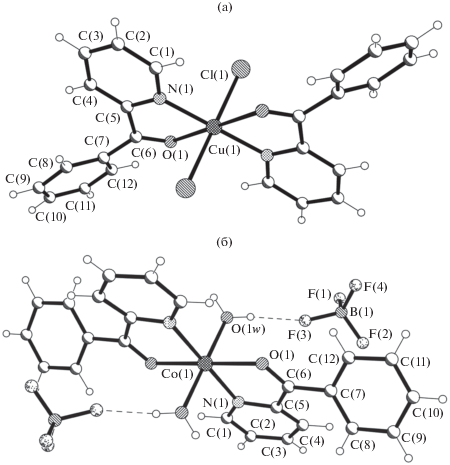
В результате РСА установлено, что комплекс I молекулярный, а II – ионного типа.
Молекулярная структура центросимметричного комплекса I приведена на рис. 1а. В комплексе меди(II) центальный атом металла имеет октаэдрическое окружение. Два органических нейтральных лиганда Bzpy координированы бидентатно-хелатным способом через два N,O-донорных атома с образованием двух пятичленых металлоциклов и расположены в экваториальной плоскости полиэдра. На аксиальных координатах октаэдра расположены два атома Cl. Координационный полиэдр Cu(II) сформирован набором донорных атомов NOCl. Значения межатомных расстояний Co–N, Co–N и Co–Cl равны 1.977(2), 2.457(1) и 2.3184(8) Å соответственно. Подобное найдено в полиморфном комплексе Cu(II) в [3], кристаллизирующемся в моноклинной пр. гр. С2/c, заметно отличаются и межатомные расстояния Co–N, Co–N и Co–Cl, равные 2.006, 2.495 и 2.281 Å соответственно.
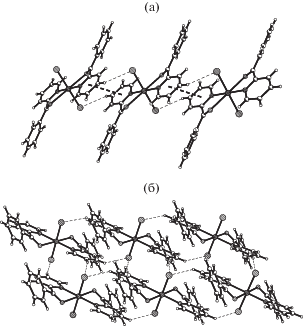
Анализ упаковки молекулярных комплексов в I указывает на существование лишь слабых межмолекулярных водородных связей С–H···Cl (C(2)···Cl(1) (x + 1, y, z) 3.703, C(3)···Cl(1) (–x + 2, –y, –z + 2) 3.535 Å) и π···π межмолекулярных взаимодействий между гетероароматическими циклами (центроид···центроид 3.734 Å), что диктует формирование цепочек, связанных в кристалле в слои (рис. 2).
Рис. 2.
Формирование цепочки из центросимметричных комплексов I (a), ассоциация цепочек в слои в I (б).
Соединение ионного типа II образовано комплексным катионом [Cо(Bzpy)2(H2O)2]+ и анионами [BF4]– (рис. 1б). Октаэдрический координационный полиэдр атома Co(II) сформирован набором донорных атомов N2O2 двух лигандов Bzpy, координированных таким же способом, как и в I, с образованием двух пентаметаллоциклов, расположенных в экваториальной плоскости полиэдра, и двух атомов О двух молекул воды на аксиальных координатах. Значения межатомных расстояний Co–N 2.072(4), Co–О 2.089(4) и Co–О(w) 2.094(4) Å немного отличны от найденных в подобном соединении с перхлоратом [7], в котором эти же расстояния равны 2.077, 2.105 и 2.078 Å соответственно.
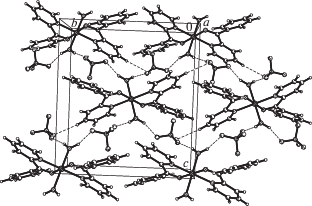
Комплексный катион содержит координированные молекулы воды, которые вовлечены в межмолекулярные водородные связи в качестве доноров протонов, а в качестве акцепторов вовлечены атомы фтора анионов [BF4]– (рис. 3). В кристалле комплексные катионы соединены с анионами [BF4]–, помимо электростатических взаимодействий, в слои межмолекулярными водородными связями O(1w)–Н(1)···F(3) (O(1w)···F 2.692(7), Н···F 1.88 Å, угол OНF 170°) и O(1w)–Н(2)···F(2) (–x + 1/2, y – 1/2, –z + 3/2) (O(1w)···F 2.687(9), Н···F 1.85 Å, угол OНF 160°). Cлои дополнительно стабилизированы слабыми водородными связями С–H···F (C(3)···F(4) (–x + 1/2, y + 1/2, –z + 3/2) 3.408 Å) (рис. 2) и объединены между собой также слабыми взаимодействиями С–H···F (C(1)···F(4) (x – 1, y, z) 3.148 Å) (рис. 3).
Таким образом, в результате взаимодействия солей Cu(II) и Co(II) с 2-бензоилпиридином получены два соединения, различных по типу (молекулярный комплекс и соединение ионного типа), в которых органический лиганд координирован N,O-бидентатно-хелатным способом, с образованием пентаметаллоциклов.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Allen F.H. // Acta Crystallogr. B. 2002. V. 58. № 3–1. P. 380.
Mak T.C.W., Goher M.A.S. // Inorg. Chim. Acta. 1986. V. 115. P. 17.
Malecki J.G., Machura B., Switlicka A., Kusz J. // Polyhedron. 2011. V. 30. P. 410.
Kriza A., Tatucu M., Maxim C., Rau I. // Synth. React. Inorg. Met.-Org. Nano-Met. Chem. 2009. V. 39. P. 419.
Milios C.J., Stamatatos T.C., Kyritsis P. et al. // Eur. J. Inorg. Chem. 2004. № 14. P. 2885.
Hsueh M.-L., Yang Ch.-H. // Acta Crystallogr. E. 2009. V. 65. P. m269.
Li Ya-M., Zhao X.-W. // Acta Crystallogr. E. 2007. V. 63. P. m1589.
Li Y., Jin L. // J. Cluster Sci. 2011. V. 22. P. 41.
Malecki J.G., Maron A. // Transition Met. Chem. 2011. V. 36. P. 297.
Kovala-Demertzi D., Michaelides A., Aubry A. // Inorg. Chim. Acta. 1992. V. 194. P. 189.
Schneider A., Vahrenkamp H. // Z. Anorg. Allg. Chem. 2003. V. 629. P. 2122.
Machura B., Nawrot I., Michalik K., Drzazga Z. // Polyhedron. 2011. V. 30. P. 2294.
Sudbrake C., Vahrenkamp H. // Inorg. Chim. Acta. 2001. V. 318. P. 23.
Goher M.A.S., Abdou A.E.H., Yip W.-H., Mak T.C.W. // Polyhedron. 1993. V. 12. P. 2981.
Patel R.N., Singh Y.P., Singh Y. et al. // RSC Advances. 2017. V. 6. P. 107379.
Kitos A.A., Efthymiou C.G., Manos M.J. et al. // Dalton Trans. 2016. V. 45. P. 1063.
Zhang Y.-Z., Gao S., Sato O. // Dalton Trans. 2015. V. 44. P. 480.
Zhang Yu.-Z., Wernsdorfer W., Pan F. et al. // Chem. Commun. 2006. P. 3302.
Abu-Youssef M.A.M., Escuer A., Gatteschi D. et al. // In-org. Chem. 1999. V. 38. P. 5716.
Goher M.A.S., Mak T.C.W. // Inorg. Chim. Acta. 1985. V. 99. P. 223.
Kriza A., Tatucu M. // J. Coord. Chem. 2011. V. 64. P. 195.
Ghosh T., Chattopadhyay T., Das S. et al. // Cryst. Growth Des. 2011. V. 11. P. 3198.
Beck R., Florke U., Klein H.-F. // Inorg. Chim. Acta. 2009. V. 362. P. 1984.
CrysAlis RED. Version 1.171.34.76. 2003.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. № 1. P. 112.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия