Координационная химия, 2019, T. 45, № 12, стр. 746-755
Химический и электрохимический синтез, кристаллическая структура, магнитные свойства комплексов Cu(II), Ni(II), Co(II) тетрадентатных азометиновых лигандов
Т. В. Лифинцева 1, А. С. Бурлов 2, *, В. Г. Власенко 3, Ю. В. Кощиенко 2, Д. А. Гарновский 4, С. А. Мащенко 2, С. И. Левченков 1, 4, В. А. Лазаренко 5, В. Н. Хрусталев 5, 6, А. Л. Тригуб 5
1 Южный федеральный университета
Ростов-на-Дону, Россия
2 НИИ физической и органической химии Южного федерального университета
Ростов-на-Дону, Россия
3 НИИ физики Южного федерального университета
Ростов-на-Дону, Россия
4 Южный научный центр РАН
Ростов-на-Дону, Россия
5 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
6 Российский университет дружбы народов
Москва, Россия
* E-mail: anatoly.burlov@yandex.ru
Поступила в редакцию 19.04.2010
После доработки 18.07.2019
Принята к публикации 22.07.2019
Аннотация
Осуществлен химический и электрохимический синтез комплексов CuL1 ⋅ MeOH (Iа), NiL1 ⋅ MeOH (Iб), CоL1 ⋅ MeOH (Iв), CuL2 (IIа), NiL2 (IIб), CоL2 (IIв) тетрадентатных азометиновых соединений 4-метил-N-[2-[(E)-2-[2-[2-[(E)-[2-(п-толуолсульфамино)фенил]метиленамино]этокси]этокси]этилиминометил]-фенил]бензолсульфамида (H2L1) и 4-метил-N-[2-[(E)-3-[4-[3-[(E)-[2-(п-толуолсульфамино)фенил]метиленамино]пропокси]бутокси]-пропилиминометил]фенил]бензолсульфамида (H2L2) – продуктов конденсации 2-(N-тозиламино)бензальдегида с 3,4-диокса-1,8-октандиамином и 4,9-диокса-1,12-додекандиамином. Строение, состав и свойства полученных металлокомплексов изучены методами элементного анализа, ИК-, рентгеновской спектроскопии поглощения, магнетохимии и РСА (СIF files CCDC № 1910746 (Ia), 1910747 (Iб) и 1910748 (Iв)). В молекулах Iа–Iв макроциклический лиганд L1 координирует атом металла тетрадентатно-хелатно четырьмя атомами азота с формированием полиэдра в форме искаженного тетраэдра.
Комплексы металлов, содержащие основания Шиффа с различными донорными центрами в качестве лигандов, привлекают большое внимание в связи с их разнообразным применением как катализаторов многих реакций [1–3], функциональных материалов с интересными фото- и электролюминесцентными [4–7] и магнитными характеристиками [8–12]. Металлокомплексы переходных металлов с хелатирующими лигандами, содержащими О,N,S-донорные атомы, проявляют широкую биологическую активность и могут быть использованы в качестве новых структурных зондов в химии нуклеиновых кислот и как терапевтические агенты [13–15]. Известны многочисленные примеры исследований комплексов металлов оснований Шиффа как противоракового средства, противовирусных, противогрибковых препаратов [16–20].
Комплексы меди, никеля, кобальта и др. оснований Шиффа играют важную роль как в синтетических, так и в структурных исследованиях благодаря их препаративной доступности и структурного разнообразия, обусловленного количеством способов связывания лигандов к ионам металлов.
В настоящей работе проведен синтез химическим (из ацетатов металлов, ХС) и электрохимическим (при анодном растворении металла, ЭС) способами комплексов Cu(II), Ni(II), Co(II) тетрадентатных лигандов, продуктов конденсации 2-N-тозиламинобензальдегида с 3,4-диокса-1,8-октандиамином и 4,9-диокса-1,12-додекандиамином с целью изучения их атомного строения и магнитных свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали коммерчески доступные 3,6-диокса-1,8-октандиамин, 4,9-диокса-1,12-додекандиамин, моногидрат ацетата меди, тетрагидраты ацетатов никеля и кобальта (Alfa Aesar). 2-(N-Тозиламино)бензальдегид получали по методике [21].
Азометиновые соединения 4-метил-N-[2-[(E)-2-[2-[2-[(E)-[2-(п-толуолсульфамино)фенил]метиленамино]этокси]этокси]этилиминометил]-фенил] бензолсульфамид (H2L1) и 4-метил-N-[2-[(E)-3-[4-[3-[(E)-[2-(п-толуолсульфамино)фенил]метиленами-но]пропокси]бутокси]-пропилиминометил]фенил]-бензолсульфамид (H2L2) получены и описаны в работе [4].
Синтез комплексов I и II способом ХС. К раствору 0.33 г (0.5 ммоль) лиганда H2L1 или 0.36 г (0.5 ммоль) лиганда H2L2 в 20 мл метанола добавляли, соответственно, раствор 0.20 г (0.5 ммоль) моногидрата ацетата меди или 0.25 г (0.5 ммоль) тетрагидрата ацетата никеля или 0.25 г (0.5 ммоль) тетрагидрата ацетата кобальта в 10 мл метанола. Смесь кипятили в течение 2 ч. Выпавшие по охлаждении осадки комплексов Iа–Iв и IIа–IIв отфильтровывали, промывали метанолом (2 раза по 2 мл), перекристаллизовывали из смеси метанол–хлороформ (2 : 1) и сушили в вакуум-сушильном шкафу при 150°С.
Синтез комплексов I и II способом ЭС осуществляли по стандартной классической методике [22] c использованием потенциостата EG&GPAR/173 в растворе метанол–ацетонитрил (1 : 1) с платиновым электродом а качестве катода и пластинками металлов (Cu, Co и Ni) в качестве анода. Рабочий раствор (25 мл) содержал 0.33 г (0.5 ммоль) H2L1 или 0.36 г (0.5 ммоль) H2L2, и Et4NСlO4 (0.020 г) в качестве токопроводящей присадки. Электролиз проводили в U-образной стеклянной трубке с неразделенными анодным и катодным пространствами при силе тока 16 мА и начальном напряжении 10 В в течение 1.3 ч. По окончании электролиза образовавшиеся осадки комплексов отфильтровывали, перекристаллизовывали из смеси метанол–хлороформ (2 : 1) и сушили в вакуум-сушильном шкафу при 150°С.
Монокристаллы комплексов Iа–Iв выращивали из смеси метанол–хлороформ (2 : 1). РСА проводили для выпавших из раствора кристаллов без дальнейшего высушивания, вследствие чего получены комплексы с сольватом (MeOH).
Iа: сиренево-красные кристаллы, выход 0.31 г (85% ХС), 0.32 г (89% ЭС). Тпл > 300°С.
| Найдено, %: | С 55.42; | H 5.15; | N 7.48; | Cu 8.50 (ХС). |
| С 55.45; | H 5.25; | N 7.42; | Cu 8.57 (ЭС). | |
| Для С35H40N4O7S2Cu | ||||
| вычислено, %: | С 55.58; | H 5.33; | N 7.41; | Cu 8.40. |
ИК-спектр (ν, см–1): 1634 ν(CH=N), 1259, 1288 νas(SO2), 1135 νs(SO2). µэфф = 1.84 µB (294 К).
Iб: светло-зеленые кристаллы, выход 0.31 г (86% ХС), 0.32 г (90% ЭС). Тпл > 300°С.
| Найдено, %: | С 56.12; | H 5.45; | N 7.50; | Ni 7.92 (ХС). |
| С 56.20; | H 5.38; | N 7.52; | Ni 7.90 (ЭС). | |
| Для С35H40N4O7S2Ni | ||||
| вычислено, %: | С 55.94; | H 5.36; | N 7.46; | Ni 7.81. |
ИК-спектр (ν, см–1): 1625 ν(CH=N), 1260, 1302 νas(SO2), 1133 νs(SO2). µэфф = 3.19 µB (294 К).
Iв: красно-коричневые кристаллы, выход 0.30 г (82% ХС), 0.32 г (90% ЭС). Тпл > 300°С.
| Найдено, %: | С 56.18; | H 5.28; | N 7.32; | Cо 7.95 (ХС). |
| С 56.32; | H 5.20; | N 7.34; | Cо 7.98 (ЭС). | |
| Для С35H40N4O7S2Cо | ||||
| вычислено, %: | С 55.92; | H 5.36; | N 7.45; | Cо 7.84. |
ИК-спектр (ν, см–1): 1624 ν(CH=N), 1256 νas(SO2), 1133 νs(SO2). µэфф = 4.70 µB (294 К).
IIа: сиренево-красный порошок, выход 0.33 г (87% ХС), 0.35 г (90% ЭС). Тпл > 270°С.
| Найдено, %: | С 58.91; | H 5.81; | N 7.35; | Cu 8.30 (ХС). |
| С 58.79; | H 5.69; | N 7.24; | Cu 8.32 (ЭС). | |
| Для С37H44N4O6S2Cu | ||||
| вычислено, %: | С 57.83; | H 5.77; | N 7.29; | Cu 8.27. |
ИК-спектр (ν, см–1): 1629 ν(CH=N), 1257, 1288 νas(SO2), 1136 νs(SO2). µэфф = 2.09 µB (294 К).
IIб: зеленый порошок, выход 0.31 г (80% ХС), 0.33 г (87% ЭС). Тпл > 270°С.
| Найдено, %: | С 58.23; | H 5.79; | N 7.40; | Ni 7.72 (ХС). |
| С 58.29; | H 5.83; | N 7.32; | Ni 7.78 (ЭС). | |
| Для С37H44N4O6S2Ni | ||||
| вычислено, %: | С 58.20; | H 5.81; | N 7.34; | Ni 7.69. |
ИК-спектр (ν, см-1): 1623 ν(CH=N), 1251, 1304 νas(SO2), 1127 νs(SO2). µэфф = 3.34 µB (294 К).
IIв: красно-коричневый порошок, выход 0.31 г (80% ХС), 0.32 г (85% ЭС). Тпл > 270°С.
| Найдено, %: | С 58.23; | H 5.87; | N 7.38; | Co 7.80 (ХС). |
| С 58.20; | H 5.83; | N 7.40; | Co 7.79 (ЭС). | |
| Для С37H44N4O6S2Co | ||||
| вычислено, %: | С 58.18; | H 5.81; | N 7.34; | Co 7.72. |
ИК-спектр (ν, см−1): 1618 ν(CH=N), 1254 νas(SO2), 1129 νs(SO2). µэфф = 4.72 µB (294 К).
Рентгеновская спектроскопия поглощения. Рентгеновские Cu, Ni и Co K-края поглощения IIа, IIб, IIв получили в режиме пропускания на EXAFS-спектрометре станции “Структурного материаловедения” в Курчатовском синхротронном центре (г. Москва) [23]. Энергия электронного пучка, использованного в качестве источника рентгеновского синхротронного излучения, составляла 2.5 ГэВ при токе 100–140 мА. Для монохроматизации рентгеновского излучения использовали двухкристальный Si(111) монохроматор. Рентгеновские спектры обрабатывали стандартными процедурами [24] выделения фона, нормирования на величину скачка K-края и выделения атомного поглощения (μ0), после чего проводили Фурье-преобразование EXAFS (χ)-спектров в интервале волновых векторов фотоэлектронов (k) от 2.5 до 13.0 Å–1 с весовой функцией (k3). Полученные модули Фурье-трансформант (МФТ) представляли собой псевдорадиальное распределение атомов ближайших координационных сфер (КС) вокруг поглощающего атома металла. Пороговую энергию ионизации (E0) выбирали по значению максимума первой производной K-края. Точные значения параметров структуры ближайшего окружения ионов металлов в комплексах определяли путем нелинейной подгонки параметров соответствующих КС при сопоставлении рассчитанного EXAFS-сигнала и выделенного из полного EXAFS-спектра методом Фурье-фильтрации МФТ. Указанную нелинейную подгонку произ-водили с использованием пакета программ IFFEFIT-1.2.11 [25]. Необходимые для построения модельного спектра фазы и амплитуды рассеяния фотоэлектронной волны рассчитывали по программам FEFF7 [26] и атомных координат соединений с близкой атомной структурой. Функцию качества подгонки (Q), минимизация которой проводилась при нахождении параметров структуры ближайшего окружения, рассчитывали по формуле:
Рентгенодифракционные данные для монокристаллов Iа, Iб, Iв, выращенных в смеси метанол–хлороформ (2 : 1), получены с использованием источника синхротронного излучения НИЦ “Курчатовский институт” на станции “Белок” [27] при 100 K в прямой (θ = 0°) геометрии. В сумме около 500 фреймов было снято в режиме ϕ-сканирования. Поглощение учтено по программе Scala [28]. Рентгенодифракционные данные проинтегрированы по программе iMOSFLM [29]. Расшифровка и уточнение структур проведены по программе SHELXTL [30]. Уточнение и анализ структур произведен полноматричным методом наименьших квадратов F 2 в программе Olex2 [31] с помощью программы SHELXL. Атомы водорода расставлены в соответствии с геометрией и остаточными пиками электронной плотности. Характеристики эксперимента и кристаллографические данные для Iа–Iв приведены в табл. 1.
Таблица 1.
Кристаллографические параметры и данные эксперимента кристаллов Iа · Х, Iб · Х, Iв · Х, (Х = MeOH)
| Параметры | Значение | ||
|---|---|---|---|
| Ia ∙ MeOH | Iб ∙ MeOH | Iв ∙ MeOH | |
| Брутто-формула | С35H40N4O7S2Cu | С35H40N4O7S2Ni | С35H40N4O7S2Со |
| М | 756.37 | 751.54 | 751.76 |
| Цвет, габитус | Сиренево-красные пластинки |
Светло-зеленые пластинки | Красно-коричневые пластинки |
| Размер образца, мм | 0.2 × 0.1 × 0.1 | 0.2 × 0.1 × 0.1 | 0.3 × 0.2 × 0.1 |
| Температура, K | 100 | ||
| Сингония | Триклинная | ||
| Пр. гр. | P1 | ||
| a, Å | 11.096(2) | 11.285(2) | 11.303(2) |
| b, Å | 12.542(3) | 12.374(3) | 12.493(3) |
| c, Å | 12.896(3) | 12.925(3) | 12.891(3) |
| α, град | 80.35(3) | 79.96(3) | 80.13(3) |
| β, град | 76.37(3) | 76.22(3) | 75.61(3) |
| γ, град | 81.890(3) | 81.84(3) | 81.92(3) |
| V, Å3 | 1709.7(7) | 1716.5(7) | 1728.0(7) |
| Z | 2 | 2 | 2 |
| ρ(выч.), г/см3 | 1.469 | 1.454 | 1.568 |
| μ, см–1 | 1.10 | 1.00 | 1.08 |
| F(000) | 790 | 788 | 850 |
| Синхротронное излучение (λ, Å) | Rayonix SX165 CCD (0.7937) | ||
| θ, град | 1.8/31.0 | 1.8/31.0 | 1.8/31.0 |
| Интервал индексов h, k, l | –14 ≤ h ≤ 14, –16 ≤ k ≤ 16, –16 ≤ l ≤ 16 |
–14 ≤ h ≤ 14, –15 ≤ k ≤ 16, –16 ≤ l ≤ 16 |
–14 ≤ h ≤ 14, –16 ≤ k ≤ 16, –16 ≤ l ≤ 16 |
| Общее число измеренных oтражений | 39 067 | 27 855 | 46 043 |
| Число независимых отражений | 7783 | 7768 | 7810 |
| Число отражений с I > 2σ(I) | 7326 | 7250 | 7211 |
| Rint | 0.029 | 0.072 | 0.034 |
| (sin θ/λ)max, Å–1 | 0.648 | 0.594 | 0.648 |
| Число уточняемых параметров | 446 | 446 | 447 |
| R (I > 2σ(I)) | R1 = 0.038 wR2 = 0.138 |
R1 = 0.044 wR2 = 0.144 |
R1 = 0.034 wR2 = 0.098 |
| Δρmax/Δρmin, e/Å3 | 0.72/–0.81 | 0.58/–0.73 | 0.50/–0.43 |
Координаты атомов и температурные факторы Iа, Iб, Iв депонированы в Кембриджском банке структурных данных (CCDC № 1910746, 1910747 и 1910748 соответственно; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В продолжение работы [4] по исследованию комплексообразующей способности тетрадентатных азометиновых соединений, производных 2-(N-тозиламино)бензальдегида и соответствующих диоксадиаминов H2L1 и H2L2 методами ХС и ЭС получены комплексы Cu(II), Ni(II), Co(II) Iа–Iв, IIа–IIв.
Строение тетрадентатных лигандов H2L1, H2L2 и комплексов Iа–Iв, IIа–IIв установлено методами элементного анализа, ИК-, ЯМР 1H (для I), рентгеновской спектроскопии поглощения и РСА. Согласно данным элементного анализа, комплексы Iа–Iв имеют составы ML1 ∙ MeOH, IIа–IIв – ML2 независимо от способа синтеза, и одинаковые ИК-спектральные характеристики. Однако преимуществом ЭС по сравнению с ХС являются более “мягкие” условия получения комплексов и увеличение на 5–10% их выходов [32–35]. В ИК-спектрах комплексов исчезают полосы поглощения ν(NH) лигандов H2L1, H2L2 в области 2700–3150 см–1. Полосы поглощения ν(CH=N) 1638 см–1 (H2L1) и 1634 см–1 (H2L2) при образовании комплексов Iа–Iв, IIа–IIв незначительно понижаются до 1618–1629 см–1. Полосы поглощения лиганда H2L1 в области 1336 νas(SO2), 1156 см–1 νs(SO2) и лиганда H2L2 1338 νas(SO2), 1154 см–1 νs(SO2) в комплексах Iа–Iв понижаются до 1256–1288 νas(SO2) и 1133–1135 см–1 νs(SO2), для комплексов IIа–IIв понижаются до 1254–1288 νas(SO2) и до 1127–1136 см–1 νs(SO2) соответственно. Такое спектральное поведение свидетельствует о депротонировании лигандов H2L1, H2L2 и образовании хелатных структур Iа–Iв, IIа–IIв.
Строение соединений Iа–Iв · Х (Х = MeOH) установлено методом РСА. Кристаллы Iа · Х, Iб · Х, Iв · Х изоструктурны. Соединения состава ML1 · · MeOH (Iа · Х, Iб · Х, Iв · Х) близки и весьма сходны с ранее описанными комплексами ZnL · MeOH и CdL · CHCl3 [4]. Незначительные различия в структуре соединений обусловлены, по-видимому, изменением атомного радиуса металла-комплексообразователя. Молекулярное строение комплекса Iа показано на рис. 1, длины связей и валентные углы в координационных полиэдрах металлов приведены в табл. 2.
Рис. 1.
Структура молекулы комплекса Iа в представлении атомов эллипсоидами атомных смещений с 50%-ной вероятностью.
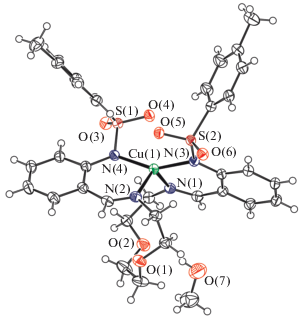
Таблица 2.
Длины связей и валентные углы в координационных полиэдрах комплексов Iа–Iв
| Связь | d, Å | ||
|---|---|---|---|
| Iа (М = Cu) | Iб (М = Ni) | Iв (М = Co) | |
| M(1)–N(1) | 2.0160(16) | 2.0131(16) | 2.0193(15) |
| M(1)–N(2) | 2.0447(16) | 2.0137(16) | 2.0264(15) |
| M(1)–N(3) | 1.9504(15) | 1.9781(15) | 2.0007(14) |
| M(1)–N(4) | 1.9465(16) | 1.9760(16) | 1.9939(15) |
| Угол | ω, град | ||
| N(1)M(1)N(2) | 117.32(6) | 105.91(6) | 112.35(6) |
| N(3)M(1)N(1) | 92.19(6) | 91.41(7) | 92.18(6) |
| N(3)M(1)N(2) | 103.44(6) | 105.76(7) | 107.86(6) |
| N(4)M(1)N(1) | 101.65(7) | 102.53(7) | 105.91(6) |
| N(4)M(1)N(2) | 92.46(7) | 91.58(7) | 93.03(6) |
| N(4)M(1)N(3) | 151.28(6) | 153.96(6) | 144.83(6) |
В молекулах МL1 макроциклический лиганд координирует атом металла тетрадентатно-хелатно четырьмя атомами азота с формированием полиэдра в форме искаженного тетраэдра. Полиэдр Cu(II) несколько более уплощен (двугранный угол между плоскими фрагментами N(1)M(1)N(3) и N(2)M(1)N(4) составляет 69.1° в Ia, 79.2° в Iб и 76.9° в Iв).
Длины связей M–N в комплексах Iа–Iв достаточно близки; можно отметить некоторое закономерное увеличение длин связей M(1)–N(3) и M(1)–N(4) в ряду Cu–Ni–Co (табл. 2).
При координации органического лиганда к иону металла образуются два шестичленных и одиннадцатичленный металлоциклы. Строение шестичленных хелатных циклов близко к плоскому, вследствие сопряжения с соответствующим фенильным кольцом.
Одиннадцатичленные металлоциклы, включающие диоксадиаминовый фрагмент, имеют неплоскую конформацию и не содержат кратных связей.
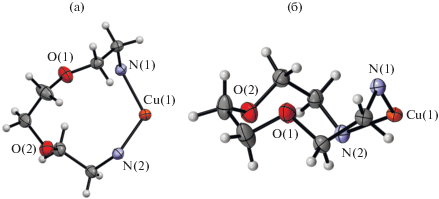
Вид одиннадцатичленного цикла в комплексе Ia представлен на рис. 2. Присутствие атома металла приводит к значительной деформации циклов. Металлоциклы псевдоцентросимметричны при условии, что атому металла противолежит фрагмент CH2–CH2, соединяющий атомы кислорода. Торсионные углы с участием металла находятся в конформации гош-гош-гош, остальные углы – в конформации гош-транс-гош и гош-гош-транс.
Рис. 2.
Вид 11-членного металлхелатного цикла в молекуле комплекса Iа вдоль кристаллографических осей c (а) и b (б).
Во всех структурах из комплексных молекул формируются плоские слои (рис. 3), между которыми размещаются сольватные молекулы метанола, образующие с комплексными молекулами прочные межмолекулярные водородные связи с близкими параметрами (табл. 3). Каких-либо специфических взаимодействий между комплексными молекулами в монокристаллах соединений не обнаружено.
Таблица 3.
Параметры водородных связей в кристаллической структуре соединений Iа–Iв
| Соединение | D–H···A | Расстояние, Å | Угол DHA, град | ||
|---|---|---|---|---|---|
| D–H | H···A | D···A | |||
| Iа | O(7)–H(7A)···O(1) | 0.82 | 1.97 | 2.780(3) | 170 |
| Iб | O(7)–H(7A)···O(1) | 0.82 | 1.97 | 2.772(3) | 167 |
| Iв | O(7)–H(7A)···O(1) | 0.82 | 1.98 | 2.790(2) | 171 |
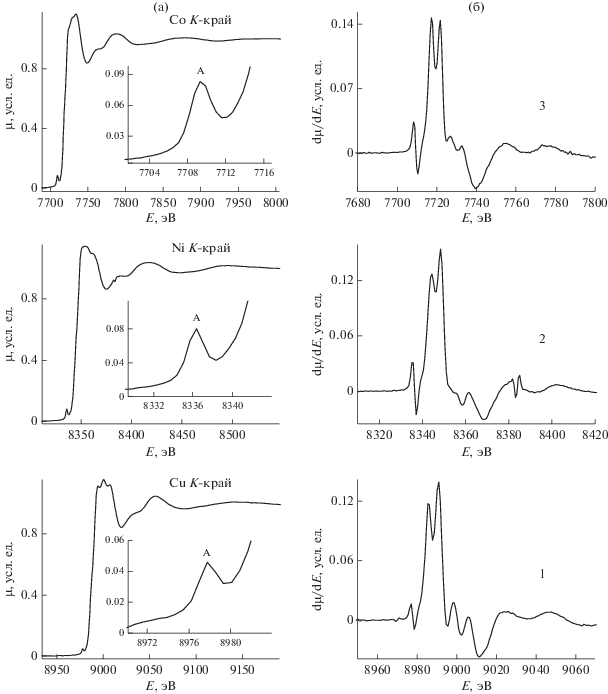
Локальное атомное строение комплексов IIa–IIв определено из анализа XANES и EXAFS соответствующих K-краев поглощения. На рис. 4 показаны рентгеновские Cu-, Ni- и Co K-края поглощения и их первые производные для комплексов IIa, IIб, IIв. Во всех XANES присутствует ярко выраженная предкраевая структура А (вставки к рис. 4), обусловленная 3d–4p смешиванием АО металла, интенсивность которой пропорциональна степени заполнения вакантной 3d-оболочки и симметрией окружения. Форма XANES и особенно первых производных краев, состоящих из двух уширенных максимумов, типична для комплексов с тетраэдрическим окружением поглощающего атома.
Рис. 4.
Рентгеновские Cu-, Ni- и CoK-края поглощения (а), где на вставках показана предкраевая область А, и первые производные краев dμ/dE (б) для комплексов IIа (1), IIб (2), IIв (3).
Количественные характеристики локального атомного строения IIa, IIб, IIв получены из анализа EXAFS Cu-, Ni- и CoK-краев рентгеновских спектров поглощения этих соединений. Из рис. 5 видно, что все МФТ EXAFS состоят из основного пика около r = 1.56 Å, который однозначно соответствует рассеянию на ближайших КС, состоящих из атомов азота лигандов, и пиков на больших расстояниях, отвечающих рассеянию на последующих КС.
Рис. 5.
МФТ Cu (1), Ni (2) и Co (3) K-краев для комплексов IIа, IIб, IIв (сплошная линия – эксперимент, пустые кружки – теория).
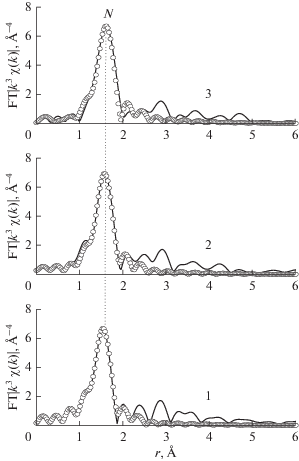
Результаты расчетов параметров локального атомного окружения ионов металлов в IIa–IIв при выборе соответствующих моделей атомного строения координационного узла (табл. 4) указывают на близкие структурные параметры координационного центра в этих комплексах. Вокруг ионов металла на среднем расстоянии 1.98 Å (IIа), 2.00 Å (IIб) и 2.01 Å (IIв) находятся четыре атома азота. Эти расстояния соответствуют значениям длин связей для IIa, IIб, IIв из данных РСА. Значения факторов Дебая–Валлера для ближайших КС несколько выше типичных значений для таких расстояний, но такое увеличение можно объяснить усреднением длин связей для ближайшей КС при односферной подгонке. Таким образом, локальное атомное строение координационных центров комплексов Iа–Iв и IIа–IIв имеет близкие значения структурных параметров, указывая на ее независимость от значения m.
Таблица 4.
Структурные данные локального атомного строения IIа, IIб, IIв, полученные из односферной подгонки EXAFS-данных*
| Соединение | N | R, Å | σ2, Å2 | Атом | Q, % |
|---|---|---|---|---|---|
| IIа | 4 | 1.98 | 0.0045 | N | 0.4 |
| IIб | 4 | 2.00 | 0.0040 | N | 1.4 |
| IIв | 4 | 2.01 | 0.0045 | N | 4.0 |
Комплексы типа I–II парамагнитны. Значения μэфф составляют при комнатной температуре 1.94–2.0 (Cu), 3.19–3.30 (Ni), 4.70–4.72 µB (Co) и практически не меняются с понижением температуры, что свидетельствует о моноядерном тетраэдрическом строении комплексов.
В заключении отметим, что методами химического и электрохимического синтезов получены комплексы Cu(II), Ni(II), Cо(II) тетрадентатных азометиновых соединений продуктов конденсации 2-(N-тозиламино)бензальдегида с 3,4-диокса-1,8-октандиамином и 4,9-диокса-1,12-додекандиамином. Из данных рентгеновской спектроскопии поглощения установлено, что в комплексах с 4,9-диокса-1,12-додекандиамином вокруг ионов металла на средних расстояниях 1.98–2.01 Å находятся четыре атома азота. Рентгеноструктурные исследования для комплексов металлов с 3,4-диокса-1,8-октандиамином показали, что они имеют состав ML1 · MeOH и их кристаллы изоструктурны с незначительными различиями в расстояниях и углах в координационных полиэдрах. В молекулах комплексов макроциклические лиганды тетрадентатно-хелатно координируют атомы металла четырьмя атомами азота с формированием полиэдра в форме искаженного тетраэдра.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Cozzi P.G. // Chem. Soc. Rev. 2004. V. 33. P. 410. https://doi.org/10.1039/b307853c
Gupta K.C., Sutar A.K. // Coord. Chem. Rev. 2008. V. 252. № 12–14. P. 1420. https://doi.org/10.1016/j.ccr.2007.09.005
Pawanoji A.A., Mehta B.H. // Imper. J. Interdiscipl. Res. 2016. V. 2. № 12. P. 448.
Бурлов А.С., Власенко В.Г., Гарновский Д.А. и др. // Журн. неорган. химии. 2014. Т. 59. № 7. С. 934 (Burlov A.S., Vlasenko V.G., Garnovskii D.A. et al. // Russ. J. Inorg. Chem. 2014. V. 59. P. 721). https://doi.org/10.1134/S0036023614070031
Burlov A.S., Vlasenko V.G., Koshchienko Yu.V. et al. // Polyhedron. 2018. V. 144. P. 249. https://doi.org/10.1016/j.poly.2018.01.020
Burlov A.S., Mal’tsev E.I., Vlasenko V.G. et al. // Polyhedron. 2017. V. 133. P. 231. https://doi.org/10.1016/j.poly.2017.05.045
Лысакова Т.П., Бурлов А.С., Власенко В.Г. и др. // Коорд. химия. 2016. Т. 42. № 11. С. 665 (Lysakova T.P., Burlov A.S., Vlasenko V.G. et al. // Russ. J. Coord. Chem. 2016. V. 42. P. 701). https://doi.org/10.1134/S1070328416110075
Бурлов А.С., Власенко В.Г., Кощиенко Ю.В. и др. // Коорд. химия. 2016. Т. 42. № 4. С. 267 (Burlov A.S., Vlasenko V.G., Koshchienko Y.V. et al. // Russ. J. Coord. Chem. 2016. V. 42. P. 267). https://doi.org/10.1134/S1070328416030027
Бурлов А.С., Икорский В.Н., Николаевский С.А. и др. // Журн. неорган. химии. 2008. Т. 53. С. 1677 (Burlov A.S., Ikorskii V.N., Nikolaevskii S.A. et al. // Russ. J. Inorg. Chem. 2008. V. 53. № 10. P. 1566). https://doi.org/10.1134/S0036023608100082
Burlov A.S., Vlasenko V.G., Koshchienko Yu.V. et al. // Polyhedron. 2018. V. 154. P. 123. https://doi.org/10.1016/j.poly.2018.07.053
Бурлов А.С., Кощиенко Ю.В., Икорский В.Н. и др. // Журн. неорган. химии. 2006. Т. 51. С. 1143 (Burlov A.S., Koshchienko Yu.V., Ikorskii V.N. et al // Russ. J. Inorg. Chem. 2006. V.51. № 7. P. 1065). https://doi.org/10.1134/S0036023606070096
Бурлов А.С., Ураев А.И., Икорский В.Н. и др. // Журн. общ. химии. 2008. Т. 78. С. 1002 (Burlov A.S., Uraev A.I., Ikorskii V.N. et al. // Russ. J. Gen. Chem. 2008. V. 78. № 6. P. 1230). https://doi.org/10.1134/S1070363208060224
Barton J.K. // Science. 1986. V. 233. P. 727.
Burrows C.J., Muller J.G. // Chem. Rev. 1998. V. 98. P. 1109. https://doi.org/10.1021/cr960421s
Erkkila K.E., Odom D.T., Barton J.K. // Chem. Rev. 1999. V. 99. P. 2777. https://doi.org/10.1021/cr9804341
Santini C., Pellei M., Gandin V. et al. // Chem. Rev. 2014. V. 114. № 1. P. 815. https://doi.org/10.1021/cr400135x
Peng Li, MeiJu Niu, Min Hong et al. // J. Inorg. Biochem. 2014. V. 137. P. 101. https://doi.org/10.1016/j.jinorgbio.2014.04.005
Singh K., Barwa M.S., Tyagi P. // Eur. J. Med. Chem. 2006. V. 41. P. 147. https://doi.org/10.1016/j.ejmech.2005.06.006
Fonkui T.Y., Ikhile M.I., Ndinteh D.T. et al. // Trop. J. Pharm. Res. 2018. V. 17. P. 2507. https://doi.org/10.4314/tjpr.v17i12.29
Abd El-Halim H.F., Mohamed G.G., Anwar M.N. // A-ppl. Organometal. Chem. 2018. V. 32. P. e3899. https:// https://doi.org//10.1002/aoc.3899
Чернова Н.И., Рябокобылко Ю.С., Брудзь В.Г., Болотин Б.М. // Журн. орган. химии. 1971. Т. 7. № 8. С. 1680 (Chernova N.I., Ryabokobylko Yu.S., Brudz’ V.G., Bolotin B.M. // Zh. Org. Khim.1971. V. 7. P. 1680).
Tuck D.G. // Pure Appl. Chem. 1979. V. 51. № 10. P. 2005. https://doi.org/10.1351/pac197951102005
Chernyshov A.A., Veligzhanin A.A., Zubavichus Ya.V. // Nucl. Instr. Meth. Phys. Res. A. 2009. V. 603. P. 95. https://doi.org/10.1016/j.nima.2008.12.167
Кочубей Д.И., Бабанов Ю.А., Замараев К.И. и др. Рентгеноспектральный метод изучения структуры аморфных тел: EXAFS-спектроскопия. Новосибирск: Наука СО, 1988. 306 с.
Newville M. // J. Synchrotron Rad. 2001. V. 8. P. 96. https://doi.org/10.1107/S0909049500016290
Zabinski S.I., Rehr J.J., Ankudinov A., Alber R.C. // Phys. Rev. 1995. V. 52. P. 2995. https://doi.org/10.1103/PhysRevB.52.2995
Lazarenko V.A., Dorovatovskii P.V., Zubavichus Y.V. et al. // Crystals. 2017. V. 7. № 11. P. 325. https://doi.org/10.3390/cryst7110325
Evans P.R. // Acta Crystallogr. D. 2006. V. 62. P. 72. https://doi.org/10.1107/S0907444905036693
Battye T.G., Kontogiannis L., Johnson O. et al. // Acta Crystallogr. D. 2011. V. 67. P. 271. https://doi.org/10.1107/S0907444910048675
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. № 1. P. 112. https://doi.org/10.1107/S0108767307043930
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Kharisov B.I., Blanco L.M., Garnovskii A.D. et al. // Polyhedron. 1998. V. 17. № 2–3. P. 381. https://doi.org/10.1016/S0277-5387(97)00284-2
Kharisov B.I., Garnovskii D.A., Blanco L.M., Burlov A.S. et al. // Polyhedron. 1999. V. 18. № 7. P. 985. https://doi.org/10.1016/S0277-5387(98)00383-0
Vlasenko V.G., Garnovskii D.A., Aleksandrov G.G. et al. // Polyhedron. 2019. V. 157. P. 6. https://doi.org/10.1016/j.poly.2018.09.065
Гарновский Д.А., Власенко В.Г., Александров Г.Г. и др. // Коорд. химия. 2018. Т. 44. № 5. С. 295 (Garnovskii D.A., Vlasenko V.G., Aleksandrov G.G. et al. // Russ. J. Coord. Chem. 2018. V. 44. P. 596). https://doi.org/10.1134/S1070328418100032
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия