Координационная химия, 2019, T. 45, № 12, стр. 763-768
Трис-(1,5-диметил-1Н-пиразол-4-ил)-4,4,4-трифторбутан-1,3-дионато)(диметанол)тербий(III): синтез, кристаллическая структура и люминесцентные свойства
И. В. Тайдаков 1, *, Р. И. Аветисов 2, Н. П. Дацкевич 1
1 Физический институт им. П.Н. Лебедева РАН
Москва, Россия
2 Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
* E-mail: taidakov@gmail.com
Поступила в редакцию 25.06.2019
После доработки 10.07.2019
Принята к публикации 22.07.2019
Аннотация
Нейтральный комплекс состава [Tb(L3)(MeOH)2] неожиданно получили в качестве основного продукта при взаимодействии Tb(NO3)3 ∙ 6H2O c 1-(1,5-диметил-1Н-пиразол-4-ил)-4,4,4-трифторбутан-1,3-дионом (HL) и CsOH в водно-спиртовой среде при мольном соотношении реагентов 1 : 4 : 4. Состав комплекса подтвержден методом элементного анализа и РСА (СIF file CCDC № 1876652), изучены его люминесцентные свойства комплекса.
Гетероциклические β-дикетоны являются интенсивно исследуемым классом хелатирующих O^O-лигандов, используемых в том числе и для синтеза различных комплексных соединений с редкоземельными элементами [1, 2]. Такие комплексы находят разнообразное практическое применение, например, при разделении продуктов переработки ядерного топлива [3], в качестве люминесцентных материалов [4], для получения неорганических покрытий методом CVD [5] и других приложений. Свойства координационных соединений в значительной степени зависят от природы применяемых лигандов, поэтому задача синтеза новых молекул-комплексообразователей весьма актуальна. Ранее мы описали синтез новых β-дикетонов, несущих пиразольные заместители [6]. Особенностью данных лигандов является способность образовывать не только обычные нейтральные трис- и анионные тетракис-комплексы [7–9], но также необычные полимерные структуры (2D-полимеры) за счет дополнительного комплексообразования по атомам азота пиразольных циклов [10]. В настоящей работе мы описали неожиданное образование нейтрального трис-комплекса тербия в условиях, ранее применявшихся для получения анионных тетракис-комплексов европия с тем же лигандом пиразольного ряда [9].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1-(1,5-Диметил-1Н-пиразол-4-ил)-4,4,4-трифторбутан-1,3-дион (HL) синтезировали по известной методике [6]. Нитрат тербия (99.9%, Aldrich, США) использовали без дополнительной очистки. Остальные реактивы и растворители получали от компании Acros Organics (Бельгия) и использовали без очистки.
Элементный CHN-анализ выполняли на анализаторе Elementar Vario MicroCube (Elementar Analysensysteme GmbH, Германия). Анализ на металл проводили титрованием ЭДТА после кислотного разложения комплекса.
ЭСП записывали на спектрофотометре Shimadzu UV-1800 (Япония), спектры люминесценции и времена жизни возбужденного состояния измеряли на спектрофлуориметре Fluorolog 3-22 (Horiba-Jobin-Yvon, США) для твердых образцов, помещенных в кварцевые ампулы диаметром 4 мм. Абсолютные квантовые выходы люминесценции определяли на том же приборе с использованием интегрирующей сферы (GMP, Швейцария) и усредняли как минимум по результатам 3 измерений. Ошибка измерения квантового выхода ±15%.
Синтез [Tb(L)3(MeOH)2] (I). Навеску 0.937 г (4 ммоль) HL растворяли в 15 мл метанола при нагревании (40°С). Раствор фильтровали, добавляли 4 мл (4 ммол) 1 М водного раствора CsOH. Затем при перемешивании прикапывали раствор 0.446 г (1 ммол) Tb(NO3)3 ∙ 6H2O в 5 мл воды при 40°С, выдерживали в течение 1 ч и оставляли при комнатной температуре на сутки. После этого смесь упаривали досуха в вакууме и экстрагировали 50 мл кипящего MeOH. Раствор фильтровали через тонкий слой целита, упаривали до объема 5 мл и выдерживали до начала кристаллизации. Кристаллы отфильтровывали, промывали 5 мл гексана и сушили до постоянной массы в вакууме (50°С, 0.1 Торр). Выход бесцветного мелкокристаллического порошка 0.673 г (73%).
| Найдено, %: | C 37.94; | H 3.611; | N 9.02; | Tb 13.98. |
| Для C29H32F9N6O8Tb | ||||
| вычислено, %: | C 37.76; | H 3.50; | N 9.11; | Tb 13.63. |
PCA. Бесцветные пластинчатые кристаллы I, пригодные для РСА, получали медленным испарением насыщенного раствора комплекса I в дихлорметане при комнатной температуре. Экспериментальный набор 20 925 отражений получен на дифрактометре Bruker APEX-II CCD при 120 К для кристалла размером 0.10 × 0.05 × 0.05 мм. Структура решена прямым методом, все неводородные атомы локализованы в разностных синтезах электронной плотности и уточнены по F 2 в анизотропно-изотропном приближении. Все вычисления выполнены в программном пакете SHELX [11]. Основные структурные данные и параметры уточнения соединения I приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структуры I
| Параметр | Значение |
|---|---|
| М | 922.53 |
| Температура, К | 120(2) |
| λ(MoKα), Å | 0.71073 |
| Сингония | Триклинная |
| Пр. гр. | P1 |
| a, Å | 11.2242(4) |
| b, Å | 11.6788(4) |
| c, Å | 15.3556(6) |
| α, град | 88.7250(10) |
| β, град | 76.1870(10) |
| γ, град | 64.1270(10) |
| V, Å3 | 1751.00(11) |
| Z | 2 |
| ρ(выч.), г см–3 | 1.750 |
| μ(MoKα), мм–1 | 2.124 |
| F(000) | 916 |
| Область θ, град | 1.37–29.00 |
| Число собранных отражений | 20 925 |
| Число независимых отражений (Rint) | 9286 (0.0274) |
| Число отражений с I > 2σ(I) | 8465 |
| Tmin/Tmax | 0.817/0.902 |
| Число уточненных параметров | 486 |
| GOOF | 1.014 |
| R факторы (I > 2σ(I)) | R1 = 0.0266, wR2 = 0.0604 |
| R факторы (по всему массиву) | R1 = 0.0307, wR2 = 0.0626 |
| Δρmax/Δρmin, e Å–3 | 0.855/–0.813 |
Кристаллографические данные для структуры I депонированы в Кембриджском банке структурных данных (CCDC № 1876652; deposit@ccdc.cam.ac. uk or http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
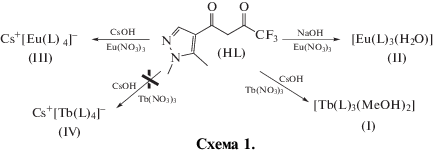
Общепринятым методом синтеза как трис-, так и тетракис-комплексов лантанидов с β-дикетонами является взаимодействие щелочных растворов лигандов с необходимым количеством соли металла, обычно нитрата или хлорида [12, 13]. Как правило, реакцию проводят в водно-спиртовых средах. При мольном соотношении лиганд : основание : соль лантанида = 3 : 3 : 1 образуется трис-комплекс, при соотношении 4 : 4 : 1 – тетракис-комплекс, несущий дополнительный катион на внешней сфере. Однако в случае HL наблюдается более сложная зависимость. Взаимодействие лиганда HL с нитратами тербия и европия в присутствии различных оснований представлено на схеме 1:
Как мы показали ранее, взаимодействие лиганда и Eu(NO3)3, взятых в мольном отношении 3 : 1 в присутствии 3 экв. NaOH, приводит к образованию ожидаемого трис-комплекса II ([Eu(L)3(H2O)]), имеющего структуру 2D-координационного полимера [9], а при отношении 4 : 1 под действием 4 экв. основания (CsOH) образуется тетракис-комплекс цезия III (Cs+[EuL4]–) [10]. При замене CsOH на NaOH или KOH образуется сложная смесь неидентифицированных продуктов взаимодействия. Таким образом, радиус катиона щелочного металла оказывает существенное влияние на стабильность образующихся комплексных анионов. Однако, как оказалось, важна также природа используемого иона лантанида. При попытке синтезировать трис-комплексы тербия по той же методике, что и комплексы европия, получили смесь основных солей и гидроксидов. При увеличении количества лиганда до 4 моль на 1 моль Tb(NO3)3 и, соответственно, 4 экв. основания выделить и идентифицировать продукт удалось только при действии CsOH. Необходимо отметить, что вместо ожидаемого тетракис-комплекса IV (Cs+[TbL4]–) с высоким выходом в качестве единственного продукта в этом случае выделили мономерный трис-комплекс I, в котором нет координации атомов азота пиразольного цикла с атомом металла, как в его аналоге с европием II. Координационная сфера иона Tb3+ достраивается за счет атомов кислорода ОН-групп координированных молекул метанола. Таким образом, небольших изменений ионного радиуса лантанида, видимо, достаточно, чтобы в значительной степени повлиять на устойчивость образующихся координационных соединений и полностью изменить распределение продуктов реакции с данным лигандом. Возможно также, что для установления направления реакции, большое значение имеет стабилизация аниона енольной формы HL и соответствующего комплексного тетракис-аниона за счет специфических Cs···F взаимодействий. Множественные Cs···F контакты наблюдали ранее в кристаллах соединения III.
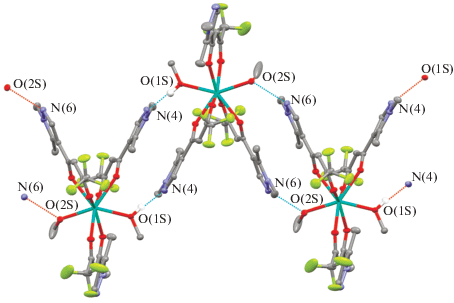
Кристаллическая структура соединения I представлена на рис. 1. В соединении I КЧ иона Tb3+ равно 8, координационный полиэдр {TbO8} лучше всего можно описать как треугольный додекаэдр (TDD-8), что следует из анализа соответствующих длин связей и углов. Примечательно, что кристаллы соединения I не содержат молекул растворителя, кроме входящих в ближайшую координационную сферу иона тербия. Длины связей Tb–O в дикетонатных фрагментах лежат в диапазоне 2.334(2)–2.385(2) Å. Cвязи Tb–O с молекулами метанола длиннее (2.418(3) и 2.420(3) Å). Основные длины связей и валентные углы для соединения I представлены в табл. 2.
Рис. 1.
Молекулярная структура соединения [Tb(L)3(MeOH)2]. Атомы водорода не показаны, тепловые эллипсоиды представлены с вероятностью 50%.
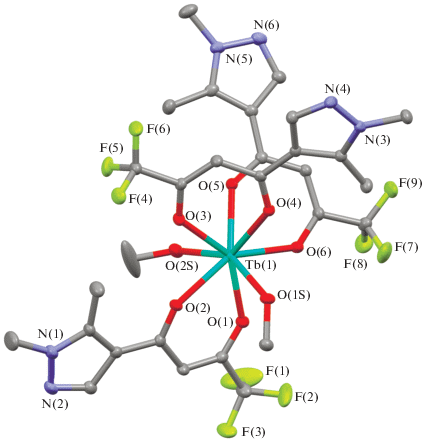
Таблица 2.
Некоторые длины связей (Å) и углы (град) в соединении I
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Tb(1)O(6) | 2.3343(16) | Tb(1)O(5) | 2.3706(16) |
| Tb(1)O(3) | 2.3373(16) | Tb(1)O(4) | 2.3847(15) |
| Tb(1)O(1) | 2.3417(16) | Tb(1)O(2S) | 2.4184(16) |
| Tb(1)O(2) | 2.3600(16) | Tb(1)O(1S) | 2.4198(16) |
| Угол | ω, град | Угол | ω, град |
| O(6)Tb(1)O(3) | 143.34(6) | O(5)Tb(1)O(2S) | 71.18(6) |
| O(6)Tb(1)O(1) | 74.59(6) | O(4)Tb(1)O(2S) | 140.63(6) |
| O(3)Tb(1)O(1) | 142.01(6) | O(6)Tb(1)O(1S) | 88.02(6) |
| O(6)Tb(1)O(2) | 145.61(6) | O(3)Tb(1)O(1S) | 101.00(6) |
| O(3)Tb(1)O(2) | 70.70(6) | O(1)Tb(1)O(1S) | 76.83(6) |
| O(1)Tb(1)O(2) | 71.91(6) | O(2)Tb(1)O(1S) | 77.09(6) |
| O(6)Tb(1)O(5) | 72.60(5) | O(5)Tb(1)O(1S) | 139.76(5) |
| O(3)Tb(1)O(5) | 78.06(6) | O(4)Tb(1)O(1S) | 68.88(5) |
| O(1)Tb(1)O(5) | 127.86(6) | O(2S)Tb(1)O(1S) | 149.02(6) |
| O(2)Tb(1)O(5) | 136.38(5) | O(3)Tb(1)O(4) | 72.26(5) |
| O(6)Tb(1)O(4) | 78.33(6) | O(1)Tb(1)O(4) | 136.58(6) |
| O(2)Tb(1)O(4) | 122.64(6) | O(3)Tb(1)O(2S) | 85.27(6) |
| O(5)Tb(1)O(4) | 72.76(5) | O(1)Tb(1)O(2S) | 79.78(6) |
| O(6)Tb(1)O(2S) | 105.05(6) | O(2)Tb(1)O(2S) | 76.53(6) |
В кристалле отдельные молекулы образуют зигзагообразные цепочки (рис. 2) из-за наличия большого количества контактов различного типа: водородных связей O(1S)–H(1S)···N(4) (О···N 2.725(3) Å) и O(2S)–H(2S)···N(6) (О···N 2.776(3) Å) и целого ряда слабых взаимодействий CF···H(Me), F···C, F···F со средними длинами связей 3.228(3), 3.374(3) и 2.833(2) Å соответственно. Примечательно, что π···π-взаимодействий между отдельными пиразольными циклами в данной структуре не наблюдается.
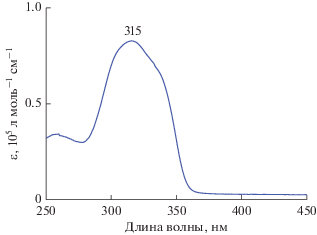
В растворе в ацетонитриле комплекс I обнаруживает интенсивное поглощение УФ-излучения в диапазоне длин волн 250–370 нм, причем максимум приходится на длину волны ~315 нм (рис. 3). Поглощение обусловлено электронными π → π*-переходами в сопряженной системе лиганда, образованной пиразольным циклом и енолизованным дикетонным фрагментом. Слабые линии собственного поглощения иона Tb3+, возникающие за счет запрещенных 4f → 4f-переходов при данных условиях в спектре не проявляются.
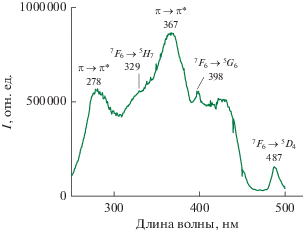
В кристаллическом состоянии комплекс I обладает яркой зеленой люминесценцией под действием УФ-излучения. В спектре возбуждения твердого I наблюдаются сильные полосы поглощения, соответствующие π → π*-переходам в лиганде, которые также можно наблюдать и в растворе, что свидетельствует об эффективной передаче энергии электронного возбуждения от лигандов к центральному иону тербия, а также более слабые полосы, относящиеся к собственному 4f → 4f-поглощению иона Tb3+. Значения длин волн максимумов полос и соответствующие им переходы представлены на рис. 4.
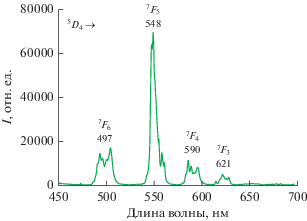
Спектр эмиссии кристаллического комплекса I при возбуждении излучением с длиной волны 365 нм представлен на рис. 5. Люминесценция лиганда не наблюдается, а четыре основных линии могут быть отнесены к переходам в ионе Tb3+, происходящим с резонансного уровня 5D4 на более низкие энергетические уровни 7F6–3. Наиболее интенсивный переход 5D4 → 7F4 соответствует полосе с максимумом при 548 нм (зеленая область спектра). Все полосы достаточно сильно расщеплены, что свидетельствует о низкой симметрии лигандного окружения Tb3+.
Время жизни возбужденного состояния иона Tb3+ (τнабл) в комплексе I равно 305 мкс (при возбуждении на длине волны 365 нм и регистрации на длине волны 548 нм), а абсолютный квантовый выход люминесценции составляет 6.5%. Ранее из спектров фосфоресценции комплекса [Gd(L)3(EtOH)2] при 77 К мы определили значение энергии триплетного уровня T1 лиганда HL (19 800 см–1) и показали, что данный лиганд эффективно сенсибилизирует люминесценцию ионов Eu3+ [14]. Значение энергии для первого возбужденного синглетного уровня S1 лиганда (36 650 см–1) нашли из анализа его спектров поглощения. Поскольку энергия резонансного уровня 5D4 иона Tb3+ составляет 20 430 см–1, невозможно ожидать эффективной передачи энергии по пути T1 → 5D4 в комплексе I. Oднако измеренный квантовый выход люминесценции относительно высок, как и время жизни возбужденного состояния. Это заставляет думать, что в комплексе I pеализуется более сложный путь передачи энергии, чем простой перенос с триплетного уровня лиганда на резонансный уровень иона тербия, видимо, с вовлечением возбужденных синглетных (S1 или более высоких) уровней лиганда, имеющих достаточную энергию. Подобные аномальные пути передачи энергии были рассмотрены еще в классической работе Сато [15], однако для доказательства этого требуются дополнительные фотофизические измерения.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Исакова В.Г., Хлебникова Т.С., Лахвич Ф.A. // Успехи химии. 2010. Т. 79. № 10. С. 849.
Vigato P.A., Peruzzo V., Tamburini S. // Coord. Chem. Rev. 2009. V. 253. P. 1099.
Cary S.K., Livshits M., Kozimor, S.A. et al. // Inorg. Chem. 2018. V. 57. P. 3782.
Bünzli, J.-C.G. // Eur. J. Inorg. Chem. 2017. P. 5058.
Базуев Г.В., Курбатова Л.Д. // Успехи химии. 1993. Т. 62. № 10. С. 981.
Тайдаков И.В., Красносельский С.С. // Химия гетероцикл. соед. 2011. № 6. С. 843.
Тайдаков И.В., Зайцев Б.Е., Красносельский С.С. и др. // Изв. РАН. Сер. хим. 2011. № 8. С. 1570.
Тайдаков И.В., Зайцев Б.Е., Лобанов А.Н. и др. // Журн. неорган. химии. 2012. Т. 57. № 6. С. 943 (Taidakov I.V., Zaitsev B.E., Lobanov A.N. et al. // Russ. J. Inorg. Chem. 2012. V. 57. P. 870). https://doi.org/10.1134/S0036023612060241
Тайдаков И.В., Лобанов А.Н., Старикова З.А и др. // Коорд. химия. 2013. Т. 39. № 9. С. 567 (Taidakov I.V., Krasnosel’skii S.S., Lobanov A.N. et al. // Russ. J. C-oord. Chem. 2013. V. 39. P. 680). https://doi.org/10.1134/S107032841309008X
Тайдаков И.В., Старикова З.А., Красносельский С.С. и др. // Коорд. химия. 2013. Т. 39. № 6. С. 334 (Taidakov I.V., Lobanov A.N., Vitukhnovskii A.G. et al. // Russ. J. Coord. Chem. 2013. V. 39. P. 437). https://doi.org/10.1134/S1070328413050072
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. № 1. C. 112.
Lyle S.J., Witts AD. // Inorg. Chim. Acta. 1971. V. 5. P. 481.
Bauer H., Blanc J., Ross D.L. // J. Am. Chem. Soc. 1964. V. 86. P. 23.
Varaksina E.A., Ambrozevich S.A., Taydakov I.V. et al. // J. Lumin. 2018. V. 196. P. 161.
Sato S., Wado M. // Bull. Chem. Soc. Jpn. 1970. V. 43. P. 1955.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия