Координационная химия, 2019, T. 45, № 12, стр. 720-733
Синтез и структура соли дианилинглиоксима и его биядерных комплексов Zn(II) И Mn(II) с 1,3-бензолдикарбоновой кислотой
Д. Уреке 1, 2, И. Булхак 1, А. Рижа 1, Э. Коропчану 1, 2, П. Боурош 2, 3, *
1 Институт химии
Кишинев, Республика Молдова
2 Тираспольский государственный университет
Кишинев, Республика Молдова
3 Институт прикладной физики
Кишинев, Республика Молдова
* E-mail: bourosh.xray@phys.asm.md
Поступила в редакцию 08.04.2019
После доработки 03.07.2019
Принята к публикации 08.07.2019
Аннотация
Получены монокристаллы дианилинглиоксима (DAnH2) в виде гидратных солей [DAnH3](ClO4) ∙ H2O (I), [DAnH3](ClO4) ∙ 1.25H2O (II). Ситезированы три биядерных соединения цинка(II) и марганца(II) с дианилинглиоксимом и 1,3-бензолдикарбоновой кислотой (1,3-Н2Bdc): [Zn2(DAnH2)2(1,3-Bdc)2(DMF)4] ∙ 2DMF ∙ MeOH · 1.5H2O (III), [Mn2(DAnH2)2(1,3-Bdc)2(DMF)4] · 2DMF (IV) и {[Mn2(DAnH2)2(1,3-Bdc)2(DMF)2(CH3OH)2] [Mn2(DAnH2)2(1,3-Bdc)2(DMF)4] ∙ 2CH3OH} (V). Состав и строение соединений I–V подтверждены методами ИК-спектроскопии и РСА (CIF files CCDC № 1906360 (I), 1906362 (II), 1906361 (III), 1906363 (IV), 1906364 (V)). Последним показано, что DAnH2 координируется к ионам металлов хелатно-бидентатным способом, а (1,3-Вdc)2– – бидентатно-мостиковым, образуя биядерные структуры. К каждому атому металла координируется один нейтральный DAnH2, как и большинство α-диоксимов, через два атома азота, и два аниона (1,3-Вdc)2– – каждый через один атом кислорода. Координационные полиэдры металлов в III–V достроены атомами кислорода DMF и CH3OH.
α-Диоксимы широко используются в качестве хелатирующих агентов в координационной химии с начала 1900-х гг. [1–3]. Из-за двух оксимных групп в этих лигандах при получении координационных соединений необходимо было учитывать три геометрических изомера: анти-/цис- (E,E), амфи- (E,Z) и син-/транс- (Z,Z) [4, 5]. Структурные результаты из Кембриджского банка структурных данных (КБСД) [6] подтвердили, что в диоксиматных соединениях чаще всего для координации этих лигандов используется N,N-хелатирующий способ, стабилизирующий (E,E) анти-форму.
Cтруктура диоксиматов переходных металлов определяется многими факторами: природа и степень окисления комплексообразователя, свoйства самого диоксима, рН среды и др. Известны диоксиматы никеля(II), палладия(II) и платины(II) с квадратной координацией [7], биядерные меди(II) с квадратно-пирамидальным [8], железа(II) [9], железа(III) [10], кобальта(II) [5], кобальта(III) [11, 12], никеля(III) [13] с октаэдрическим строением. Во всех упомянутых комплексах два оксимных лиганда координируются как моноанионы, расположенные примерно в одной плоскости с образованием достаточно сильных внутримолекулярных водородных связей (ВС) О–Н∙∙∙О. Описаны также комплексы железа(II) [14], никеля(II), кобальта(II), меди(II) [15–17] и меди(I) [18], полученые в сильнo-кислой среде, в которых молекулы диоксима не депротонируются и координируются без образования подобных водородных связей с различной ориентацией ОН-групп. Описаны одноядерные диоксиматы Zn(II) и Cd(II) [19], двуядерные комплексы Co(III), Cu(II), Zn(II) и Cd(II) с использованием дополнительных бидентатных пиридиновых лигандов [20–22], а также координационные полимеры [23]. Известны также комплексы переходных металлов би- и полиядерного типа Zn(II), Cd(II), Mn(II), Co(III) и Cu(II) со смешанными лигандами, включаяющие диоксимы, а также ди- или трикарбоновые кислоты [24, 25]. Однако координационные соединения марганца(II) и цинка(II) биядерного типа с диоксимами, в том числе с дианилинглиоксимом, изучены в меньшей степени. Такие комплексы представляют интерес с точки зрения их биологической активности, например, их антибактериальных и фунгицидных свойств [26–28].
Настоящая работа посвящена синтезу и кристаллической структуре биядерных координационных соединений марганца(II) и цинка(II) на основе дианилинглиоксима (DAnH2) и 1,3-бензолдикарбоновой кислотой (1,3-Н2Вdc).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза использовали комерческие реактивы и растворители “x. ч.” без дополнительной очистки.
Дианилинглиоксим получали конденсацией дихлорглиоксима с анилином по методике [26].
ИК-спектр (ν, cм–1): 3370 ср, 3057 с, 3039 пл, 2977 о. сл, 2903 ср, 2833 пл, 2780 с, 2087 сл. ш, 1939 сл, 1871 сл. ш, 1794 сл, 1744 сл. ш, 1637 о.с, 1596 о. с, 1494 о. с, 1475 пл, 1432 о. с, 1354 с, 1292 ср, 1272 с, 1218 ср, 1183 сл, 1110 о. сл, 1074 ср, 1026 сл, 1004 сл, 971 о. с, 909 ср, 884 ср, 804 сл. ш, 752 с, 733 ср, 711 сл, 689 о. с, 619 о. сл, 605 ср, 588 ср, 508 пл, 503 ср, 487 ср, 441 ср, 425 пл, 407 ср.
Получить монокристалы дианилинглиоксима с параметрами, пригодными для РСА, не удалось. Однако при попытке синтезировать комплексы кадмия с дианилинглиоксимом получили два типа бесцветных кристаллов состава [DAnH3]ClO4 ∙ Н2О (I) и [DAnH3]ClO4 ∙ 1.25H2O (II), различающиеся лишь соотношением катион : анион : количество молекул воды.
Синтез [Zn2(DAnH2)2(1,3-Вdc)2(DMF)4] ∙ 2DMF ∙ ∙ MeOH · 1.5H2O (III). Смесь из 0.054 г (0.2 ммoля) DAnH2 и 0.022 г (0.1 ммoля) Zn(CH3COO)2 · 2H2O растворяли в 12 мл смеси диметилформамид–метанол в объемном соотношении 1 : 1. К полученному раствору при постоянном перемешивании добавляли раствор 0.034 г (0.2 ммoля) 1,3-H2Вdc в 3 мл метанола. Реакционную смесь светло-желтой окраски перемешивали еще 10–15 мин, после чего раствор фильтровали и фильтрат оставляли при комнатной температуре для кристаллизации. Через 30 сут образовывались блочные бесцветные кристаллы. Продукт растворим в DMSO, нерастворим в DMF, метаноле, воде, диэтиловом эфире.
| Найдено, %: | C 51.04; | H 5.77; | N 13.34; | Zn 8.89. |
| Для C63H85N14O20.5Zn2 | ||||
| вычислено, %: | C 50.53; | H 5.72; | N 13.11; | Zn 8.74. |
ИК-спектр (ν, cм–1): 3317 ср, 3068 сл, 3045 о. сл, 2930 ср, 2807 о. сл, 2310 ср. ш, 1869 ср. ш, 1672 пл, 1649 о.с, 1599 с, 1540 ср, 1497 с, 1470 ср, 1458 ср, 1435 ср, 1374 о.с, 1315 сл, 1297 ср, 1253 ср, 1179 сл, 1155 сл, 1104 ср, 1087 ср, 1080 пл, 1062 сл, 994 с, 949 ср, 911 ср, 892 ср, 868 сл, 837 сл, 805 ср, 749 с, 707 с, 699 с, 677 ср, 658 ср, 633 ср, 602 ср, 553 о. сл, 518 ср, 493 ср, 451 ср, 413 сл.
Синтез [Mn2(DAnH2)2(1,3-Вdc)2(DMF)4] · 2DMF (IV). В 12 мл смеси растворителей диметилформамид–этанол в объемном соотношении 1 : 1 растворяли 0.054 г (0.2 ммоля) DAnH2 и 0.024 г (0.1 ммоля) Mn(CH3COO)2 · 4H2O. К раствору слабо-желтого цвета прибавляли при комнатной температуре 0.034 г (0.2 ммоля) 1,3-H2Вdc, растворенного в 3 мл этилового спирта, после чего цвет менялся на светло-коричневый. Раствор перемешивали в течение 20 мин при комнатной температуре. Образовавшийся осадок желтого цвета отфильтровывали, фильтрат оставляли при комнатной температуре для кристаллизации. Через три недели в фильтрате образовывались кристаллы желтого цвета в виде призм, пригодные для РСА. Продукт растворим в DMSO, нерастворим в DMF, метаноле, воде, диэтиловом эфире.
| Найдено, %: | C 52.77; | H 5.38; | N 13.88; | Mn 7.81. |
| Для C62H78N14O18Mn2 | ||||
| вычислено, %: | C 52.54; | H 5.55; | N 13.84; | Mn 7.75. |
ИК-спектр (ν, cм–1): 3622 сл, 3296 ср, 3078 о. сл, 2932 сл, 2540 ср. ш, 2331 ср. ш, 1877 сл. ш, 1649 с, 1628 пл, 1599 с, 1539 ср, 1497 ср, 1472 ср, 1453 сл, 1436 ср, 1419 сл, 1376 о.с, 1309 сл, 1295 сл, 1178 сл, 1157 сл, 1112 ср, 1096 сл, 1078 ср, 994 с, 1112 пл, 949 ср, 909 ср, 893 сл, 835 сл, 807 сл, 802 сл, 752 с, 708 с, 696 с, 679 ср, 633 сл, 603 сл, 546 сл, 513 ср, 490 ср, 443 ср.
Синтез {[Mn2(DAnH2)2(1,3-Вdc)2(DMF)2(CH3OH)2]- [Mn2(DAnH2)2(1,3-Вdc)2(DMF)4] ∙ 2CH3OH} (V). DAnH2 массой 0.054 г (0.2 ммоля) и Mn(CH3COO)2 · · 4H2O массой 0.024 г (0.1 ммоля) растворяли в 12 мл смеси диметилформамид–метанол в объемном соотношении 1 : 1. К полученному раствору желтого цвета при комнатной температуре и постоянном перемешивании прибавляли раствор 0.034 г (0.2 ммoля) 1,3-H2Вdc в 3 мл метанола. При перемешивании реакционной массы в течение 10–15 мин наблюдали образование осадка слабо-желтого цвета, который отделяли путем фильтрования, а фильтрат оставляли для кристаллизации при комнатной температуре. Через 26 сут в фильтрате образовывались кристаллы того же цвета в виде призм, пригодные для РСА. Продукт растворим в DMSO, нерастворим в DMF, метаноле, воде, диэтиловом эфире.
| Найдено, %: | C 52.63; | H 5.17; | N 12.54; | Mn 8.73. |
| Для C110H130N22O34Mn4 | ||||
| вычислено, %: | C 52.34; | H 5.19; | N 12.21; | Mn 8.71. |
ИК-спектр (ν, cм–1): 3617 сл, 3400 сл. ш, 3302 ср, 3063 о. сл, 2937 сл. ш, 2479 сл. ш, 1840 ср. ш, 1649 о.с, 1628 пл, 1598 ср, 1539 ср, 1497 ср, 1472 ср, 1436 ср, 1419 сл, 1376 о.с, 1295 ср, 1281 сл, 1254 сл, 1177 сл, 1156 сл, 1114 ср, 1095 сл, 1078 ср, 1027 пл, 1007 пл, 999 с, 949 ср, 920 сл, 906 ср, 892 ср, 832 сл. ш, 812 сл, 805 сл, 751 о.с, 735 пл, 708 о.с, 698 с, 680 ср, 666 ср, 659 пл, 634 ср, 603 ср, 552 сл, 514 ср, 490 ср, 477 ср, 442 ср, 432 пл.
ИК-спектры регистрировали на спектрометре Perkin-Elmer 100 FT-IR в диапазоне 4000–400 см–1 (суспензии в вазелиновом масле) и АТР в диапазоне 4000–650 см–1.
РСА. Экспериментальные данные для I–V получены при комнатной температуре 293(2) К на дифрактометре Xсalibur Е (МоКα-излучение, графитовый монохроматор). Параметры элементарной ячейки, уточненные по всему массиву, и остальные экспериментальные данные получены, используя комплекс программ CrysAlis Oxford Diffraction [29]. Структура соединений решена прямыми методами и уточнена методом наименьших квадратов в анизотропном полноматричном варианте для неводородных атомов (SHELX-97) [30]. Позиции атомов водорода сольватных молекул воды определены из разностного Фурье синтеза, остальных атомов Н рассчитаны геометрически. Все атомы Н уточнены изотропно в модели “жесткого тела” c Uэфф = 1.2 Uэкв или 1.5 Uэкв соответствующих атомов O, N и C. Характеристики эксперимента и уточнения структуры соединений I–V приведены в табл. 1, некоторые межатомные расстояния и валентные углы – в табл. 2 и 3, геометрические параметры ВС – в табл. 4.
Таблица 1.
Кристаллографические данные и характеристики эксперимента для структуры I–V
| Параметры | Значение | ||||
|---|---|---|---|---|---|
| I | II | III | IV | V | |
| Эмпирическая формула | C14H17N4O7Cl | C56H70N16O28.4Cl4 | C63H85N14O20.5Zn2 | C62H78N14O18Mn2 | C110H130N22O34Mn4 |
| М | 388.77 | 1563.48 | 1497.19 | 1417.26 | 2524.12 |
| Сингония | Mоноклинная | Триклинная | Mоноклинная | Mоноклинная | Триклинная |
| Пр. гр. | P21/c | P1 | P2/n | P21/n | P1 |
| Параметры элементарной ячейки | |||||
| a, Å | 12.2803(7) | 10.7746(7) | 14.1178(5) | 9.4953(5) | 13.9891(9) |
| b, Å | 10.6201(7) | 12.8312(8) | 9.1592(4) | 13.7464(5) | 14.6400(8) |
| c, Å | 14.2762(6) | 26.7126(16) | 28.4951(9) | 26.9683(13) | 16.2122(9) |
| α, град | 90 | 89.810(5) | 90 | 90 | 93.752(4) |
| β, град | 92.367(5) | 84.983(5) | 90.826(3) | 93.122(5) | 113.819(6) |
| γ, град | 90 | 85.435(5) | 90 | 90 | 94.536(5) |
| V, Å3 | 1860.27(18) | 3667.2(4) | 3684.3(2) | 3514.8(3) | 3010.6(3) |
| Z | 4 | 2 | 2 | 2 | 1 |
| ρ(выч.), г/см3 | 1.388 | 1.416 | 1.350 | 1.339 | 1.392 |
| μ, мм–1 | 0.248 | 0.253 | 0.729 | 0.436 | 0.497 |
| F(000) | 808 | 1626 | 1570 | 1484 | 1316 |
| Размеры кристалла, мм | 0.35 × 0.18 × 0.01 | 0.35 × 0.15 × 0.08 | 0.42 × 0.36 × 0.22 | 0.35 × 0.2 × 0.08 | 0.2 × 0.18 × 0.06 |
| Область θ, град | 2.94–25.50 | 2.92–25.50 | 3.00–25.05 | 2.96–25.05 | 2.97–25.05 |
| Интервалы индексов отражений | –14 ≤ h ≤ 14, –12 ≤ k ≤ 12, –17 ≤ l ≤ 11 |
–11 ≤ h ≤ 13, –15 ≤ k ≤ 15, –20 ≤ l ≤ 32 |
–16 ≤ h ≤ 16, –10 ≤ k ≤ 9, –33 ≤ l ≤ 25 |
–11 ≤ h ≤ 6, –16 ≤ k ≤ 16, –32 ≤ l ≤ 28 |
–15 ≤ h ≤ 16, –17 ≤ k ≤ 16, –19 ≤ l ≤ 14 |
| Число измеренных/независимых рефлексов (Rint) | 6375/3446 (0.0370) | 20 663/13 525 (0.0442) | 11 720/6486 (0.0378) | 13 487/6204 (0.0583) | 16 374/10 611 (0.0413) |
| Число рефлексов с I > 2σ(I) | 1907 | 6545 | 4493 | 3230 | 6024 |
| Заполнение, % | 99.4 (θ =25.50°) | 99.1 (θ = 25.50°) | 99.5 (θ = 25.05°) | 99.7 (θ = 25.05°) | 99.5 (θ = 25.05°) |
| Число уточняемых параметров | 235 | 955 | 470 | 440 | 757 |
| GOOF | 1.005 | 1.000 | 1.003 | 1.005 | 1.000 |
| R факторы (I > 2σ(I)) | R1 = 0.0619, wR2 = 0.1542 |
R1 = 0.0818, wR2 = 0.1921 |
R1 = 0.0648, wR2 = 0.1670 |
R1 = 0.0713, wR2 = 0.1330 |
R1 = 0.0722, wR2 = 0.1413 |
| R факторы (по всему масиву) | R1 = 0.1306, wR2 = 0.1817 |
R1 = 0.1656, wR2 = 0.2386 |
R1 = 0.0991, wR2 = 0.1911 |
R1 = 0.1440, wR2 = 0.1669 |
R1 = 0.1367, wR2 = 0.1714 |
| Δρmax/Δρmin, e Å–3 | 0.260/–0.236 | 0.529/–0.406 | 0.589/–0.447 | 0.452/–0.393 | 0.697*–0.506 |
Таблица 2.
Межатомные расстояния (d) и валентные углы (ω) в координационных полиэдрах структуры III–V
| Связь | d, Å | |||
|---|---|---|---|---|
| III (М = Zn(1)) |
IV (M = Mn(1)) |
V (M = Mn(1)/Mn(2)) |
||
| A | B | |||
| M–N(1) | 2.168(3) | 2.310(3) | 2.320(3) | 2.306(3) |
| M–N(2) | 2.302(2) | 2.371(3) | 2.322(4) | 2.347(4) |
| M–O(3) | 2.122(4) | 2.172(4) | 2.131(4) | 2.173(4) |
| M–O(4) | 2.207(5) | 2.189(4) | 2.251(4) | 2.184(4) |
| M–O(5) | 2.014(3) | 2.086(3) | 2.152(4) | 2.110(3) |
| M–O(7)#1 | 2.035(3) | 2.102(3) | 2.106(3) | 2.126(3) |
| Угол | ω, град | |||
| III (М = Zn(1)) |
IV (M = Mn(1)) |
V (M = Mn(1)/Mn(2)) |
||
| A | B | |||
| N(1)MN(2) | 71.6(1) | 69.0(1) | 69.9(1) | 68.7(1) |
| N(1)MO(3) | 91.7(1) | 85.3(2) | 90.4(1) | 91.4(1) |
| N(1)MO(4) | 85.0(2) | 85.4(2) | 89.4(1) | 89.6(2) |
| N(1)MO(5) | 169.0(1) | 166.3(1) | 96.8(1) | 161.8(1) |
| N(1)MO(7)#1/#2 | 100.9(1) | 99.3(1) | 168.7(2) | 97.3(1) |
| N(2)MO(3) | 90.9(2) | 91.3(2) | 96.4(2) | 87.9(1) |
| N(2)MO(4) | 86.3(2) | 86.2(1) | 84.6(1) | 99.4(1) |
| N(2)MO(5) | 97.7(1) | 97.3(1) | 163.8(1) | 93.5(1) |
| N(2)MO(7)#1/#2 | 172.5(1) | 168.0(1) | 99.1(1) | 165.1(1) |
| O(3)MO(4) | 176.0(2) | 170.7(2) | 178.9(2) | 172.5(2) |
| O(3)MO(5) | 91.0(2) | 96.8(2) | 92.7(1) | 91.4(1) |
| O(3)MO(7)#1/#2 | 90.2(2) | 90.5(2) | 93.3(1) | 87.5(1) |
| O(4)MO(5) | 91.9(2) | 92.4(2) | 86.2(2) | 90.0(2) |
| O(4)MO(7)#1/#2 | 92.3(2) | 90.1(2) | 87.0(1) | 84.9(1) |
| O(5)MO(7)#1/#2 | 89.7(1) | 94.2(1) | 93.7(1) | 100.8(1) |
Таблица 3.
Межатомные расстояния (d) и валентные углы (ω) в фрагментах органических катионов I, II и координированных лигандов III–V
| Связь | d, Å | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| I | II | III | IV | V | |||||
| A | B | C | D | A | B | ||||
| N(1)–C(1) | 1.299(4) | 1.293(5) | 1.287(5) | 1.289(6) | 1.281(6) | 1.288(5) | 1.293(5) | 1.286(6) | 1.284(5) |
| N(1)–O(1) | 1.383(4) | 1.413(4) | 1.402(4) | 1.380(4) | 1.414(4) | 1.397(4) | 1.396(4) | 1.398(4) | 1.394(4) |
| N(2)–C(2) | 1.290(5) | 1.302(5) | 1.305(5) | 1.292(5) | 1.316(5) | 1.289(5) | 1.294(5) | 1.292(5) | 1.289(5) |
| N(2)–O(2) | 1.408(4) | 1.392(4) | 1.381(4) | 1.416(4) | 1.380(4) | 1.396(4) | 1.399(4) | 1.401(4) | 1.400(4) |
| C(1)–C(2) | 1.492(5) | 1.509(6) | 1.487(6) | 1.502(6) | 1.473(6) | 1.502(5) | 1.489(5) | 1.488(6) | 1.481(6) |
| Угол | ω, град | ||||||||
| I | II | III | IV | V | |||||
| A | B | C | D | A | B | ||||
| C(1)N(1)O(1) | 117.4(3) | 107.8(3) | 108.4(3) | 117.2(4) | 109.8(4) | 112.0(3) | 111.4(3) | 110.6(3) | 111.3(3) |
| C(2)N(2)O(2) | 109.5(3) | 117.1(3) | 117.9(4) | 109.5(3) | 116.9(4) | 111.1(3) | 110.5(3) | 111.2(4) | 110.3(4) |
| N(1)C(1)C(2) | 114.1(3) | 113.4(4) | 113.6(4) | 114.2(5) | 113.9(5) | 113.1(3) | 112.9(4) | 113.9(4) | 113.7(4) |
| N(2)C(2)C(1) | 113.4(3) | 113.7(4) | 115.3(4) | 113.2(4) | 115.1(4) | 111.8(4) | 113.0(4) | 112.9(4) | 113.3(4) |
Таблица 4.
Геометрические параметры внутри- и межмолекулярых водородных связей в структуре I–V
| Контакт D–H⋅⋅⋅A | Расстояние, Å | Угол DHA, град | Координаты атомов А | ||
|---|---|---|---|---|---|
| D–H | H···A | D···A | |||
| I | |||||
| N(1)–H···O(1w) | 0.89 | 1.79 | 2.677(4) | 174 | x, y, z |
| N(3)–H···O(5) | 0.86 | 2.26 | 3.082(4) | 161 | –x + 1, –y + 2, –z + 1 |
| N(4)–H···O(5) | 0.86 | 2.22 | 3.027(4) | 157 | –x + 1, y – 1/2, –z + 3/2 |
| O(1)–H···N(2) | 0.82 | 1.87 | 2.684(4) | 175 | –x + 1, –y + 2, –z + 1 |
| O(2)–H···O(3) | 0.82 | 2.09 | 2.895(5) | 168 | x, y, z |
| O(1w)–H(1)···O(4) | 0.82 | 2.03 | 2.812(4) | 159 | x, y, z |
| O(1w)–H(2)···O(6) | 0.92 | 2.17 | 3.016(4) | 153 | x, –y + 3/2, z – 1/2 |
| O(1w)–H(2)···O(3) | 0.92 | 2.40 | 3.144(4) | 138 | x, –y + 3/2, z – 1/2 |
| II | |||||
| N(2A)–H···O(1w) | 1.06 | 1.70 | 2.716(5) | 159 | x, y, z |
| N(3A)–H···O(5B) | 0.86 | 2.34 | 3.105(6) | 148 | x, y, z |
| N(4A)–H···O(6B) | 0.86 | 2.10 | 2.860(5) | 146 | x + 1, y, z |
| N(2B)–H···O(3w) | 0.74 | 2.04 | 2.743(5) | 158 | x, y, z |
| N(3B)–H···O(5A) | 0.86 | 2.39 | 3.089(5) | 139 | x – 1, y, z |
| N(3B)–H···O(6w) | 0.86 | 2.37 | 3.07(2) | 138 | x – 1, y, z |
| N(4B)–H···O(6A) | 0.86 | 2.40 | 3.102(5) | 139 | x, y, z |
| N(4B)–H···O(4A) | 0.86 | 2.41 | 3.189(6) | 151 | x, y, z |
| N(1C)–H···O(4w) | 0.91 | 1.74 | 2.648(6) | 175 | x, y, z |
| N(2D)–H···O(2w) | 0.84 | 1.83 | 2.662(5) | 168 | –x + 1, –y + 1, –z |
| N(4D)–H···O(6C) | 0.86 | 2.47 | 3.101(7) | 131 | x – 1, y, z |
| N(4D)–H···O(4C) | 0.86 | 2.37 | 3.157(6) | 153 | x – 1, y, z |
| O(1A)–H···N(1D) | 0.82 | 1.97 | 2.791(5) | 175 | –x + 1, –y + 1, –z |
| O(2A)–H···N(1A) | 0.82 | 1.86 | 2.677(4) | 180 | –x + 2, –y + 2, –z |
| O(1B)–H···O(5w) | 0.82 | 1.83 | 2.653(5) | 177 | x – 1, y, z |
| O(2B)–H···O(4A) | 0.82 | 1.91 | 2.722(6) | 170 | –x + 1, –y + 2, –z + 1 |
| O(1C)–H···N(2C) | 0.82 | 1.83 | 2.651(5) | 175 | –x + 1, –y + 1, –z + 1 |
| O(2C)–H···N(1B) | 0.81 | 1.93 | 2.744(5) | 177 | –x + 1, –y + 1, –z + 1 |
| O(1D)–H···O(1A) | 0.82 | 2.36 | 3.089(4) | 149 | x, y – 1, z |
| O(2D)–H···O(4C) | 0.82 | 1.86 | 2.675(7) | 174 | –x + 1, –y + 1, –z |
| O(1w)–H(1)···O(5C) | 0.85 | 2.32 | 3.078(9) | 149 | x, y + 1, z |
| O(1w)–H(2)···O(2B) | 0.85 | 2.26 | 3.108(7) | 179 | –x + 1, –y + 2, –z |
| O(2w)–H(2)···O(3B) | 0.82 | 2.07 | 2.870(6) | 167 | x, y, z |
| O(3w)–H(1)···O(5A) | 0.89 | 2.16 | 3.047(7) | 175 | –x + 1, –y + 2, –z + 1 |
| O(3w)–H(2)···O(2C) | 0.85 | 2.19 | 3.040(6) | 179 | –x + 1, –y + 1, –z + 1 |
| O(4w)–H(1)···O(5w) | 0.88 | 1.91 | 2.764(5) | 164 | x, y, z |
| O(4w)–H(2)···O(3A) | 0.85 | 2.26 | 3.115(7) | 180 | x, y, z |
| O(5w)–H(1)···O(5D) | 1.06 | 2.01 | 3.06(1) | 170 | –x + 1, –y + 1, –z + 1 |
| O(5w)–H(2)···N(2C) | 0.88 | 2.41 | 3.286(6) | 171 | x, y, z |
| O(5w)–H(2)···O(2C) | 0.88 | 2.20 | 2.952(6) | 142 | x, y, z |
| O(6w)–H(1)···O(4D) | 0.91 | 2.01 | 2.92(2) | 176 | x + 1, y, z |
| O(6w)–H(2)···O(5A) | 0.77 | 2.03 | 2.80(2) | 178 | x, y, z |
| III | |||||
| N(3)–H···O(1) | 0.86 | 2.33 | 3.159(5) | 162 | –x + 5/2, y, –z + 1/2 |
| N(4)–H···O(2) | 0.86 | 2.25 | 3.087(5) | 164 | –x + 3/2, y, –z + 1/2 |
| O(1)–H···O(8) | 0.82 | 1.71 | 2.508(4) | 163 | –x + 2, –y + 1, –z + 1 |
| O(2)–H···O(6) | 0.82 | 1.74 | 2.523(4) | 158 | x, y, z |
| O(1M)–H···O(1) | 0.85 | 2.39 | 3.19(3) | 178 | x – 1, y, z |
| O(1w)–H(1)···O(1w) | 0.96 | 2.56 | 3.39(6) | 144 | –x + 1/2, y, –z + 1/2 |
| O(3w)–H(1)···O(3w) | 0.98 | 1.82 | 2.75(8) | 158 | –x + 1/2, y, –z + 1/2 |
| IV | |||||
| O(2)–H···O(6) | 0.82 | 1.73 | 2.539(4) | 171 | x, y, z |
| O(1)–H···O(8) | 0.82 | 1.72 | 2.522(4) | 166 | –x + 1, –y + 2, –z + 1 |
| N(4)–H···O(1) | 0.86 | 2.14 | 2.960(4) | 159 | –x + 1/2, y–1/2, –z + 3/2 |
| N(3)–H···O(2) | 0.86 | 2.34 | 3.179(4) | 167 | –x + 1/2, y + 1/2, –z + 3/2 |
| V | |||||
| N(3A)–H···O(8B) | 0.86 | 2.24 | 3.007(5) | 148 | –x, –y + 1, –z |
| N(4A)–H···O(2B) | 0.86 | 2.22 | 3.044(5) | 162 | x, y + 1, z |
| N(3B)–H···O(6A) | 0.86 | 2.41 | 3.258(5) | 171 | x, y, z |
| N(4B)–H···O(2A) | 0.86 | 2.27 | 3.085(5) | 158 | x, y – 1, z |
| O(1A)–H···O(6A) | 0.82 | 1.81 | 2.626(5) | 172 | x, y, z |
| O(2A)–H···O(8A) | 0.82 | 1.71 | 2.524(4) | 170 | –x + 2, –y + 2, –z + 1 |
| O(4A)–H···O(1M) | 0.93 | 1.78 | 2.689(6) | 164 | x, y, z |
| O(1B)–H···O(8B) | 0.82 | 1.73 | 2.549(4) | 173 | –x, –y + 1, –z |
| O(2B)–H···O(6B) | 0.82 | 1.67 | 2.481(5) | 171 | x, y, z |
| O(1M)–H···O(5A) | 0.79 | 2.04 | 2.823(6) | 176 | x, y, z |
Позиционные и тепловые параметры атомов соединений I–V депонированы в КБСД (CIF files CCDC № 1906360 (I), 1906362 (II), 1906361 (III), 1906363 (IV), 1906364 (V)); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
ИК-спектры исследуемых соединений сложные, однако они несут ценную информацию о составе комплексов, о способе координации лигандов к иону металла, о взаимодействии лигандов, об образовании ВС и др. В спектре DAnH2 проявляется довольно узкая полоса поглощения средней интенсивности при 3370 см–1, которую можно отнести к колебаниям ν(NH) [31]. Интенсивные полосы поглощения при 3057 и 2780 см–1, вероятно, относятся к ν(ОН) оксимных групп, участвующих в образовании различных ВС в DAnH2 в твердом состоянии. В области 2000–1667 см–1 наблюдаются четыре полосы поглощения слабой интенсивности при 1941, 1865, 1791 и 1737 см–1 (обертон и результирующие составные полосы основных частот внеплоскостных колебаний СН ароматического кольца, лежащие в интервале 1000–700 см–1). Интенсивные полосы поглощения при 752 и 689 см–1, обусловленные колебаниями δ(СНвнепл), характерны для монозамещенного бензольного кольца [31, 32]. Идентификация плоскостных деформационных колебаний δ(СН) ароматического кольца затруднена, так как в данной области проявляются и другие полосы поглощения. К колебаниям ν(C=N) и ν(N–О) оксимных групп можно отнести интенсивные полосы поглощения при 1637 и 971 см–1 соответственно [32]. Плоскостные колебания скелета С=С проявляются полосами поглощения при 1595, 1493 и 1432 см–1 [33].
Контуры спектров комплексов III–V имеют много общего. Во всех присутствуют полосы поглощения ν(NН) в интервале 3317–3296 cм–1 и отсутствуют полосы поглощения ν(ОН) оксимных групп в обычной для спектров оксимов области. Вероятно, две широкие и достаточно интенсивные полосы поглощения в областях 2700–2200 и 2000–1700 cм–1 относятся к ν(ОН) оксимных групп, участвовавших в образовании достаточно сильных и отличающихся по длине ВС [34, 35].
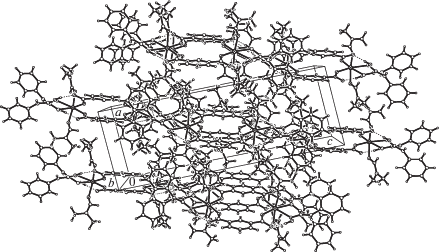
Асимметричная часть элементарной ячейки I содержит органический катион [DAnH3]+, анион ${\text{ClO}}_{{\text{4}}}^{ - }$ и одну молекулу воды. Молекулярная структура I показана на рис. 1a. Катион [DAnH3]+ имеет форму бабочки, в которой две центральные части ONCN составляют двугранный угол 54.4°, а оксимные группы имеют анти (E,E) конформацию. Межатомные расстояния O–N и N–C в оксимных фрагментах отличаются несущественно от подобных в нейтральных модифицированных диоксимах VI, VII, содержащих аминогруппу [36, 37]. Например, в I межатомные расстояния O–N равны 1.383(4) и 1.408(4) (табл. 3), в VI – 1.434, в VII – 1.422 Å.
Рис. 1.
Структура соединения I (а), центросимметричные димеры из катионов [DAnH3]+, связаные между собой межмолекулярными ВС O–H···N (б), цепочки из анионoв ${\text{ClO}}_{{\text{4}}}^{ - }$ и молекул воды (в), фрагмент упаковки компонентов в I (г).
В кристалле I катионы [DAnH3]+ объединены межмолекулярными ВС O–H···N в центросимметричный димер (рис. 1б, табл. 4), а катионы с анионами – межмолекулярными ВС O–H···O или вовлекают молекулу воды межмолекулярными ВС N–H···O и O–H···O (рис. 1a, табл. 4). При этом анионы ${\text{ClO}}_{{\text{4}}}^{ - }$ и молекулы воды связаны в цепочки (рис. 1в, табл. 4), на которые нанизываются катионы [DAnH3]+ (рис. 1г, табл. 4).
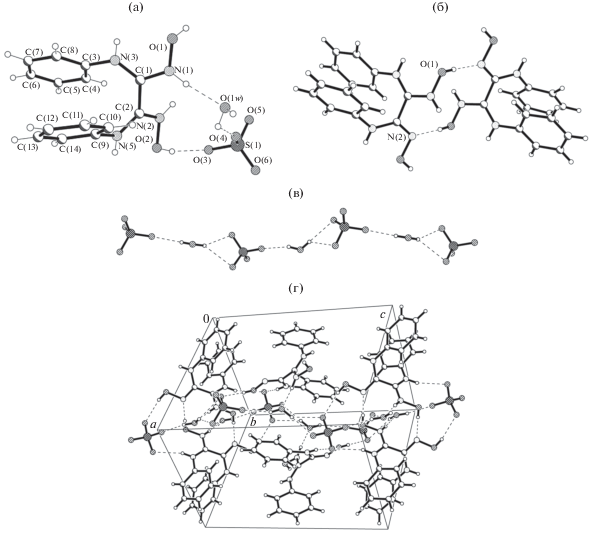
Асимметричная часть элементарной ячейки кристалла II содержит четыре независимых органических катиона [DAnH3]+ (A–D), четыре аниона ${\text{ClO}}_{{\text{4}}}^{ - }$ (A–D) и пять молекул воды, две из которых разупорядочены по двум позициям. Mолекулярная структура катиона А из II показана на рис. 2a, строение всех компонентов – на рис 2б. Катионы [DAnH3]+ в II подобны найденным в I. Оксимные группы имеют анти (E,E) конформацию, а двугранные углы между центральными фрагментами ONCN в четырех независимых катионах принимают значения от 47.3° до 58.4°. Межатомные расстояния O–N и N–C в оксимных фрагментах незначительно отличаются от подобных, найденных в I (табл. 3).
Рис. 2.
Строение катиона А в II (a), упаковка компонентов (б), формирование различных синтонов из анионов и молекул воды посредством ВС (в).
В кристалле II анионы ${\text{ClO}}_{{\text{4}}}^{ - }$ и молекулы воды связаны в различные синтоны (рис. 2в, 2г; табл. 4), а катионы [DAnH3]+ объединены между собой и с анионами разветленной системой межмолекулярных ВС O–H···O (рис. 3, табл. 4).
Попытки получения комплексов различных металлов со смешанными лигандами, 1,3-Н2Bdc и синтезированный DAnH2, привели к получению одного комплекса Zn(II) (III) и двух комплексов Mn(II) (IV, V).
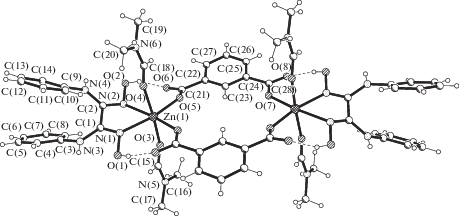
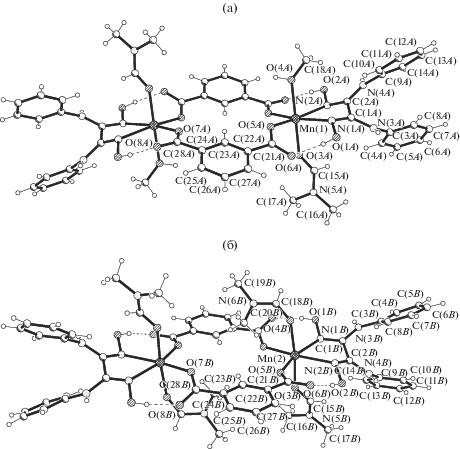
Несимметричная часть элементарной ячейки соединения III содержит один кристаллографически независимый катион Zn2+, с которым координированы один нейтральный лиганд DАnH2, бидепротонированный карбоксилат (1,3-Вdc)2–, две молекулы DMF и кристаллизационные молекулы DMF, MeOH и H2O в соотношении 2 : 1 : 1.5 соответственно. В результате в кристалле находятся центросимметричные биядерные молекулярные комплексы, два атома металла которых связаны мостиковыми бидентатными карбоксилатными лигандами (рис. 4). Атом металла координирует хелатно через два атома азота лиганд DАnH2, монодентатно через один атом кислорода два лиганда (1,3-Вdc)2–, а достраивают его окружение два атома кислорода двух монодентатных лигандов DMF. Координационный полиэдр атома Zn(II) – октаэдр N2О4. Межатомные расстояния Zn–N(oксим) в экваториальной плоскости координационного полиэдра металла 2.167(3) и 2.300(4), Zn–O(Вdc) 2.013(3) и 2.037(3) Å, аксиальные расстояния Zn–O(DMF) 2.123(4) и 2.205(5) Å (табл. 2), что согласуются с данными комплекса Zn(II) с диоксимом [38]. В комплексе соединения III каждый нейтральный лиганд DАnH2 образует две внутримолекулярные ВС O–H···O с двумя (1,3-Вdc)2– (О…О 2.508(4) и 2.521(4) Å, тaбл. 4, рис. 4). Анализ КБСД [6] выявил биядерный комплекс Zn(II) c диоксимом, в котором мостиковый лиганд – бипиридин [22]. Для соединений Zn(II) cо смешанными лигандами, диоксимом и карбоксилатами, получены как моноядерные соединения [38], так и полимерные [39].
В кристалле III биядерные комплексы связаны в слои, параллельные плоскости ас, межмолекулярными ВС N–H···O, где в качестве доноров протонов выступают функциональные NH-группы, акцепторов – атомы кислорода оксимных лигандов. Слои дополнительно стабилизированы более слабыми ВС С–H···O: C(4)–H···O(8) (x + + 1/2, –y + 1, z – 1/2), H···O 2.47, C···O 3.380 Å, угол CHO 166°; C(14)–H···O(6) (–x + 3/2, y, –z + + 1/2) – H···O 2.57, C···O 3.489 Å, угол CHO 170° (рис. 5). Кристаллизационные молекулы связаны с комплексами слабыми ВС О–H···O и С–H···O (C(5)–H···O9 (x + 1, y, z – 1), H···O 2.71, C···O 3.415 Å, угол CHO 133°.
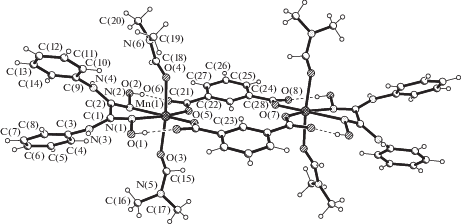
Соединение Mn(II) с этими же лигандами IV содержит в несимметричной части элементарной ячейки один кристаллографически независимый катион металла (к нему координированы нейтральный лиганд DАnH2, бидепротонированный карбоксилат (1,3-Вdc)2–, две молекулы DMF) и одну внешнесферную молекулу DMF. В результате в кристалле IV образованы центросимметричные биядерные молекулярные комплексы Mn(II) (рис. 6), подобные найденым в III. Координационные полиэдры атомов металла – октаэдры, образованные набором донорных атомов N2О4, принадлежащих хелатно координирующему DАnH2, двум лигандам (1,3-Вdc)2– и двум координированным молекулам DMF. Межатомные расстояния Mn–N(oксим) (2.310(3) и 2.371(4) Å, табл. 2) согласуются с данными для комплексов Mn(II) с диоксимом [40–42], а Mn–O(Вdc), равные 2.086(3) и 2.102(3) Å, соответствуют данным комплекса Mn(II) с (1,3-Вdc)2– с подобным способом координирования в полимерах Mn(II) [43, 44]. Длины связей Mn–O(DMF) равны 2.172(4) и 2.189(4) Å. В КБСД [6] представлены три трехъядерных комплекса Mn(II) c диоксимами, координированными хелатно (N, O) к одному атому металла, другим атомом кислорода к другому атому металла [45, 46]. В комплексе IV каждый нейтральный лиганд DАnH2 образует две внутримолекулярные ВС O–H···O с двумя (1,3-Вdc)2– (О···О 2.539(4) и 2.522(4) Å, тaбл. 4, рис. 6). В кристалле IV (рис. 7) биядерные комплексы связаны между собой межмолекулярными ВС N–H···O и С–H···O в слои (подобные таковым в III), параллельные плоскости bс. Внешнесферные молекулы DMF связаны с комплексами слабыми ВС (C(13)–H···O(9) (x – 1/2, –y + 3/2, z + 1/2): H···O 2.63, C···O 3.412 Å, угол CHO 142°.
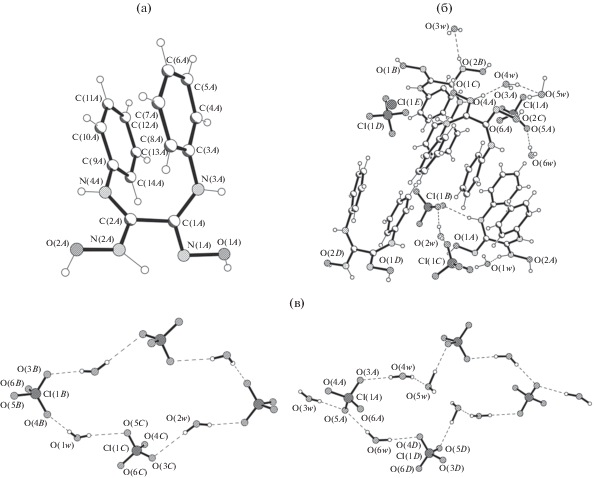
В соединении Mn(II) с этими же лигандами V несимметричная часть элементарной ячейки содержит два кристаллографически независимых катиона Mn2+, два нейтральных лиганда DАnH2, два бидепротонированных карбоксилата (1,3-Вdc)2–, три молекулы DMF и две метанола, координированные к атомам металла, а также кристаллизационную молекулу метанола. В результате в кристалле V находятся два центросимметричных биядерных молекулярных комплекса (А и В), различающиxся аксиальными лигандами. В одном комплексе к атому Mn(1) монодентатно координируются в транс-положениях нейтральные молекулы метанола и DMF, a к атому Mn(2) координируются две молекулы DMF (рис. 8). Октаэдрические координационные полиэдры атомов Mn(1) и Mn(2) образованы тем же набором донорных атомов N2О4, как и в IV. В экваториальных плоскостях координационных полиэдров атомов металла расположены четыре атома N2O2: два атома азота одного лиганда DАnH2, два атома кислорода – двух лигандов (1,3-Вdc)2–. Каждый нейтральный лиганд DАnH2 координируется хелатно к одному атому металла димера с образованием пятичленных металлоциклов. Каждый дважды депротонированный мостиковый лиганд (1,3-Вdc)2– в V, так же как в III и IV, координируется двумя атомами кислорода двух карбоксильных групп к центральным атомам. Значения межатомных расстояний Mn–N(oксим) 2.306(3)–2.347(4), Mn–O(Вdc) 2.106(3)–2.152(4), Mn–O(DMF) – 2.131(4)–2.184(4) Å (табл. 2) согласуются с данными комплекса IV, Mn–O(метанол) в V равно 2.251(4). Биядерные комплексы в V стабилизированы так же, как и в III, IV двумя внутримолекулярными ВС O–H···O (О···О 2.481(5)–2.625(5) Å, тaбл. 4, рис. 8). Внешнесферные молекулы метанола также стабилизируют комплексы А, связывая последние межмолекулярными ВС О–H···O, в которые они вовлечены в качестве и донора, и акцептора протона (O(1M)–H···O(5A), O(4A)–H···O(1M), табл. 4).
Рис. 8.
Строение центросимметричных биядерных комплексов [Mn2(DAnH2)2(1,3-Вdc)2(DMF)2(CH3OH)2] и [Mn2(DAnH2)2(1,3-Вdc)2(DMF)4] в V.
В кристалле V (рис. 9) биядерные чередующиеся комплексы А и В связаны между собой межмолекулярными ВС N–H···O и С–H···O в цепочки (рис. 9а), которые посредством ВС объедены в слои (рис. 9б), подобные образованным в III и IV.
Рис. 9.
Фрагмент цепочки, образованной чередованием комплексов А (Mn(1)) и В (Mn(2)) в V (а), объединение цепочек в слои (б).
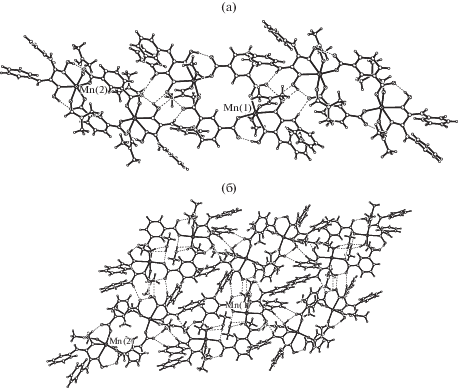
Таким образом, взаимодействие солей цинка(II) и марганца(II) c дианилинглиоксимом и 1,3-бензолдикарбоновой кислотой привело к образованию трех новых биядерных соединений: [Zn2(DAnH2)2(1,3-Вdc)2(DMF)4] ∙ 2DMF ∙ MeOH · · 1.5H2O, [Mn2(DAnH2)2(1,3-Вdc)2(DMF)4] · 2DMF и {[Mn2(DAnH2)2(1,3-Вdc)2(DMF)2(CH3OH)2]- [Mn2(DAnH2)2(1,3-Вdc)2(DMF)4] ∙ 2CH3OH}.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Чугаев Л.А. // Избранные труды Т. 1. М.: Изд-во АН СССР, 1954. 639 с.
Tschugaeff L. // Chem. Ber. 1907. V. 40. P. 186.
Ulpiani C.P. // Gazz. Chim. Ital. 1912. V. 42. № 1. P. 503.
Forster M.O. // Dalton Trans. 1903. V. 83. P. 514.
Chakravorty A. // Coord. Chem. Rev. 1974. V. 13. P. 1.
Allen. F.H. // Acta Crystallogr. B. 2002. V. 58. P. 38.
Godycki L.E., Rundle R.E. // Acta Crystallogr. 1953. V. 6. № 6. P. 487.
Frasson E., Bardi R., Bezzi S. // Acta Crystallogr. 1959. V. 12. № 3. P. 201.
Боурош П., Булхак И., Ковач О. и др. // Коорд. химия. 2018. Т. 44. № 4. С. 255 (Bourosh P., Bulhac I., Covaci O. et al. // Russ. J. Coord. Chem. 2018. V. 44. no. 8. P. 507).https://doi.org/10.1134/S1070328418080018
Дворкин А.А., Симонов Ю.А., Малиновский Т.И. и др. // Докл. АН СССР. 1977. Т. 234. № 6. С. 1372.
Боурош П.Н., Коропчану Э.Б., Чилочи А.А. и др. // Коорд. химия. 2013. Т. 39. № 11. С. 669. (Bourosh P.N., Coropceanu E.B., Ciloci A.A. et al. // Russ. J. Coord. Chem. 2013. V. 39. no. 11. P. 777). https://doi.org/10.1134/S107032841311002X
Bourosh P., Coropceanu E., Rija A. et al. // J. Mol. Struct. 2011. V. 998. № 1–3. P. 198.
Батыр Д.Г., Киструга Л.Я. // Коорд. химия. 1981. Т. 7. № 2. С. 274.
Симонов Ю.А., Дворкин А.А., Малиновский Т.И. и др. // Коорд. химия. 1985. Т. 11. № 11. С. 1554.
Симонов Ю.А., Ботошанский М.М., Малиновский Т.И. и др. //Докл. АН СССР. 1979. Т. 246. № 3. С. 609.
Симонов Ю.А., Ботошанский М.М., Озол Л.Д. и др. // Коорд. химия. 1981. № 4. С. 612.
Озол Л.Д., Ботошанский М.М., Булгак И.И. и др. // Журн. неорган. химии. 1980. Т. 25. № 4. С. 1137.
Симонов Ю.А., Дворкин А.А., Малиновский Т.И. и др. // Докл. АН СССР. 1982. Т. 263. № 5. С. 1135.
Croitor L., Coropceanu E.B., Duca Gh. et al. // Polyhedron. 2017. V. 129. P. 9.
Coropceanu E., Rija A., Lozan V. et al. // Cryst. Growth Des. 2016. V. 16. № 2. P. 814.
Coropceanu E.B., Croitor L., Botoshansky M.M., Fo-nari M.S. // Polyhedron. 2011. V. 30. № 15. P. 2592.
Croitor L., Coropceanu E., Jeanneau E. et al. // Cryst. Growth Des. 2009. V. 9. P. 5233.
Coropceanu E., Croitor L., Siminel A. et al. // Polyhedron. 2016. V. 109. P. 107.
Margaritis I. M., Winterlich M., Efthymiou C.G. et al. // Polyhedron. 2018. V. 151. P. 360.
Çolak A.T., Irez G., Mutlu H. et al. // J. Coord. Chem. 2009. V. 62. № 6. P. 1005.
Rija A., Bulhac I., Coropceanu E. et al. // Chem. J. Mold. 2011. V. 6. № 2. P. 73.
Mercimek B., Özler M.A., Ira G., Bekaroglu O. // Synth. React. Inorg. Met.-Org. Chem. 1999. V. 29. № 3. P. 513.
Nogheu L.N., Ghogomu J.N., Mama D.B. et al. // Comput. Chem. 2016. V. 4. P. 119.
CrysAlis RED. O.D.L. Version 1.171.34.76, 2003.
Sheldrick G.M. // Acta Crystallogr. A. 2008. 64. № 1. P. 112.
Беллами Л. Инфракрасные спектры сложных молекул. М.: ИЛ, 1963. 590 с.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. 541 с.
Наканиси К. Инфракрасные спектры и строение органических соединений. М.: Мир, 1965. 216 с.
Накамотo К. ИК-спектры и спектры КР неорганических и координационных соединений. M.: Мир, 1991. 536 с.
Накамотo К. Инфракрасные спектры неорганических и координационных соединений. М.: Мир, 1966. 411 с.
Durmus M., Ahsen V., Luneau D., Pecaut J. // Inorg. Chim. Acta. 2004. V. 357. P. 588.
Kakanejadifard A., Amani V. // Acta Crystallogr. E. 2008. V. 64. P. o1512.
Коропчану Э.Б., Кроитор Л., Чилочи А. и др. // Коорд. химия. 2017. Т. 43. № 7. С. 399. (Coropceanu E.B., Croitor L., Ciloci A.A. et al. // Russ. J. Coord. Chem. 2017. V. 43. № 5. P. 278).https://doi.org/10.1134/S1070328417050025
Croitor L., Coropceanu E., Masunov A. et al. // J. Phys. Chem. C, 2014. V. 118. P. 9217.
Jurisson S., Francesconi L., Linder K.E. et al. // Inorg. Chem. 1991. V. 30. P. 1820.
Birkelbach F., Florke U., Haupt H.-J. et al. // Inorg. Chem. 1998. V. 37. P. 2000.
Hsieh W.-Yu., Liu Sh. // Inorg. Chem. 2006. V. 45. P. 5034.
Yan Li, Li Ch., Chen X. // J. Mol. Struct. 2014. V. 1058. P. 277.
Jones L.F., Prescimone A., Evangelisti M., Brechin E.K. // Chem. Commun. 2009. P. 2023.
Chen Z., Hu Zh., Li Y. et al. // Dalton Trans. 2016. V. 45. P. 15634.
Chen Z., Jia M., Zhang Zh., Liang F. // Cryst. Growth Des. 2010. V. 10. P. 4806.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия