Координационная химия, 2019, T. 45, № 2, стр. 79-83
Синтез и рентгеноструктурное исследование комплекса иодида кадмия(II) с 3,4-дифенил-1-(пиридин-2-ил)-6,7-дигидро-5H-циклопента[c]пиридином
А. Ф. Хасанов 1, 2, П. А. Слепухин 1, 2, *, Д. С. Копчук 1, 2, А. П. Криночкин 1, 2, И. С. Ковалев 2, Г. В. Зырянов 1, 2, Г. А. Ким 1, В. Л. Русинов 1, 2, О. Н. Чупахин 1, 2
1 Институт органического синтеза им. И.Я. Постовского УрО РАН
, Екатеринбург, Россия
2 Уральский федеральной университет
, Екатеринбур, Россия
* E-mail: slepukhin@ios.uran.ru
Поступила в редакцию 02.04.2018
После доработки 15.06.2018
Принята к публикации 18.05.2018
Аннотация
Методом РСА исследована и установлена структура комплекса иодида кадмия(II) с 3,4-дифенил-1-(пиридин-2-ил)-6,7-дигидро-5H-циклопента[c]пиридином (СIF file CCDC № 1833097). Изучен вопрос о возможности координации фенильных заместителей лиганда на центральный ион кадмия. Степень участия π-системы фенильного заместителя лиганда в координации на центральный ион проанализирована с привлечением квантово-химических расчетов.
В настоящее время химия координационных соединений кадмия привлекает особое внимание из-за их высокой биотоксичности и связанных с ней экологических проблем [1–4]. Кроме этого, на основе кадмиевых комплексов можно построить координационные полимеры с перспективными прикладными свойствами [5]. Также кадмиевые комплексы на основе производных бипиридинов интересны своими фотофизическими характеристиками [6, 7].
В Кембриджском банке структурных данных к настоящему времени представлено около 150 структур комплексов кадмия на основе лигандов 2,2'-бипиридинового типа [8]. При этом в большинстве случаев в качестве лигандов использованы производные фенантролинов, а не 2,2'-бипиридинов (2,2-Bipy). Ранее мы рассмотрели структуры трех комплексов кадмия на основе (поли)арилзамещенных 2,2-Bipy (по данным РСА [9]) и показали, что длина связи Cd–N зависит от структуры органического лиганда. В рамках данной работы мы изучили методом РСА структуру комплекса на основе 3,4-дифенил-1-(пиридин-2-ил)-6,7-дигидро-5H-циклопента[c]пиридина (L1) с CdI2 и сравнили ее с рядом ранее описанных комплексов кадмия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Настоящая работа выполнена с использованием оборудования Центра коллективного пользования “Спектроскопия и анализ органических соединений” (ЦКП САОС).
Спектры ЯМР 1H записывали на спектрометре Bruker Avance-400 (400 МГц), внутренний стандарт – SiMe4. Температуры плавления измеряли на приборе Boёtius. Масс-спектры (тип ионизации – электроспрей) записывали на приборе MicrOTOF-Q II фирмы Bruker Daltonics (Бремен, Германия). Элементный анализ выполняли на CHN анализаторе РЕ 2400 II фирмы Perkin Elmer. 3-(2-Пиридил)-5,6-дифенил-1,2,4-триазин (L2) получали по описанному ранее методу [10].
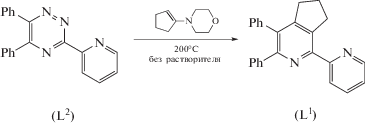
Синтез L1. Смесь L2 (345 г, 1.1 ммоль) и 1-морфолиноциклопентена (0.89 мл, 5.5 ммоль) перемешивали при 200°С в отсутствие растворителя в атмосфере аргона в течение 2 ч. Затем добавляли дополнительную порцию 1-морфолиноциклопентена (0.45 мл, 2.75 ммоль) и смесь перемешивали при тех же условиях ещев течение часа. Продукт очищали колоночной хроматографией (элюент: гексан, затем этилацетат). Растворитель из фракций, содержащих продукт, удаляли при пониженном давлении. Остаток обрабатывали этанолом, образовавшийся осадок отфильтровывали, промывали спиртом и высушивали. Аналитический образец получали перекристаллизацией из этанола. Выход 265 мг (0.76 ммоль, 69%). Тпл = 172–174°С.
ЯМР 1Н (CDCl3; δ, м.д.): 2.05–2.14 (м., 2H, 6‑СН2), 2.84 (т., 2Н, 3J = 7.6 Гц, 7-СН2), 2.53 (т., 2Н, 3J = 7.6 Гц, 5-СН2), 7.13–7.22 (м., 5Н, Ph), 7.24–7.33 (м, 3Н, Ph, H-5 (Py)), 7.38–7.44 (м., 2Н, Ph), 7.80–7.86 (д. д. д., 1Н, 3J = 8.0, 8.0 и 2.0 Гц, Н‑4 (Py)), 8.39 (д., 1Н, 3J = 7.8 Гц, Н-3 (Py)), 8.72 (д., 1Н, 3J = 4.8 Гц, Н-6 (Py)). Масс-спектр m/z (Iотн, %)): 349.17 [M + H]+ (100), вычислено 349.17.
Синтез (3,4-дифенил-1-(пиридин-2-ил)-6,7-дигидро-5H-циклопента[c]-пиридин)дииодокадмия(II) (I) · 2СН3СN. Кристаллы комплекса I, пригодные для РСА, получали медленным упариванием раствора лиганда L1 (20 мг) и CdI2 (21 мг, 1 экв.) в ацетонитриле (5 мл).
РСА комплекса I проведен на автоматическом четырехкружном дифрактометре Xcalibur 3 c CCD-детектором по стандартной процедуре (МоКα-излучение, графитовый монохроматор, ω-сканирование с шагом 1° при Т = 295(2) К). Введена эмпирическая поправка на поглощение (μ(MoKα) = 2.815 мм–1). Сбор и обработка данных проведены с использованием программного пакета CrysAlisPro [11]. Решение и уточнение структуры проведено по программе OLEX [12] с использованием программного пакета SHELX [13]. Неводородные атомы уточнены в анизотропном приближении. Атомы водорода помещены в геометрически рассчитанные положения и включены в уточнение в изотропном приближении в модели “наездника” с зависимыми изотропными тепловыми параметрами. Результаты уточнения структуры и основные кристаллографические параметры: кристалл моноклинный, a = 16.7324(9), b = 8.1348(4), c = 23.0488(11) Å, β = 107.384(6)°, V = = 2994.0(3) Å3, пр. гр. P21/n, M = 796.74, Z = 4. На углах рассеяния 3.7° < 2θ < 61.58° собрано 16300 отражений, из них 8129 независимых (Rint = 0.0374), в том числе 4939 с I > 2σ(I). Окончательные параметры уточнения структуры: R1 = 0.0994, wR2 = = 0.1338 (все отражения); R1 = 0.0492, wR2 = 0.1004 (I > 2σ(I)), GOOF on F 2 1.018. Пики остаточной электронной плотности 0.93/–1.18 eÅ–3.
Результаты РСА зарегистрированы в Кембриджском банке структурных данных (CCDC № 1833097; deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk).
Квантово-химические расчеты проводили по программе Orca 4.0.1, методом ab initio в базисе def2-TZVP. Оптимизацию геометрии молекулы не проводили, трехмерную модель взяли из данных РСА.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Лиганд L1 мы получили с использованием описанной ранее “1,2,4-триазиновой” методологии [14, 15] в результате реакции аза-Дильса-Альдера с обратными электронными требованиями между 1,2,4-триазином L2 (диеном) [10] и 1-морфолиноциклопентеном (диенофилом) в отсутствие растворителя при 200°С согласно схеме.
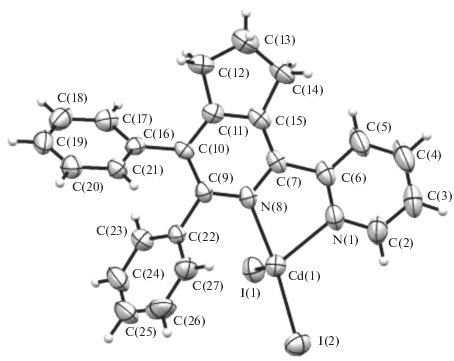
Кристаллы комплекса кадмия I с лигандом L1 получены кристаллизацией из его насыщенного раствора в ацетонитриле посредством медленного упаривания при комнатной температуре. По данным РСА, моноядерный нейтральный комплекс состава Cd(L1)I2 (рис. 1) кристаллизуется в центросимметричной пространственной группе в виде сольвата с двумя молекулами CH3CN, не входящими в ближнюю координационную сферу комплексообразователя. Координационный полиэдр атома Cd – искаженный тетраэдр, близкий к тригональной пирамиде. При этом атом кадмия отклоняется от плоскости атомов I(1)I(2)N(8) на (0.268 Å). Длины связей: Cd(1)–I(1) 2.7213(6), Cd(1)–I(2) 2.7148(6), Cd(1)–N(8) 2.305(4), Cd(1)–N(1) 2.300(5) Å и не демонстрируют значительных отклонений от нормы, причем длины двух связей Cd–N одинаковы в пределах погрешности эксперимента. Лиганд L1 – типичный хелатирующий агент α,α-дипиридильного типа, хелатный валентный угол N(1)Cd(1)N(8) 70.89(16)°. Атом кадмия выходит из плоскости атомов N(1)C(6)C(7)N(8) на 0.441 Å. Длина связи C(6)–C(7) в металлохелатном цикле (1.507 Å) указывает на незначительный эффект сопряжения π-систем пиридильных колец.
Оба фенильных заместителя в молекуле I развернуты на 60° к плоскости пиридинового цикла. Расстояние для атомов фенильных заместителей С(16)···С(22) 2.95 Å позволяет говорить о частичном перекрывании π-систем последних. С учетом укороченного межмолекулярного контакта между фенильными заместителями соседних молекул С(25)···С(25) (–x, 2 – y, 1 – z) 3.354 Å можно допускать наличие π-стэкинг-взаимодействия в ансамблях четырех фенильных колец молекулярной кристаллической упаковки.
По-видимому, отклонение от тетраэдрической конфигурации кадмия нельзя объяснить только стерическим влиянием объемных заместителей, особенно с учетом того, что ван-дер-ваальсовы радиусы атомов иода и углерода фенильных колец в молекуле не перекрываются. Ранее для комплексов CdI2 с лигандами α,α-дипиридильного типа (КЧ(Cd) 4) тетракоординация не наблюдалась [8], а структурное многообразие ограничивалось пента- и гексакоординированными комплексами. Межатомное расстояние С(27)···Сd(1) 3.188 Å между центральным ионом и фенильным заместителем позволяет допускать значительное перекрывание ароматической π-системы с электронной оболочкой кадмия и формирование связи по типу “сэндвичевой” структуры. В этом случае центральный ион Сd2+ приобретает довольно обычную искаженную тригонально-бипирамидальную конфигурацию, объясняющую наблюдаемое расположение заместителей ближней координационной сферы. Ранее подобный тип взаимодействия был отмечен для комплексов кадмия с порфириноидными лигандами [16].
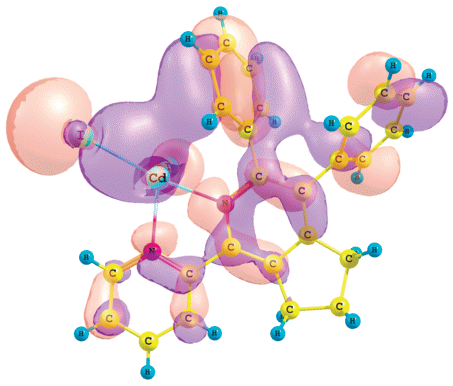
Действительно, в результате расчета методом квантовой механики обнаружено перекрытие электронной плотности 121-й молекулярной орбитали с энергией –7.23 эВ между атомом Cd и фенильным кольцом для значения изоплотностной поверхности <0.028 (рис. 2). Аналогичного перекрытия для других молекулярных орбиталей не выявлено.
Таким образом, между центральным атомом и π-системой фенила наблюдается взаимодействие, промежуточное между простым ван-дер-ваальсовым контактом и формированием полноценного π-комплекса по типу металлоцена.
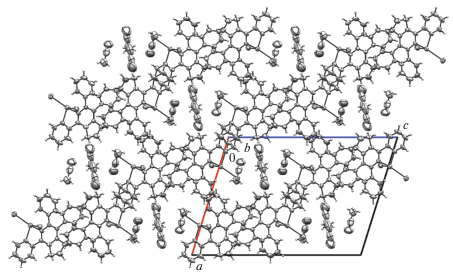
Укладка молекул в кристалле лестнично-паркетная. Имеются значительные поры, ориентированные вдоль оси 0b и заполненные молекулами растворителя CH3CN (рис. 3). Существенно укороченные межмолекулярные контакты в кристалле отсутствуют.
Работа выполнена по программе научных исследований ИОС УрО РАН (проект № 115030310087 0398-2014-0030), при финансовой поддержке Российского научного фонда (грант № 16-43-02020) и Совета по грантам Президента РФ (грант МК-644.2017.3).
Список литературы
Duruibe J.O., Ogwuegbu M.O.C., Egwurugwu J.N. // Intern. J. Phys. Sci. 2007. V. 2. № 5. P. 112.
Verma R., Dwivedi P. // Recent Res. Sci. Technol. 2013. V. 5. № 5. P. 98.
Pinot F.I., Kreps S.E., Bachelet M. et al. // Rev. Environ. Health. 2000. V. 15. № 3. P. 299.
Kazantzis G. // IARC Sci. Publ. 1986. V. 71. P. 93.
Seidel R.W., Goddard R., Zibrowius B., Oppel I.M. // Polymers. 2011. V. 3. P. 1458.
Kumara R., Bhargava P., Dvivedi A. // Proc. Mater. Sci. 2015. V. 10. P. 37.
Suna X.-Z., Huangc Z.-L., Wangc H.-Z. et al. // Z. Anorg. Allg. Chem. 2005. V. 631. P. 919.
Cambridge Structural Database. Version 5.39. 2017.
Kopchuk D.S., Slepukhin P.A., Kovalev I.S. et al. // Polyhedron. 2016. V. 110. P. 235.
Case F.H. // J. Org. Chem. 1965. V. 30. P. 931.
CrysAlisPro. Agilent Technologies. Version 1.171.36.28.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Pabst G.R., Sauer J. // Tetrahedron Lett. 1998. V. 39. P. 6687.
Rykowski A., Branowska D., Kielak J. // Tetrahedron Lett. 2000. V. 41. P. 3657.
Stepień M., Latos-Grażyński L. // J. Am. Chem. Soc. 2002. V. 124. № 15. P. 3838.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия