Координационная химия, 2019, T. 45, № 3, стр. 170-177
Синтез и кристаллическая структура [Co(DmgH)2(Thio)2]2F[PF6]. Влияние фторсодержащих диоксиматов Co(III) на физиологические процессы микроводоросли Porphyridium cruentum
Э. Коропчану 1, 2, *, В. Рудик 3, Л. Чепой 3, Л. Рудь 3, В. Лозан 1, Т. Кирияк 3, В. Миску 3, И. Булхак 1, В. Кравцов 4, П. Боурош 2, 4
1 Институт химии
Кишинев, Республика Молдова
2 Тираспольский государственный университет
Кишинев, Республика Молдова
3 Институт микробиологии и биотехнологии
Кишинев, Республика Молдова
4 Институт прикладной физики
Кишинев, Республика Молдова
* E-mail: ecoropceanu@yahoo.com
Поступила в редакцию 14.07.2018
После доработки 24.08.2018
Принята к публикации 15.08.2018
Аннотация
Получены новые соединения класса фторсодержащих диоксиматов кобальта(III) с формулой [Co(DmgH)2(Thio)2]2F[PF6] (I) и [Co(DmgH)2(Sam)2]2[TiF6] · 4H2O (II) (DmgH = моноанион диметилглиоксима, Thio = тиокарбамид, Sam = сульфаниламид). Структура I определена методом РСА (CIF file CCDС № 1852216). Кристаллы кубической сингонии, пр. гр. Pn$\bar {3}$n. Октаэдрический координационный полиэдр металла образован набором донорных атомов N4S2 двух лигандов DmgH– и двух молекул Thio. Изучено влияние соединений I и II и двух ранее описанных соединений этого класса с фторсодержащими анионами [Co(DmgH)2(Thio)2]2[TiF6] · 2H2O (III) и [Co(DmgH)2(An)2]2[ZrF6] (IV) (An = анилин) на физиологические процессы красной микроводоросли Porphyridium cruentum. Установленно, что комплекс III в концентрации 20 мг/л стимулирует продуктивность микроводоросли нa 20% и биосинтез жиров на 17% и может быть предложен для внедрения в различные биотехнологии.
Получение химических соединений в качестве биологических моделей и исследование степени их влияния на метаболические процессы микроорганизмов – перспективная область в направленном синтезе молекул с биологически активными свойствами. Особо привлекательны при этом координационные соединения переходных металлов [1], которые отличаются как разнообразием состава, так и строения. Микроэлементы соединений, вовлеченные в метаболическую активность организмов, в реакциях катализа, окисления и восстановления, гидратации и гидролиза, часто влияют на активность энзимoв [2]. Одним из жизненно важных микроэлементов для микроорганизмов является кобальт [3], который наряду с ионами других металлов играет роль активатора большинства киназ, синтетаз и участвует в метаболических реакциях, зависимых от витамина B12.
Свойства координационных соединений, хотя в большой степени определены атомом металла, также зависят от природы лигандов, которые, благодаря широкому набору донорных атомов, образуют с ионами переходных металлов устойчивые комплексы, разные по составу, строению и свойствам [4, 5]. Биологически активные молекулы или частицы, включенные в состав комплексов металлов в качестве лигандов, повышают их эффективность [4]. Таким образом, была установлена биологическая активность диоксиматов переходных металлов, которые можно рассмотреть как модели витамина В12 [5, 6]. Эти соединения по значимости находятся на стыке классической координационной химии, химии органометаллических соединений и биохимии. Mы описали ряд полученных фторсодержащих диоксиматов Co(III) [7–13], в том числе проявляющих свойства стимуляторов как биосинтеза витамина B12 [14], так и гидролитических энзимов у некоторых микроскопических грибов [15–18].
Интерес представляет также исследование влияния комплексных соединений этого ряда на микроводоросли, в том числе на красную микроводоросль Porphyridium cruentum, которая используется в биотехнологии в качестве производителя полиеновых жирных кислот, фикобилинов и сульфатированных полисахаридов [19]. Известные технологии выращивания этой микроводоросли включают использование органических и неорганических симуляторов роста и биосинтетической активности, в том числе координационных соединений, которые воспринимаются клетками как ксенобиотики [20]. Porphyridium cruentum, являясь эукариотическим организмом, обладает системами и механизмами устойчивости к действию ксенобиотиков. В случае применения координационных соединений металлов часто наблюдается селективный эффект повышения количества биомассы и биологически активных веществ в водорослевой биомассе в зависимости от природы металла и лигандов в составе соединения [1].
Для установления степени влияния фторсодержащих диоксиматов кобальта(III) на физиологические процессы красной микроводоросли Porphyridium cruentum и определения роли разных координационных соединений было решено тестировать ряд комплексов Co(III) c идентичным экваториальным фрагментом, однако различающихся как аксиальными лигандами, так и внешнесферными анионами: [Co(DmgH)2(Thio)2]2F[PF6] (I), [Co(DmgH)2(Sam)2]2[TiF6] · 4H2O (II), [Co(DmgH)2 (Thio)2]2[TiF6] · 2H2O (III), [Co(DmgH)2(An)2]2[ZrF6] (IV) (DmgH = моноанион диметилглиоксима, Thio = тиомочевинa, Sam = сульфаниламид, An = = aнилин). Синтез и структура комплексов III и IV описаны в [11, 21]; соединения I и II – новые материалы. Для соединения I методом РСА определена кристаллическая структура. Для II не удалось получить монокристаллы, пригодные для РСА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез I. 0.5 г (0.001 моль) [Co(DmgH)2(Thio)2]F ⋅ ⋅ 3H2O растворяли в 20 мл метанола. После фильтрования в раствор добавляли 15 мл раствора, содержащего 0.2 г (0.001 моль) KPF6 в H2O, затем 0.015 г (0.002 моль) тиомочевины в 10 мл воды для предотвращения процесса замещения тиомочевины водой из комплексного катиона. Раствор нагревали до ~40°C с перемешиванием ~5 мин, фильтровали и оставляли для медленного испарения при комнатной температуре. В растворе образовывались мелкие кристаллы в форме пирамид вишневого цвета, которые отделяли фильтрованием и высушивали на воздухе. Выход ~55%. Вещество слабо растворимо в воде, метаноле и этаноле.
| Найдено, %: | C 22.73; | H 4.21; | N 21.32; | Co 11.08. |
| Для C20H44N16O8F7S4P1Co2 | ||||
| вычислено, %: | C 22.95; | H 4.24; | N 21.41; | Co 11.26. |
Комплекс I также получали из системы СоF2 · · 4H2O–2DmgH2–2Thio–KPF6.
Синтез II. К раствору 0.33 г (0.001 моль) СoTiF6 · · 6H2O в 30 мл воды добавляли 0.23 г (2 моль) диметилглиоксима в 40 мл метанола и 0.35 г (0.002 моль) сульфаниламида в 30 мл метанола. Полученный раствор нагревали на водянной бане при 60°C в течение 10 мин. Из темно-коричневого раствора при медленном испарении получали коричневое порошкообразное вещество. Выход 37%. Вещество растворимо в воде, ДМСО, ДMФ, спиртах, менее растворимо в воде.
| Найдено, %: | C 31.89; | H 4.41; | N 14.78; | Co 7.66. |
| Для C40H68N16O20F6S4TiCo2 | ||||
| вычислено, %: | C 32.00; | H 4.57; | N 14.93; | Co 7.85. |
РСА. Экспериментальный материал для I получен на дифрактометре STOE IPDS при комнатной температуре (MoKα-излучение, графитовый монохроматор). Структура соединений решена прямыми методами и уточнена методом наименьших квадратов в анизотропном полноматричном варианте для неводородных атомов (SHELX-97) [22]. Центральный атом комплексного катиона [Co(DmgH)2(Thio)2]+ находится на оси 2, центральный атом аниона [PF6]– – на оси 4. Ион F– занимает пять позиций с различными коэффициентами заполнения, одна из которых в общем положении. Позиции атомов водорода рассчитаны геометрически и уточнены изотропно в модели “жесткого тела” c Uэф = 1.2 Uэкв или 1.5 Uэкв, соответствующих атомов O, N и C. Кристаллографические данные и характеристики эксперимента РСА для I приведены в табл. 1, некоторые межатомные расстояния и валентные углы cоединений – в табл. 2, геометрические параметры водородных связей (ВС) – в табл. 3.
Таблица 1.
Кристаллографические данные и характеристики эксперимента для структуры I
| Параметр | Значение |
|---|---|
| М | 1046.78 |
| Сингония | Кубическая |
| Пр. гр. | Pn$\bar {3}$n |
| а, Å | 23.3960(10) |
| V, Å3 | 12806.3(9) |
| Z | 12 |
| ρ(выч.), г/см3 | 1.629 |
| μ, мм–1 | 1.101 |
| F(000) | 6432 |
| Размеры кристалла, мм | 0.30 × 0.20 × 0.15 |
| Область θ, град | 2.46–25.24 |
| Интервалы индексов отражений | –25 ≤ h ≤ 28 –24 ≤ k ≤ 26 –23 ≤ l ≤ 28 |
| Число измеренных/независимых рефлексов (Rint) | 38 570/1943 (0.1003) |
| Заполнение, % | 99.7 |
| Число рефлексов с I > 2σ(I) | 1524 |
| Число уточняемых параметров | 169 |
| GOOF | 1.004 |
| R фактор (I > 2σ(I)) | 0.0486, 0.1224 |
| R фактор (по всему массиву) | 0.0649, 0.1303 |
| Δρmax/ρmin, e Å–3 | 0.775/–0.418 |
Таблица 2.
Межатомные расстояния и валентные углы в I*
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Co(1)–N(1) | 1.876(3) | C(1)–C(1)#1 | 1.459(8) |
| Co(1)–N(2) | 1.924(3) | C(1)–C(3) | 1.500(6) |
| Co(1)–S(1) | 2.2876(9) | C(2)–C(2)#1 | 1.462(10) |
| O(1)–N(1) | 1.335(4) | C(2)–C(4) | 1.491(6) |
| O(2)–N(2) | 1.358(4) | S(1)–C(5) | 1.741(4) |
| N(1)–C(1) | 1.293(5) | N(3)–C(5) | 1.309(5) |
| N(2)–C(2) | 1.283(5) | N(4)–C(5) | 1.317(5) |
| Угол | ω, град | Угол | ω, град |
| N(1)Co(1)N(2) | 99.4(1) | C(2)N(2)Co(1) | 117.1(3) |
| N(1)Co(1)N(1)#1 | 81.4(2) | O(2)N(2)Co(1) | 124.0(3) |
| N(1)Co(1)N(2)#1 | 178.2(1) | N(1)C(1)C(1)#1 | 112.5(2) |
| N(1)Co(1)S(1) | 88.61(9) | N(1)C(1)C(3) | 122.6(4) |
| N(1)Co(1)S(1)#1 | 97.13(9) | C(3)C(1)C(1)#1 | 124.9(3) |
| N(2)Co(1)N(2)#1 | 79.7(2) | N(2)C(2)C(2)#1 | 113.0(3) |
| N(2)Co(1)S(1) | 84.53(10) | N(2)C(2)C(4) | 124.4(5) |
| N(2)Co(1)S(1)#1 | 89.68(10) | C(4)C(2)C(2)#1 | 122.5(4) |
| S(1)Co(1)S(1)#1 | 172.45(6) | C(5)S(1)Co(1) | 115.2(1) |
| C(1)N(1)O(1) | 121.9(3) | N(3)C(5)N(4) | 119.7(4) |
| C(1)N(1)Co(1) | 116.8(3) | N(3)C(5)S(1) | 115.6(3) |
| O(1)N(1)Co(1) | 121.3(2) | N(4)C(5)S(1) | 124.7(3) |
| C(2)N(2)O(2) | 118.8(4) |
Таблица 3.
Геометрические параметры водородных связей в I
| D–H···A | Расстояние, Å | Угол DHA, град |
Симметрическое преобразование для А | ||
|---|---|---|---|---|---|
| D–H | H···A | D···A | |||
| O(2)–H(1)···O(1) | 0.82 | 1.77 | 2.547(4) | 158 | x, y, z |
| N(3)–H(1)···O(1) | 0.80 | 2.23 | 2.953(5) | 150 | x + 1, y – 1, z |
| N(3)–H(2)···F(4) | 0.87 | 1.96 | 2.829(4) | 173 | x, y, z |
| N(4)–H(1)···F(1) | 0.89 | 2.49 | 3.213(6) | 139 | x, y, z |
| N(4)–H(1)···F(2A) | 0.89 | 2.48 | 3.16(3) | 134 | x, y, z |
| N(4)–H(1)···O(1) | 0.89 | 2.21 | 2.956(5) | 141 | x + 1, y – 1, z |
| N(4)–H(2)···O(1) | 0.84 | 2.25 | 2.977(5) | 146 | –x + 3/2, z,y |
Позиционные и тепловые параметры для структуры I депонированы в Кембриджском банке структурных данных (КБСД № 1852216); deposit@ccdc.cam.ac.uk or http://www.ccdc.cam.ac.uk/ data_request/cif).
Биологические методы. Для опытов использовали штамм красной морской микроводоросли Porphyridium cruentum CNMN-AR-01 из Национальной Коллекции непатогенных микроорганизмов Института микробиологии и биотехнологии. Mикроводоросль была культивирована на минеральной среде [20] в колбах Erlenmayer на 100 мл с экспериментальным объемом в 50 мл. Продолжительность эксперимента – 14 дней в условиях постоянного освещения при температуре 22°C. В таких условиях продуктивность составляет 2.2–2.5 г/л. Полученная биомасса содержит до 27–32% белка и 12–14% жиров.
В целях изучения биологического эффекта координационные соединения вносили в питательную среду в первый день культивирования микроводоросли в двух концентрациях – 10 и 20 мг/л.
Количество биомассы определяли спектрофотометрически на основании калибровочной кривой зависимости оптической плотности культуры при длине волны 545 нм от количества биомассы в среде. Coдержание белков в водорослевой биомассе определяли по методу Лоури c применением реагента Фолин–Чикальтеу [23]. Количество липидов в биомассе определяли с применением фосфо-ванилинового реагента после их предварительной экстракции в хлороформе [24]. Опыт и измерения проводили в трех повторностях. Полученные результаты обрабатывали статистически согласно принятым для биологических исследований методам [25].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В ИК-спектрах координация DmgH– к центральному атому в I и II подтверждена наличием полос при 1230–1245 νas(NO) и 1080–1095 cм–1 νs(NO), которых нет в ИК-спектре некоординированного диметилглиоксима. Присутствие моноанионов диоксима также подверждается полосами при 1560–1580 ν(CN), 505–525 νas(Co–N) и 425–440 cм–1 νs(Co–N). На присутствие координированной молекулы тиомочевины в I и III указывают полосы при 3312–3327 νas(NH), 3215–3221 νs(NH), 1617–1621 δ(NH2), 1408 cм–1 ν(C=S). В случае диоксиматов Co(III), содержащих на 1.6 координатах молекулы сульфаниламида (II), также присутствуют полосы поглощения при 1580–1610 νas(CC) + δ(CCH), 1480–1495 νs(CC) + δ(CCH), 1310–1340 νas(SO), 1150–1170 cм–1 νs(SO), полосы деформационных колебаний ароматического пара-замещенного кольца 670–740 cм–1 δ(CH). Координация молекул анилина в IV на координатах 1.6 октаэдра в [Co(DmgH)2(An)2]+ подтверждается присутствием полос поглощения при 3068–3135 ν(CH), 1590–1602 cм–1 ν(CC) + δ(CCH), а также полосами при 670–770 cм–1 δ(CH), характерными для монозамещенного ароматического кольца [26].
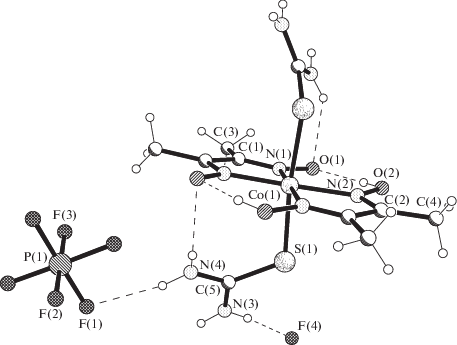
Соединение I дополняет полученный нами ранее ряд фторсодержащих диоксиматов [7–13], для которых методом РСА определена кристаллическая структура. В ионной структуре I, как в диоксиматах [12, 13], в качестве внешнесферного аниона использован [PF6]–, однако в КБСД [27] есть еще пять диоксиматов переходных металлов (в основном гетеросоединения) с этим же анионом [28–32]. В кристаллической структуре I выявлен необыкновенный тип раcположения и упаковки структурных единиц, диктуемый кубической сингонией, в которой кристаллизует вещество. Частное положение центрального атома кобальта (на оси симметрии 2) предполагает, что в элементарной ячейке кристалла расположены 24 комплексных катиона [Co(DmgH)2(Thio)2]+. Октаэдрическое окружение атома Co(III) образовано четырьмя атомами азота двух монодепротонированных бидентатно-хелатных лигандов DmgH– и двумя атомами серы двух нейтральных монодентатных лигандов Thio (рис. 1). Межатомные расстояния в координационном полиэдре: Co(1)–N(1) 1.876(3), Co(1)–N(2) 1.924(3) и Co(1)–S(1) 2.2876(9) Å (тaбл. 2). Если два лиганда DmgH– расположены в экваториальной плоскости координационного полиэдра металла и объеденены между собой двумя внутримолекулярными ВС O–H···O (O···O 2.547(4) Å, тaбл. 3), в аксиальных позициях расположены молекулы Thio, что согласуется с ранее полученными результатами для диоксиматов Co(III) c Thio в [Co(DmgH)2(Thio)2]3F[SiF6] · 1.5H2O [7], [Co(DmgH)2(Thio)2]2[SiF6]· 2H2O · C2H5OH [8], Co(DmgH)2(Thio)2]3[AlF6] · 2H2O [9], [Co(DmgH)2 (Thio)2]2[ZrF6] · H2O [10], [Co(DmgH)2(Thio)2]2[TiF6] · · 2H2O [11], [Co(NioxH)2(Thio)2]2[PF6] · DMF · · 1/2H2O [12] (NioxH2 = 1,2-циклогексадиондиоксим). В результате координации DmgH– к иону Co3+ образуются два практически копланарных металлоцикла, так как двугранный угол между плоскостями, проходящими через атомы металлоциклов, равен 2.8°. Для диоксиматов, содержащих координированные молекулы тиомочевины [7–12], было установлено, что последние могут распологаться в комплексном катионе как перпендикулярно экваториальной плоскости, так и практически паралельно ей или могут занимать промежуточное положение. В результате внутримолекулярные взаимодействия между органическими лигандами в комплексном катионе также могут быть разными: а) DmgH– и Thio объединены ВС N–H···O, в которых в качестве доноров протонов выступают аминные группы Thio, а в качестве акцепторов – атомы кислорода DmgH–; б) между молекулами Thio и металлоциклами, образованными в результате хелатирования DmgH–, действуют слабые π–π-взаимодействия. Установлено, что комплексный катион [Co(DmgH)2 (Thio)2]+ в I стабилизируется двумя симметричными внутримолекулярными ВС N–H···O (рис. 1): N(4)···O(1) (–x + 3/2, z, y) 2.977(5), H···O(1) 2.25 Å, угол NHO 146° (табл. 3), что согласуется с данными для соединений, описанных в [7–12].
В кристалле I компоненты объединены системой ВС, в которых в качестве доноров протонов выступают аминные группы лигандов Thio комплексных катионов, а в качестве акцепторов – как атомы кислорода оксимных групп соседних катионов, так и ионы F– и атомы фтора анионов [PF6]–. В результате в кристалле можно выделить катионные cетки (рис. 2 и 3), в образовании которых важную роль играют две межмолекулярные ВС N–H···O: N(3)···O(1) (x + 1, y – 1, z) и N(4)···O(1) (x + 1, y – 1, z) 2.953(5) и 2.956(5), N(3)–H(2) 0.80, H(2)···O(1) 2.23 Å, угол NHO 150° и N(4)–H(1) 0.89, H(1)···O(1) 2.21 Å, угол NHO 141°.
Рис. 2.
Фрагмент катионной cетки в I (а); тунели, образованные комплексными катионами и занятые анионами [PF6]– (б).
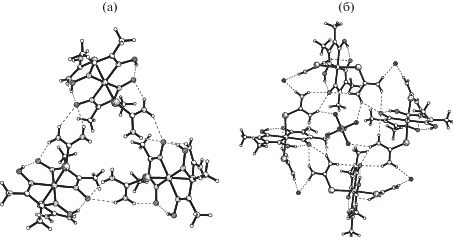
Способ упаковки структурных единиц в кристалле I определяется и расположением в кристалле анионов [PF6]– и F–. Каждый анион [PF6]–, расположенный на оси симетрии четвертого порядка, вовлечен через атомы фтора в образование четырех ВС N–H···F (рис. 2б) только через атом F(1), находящийся в общем положении: N(4)···F(1) 3.213(6), N(4)–H(1) 0.89, H(1)···F(1) 2.49 Å, угол NHF 139°. Обнаружены взаимодействия F···F между атомами F(2) двух анионов [PF6]– в частных положениях с различным коэффициентом заполнения (КЗ). Если F(2A) (КЗ 0.25) участвует в одной ВС (N–H···F N(4)···F(2A) 3.16(3), N(4)–H(1) 0.89, H(1)···F(2A) 2.48 Å, угол NHF 134°), то атом F(2) (КЗ 0.75) участвует лишь в одном слабом взаимодействии F(2)···F(2) (x, –y – 1/2, –z + 1/2) 2.638 Å (рис. 2б). Атомы F(3) не вовлечены во взаимодействия между компонентами кристалла. В КБСД [27] выявлены соединения с подобными типами взаимодействия F···F [33, 34], однако менее сильные, чем в I. Ион F– (F(4)), расположенный в центре симметрии, вовлечен в ВС с шестью комплексными катионами, связанными между собой инверсионной осью третьего порядка (рис. 3) (N(3)···F(4) 2.829(4), N(3)–H(1) 0.87, H(1)···F(4) 1.96 Å, угол NHF 173°), а ион F– (F(6)), расположенный на оси третьего порядка, вовлечен лишь в слабые ВС C–H···F (C(3)···F(6) (x, –y – 1/2, –z – 1/2) 3.42(2), C(3)–H(2) 0.96, H(2)···F(6) 2.84 Å, угол NHF 119°).
В результате комплексные катионы [Co(DH)2(Thio)2]+, объединяясь через ВС, образуют трехмерную решетку, полости которой заняты анионами F– и [PF6]–.
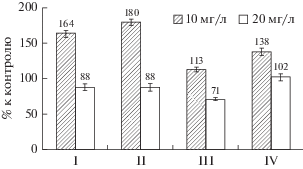
Одним из основных параметров, который может указать на толерантность микроорганизмов к ксенобиотикам, проникающих из внешней среды, является процесс накопления биомассы. Поэтому в первую очередь было определено влияние координационных соединений на рост культуры порфиридиума.
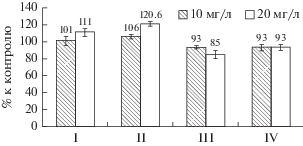
При добавлении в питательную среду комплексных соединений в концентрации 10 мг/л, накопление биомассы микроводоросли P. cruentum существенно не изменилось (рис. 4). При наличии в среде комплексов II и IV произошло несущественное снижение (на 7%) биомассы микроводоросли. При концентрации 20 мг/л изучаемых комплексов наблюдается изменение процесса накопления биомассы P. cruentum. Так, наличие в питательной среде 20 мг/л комплекса III привело к увеличению биомассы микроводоросли на 20%. При добавлении соединения II произошло снижение биомассы порфиридиума на 15%, а при добавлении 20 мг/л комплекса IV реакция культуры микроводоросли идентична той, которая наблюдалась при концентрации 10 мг/л.
Рис. 4.
Биомасса (% к контролю) микроводоросли P. cruentum, полученная при выращивании в присутствии комплексов кобальта.
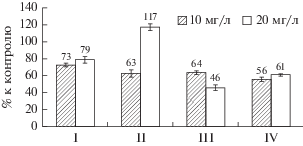
Накопление белков в биомассе является важным показателем биосинтетической активности микроводорослей.
При концентрации 10 мг/л соединений в среде происходит увеличение содержания белков в биомассе порфиридиума (рис. 5). Так, coединения I и III, при добавлении которых не наблюдалось ингибирование роста культуры микроводоросли, обеспечивают увеличение содержания белка в биомассе на 64–80% по сравнению с контролем. Повышение содержания белка на 38% наблюдается также в опытах с применением комплекса IV, а соединение II в той же концентрации (10 мг/л) не приводит к изменению содержания белка в биомассе. При концентрации 20 мг/л координационные соединения I–III ингибируют биосинтез белка, содержание которого в биомассе на 20–30% ниже, чем в контроле, а соединение IV в этой же концентрации не приводит к изменению содержания белков в биомассе.
Рис. 5.
Coдержание белков (% к контролю) в биомассе P. cruentum, полученное при выращивании в присутствии комплексов кобальта.
Эффект стимуляции биосинтеза белков сопровождается также изменением других биосинтетических параметров микроводоросли. Повышение содержания липидов в биомассе порфиридиума на 17% наблюдалось при добавлении в питательную среду комплекса III в концентрации 20 мг/л (рис. 6). При концентрации 10 мг/л данного соединения, наоборот, происходит снижение содержания липидов в биомассе на 37% по сравнению с контролем. Добавление в питательную среду соединения I в концентрациях 10 и 20 мг/л приводит к снижению содержания липидов на 19–27% по сравнению с контролем.
Рис. 6.
Coдержание жиров (% к контролю) в биомассе P. cruentum, полученное при выращивании в присутствии комплексов кобальта.
Эффект значительного снижения содержания липидов в биомассе порфиридиума, более чем на 30%, зарегистрирован в опытах с применением соединений II и IV, а в случае применения комплекса IV было установлено, что сокращение содержания липидов не зависит от его концентрации в питательной среде.
Таким образом, получены новые диоксиматы I и II и определена структура комплексного соединения I, в котором заряд комплексного катиона компенсируется одновременно двумя разными фторсодержащими анионами: F– и [PF6]–. Результаты исследования влияния этих соединений, а также III и IV на физиологические процессы красной микроводоросли Porphyridium cruentum показали, что комплекс III в концентрации 20 мг/л стимулирует накопление биомассы микроводоросли (нa 20%) и содержание липидов в биомассе (на 17%) и может быть предложен в качестве специфического стимулятора роста в рамках биотехнологий культивирования порфиридиума.
Список литературы
Рудик В., Бульмага B., Кирияк T., Чапурина Л. // Альгология. 2003. Т. 13. № 3. С. 322.
Grecu I., Neamţu M., Enescu L. Implicaţii biologice şi medicale ale chimiei anorganice. Iaşi, 1982. 300 p.
Frausto da Silva J.J.R., Williams R.J.P. The Biological Chemistry of the Elements: The Inorganic Chemistry of Life. Oxford Univ. Press, 2001. 650 p.
Bresciani-Pahor N., Farcolin M., Marzilli L.G. et al. // Coord. Chem. Rev. 1985. V. 63. № 4. P. 1.
Mokhir A., Krämer R., Voloshin Y.Z, Varzatskii O.A. // Bioorg. Med. Chem. Lett. 2004. V. 14. № 11. P. 2927.
Naur P., Petersen B.L., Mikkelsen M.D. et al. // Plant Physiol. 2003. V. 133. P. 63.
Симонов Ю.А., Кравцов В.Х., Гэрбэлэу Н.В. и др. // Журн. неоргaн. химии. 1999. Т. 44. № 9. С. 1468.
Боурош П.Н, Коропчану Э.Б., Симонов Ю.А и др. // Коорд. химия. 2002. Т. 28. № 9. С. 689 (Bourosh P.N., Coropceanu E.B., Simonov Y.A. et al. // Russ. J. Coord. Chem. 2002. V. 28. P. 647. doi 10.1023/A:1020095101054).
Боурош П.Н., Коропчану Э.Б., Симонов Ю.А. и др. // Журн. неоргaн. химия. 2002. Т. 47. № 10. С. 1604.
Малиновский С.Т., Коропчану Э.Б., Болога О.А. и др. // Журн. структур. химии. 2007. Т. 48. № 3. С. 532.
Рижа A., Коропчану Э., Болога О. и др. // Журн. неоргaн. химия. 2013. Т. 58. № 4. С. 506 (Rija A., Coropceanu E., Bologa O. et al. // Russ. J. Inorg. Chem. 2013. V. 58. P. 440. doi 10.1134/S0036023613040153).
Боурош П.Н, Коропчану Э.Б., Чилоч А.А и др. // Коорд. химия. 2013. Т. 39. № 11. С. 669 (Bourosh P.N., Coropceanu E.B., Ciloci A.A. et al. // Russ. J. Coord. Chem. 2013. V. 39. P. 777. doi 10.1134/ S107032841311002X).
Чиобэникэ О., Боурош П., Лозан В. и др. // Журн. неоргaн. химия. 2011. Т. 56. № 7. С. 1114 (Chiobenika O., Bourosh P., Lozan V. et al. // Russ. J. Inorg. Chem. 2011. V. 56. P. 1050. // doi 10.1134/S0036023611070060).
Гуля A.П., Рудик В.Ф., Гэрбэлэу Н.В. и др. А.С. СССР № 1616111. 1990.
Десятник А.А., Гэрбэлэу Н.В., Коропчану Э.Б. и др. // Коорд. химия. 2002. Т. 28. № 2. С. 144 (Desyatnik A.A., Gerbeleu N.V., Koropchanu E.B. et al. // Russ. J. Coord. Chem. 2002. V. 28. P. 135. doi 10.1023/A:1014240303176).
Coropceanu E., Bologa O., Deseatnic A. et al. // Bul. Instit. Politehnic din Iaşi. 2003. V. 49(53). № 5. P. 293.
Coropceanu E., Deseatnic A., Rija A. et al. // Chem. J. Mold. 2008. V. 3. № 2. P. 70.
Коропчану Э.Б., Кроитор Л., Чилочи А.А. и др. // Коорд. химия. 2017. Т. 43. № 7. С. 399 (Coropceanu E., Croitor L., Ciloci A. et al. // Russ. J. Coord. Chem. 2017. V. 43. P. 433. doi 10.1134/S1070328417070053).
Rebolloso F.M.M., Acien F.G.G., Sanchez P.J.A., Guil G.J.L. // Food Chem. 2000. V. 70. P. 345.
Rudic V., Chiriac T., Cojocari A. et al. Ficobiotehnologie – cercetări fundamentale şi realizări practice. Chişinău: ed. Elena SRL, 2007. 365 p.
Рижа А.П., Коропчану Э.Б., Болога О.А. и др. // Журн. структур. химии. 2007. Т. 48. № 6. С. 1197.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. № 1. P. 112.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Downloaded from www.jbc.org by on March 31, 2008. P. 265.
Johnson K.R., Ellis G., Toothill C. // Clin. Chem. 1977. V. 23. № 9. P. 1669.
Marusteri M. Noţiuni fundamentale de biostatistica. Univ. Târgu Mureş, 2006. 219 p.
Накамото К. Инфракрасные спектры неорганических и координационных соединений. Москва: Mир, 1966. 411 с.
Allen F.H. // Acta Crystallogr. B. 2002. V. 58. № 3–1. P. 380.
Lentz C., Schott O., Auvray T. et al. // Inorg. Chem. 2017. V. 56. № 18. P. 10835.
Chaudhuri P., Winter M., Della Vedova B.P.C. et al. // Inorg. Chem. 1991. V. 30. № 25. P. 4777.
Jacques A., Schott O., Robeyns K. et al. // Eur. J. Inorg. Chem. 2016. P. 1779.
Engtrakul C., Shoemaker W.J., Grzybowski J.J. et al. // Inorg. Chem. 2000. V. 39. № 22. P. 5161.
Kumar P., Singh A.K., Sharma S., Pandey D.S. // J. Organomet. Chem. 2009. V. 694. P. 3643.
Huhn A., Geue R.J., Sargeson A.M., Willis A.C. // Chem. Commun. 1989. № 21. P. 1648.
Hayashi A., Nakajima K., Nonoyama M. // Polyhedron. 1997. V. 16. № 23. P. 4087.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия