Координационная химия, 2019, T. 45, № 3, стр. 186-192
Кристаллическая структура и свойства [Co(NH3)6][PdCl4]Cl
Е. В. Волчкова 1, *, А. В. Чураков 2, Е. С. Пятахина 3, Л. А. Носикова 1, **
1 МИРЭА – Российский технологический университет
Москва, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
3 Научно-производственный комплекс “Суперметалл” им. Е.И. Рытвина
Московская область, пос. Андреевка, Россия
* E-mail: volchkovaev@bk.ru
** E-mail: nosikova_lyubov@mail.ru
Поступила в редакцию 06.07.2018
После доработки 20.09.2018
Принята к публикации 22.08.2018
Аннотация
Получены и охарактеризованы комплексы [Co(NH3)6][PdCl4]Cl (I) и [Co(NH3)6]2[PtCl4]3 (II). Комплекс I выделен впервые. Состав, строение и структуры комплексов подтверждены методами РСА (CIF file CCDC № 1830657), РФА, ИК-спектроскопии, элементного анализа. Термическое разложение комплекса I на воздухе приводит к образованию трехфазного продукта: Pd (пр. гр. Fm3m), PdO (пр. гр. P$\bar {4}$n2) и Co3О4 (пр. гр. Fd3m); комплекса II – двухфазного продукта, состоящего из металлической платины Pt (пр. гр. Fm3m) и оксида кобальта Co3О4 (Fd3m). Выявлена возможность получения однофазного продукта (твердого раствора на основе драгметалла и кобальта) либо термическим разложением соответствующих двойных комплексных соединений в токе водорода, либо химическим восстановлением с использованием раствора N2H4 · HCl.
Гетероядерные двойные комплексные соединения (ДКС), содержащие в катионной и анионной комплексных частях центральные атомы разных металлов, интересны как с точки зрения расширения научных основ координационной химии, так и в качестве предшественников порошковых полиметаллических материалов. Наличие уже в самом соединении разных металлов способствует образованию при термическом или химическом разрушении таких ДКС однофазных полиметаллических порошков [1–5], проявляющих высокую каталитическую активность в разнообразных процессах, зачастую превышающую каталитическую способность монометаллических порошков благородных металлов [6–8].
К настоящему времени значительное количество работ посвящено исследованию взаимодействия растворов, содержащих аммиачные комплексы [M(NH3)5Х]2+ (M = Co(III), Cr(III), Rh(III), Ir(III), Ru(III), Х = ацидолиганд) и хлорокомплексы платиновых металлов с зарядом анионной части 2– [9, 10], приводящего, как правило, к образованию ДКС с мольным соотношением металлов равным 1 : 1. Следует отметить, что образование ДКС зачастую происходит в результате смешения растворов, содержащих исходные комплексы металлов и не вызывает экспериментальных трудностей.
Взаимодействие хлорокомплексов платины(II, IV) и палладия(II) с катионом гексаамминокобальта(III) [Co(NH3)6]3+ изучено в гораздо меньшей степени. Первые упоминания о взаимодействии лутеосоли [Co(NH3)6]Cl3 c растворами, содержащими платиновые металлы, относятся ко второй половине ХIХ в. [11, 12]. Так, В. Гиббс [11] показал, что хлорокомплексы иридия, платины, родия и палладия в этих условиях образуют осадки двойных соединений. Однако состав и свойства образующихся соединений детально не исследованы. Ранее мы показали [13] и позже в [14] было подтверждено, что при взаимодействии [Co(NH3)6]3+ с раствором, содержащим тетрахлороплатинат(II)-ионы, в твердую фазу выделяется комплекс [Co(NH3)6]2[PtCl4]3.
Цель настоящей работы – выделение двойного комплексного соединения на основе катиона [Co(NH3)6]3+ и аниона [PdCl4]2–, a также сопоставление состава и свойств данного соединения c комплексом [Co(NH3)6]2[PtCl4]3, синтезируемого в аналогичных условиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали CoCl2 ⋅ 6H2O квалификации “х. ч.”; K2[PtCl6] квалификации “ч.”, PdCl2 квалификации “ч.”, Аурат). Реагенты NH4Cl, N2H4 · HCl, NH3, неорганические кислоты, имели квалификацию “х. ч.”. Исходные комплексы K2[PtCl4], K2[PdCl4], [Co(NH3)6]Cl3 синтезировали по методикам, описанным в [15, 16].
Комплексы [Co(NH3)6]2[PtCl4]3 и [Co(NH3)6]-[PdCl4]Cl выделяли смешением солянокислых растворов (рН 2), содержащих исходные комплексы платиновых металлов(II) [MCl4]2– (М = = Pd(II), Pt(II)), и [Co(NH3)6]3+ ($с _{{{\text{Pd,Pt,Co}}}}^{{{\text{и с х }}}}$ = = 0.01 моль/л) при комнатной температуре. Образующиеся через ~1 ч осадки отфильтровывали, промывали спиртом и сушили при 30–40°C на воздухе.
Хлорид тетрахлоропалладат(II) гексаамминокобальта(III) [Co(NH3)6][PdCl4]Cl (I) выделяется в виде мелких пластинок бордового цвета. Выход продукта 70.9%.
| Найдено, %: | H 3.9; | N 17.9; | Cl 40.3; | Со 12.5; | Pd 24.6. |
| Для H18N6Cl5CoPd (M = 444.78) | |||||
| вычислено, %: | H 4.05; | N 18.9; | Cl 39.9; | Со 13.3; | Pd 23.9. |
Монокристалл I выращивали по следующей методике. К 3 мл раствора K2[PdCl4] в 0.01 М НСl медленно приливали 2 мл раствора [Co(NH3)6]Cl3 в 0.01 М НСl ($с _{{{\text{Pd,Co}}}}^{{{\text{и с х }}}}$ = 0.01 моль/л). Исходное мольное отношение Pd : Co = 1.5 : 1. Через неделю отделяли кристаллы от маточника, промывали водой и сушили в эксикаторе до постоянной массы.
Комплекс [Co(NH3)6]2[PtCl4]3 (II) представляет собой кристаллический осадок оранжевого цвета. Выход продукта 71.6%.
| Найдено, %: | H 2.50; | N 12.9; | Cl 32.0; | Со 8.58; | Pt 43.9, |
| Для H36N12Cl12Co2Pt3 | |||||
| вычислено, %: | H 2.70; | N 12.6; | Cl 31.9; | Со 8.84; | Pt 43.9, |
Выделенные соединения мало растворимы в воде и 0.1–2 М HCl, не растворимы в метиловом и этиловом спирте, эфире, хлороформе, толуоле, метилене, гептане и четыреххлористом углероде, растворимы в 2–3 М растворах HCl при нагревании.
Маточные растворы и растворы, полученные растворением навесок выделенных соединений, анализировали на содержание платиновых металлов по известным спектрофотометрическим методикам с дихлоридом олова [17]; анализ на кобальт проводили комплексонометрическим методом [18].
ЭСП солянокислых растворов регистрировали на спектрофотометре SPECORD UV-Visible H-elios в интервале длин волн 200–1000 нм в кварцевых кюветах толщиной поглощающего слоя 1 см. ИК-спектры поглощения записывали на ИК-Фурье спектрометре Eq.55 фирмы Bruker в диапазоне частот 200–4000 см–1. Дифференциальный термический анализ образцов проводили на воздухе на дериватографе Q-1500 D (Паулик–Паулик–Эрдей; MOM, Венгрия) с одновременной записью четырех кривых: дифференциальной (DTA), температурной (Т), дифференциально-термогравиметрической (DTG) и интегральной кривой изменения массы (TG) с использованием программно-аппаратного комплекса, разработанного ООО ИП Тетран, в среде LabVIEW 8.21 фирмы National Instruments (Остин, Техас, США). Температуру измеряли термопарой платина–платинородий (ПП-1) с погрешностью ±5°С в интервале температур 20–1000°C при скорости нагрева 10 град/мин, используя в качестве стандарта α-Al2O3. Масса навески составляла 50–100 мг (погрешность взвешивания ±0.4 мг). Разложение комплексов в токе водорода проводили в трубчатой печи в кварцевых лодочках при Т = = 500–550°C в течение 2 ч.
Пикнометрическую плотность [Co(NH3)6] [PdCl4]Cl и [Co(NH3)6]2[PtCl4]3 с использованием ультратермостата марки U10 определяли по методике [19] при температуре 20°C (I) и 22°C (II). Пикнометрическую плотность (ρп) рассчитывали по формуле: ρп = (m2 – m0)ρж/[(m1 – m0) – (m3 – m2)], где m0 – масса пустого пикнометра, г; m1 – масса пикнометра с CCl4, г; m2 – масса пикнометра с пробой порошка, г; m3 – масса пикнометра с пробой порошка и CCl4, г; ρж – плотность CCl4, 1.594 г/см3 (20°C), 1.590 г/см3 (22°C).
Порошки металлов из растворов получали следующим образом. Навески комплексов [Co(NH3)6] [PdCl4]Cl или [Co(NH3)6]2[PtCl4]3 массой 0.1 ± ± 0.001 г растворяли в 50 мл 3 М HCl. Раствором щелочи доводили значение pH до 11–12 по индикаторной бумаге, затем вносили каплю раствора N2H4 · HCl с концентрацией 1 моль/л, сразу наблюдали образование мелкого черного порошка. Также разложение комплексов осуществляли обработкой навески вещества 1 М раствором NaOH и добавлением к пульпе при перемешивании раствора N2H4 · HCl с концентрацией 1 моль/л. Мгновенно происходило образование черного порошка. Порошки отделяли от маточного раствора декантацией, многократно промывали водой и сушили при 40°C до постоянной массы.
Рентгенофазовый анализ (РФА) полученных ДКС и продуктов их термолиза выполняли на дифрактометрах ДРОН‑3 (графитовый монохроматор), Bruker D8 (Ni-фильтр) и HZG-4 (Ni-фильтр): CuKα-излучение, вращение образца непрерывный (1 град/мин) b – пошаговый (шаг 0.02°, экспозиция 10 с) режимы в интервале углов 2θ 20–100. Качественный РФА проводили сравнением рентгенометрических данных синтезированных образцов и фаз, принадлежащих этой системе и изоструктурных с ними, с использованием автоматизированной порошковой базы данных ICDD PDF-2.
РСА выполнен на автоматическом дифрактометре Enraf-Nonius CAD4 при комнатной температуре (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор). Кристаллы I (M = 444.78) тетрагональные, пр. гр. P42212, a = 15.490(2), c = = 11.307(3) Å, V = 2713.0(9) Å3, Z = 8, ρ(выч.) = = 2.178 г/см3, μ(MoKα) = 3.506 мм–1, F(000) = 1744. Интенсивности 13350 отражений (из них 2661 независимых, Rint = 0.0376) измерены с использованием ω-сканирования в интервале 2.23° < θ < 25.96° (–19 ≤ h ≤ 3, –19 ≤ k ≤ 19, –13 ≤ l ≤ 13). Экспериментальные данные скорректированы с учетом факторов Лоренца и поляризации [20]. Адсорбционная коррекция введена на основе измерений интенсивностей эквивалентных отражений (программа XPREP в пакете SHELXTL [21]). Структура расшифрована прямым методом и уточнена полноматричным анизотропным МНК по F 2 для всех неводородных атомов (SHELXTL). Все H-атомы помещены в рассчитанные положения и уточнены по модели “наездника” с учетом вращения вокруг связей Co–N. Окончательные значения R1 = 0.0238, wR2 = 0.0530 для 2183 отражений с I > 2σ(I) и 126 параметров уточнения. GOOF = 1.086, Δρmax, Δρmin = 0.438, –0.558 e/Å3. Параметр абсолютной структуры 0.13(4). РСА выполнен в ЦКП ИОНХ РАН.
Кристаллографические данные структуры I депонированы в Кэмбриджском банке структурных данных (КБСД № 1830657; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Размер частиц определяли с помощью анализатора Delsa Nano (Beckman Coulter, Germany).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При взаимодействии изученных разнозарядных комплексных ионов Co(III) и Pd(II) или Pt(II) (комплексный катион имеет заряд +3, анион заряд –2) ожидаемо выделение ДКС с мольным отношением металлов, отличным от 1 : 1. Однако мы выявили, что взаимодействие раствора, содержащего катионы [Co(NH3)6]3+ с растворами, содержащими хлорокомплексы платиновых металлов [МCl4]2– (М = Pd(II) или Pt(II)) приводит к образованию двойных комплексных соединений, различающихся не только природой платинового металла, но и строением. Если в качестве исходного соединения выступает тетрахлороплатинат(II) калия, то кристаллизуется комплекс II с мольным соотношением металлов Co : Pt = 1 : 1.5, независимо от заданного исходного мольного соотношения ионов металлов в смешиваемых растворах (Сo : Pt = 1 : (0.5–2.5)). Если же в качестве исходного комплекса выступает тетрахлоропалладат(II) калия, выделяется соединение I [Co(NH3)6] [PdCl4]Cl, в котором мольное соотношение металлов Co : Pd = 1 : 1 также независимо от исходного соотношения ионов металлов Co(III) и Pd(II) в смешиваемых растворах. Данный комплекс I выделен впервые.
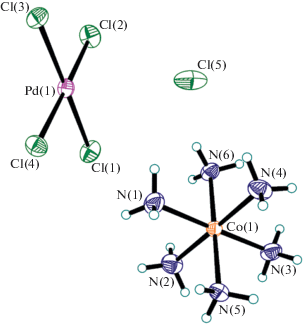
Структура I состоит из октаэдрического катиона [Co(NH3)6]3+, квадратного аниона [PdCl4]2– и хлорид-аниона (рис. 1). Все структурные единицы расположены в общих положениях. Катион представляет собой почти правильный октаэдр с цис-углами NCoN в пределах 87.71(15)°–91.64(15)° и длинами связей Co–N 1.960(3)–1.969(3) Å. Анион [PdCl4]2– – почти правильный квадрат с цис-углами ClPdCl 89.23(6)°–91.30(4)° и расстояниями Pd–Cl 2.3051(12)–2.3115(13) Å. Согласно данным КБCД [22], длины связей Co–N и Pd–Cl имеют в I обычные значения для комплексных ионов [Co(NH3)6]3+ и [PdCl4]2–.
Все восемнадцать атомов водорода аминогрупп участвуют в водородных связях (ВС) N–H···Cl как со всеми атомами хлора иона [PdCl4]2–, так и с хлорид-анионом; пять из этих ВС бифуркатные типа Cl···H(N)···Cl. Расстояния N···Cl составляют 3.253(3)–3.650(3) Å, углы N–H···Cl варьируют в пределах 111°–173°. Многочисленные ВС приводят к возникновению в кристалле сложного 3D-связанного супрамолекулярного мотива.
Пикнометрическая плотность комплекса I (2.19 ± 0.02 г/см3) и II (2.94 ± 0.02 г/см3) согласуется с данными по расчету рентгеновской плотности: 2.178 г/см3 (I, 20°C) и 2.938 г/см3 (II, 22°C [14]).
В табл. 1 приведены положения полос поглощения в ИК-спектрах комплексов I, II и их отнесение. В ИК-спектрах соединений сохраняются полосы поглощения, отвечающие колебаниям исходных комплексных ионов: [Co(NH3)6]3+ и [MCl4]2– (M = Pd(II), Pt(II)) [23]. Однако замена хлорид-иона в [Co(NH3)6]Сl3 на анионные комплексные хлориды платиновых металлов приводит к некоторым изменениям в положениях полос поглощений связей в ИК-спектрах синтезированных комплексов. Наиболее чувствительными к замене анионного окружения оказались колебания связи N–H. Так, в ИК-спектре комплекса II валентные колебания связи N–H ν(NH3) претерпевают высокочастотный сдвиг (33 см–1 для νas(NH3) и 21 см–1 для νs(NH3)), что свидетельствует об усилении связи N–H во внутренней сфере катиона [Co(NH3)6]3+ по сравнению с [Co(NH3)6]Сl3 за счет ослабления ВС между комплексными катионом и анионом. Для комплекса I наблюдается другая картина: происходит уширение и расщепление полос ν(NH3) на две компоненты. Это можно объяснить различным анионным окружением катиона [Co(NH3)6]3+ в соединении I, составляющим хлорид- и [PdCl4]2–-анионы. Также наблюдаемые изменения и расщепления в положениях полос поглощения деформационных и маятниковых колебаний связей N–H (область 1620–800 см–1) в ИК-спектрах обоих комплексов свидетельствуют о некотором искажении симметрии октаэдра [Co(NH3)6]3+ при образовании двойных комплексных соединений.
Таблица 1.
Положение полос поглощения в ИК-спектрах комплексов [Co(NH3)6]Сl3, [Co(NH3)6][PdCl4]Cl и [Co(NH3)6]2[PtCl4]3 и их отнесение
| Отнесение | [Co(NH3)6]Сl3 [23] | [Co(NH3)6][PdCl4]Cl | [Co(NH3)6]2[PtCl4]3 |
|---|---|---|---|
| νas(NH3) | 3240 | 3272, 3251 ш. с | 3273 ш. с |
| νs(NH3) | 3160 | 3150, 3118 ш. с | 3181 ш. с |
| δas(НNH) | 1619 | 1606 с | 1610 ш. с |
| δs(НNH) | 1329 | 1330 оч. с | 1341, 1323 оч. с |
| ρr(NH3) | 831 | 849 ш. с | 828 оч. с |
| ν(Co–N) | 498 477 449 |
497 сл. ш 480 ср. ш 433 ср. ш |
493 461 432 |
| δ(НNH) | 331 | 333 с | 325 |
| ν(M–Cl) (М = Pd(II), Pt(II)) | 322 с | 312 |
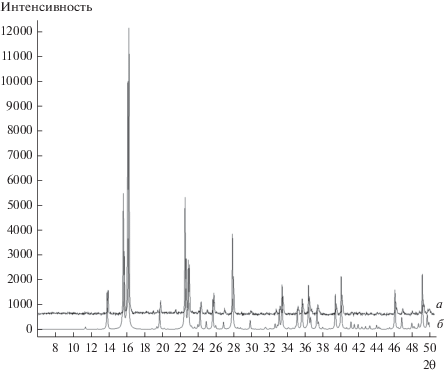
Сравнение дифрактограмм полученных продуктов I, II и исходных соединений показало, что пики отражения последних на дифрактограмме I, II отсутствуют. Экспериментальная дифрактограмма для полученного в данной статье соединения II и рассчитанная для него же на основании литературных монокристальных данных [14] представлены на рис. 2.
Рис. 2.
Экспериментальная (а) и рассчитанная из монокристальных данных (б) дифрактограммы комплекса [Co(NH3)6]2[PtCl4]3.
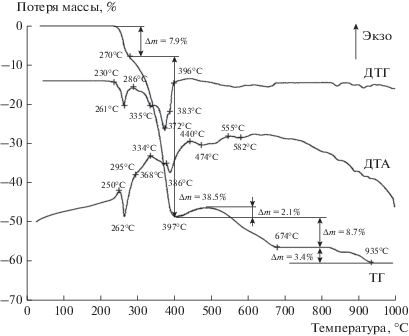
Исследована термическая устойчивость выделенных ДКС и фазовый состав продуктов разложения (разложение проводили на воздухе). В качестве примера на рис. 3 приведена термогравиграмма соединения I.
Разложение комплекса I протекает в ряд трудноразделимых стадий. Начало разложения 230°C. При 270°C наблюдается излом на кривой потери массы (TG). При этом образец теряет 7.9% от исходной массы, что может быть связано с удалением внешнесферного иона хлора (теоретическая потеря массы 7.97%). Эта стадия сопровождается узким сильным эндоэффектом с максимумом при 262°C. Основная потеря массы (38.5%) происходит в диапазоне температур 27–397°C. Далее до 491°C на кривой TG наблюдается увеличение массы образца на 2.1%, что, по-видимому, обусловлено процессами окисления металлов. Это подтверждается наличием экзоэффекта с максимумом на кривой производной DTA при 440°C. В диапазоне температур 65–900°C масса образца практически не меняется и не наблюдаются термические эффекты. Полное разложение заканчивается при 935°C; в интервале 900°–935°C происходит уменьшение массы на 3.4%. Суммарная потеря массы составляет 58.5%. РФА продукта термолиза выявил три фазы: металлический палладий Pd (пр. гр. Fm3m), следы оксида палладия PdO (пр. гр. P$\bar {4}$n2) и оксид кобальта Co3О4 (пр. гр. Fd3m).
Комплекс II оказался термически менее устойчив, чем I. Его разрушение начинается уже при 130°С и протекает через ряд трудно разделимых стадий, сопровождающихся слабо выраженными эндоэффектами (максимумы при 260 и 348°С). Процесс разложения завершается при 620°С. Конечное значение потери массы соответствует разложению комплекса до металлической платины и оксида кобальта Co3О4 (потеря массы составила 43.1%, масса остатка практическая 21.5 мг, рассчитанная на сумму: платина и оксид кобальта – 21.2 мг). РФА продукта термолиза подтвердил наличие двух фаз: металлической платины Pt (пр. гр. Fm3m) и оксида кобальта Co3О4 (пр. гр. Fd3m). Таким образом, в процессе термического разрушения комплексов на воздухе не образуются однофазные продукты.
Исследование продуктов термолиза комплексов I и II в токе водорода показало, что в восстановительной атмосфере продуктами термического разложения являются твердые растворы на основе платиновых металлов. В табл. 2 приведены рентгенометрические данные продуктов восстановления обоих комплексов. Для продукта восстановления I получено значение параметра элементарной ячейки: а = 3.748 ± 0.005 Å, соответствующее твердому раствору Pd−50% ат. Co (параметр, приводимый в базе данных ICDD PDF-2 65-6075 аα-Co,Pd = 3.750 Å (пр. гр. Fm3m)). Биметаллические частицы, полученные термолизом в токе водорода, имеют средний диаметр частиц 5.9 мкм.
Таблица 2.
Рентгенометрические данные продукта термолиза I и II в токе водорода
| Продукт разрушения | Pd (пр. гр. Fm3m) 89-4897 |
Pt (пр. гр. Fm3m) 04-0802 |
|||||
|---|---|---|---|---|---|---|---|
| I | II | ||||||
| 2θ | Iотн, % | 2θ | Iотн, % | 2θ | Iотн, % | 2θ | Iотн, % |
| 41.72 | 100 | 41.14 | 100 | 40.119 | 100 | 39.76 | 100 |
| 48.54 | 44 | 47.84 | 46 | 46.664 | 44 | 46.24 | 53 |
| 71.08 | 21 | 70.00 | 34 | 68.128 | 21 | 67.45 | 31 |
| 85.92 | 21 | 84.50 | 37 | 82.112 | 21 | 81.28 | 33 |
Параметр ячейки гомогенной фазы в образце, полученном термическим разложением II в токе водорода, a = 3.799 ± 0.004 Å соответствует твердому раствору на основе платины PtxCo1–x (параметр аPt = 3.923 Å, приводимый в базе данных ICDD PDF-2 04-0802, параметр кубической ячейки интерметаллида CoPt3${{a}_{{{\text{CoP}}{{{\text{t}}}_{3}}}}}$ = 3.831 Å [24]).
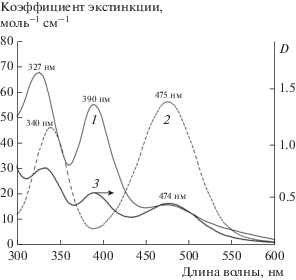
Мы выявили, что выделенные соединения I, II растворимы в 2–3 М соляной кислоте, что позволило охарактеризовать состояние комплексных ионов в растворах методом электронной спектроскопии. На рис. 4 приведены ЭСП индивидуальных растворов, полученных растворением соединений – предшественников в солянокислых растворах: K2[PtCl4] и [Co(NH3)6]Cl3 – и раствора, полученного растворением 0.02 г навески II в 3 М HCl (25 мл раствора). В ЭСП раствора, полученного растворением ДКС, наблюдаются широкая полоса поглощения при 333 нм с плечом при 327 нм. Полосы поглощения при 390 и 476 нм, которые, как хорошо видно из рис. 4, являются совокупностью спектров исходных комплексов, что свидетельствует о сохранении комплексных сфер при растворении ДКС без изменений. ЭСП раствора, полученного растворением навески I в 3 М HCl также представляет собой совокупность спектров, отвечающих поглощению [Co(NH3)6]3+-катиона и [PdCl4]2–-аниона.
Рис. 4.
ЭСП растворов, полученных растворением комплексов: K2[PtCl4] в 3 М HCl (1); [Co(NH3)6]Cl3 в 0.01 М HCl (2), [Co(NH3)6]2[PtCl4]3 в 3 М HCl (3).
Мы опробовали возможность получения гомогенных биметаллических порошков химическим восстановлением либо из растворов, содержащих растворенные ДКС, либо восстановлением из пульпы, состоящей из комплекса I и 1 М раствора NaOH. В качестве восстановителя использовали раствор N2H4 · HCl.
Во всех опытах наблюдали фактически мгновенное образование осадков черного цвета. Степень извлечение суммы металлов в твердый продукт составила более 99.9%.
Дифрактограммы продуктов восстановления имеют расширенные рефлексы, что косвенно свидетельствует об ультрадисперсном состоянии частиц. Из рентгенограмм продукта восстановления комплекса I из раствора мы выявили одну фазу, соответствующую твердому раствору PdxCo1 – x. Оксидные фазы и металлический кобальт в образце не обнаружены.
Получаемые восстановлением из растворов биметаллические частицы имеют размеры 2–3 мкм. Получение наноразмерных порошков требует дополнительного подбора условий.
Таким образом, впервые выделен и охарактеризован комплекс [Co(NH3)6][PdCl4]Cl. Показано, что термическое разложение комплексов [Co(NH3)6] [PdCl4]Cl и [Co(NH3)6]2[PtCl4]3 на воздухе приводит к образованию многофазных продуктов, содержащих металлические и оксидные фазы. Получение однофазного продукта – твердого раствора на основе драгметалла и кобальта – происходит в результате термического восстановления в токе водорода или химического восстановления с использованием в качестве восстановителя раствора N2H4 · HCl.
Список литературы
Шубин Ю.В., Коренев С.В. // ХХ Менделеевский съезд по общей и прикладной химии. Тезисы докладов. Екатеринбург, 2016. С. 130.
Asanova T.I., Asanov I.P., Zadesenets A.V. et al. // J. Nanopart. Res. 2013. V. 15. № 10. P. 1994. doi 10.1007/s11051-013-1994-6
Печенюк С.И., Семушина Ю.П., Михайлова Н.Л., Иванов Ю.В. // Коoрд. химия. 2015. Т. 41. № 3. С. 157 (Pechenyuk S.I., Semushina Y.P., Mikhailova N.L., Ivanov Y.V. // Russ. J. Coord. Chem. 2015. V. 41. № 3. P. 175. doi 10.1134/S1070328415020086).
Zadesenets A., Filatov E., Plyusnin P. et al. // Polyhedron. 2011. V. 30. № 7. P. 1305. doi 10.1016/j.poly. 2011.02.012
Мартынова С.А., Юсенко К.В., Корольков М.В., Громилов С.А. // Коoрд. химия. 2007. Т. 33. № 7. С. 541 (Martynova S.A., Yusenko K.V., Korol’kov I.V. et al. Russ. J. Coord. Chem. 2007. V. 33. P. 530. doi 10.1134/ S1070328407070093).
Chen Y., Mao J., Shen R. et al. // Nano Res. 2017. V. 10. № 3. P. 890. doi 10.1007/s12274-016-1344-y
Олексенко Л.П., Луценко Л.В. // Журн. физ. химии. 2013. Т. 87. № 2. С. 200. doi 10.7868/S0044453713020210
Эллерт О.Г., Цодиков М.В., Николаев С.А., Новоторцев В.М. // Успехи химии. 2014. Т. 83. № 8. С. 718 (Ellert O.G., Tsodikov M.V., Nikolaev S.A., Novotortsev V.M. // Russ. Chem. Rev. 2014. V. 83. № 8. Р. 718. doi 10.1070/RC2014v083n08ABEH004432).
Печенюк С.И., Домонов Д.П. // Журн. структур. химии. 2011. Т. 52. № 2. С. 419 (Pechenyuk S.I., Domonov D.P. // J. Struct. Chem. 2011. V. 52. № 2. P. 412. doi 10.1134/S0036023610050128).
Коренев С.В., Венедиктов А.Б., Шубин Ю.В. и др. // Журн. структур. химии. 2003. Т. 44. № 1. С. 58 (Korenev S.V., Venediktov A.B., Shubin Yu.V. et al. // J. Struct. Chem. 2003. V. 44. № 1. P. 46. doi 10.1023/ A:1024980930337).
Gibbs W. // Am. J. Sci. Arts. 1864. V. 57. № 109. P. 57. https://archive.org/details/mobot31753002152640/ page/56.
Rogojski J.B. // J. Prakt. Chem. 1852. 56. S. 496.
Волчкова Е.В., Буслаева Т.М., Лютикова Е.К. и др. // Платиновые металлы в современной индустрии, водородной энергетике и в сферах жизнеобеспечения будущего “Берлин – ПМ’2010”: материалы IV Междунар. конф. Берлин, 2010. С. 348.
Avisar-Levy M., Levy O., Ascarelli O. et al. // J. Alloys Compd. 2015. V. 635. P. 48. doi 10.1016/j.jallcom. 2015.02.073
Справочник. Синтез комплексных соединений металлов платиновой группы / Под ред. Черняева И.И. М.: Наука, 1972. 616 с.
Ключников Н.Г. Руководство по неорганическому синтезу. М.: Химия, 1997. 316 с.
Гинзбург С.И., Езерская Н.А. Аналитическая химия платиновых металлов. М.: Наука, 1972. 614 с.
ГОСТ 12560.1-78. Сплавы палладий-серебряно-кобальтовые. Метод определения кобальта и серебра.
ISO 8130-3:1992. Coating Powders. Pt. 3: Determination of Density by Liquid Displacement Pycnometer. Geneva, 1992. 8 p.
Harms K. XCAD4. Program for the Lp-Correction of Nonius CAD4 Data. Marburg (Germany), 1997.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. № 1. P. 112.
Groom C.R., Bruno I.J., Lightfoot M.P., Ward S.C. // Acta Crystallogr. B. 2016. № 72. P. 171.
Накамото К. ИК-спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991. 536 с.
Справочник. Диаграммы состояния двойных металлических систем. Т. 2 / Под ред. Лякишева Н.П. М.: Машиностроение, 1997. 1024 с.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия