Координационная химия, 2019, T. 45, № 7, стр. 411-419
Синтез и структура продуктов комплексообразования в системе GeO2–винная кислота–CuCl2–1,10-фенантролин
И. И. Сейфуллина 1, Е. Э. Марцинко 1, *, Е. А. Чебаненко 1, Э. В. Афанасенко 1, С. В. Шишкина 2, 3, В. В. Дьяконенко 2
1 Одесский национальный университет им. И.И. Мечникова
Одесса, Украина
2 Институт монокристаллов НАН Украины
Харьков, Украина
3 Харьковский национальный университет им. В.Н. Каразина
Харьков, Украина
* E-mail: lborn@ukr.net
Поступила в редакцию 17.12.2018
После доработки 21.01.2019
Принята к публикации 25.01.2019
Аннотация
Впервые из системы GeO2–винная кислота (H4Tart)–CuCl2–1,10-фенантролин (Phen) выделены катион-анионные координационные соединения на основе комплексов меди(II) с Phen и тартратогерманатных анионов [Cu(Phen)3]2[Ge2(OH)(HTart)(µ-Tart)2] · 11H2O (I) и [CuCl(Phen)2]4[{Ge2(OH)2-(µ-Tart)2}Cl2] · 4Н2О (II), различные по составу и строению (CIF files CCDC № 1878102 (І), 1878103 (ІІ)). В структурах I, II присутствуют одинаковые мостиковые тартратные анионы. Особенность I – наличие дополнительного аниона HTart3–, который не выполняет функцию мостика, а координируется бисхелатно, вакантными остаются гидроксильная и карбоксильная группы; диссоциация последней приводит к образованию тартратогерманатного аниона с зарядом –4.
Ранее при исследовании комплексообразования биологически активного германия в системах GeO2(GeCl4)–винная кислота (H4Tart)–соль d‑металла–H2O выделить и структурно охарактеризовать соответствующие гетерометаллические координационные соединения не удалось [1]. В результате замены водной среды 50%-ным раствором CH3COOH были получены продукты с мольным соотношением M : Ge : Tart = 2 : 2 : 3, где M = Mn2+, Co2+, Ni2+, Cu2+, Zn2+ [2]. Методом РСА установлено, что структурными единицами кристаллов комплекса [Cu2(Н2О)10Ge2(µ-Tart)3]n · 3nH2O являются полимерные анионы $\left[ {{\text{G}}{{{\text{e}}}_{{\text{2}}}}{{{\left( {\mu {\text{ - Tart}}} \right)}}_{{\text{3}}}}} \right]_{n}^{{{\text{4}}n--}},$ фрагменты Cu(H2O)5 и кристаллизационные молекулы воды [3]. В продолжение этих исследований решено было перейти к изучению продуктов комплексообразования в более сложной системе GeO2–винная кислота–CuCl2–Phen–H2O/C2H5OH. Основанием для выбора указанного гетероароматического амина в качестве второго лиганда послужила его способность к структурированию сложных гомо- и гетерометаллических разнолигандных координационных соединений [4–9]. При этом Phen, как и тартратогерманатные комплексы Cu(II), относится к биологически активным соединениям [10, 11], представляющим интерес в качестве перспективных субстанций низкотоксичных лекарственных препаратов с широким спектром фармакологического действия [12].
Цель настоящего исследования – определить, в зависимости от концентрации исходных реагентов и их мольных соотношений в рассматриваемой системе, условия выделения продуктов комплексообразования, установить их состав, структуру и сравнить с ранее охарактеризованными тартратогерманатами различных металлов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза комплексов использовали исходные реагенты фирмы Sigma-Aldrich: GeO2 (99.999%), D-винная кислота С4H6О6 (99%), CuCl2 · · 2H2O (99.99%) (≥98%) и 1,10-фенантролин (99%).
Элементный анализ выполняли с помощью полуавтоматического C,N,H-анализатора Elemental Analyzer CE-440. Содержание германия и меди определяли методом атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой на приборе Optima 2000 DV фирмы Perkin-Elmer, хлора – меркурометрически [13].
ИК-спектры поглощения (400–4000 см–1) комплексов в виде таблеток с KBr записывали на спектрофотометре Frontier фирмы Perkin Elmer.
Синтез [Cu(Phen)3]2[Ge2(OH)(HTart)(µ-Tart)2] · · 11H2O (I) проводили при мольном соотношении GeO2 : H4Tart = 2 : 3, CuCl2 : Phen = 2 : 6. Навески GeO2 (0.5 ммоль) и винной кислоты (0.75 ммоль) растворяли при кипячении в 100 мл воды и упаривали при 50°С до объема 10 мл. К охлажденному до комнатной температуры раствору прибавляли 10 мл 95%-ного этанольного раствора, содержащего Phen (0.75 ммоль) и CuCl2 (0.25 ммоль). Через сутки получили кристаллический осадок синего цвета. Монокристаллы, пригодные для РСА, отбирали из реакционной среды. Выход 60%.
ИК-спектр (ν, см–1): 3061 νs(C–H), 1667 νas(СОО–), 1585, 1518 ν(C–Cаром), 1423 νs(СОО–), 1343 ν(С–N), 1278 δ(С–ОН), 1082 ν(С–О), 852 δ(Ge–OH), 651 ν(Ge–O).
| Найдено, %: | С 50.25; | Н 3.98; | N 8.32; | Cu 6.43; | Ge 7.34. |
| Для С84H78O30N12Cu2Ge2 (I) | |||||
| вычислено, %: | С 50.20; | Н 3.88; | N 8.37; | Cu 6.37; | Ge 7.23. |
Синтез [CuCl(Phen)2]4[{Ge2(OH)2(µ-Tart)2}Cl2] · · 4Н2О (II) проводили по той же методике, как для соединения I, но при мольном соотношении GeO2 : H4Tart = 2 : 2, CuCl2 : Phen = 2 : 4. Кристаллический осадок сине-зеленого цвета образовывался в течение суток и содержал монокристаллы, пригодные для РСА. Выход 70%.
ИК-спектр (ν, см–1): 3064 νs(C–H), 1685 νas(СОО–), 1583, 1516 ν(C–Cаром), 1427 νs(СОО–), 1342 ν(С–N), 1075 ν(С–О), 851 δ(Ge–OH), 662 ν(Ge–O).
| Найдено, %: | С 50.94; | Н 3.21; | N 9.08; | Cl 8.63; | Cu 10.37; | Ge 5.92. |
| Для С104H78O18N16Cl6Cu4Ge2 (II) | ||||||
| вычислено, %: | С 50.89; | Н 3.18; | N 9.14; | Cl 8.69; | Cu 10.44; | Ge 5.84. |
Кристаллы соединения I (M = 2007.84 г/моль) моноклинные, пр. гр. P21, a = 15.084(1), b = = 21.8032(9), c = 15.547(1) Å, β = 116.248(8)°, V = = 4586.1(5) Å3, Z = 2, T = 294.0 K, μ(MoKα) = = 1.193 мм–1, ρ(выч.) = 1.454 г/см3. Измерено 39488 отражений, 17469 независимых (Rint = 0.091). Окончательные значения R1 = 0.082 (для 9300 отражений с интенсивностью I > 2σ(I)), wR2 = 0.219 (для всех отражений), S = 0.955.
Кристаллы соединения II (M = 2451.86 г/моль): моноклинные, пр. гр. C2, a = 30.390(3), b = = 14.225(2) Å, c = 15.955(2) Å, β = 116.96(1)°, V = = 6147(1) Å3, Z = 2, T = 100 K, μ(MoKα) = 1.356 мм–1, ρ(выч.) = 1.325 г/см3. Измерено 23695 отражений, 9703 независимых (Rint = 0.065). Окончательные значения R1 = 0.096 (для 8276 отражений с интенсивностью I > 2σ(I)), wR2 = 0.254 (для всех отражений), S = 1.040.
РСА соединений I и II проведен на дифрактометре Xcalibur-3 (MoKα-излучение, ССD-детектор, графитовый монохроматор, ω-сканирование). Структуры расшифрованы прямым методом и уточнены по F 2 полноматричным МНК в анизотропном приближении для неводородных атомов (SHELXTL) [14, 15]. Положения атомов водорода выявлены из разностного синтеза электронной плотности и уточнены по модели “наездника” с Uизо = nUэкв неводородного атома, связанного с атомом Н (n = 1.5 для молекул воды и n = 1.2 для остальных атомов водорода).
Координаты атомов, а также полные таблицы длин связей и валентных углов депонированы в Кембриджском банке структурных данных (CCDC № 1878102 (І), 1878103 (ІІ); deposit@ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Данные ИК-спектроскопии комплексов интерпретировали в сравнении с винной кислотой и ранее синтезированными тартратогерманатами [2]. Общим для ИК-спектров I и II является отсутствие полосы 1738 см–1, соответствующей валентным колебаниям ν(С=О) винной кислоты, и появление широких интенсивных полос 1667 (I), 1685 см–1 (II) и 1423 (I), 1427 см–1 (II), обусловленные колебаниями νаs(СОО–) и νs(СОО–) соответственно и свидетельствующие о том, что все карбоксильные группы депротонированы и связаны. Зафиксированы полосы (см–1): 651 (I), 662 (II) ν(Ge–O); 852 (I), 851 (II) δ (Ge–OH); 1082 (I), 1075 (II) ν(С–О) алкоголятного типа, а также 1585, 1518 (I), 1583, 1516 (II) скелетных колебаний кольца C–C; 3061 (I), 3064 (II) νs(C–Hаром); 1343 (I), 1342 (II) ν(С–N), характерных для Phen.
Особенностью комплекса I является наличие в его составе двух различных форм лиганда: мостикового Tart4– и немостикового бидентатно связанного с атомом германия HTart3–. Это согласуется с присутствием в ИК-спектре I полосы 1278 см–1, обусловленной колебаниями δ(С–ОН) вакантной гидроксигруппы HTart3– и полосы ионизированной карбоксилатной группы при 1519 см–1, заряд которой компенсирует комплексный катион.
Из данных РСА следует, что I и II представляют собой комплексные соединения катион-анионного типа, в которых роль аниона выполняют [Ge2(OH)- (HTart)(µ-Tart)2]4– в I и [{Ge2(OH)2(µ-Tart)2}Cl2]4– в II, а катионов – два [Cu(Phen)3]2+ в I и четыре [CuCl(Phen)2]+ в II. Анион в структуре II находится в частном положении на оси симметрии второго порядка. Комплексы I и II существуют в кристалле в виде кристаллогидратов состава 1 : 11 (I) или 1 : 4 (II).
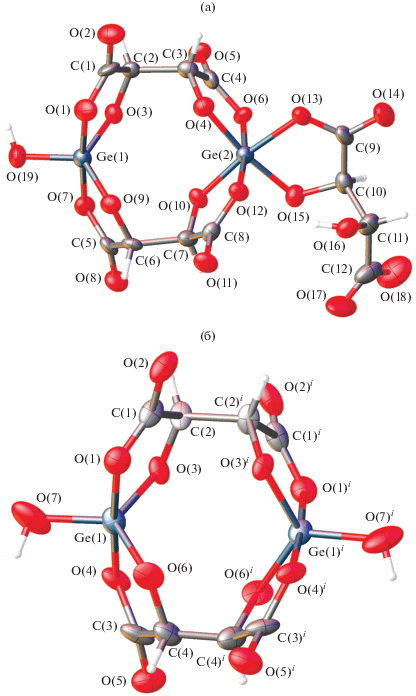
Анион [Ge2(OH)(HTart)(µ-Tart)2]4– в структуре I – комплексное биядерное соединение (рис. 1а). Атомы Ge(1) и Ge(2) в анионе имеют разные типы координации. Координационный полиэдр (КП) атома Ge(1) – искаженная тригональная бипирамида, в экваториальной плоскости которой находятся атомы О(19), О(9), О(3), в аксиальных положениях – атомы О(1), О(7). Параметр Аддисона [16] τ5 = 0.81 (валентные углы в КП приведены в табл. 1). Параметр τ определяется как τ = (α – β)/60, α > β (α и β – наибольшие углы в КП); τ = 1 для тригональной бипирамиды и τ = 0 для квадратной пирамиды. Значения длин связей Ge(1)–O изменяются в пределах 1.731(9)–1.917(10) Å, значения валентных углов ОGe(1)O в аксиальном направлении – в пределах 87.5(5)°–92.2(6)°, в экваториальном направлении – 116.7(6)°–126.3(5)°. Координационный полиэдр атома Ge(2) – искаженный октаэдр, образованный шестью атомами кислорода трех молекул винной кислоты. При этом две молекулы винной кислоты с обеими депротонированными карбоксильными и гидроксильными группами между атомами Ge(1) и Ge(2) мостиковые, третья молекула винной кислоты представляет собой концевой лиганд с депротонированными гидроксильными и одной карбоксильной группой. Длины связей Ge(2)–O в структуре I изменяются в пределах 1.832(11)–1.979(9) Å, валентные углы ОGe(2)O – в пределах 83.5(5)°–93.7(4)°. Такое строение комплекса, а также распределение длин связей и валентных углов в КП согласуется со строением анионов, образованных с участием винной кислоты, описанных ранее [2, 17].
Таблица 1.
Некоторые длины связи (Å) и валентные углы (град) в соединениях I и II
| Связь | d, Å | Связь | d, Å | Связь | d, Å |
|---|---|---|---|---|---|
| I | |||||
| Ge(2)–O(12) | 1.939(9) | Ge(1)–O(9) | 1.775(9) | Cu(1)–N(6) | 2.142(8) |
| Ge(2)–O(15) | 1.832(11) | Ge(1)–O(1) | 1.917(10) | Cu(2)–N(8) | 2.056(8) |
| Ge(2)–O(10) | 1.829(8) | Ge(1)–O(19) | 1.731(9) | Cu(2)–N(12) | 2.121(7) |
| Ge(2)–O(6) | 1.917(9) | Cu(1)–N(2) | 2.070(6) | Cu(2)–N(9) | 2.093(7) |
| Ge(2)–O(4) | 1.836(10) | Cu(1)–N(5) | 2.082(7) | Cu(2)–N(10) | 2.067(7) |
| Ge(2)–O(13) | 1.979(9) | Cu(1)–N(1) | 2.151(8) | Cu(2)–N(7) | 2.170(9) |
| Ge(1)–O(3) | 1.765(9) | Cu(1)–N(4) | 2.177(7) | Cu(2)–N(11) | 2.232(8) |
| Ge(1)–O(7) | 1.911(10) | Cu(1)–N(3) | 2.168(8) | ||
| II | |||||
| Cu(1)–Cl(1) | 2.272(4) | Cu(2)–Cl(2) | 2.264(3) | Ge(1)–O(6) | 1.783(7) |
| Cu(1)–N(2) | 2.150(10) | Cu(2)–N(5) | 2.080(9) | Ge(1)–O(3) | 1.771(5) |
| Cu(1)–N(3) | 2.012(11) | Cu(2)–N(6) | 1.978(10) | Ge(1)–O(4) | 1.872(6) |
| Cu(1)–N(4) | 2.100(9) | Cu(2)–N(8) | 1.982(5) | Ge(1)–O(7) | 1.802(15) |
| Cu(1)–N(1) | 1.978(9) | Cu(2)–N(7) | 2.177(5) | Ge(1)–O(1) | 1.929(11) |
| Угол | ω, град | Угол | ω, град | Угол | ω, град |
| I | |||||
| O(12)Ge(2)O(13) | 89.9(4) | O(3)Ge(1)O(1) | 87.8(5) | N(3)Cu(1)N(4) | 77.0(4) |
| O(15)Ge(2)O(12) | 92.9(4) | O(7)Ge(1)O(1) | 175.4(4) | N(6)Cu(1)N(1) | 99.2(4) |
| O(15)Ge(2)O(6) | 93.7(4) | O(9)Ge(1)O(7) | 87.8(4) | N(6)Cu(1)N(3) | 94.0(4) |
| O(15)Ge(2)O(4) | 170.2(4) | O(9)Ge(1)O(1) | 90.3(5) | N(8)Cu(2)N(12) | 92.9(4) |
| O(15)Ge(2)O(13) | 83.5(5) | O(19)Ge(1)O(3) | 116.7(6) | N(8)Cu(2)N(9) | 90.8(3) |
| O(10)Ge(2)O(12) | 86.4(4) | O(19)Ge(1)O(7) | 92.4(5) | N(8)Cu(2)N(10) | 167.4(4) |
| O(10)Ge(2)O(15) | 89.8(4) | O(19)Ge(1)O(9) | 117.0(6) | N(8)Cu(2)N(7) | 78.7(4) |
| O(10)Ge(2)O(6) | 90.8(4) | O(19)Ge(1)O(1) | 92.2(5) | N(8)Cu(2)N(11) | 94.7(4) |
| O(10)Ge(2)O(4) | 100.0(4) | N(2)Cu(1)N(1) | 77.7(4) | N(12)Cu(2)N(7) | 94.1(3) |
| O(10)Ge(2)O(13) | 172.2(4) | N(2)Cu(1)N(4) | 92.4(4) | N(12)Cu(2)N(11) | 76.0(4) |
| O(6)Ge(2)O(12) | 172.8(4) | N(2)Cu(1)N(3) | 92.4(3) | N(9)Cu(2)N(7) | 98.3(4) |
| O(6)Ge(2)O(13) | 93.6(5) | N(2)Cu(1)N(6) | 96.3(4) | N(9)Cu(2)N(11) | 91.9(4) |
| O(4)Ge(2)O(12) | 87.8(4) | N(5)Cu(1)N(1) | 94.5(4) | N(10)Cu(2)N(12) | 98.4(3) |
| O(4)Ge(2)O(6) | 86.1(4) | N(5)Cu(1)N(4) | 94.5(4) | N(10)Cu(2)N(9) | 79.3(3) |
| O(4)Ge(2)O(13) | 86.7(5) | N(5)Cu(1)N(3) | 96.5(4) | N(10)Cu(2)N(7) | 94.9(4) |
| O(3)Ge(1)O(7) | 90.0(5) | N(5)Cu(1)N(6) | 78.1(4) | N(10)Cu(2)N(11) | 93.4(3) |
| O(3)Ge(1)O(9) | 126.3(4) | N(1)Cu(1)N(4) | 91.1(4) | ||
| II | |||||
| N(2)Cu(1)Cl(1) | 114.0(3) | N(5)Cu(2)Cl(2) | 141.6(3) | O(6)Ge(1)O(4) | 88.1(2) |
| N(3)Cu(1)Cl(1) | 93.0(3) | N(5)Cu(2)N(7) | 107.4(3) | O(6)Ge(1)O(7) | 118.6(5) |
| N(3)Cu(1)N(2) | 102.0(4) | N(6)Cu(2)Cl(2) | 92.9(3) | O(6)Ge(1)O(1) | 90.1(4) |
| N(3)Cu(1)N(4) | 80.7(4) | N(6)Cu(2)N(5) | 81.8(4) | O(3)Ge(1)O(6) | 120.9(3) |
| N(4)Cu(1)Cl(1) | 140.8(3) | N(6)Cu(2)N(8) | 172.8(3) | O(3)Ge(1)O(4) | 90.2(2) |
| N(4)Cu(1)N(2) | 105.2(4) | N(6)Cu(2)N(7) | 103.2(2) | O(3)Ge(1)O(7) | 120.5(5) |
| N(1)Cu(1)Cl(1) | 91.4(3) | N(8)Cu(2)Cl(2) | 93.1(2) | O(3)Ge(1)O(1) | 87.7(4) |
| N(1)Cu(1)N(2) | 81.1(4) | N(8)Cu(2)N(5) | 91.1(3) | O(4)Ge(1)O(1) | 176.0(4) |
| N(1)Cu(1)N(3) | 173.0(4) | N(8)Cu(2)N(7) | 78.3(2) | O(7)Ge(1)O(4) | 90.8(5) |
| N(1)Cu(1)N(4) | 92.5(4) | N(7)Cu(2)Cl(2) | 110.8(2) | O(7)Ge(1)O(1) | 93.1(6) |
В отличие от структуры I, анион в структуре II представляет собой комплексное биядерное соединение, образованное за счет бидентантной координации атомов Ge двумя депротонированными молекулами винной кислоты. Анион находится в частном положении на оси 2. Координационный полиэдр атома Ge(1) в II – искаженная тригональная бипирамида, в экваториальной плоскости которой находятся атомы О(3), О(7), О(6), в аксиальной позициях – атомы О(1), О(4) (рис. 1б). Параметр Аддисона τ5 = 0.9; значения валентных углов ОGeO изменяются в пределах 87.7(4)°–93.1(6)° и 118.6(5)°–120.9(5)° (табл. 1). Значения длин связей Ge(1)–O изменяются в пределах 1.771(5)–1.929(11) Å; значения валентных углов ОGe(1)O – в пределах 87.5(5)°–92.2(6)° и 116.7(6)°–126.3(5)° (табл. 1). Такое строение комплекса II согласуется со строением анионов, описанных ранее [2].
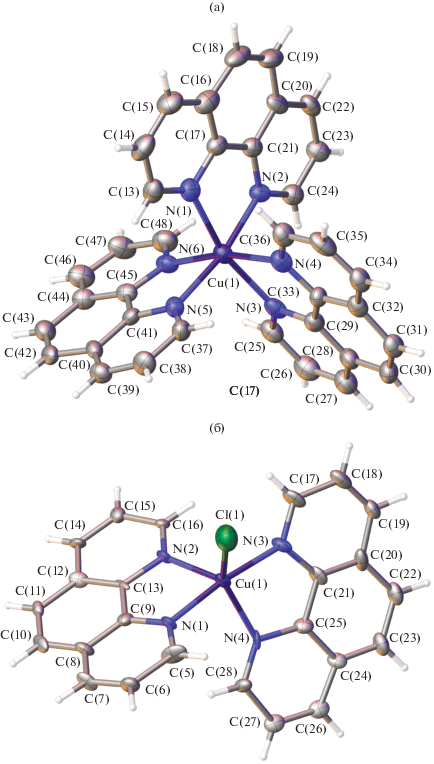
В симметрически независимой части элементарной ячейки структуры I находятся два катиона [Cu(Рhen)3]2+: А (Cu(1)) и Б (Cu(2)), в которых атомы меди связаны с тремя молекулами Phen (рис. 2а). Координационные полиэдры катионов меди в структуре I – октаэдры. Длины связей Cu–N в катионах А и Б изменяются в пределах 1.959(9)–2.001(11) Å, валентные углы NСuN – в пределах 75.9(3)°–99.2(4)° (табл. 1).
В структуре II координационные полиэдры двух симметрически независимых катионов [Cu(Phen)2Cl]+ – А (Cu(1)) и Б (Cu(2)) – представляет собой искаженную тригональную бипирамиду (рис. 2б). В экваториальной плоскости находятся атомы N(2), N(4), Cl(1) в катионе А и N(5), N(7), Cl(2) в катионе Б, в аксиальных позициях – атомы N(1), N(3) и N(6), N(8) в катионах А и Б соответственно. Параметры Аддисона τ5 равны 0.6 и 0.5 для катионов А и Б соответственно. В аксиальном направлении валентные углы NCuN изменяются в пределах 78.3(2)°–103.1(3)°, NCuCl 91.4(3)°–93.1(2)°. В экваториальном направлении валентные углы NCuN изменяются в пределах 105.2(4)°–107.4(3)°, а NCuCl – 110.8(2)°–141.6(3)° (табл. 1). Длины связей Сu(1)–N изменяются в пределах 1.978(9)–2.087(3) Å, Сu–Cl 2.272(4) и 2.264(3) Å для катионов А и Б соответственно (табл. 1).
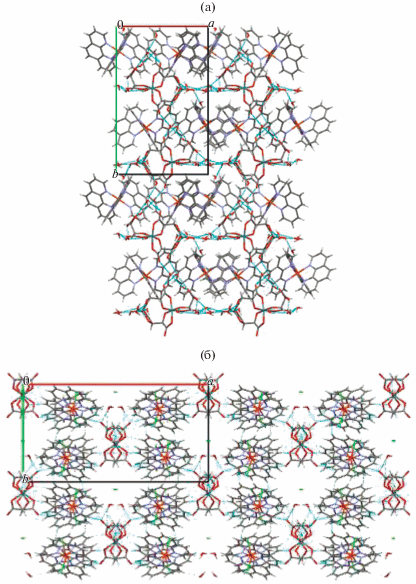
В кристаллической структуре соединений I и II анионы, катионы, а также кристаллизационные молекулы воды образуют чередующиеся слои, параллельные кристаллографическим плоскостям ac и bc для I и II соответственно (рис. 3). Образующиеся слои можно разделить на два вида: 1) содержащие анионы и молекулы воды; 2) содержащие катионы типов А и Б. Слои в структуре I объединены межмолекулярными водородными связями О–Н···О, в структуре II – слабыми водородными связями С–Н···О (табл. 2).
Таблица 2.
Геометрические характеристики водородных связей в соединениях I и II
| D–H···A | Расстояние, Å | D–H…A, град | |
|---|---|---|---|
| H···A | D···A | ||
| I | |||
| O(16)–H(16)···O(12) | 2.26 | 3.062(15) | 165 |
| O(19)–H(19A)···O(21) | 1.93 | 2.72(3) | 162 |
| O(29)–H(29A)···O(30) | 2.14 | 2.81(2) | 136 |
| O(29)–H(29B)···O(23) | 1.97 | 2.82(3) | 177 |
| O(20)–H(20A)···O(5)i | 1.97 | 2.801(16) | 166 |
| O(20)–H(20B)···O(11) | 2.08 | 2.836(16) | 148 |
| O(30)–H(30B)···O(33) | 2.04 | 2.79(2) | 146 |
| O(24)–H(24B)···O(33) | 2.02 | 2.84(3) | 164 |
| O(22)–H(22A)···O(19) | 1.97 | 2.798(16) | 163 |
| O(22)–H(22B)···O(23)ii | 2.60 | 2.72(2) | 90 |
| O(32)–H(32A)···O(31) | 2.10 | 2.93(3) | 165 |
| O(32)–H(32B)···O(2)iii | 1.97 | 2.80(2) | 161 |
| O(23)–H(23A)···O(22)iv | 2.16 | 2.72(2) | 139 |
| O(31)–H(31A)···O(11)v | 2.20 | 2.99(2) | 152 |
| O(31)–H(31B)···O(17)v | 1.97 | 2.82(3) | 168 |
| O(28)–H(28A)···O(18)v | 2.15 | 3.00(3) | 170 |
| O(28)–H(28B)···O(24)vi | 2.01 | 2.85(3) | 165 |
| O(25)–H(25A)···O(16)vii | 2.19 | 3.01(3) | 160 |
| O(25)–H(25B)···O(20)vii | 2.02 | 2.86(3) | 165 |
| O(21)–H(21A)···O(28) | 2.39 | 3.12(5) | 145 |
| O(26)–H(26A)···O(27) | 2.11 | 2.95(4) | 164 |
| O(26)–H(26B)···O(15)v | 2.03 | 2.87(2) | 163 |
| O(27)–H(27A)···O(18)v | 1.76 | 2.57(3) | 157 |
| O(27)–H(27B)···O(22) | 2.01 | 2.87(3) | 179 |
| II | |||
| C(16)–H(16)···O(5) | 2.16 | 3.089(14) | 167 |
| O(7)–H(7A)···O(9)viii | 2.07 | 2.78(2) | 141 |
| O(8)–H(8A)···O(5) | 2.11 | 2.923(17) | 159 |
Установлено, что введение Phen в реакционную систему приводит к образованию различных катион-анионных комплексов I и II с исходными соотношениями GeO2 : H4Tart = 2 : 3 и 2 : 2 соответственно. Это отличает их от синтезированного ранее координационного полимера постоянного состава [Cu2(Н2О)10Ge2(µ-Tart)3]n · 3nH2O, выделенного в условиях различных концентраций реагентов [3]. Особенность структуры I: дополнительный тартратный анион не выполняет функцию мостика, а координируется бисхелатно, вакантными остаются гидроксильная и карбоксильная группы, диссоциация последней приводит к образованию тартратогерманатного аниона с зарядом –4. Его компенсация происходит за счет электростатического взаимодействия с двумя катионами [Cu(Phen)3]2+. В составе комплекса II присутствуют два вида анионов: димер [{Ge2(OH)2(µ-Tart)2}]2–, подобный K4[Ge2(OH)2(µ-Tart)2]2 · 9H2O [18], и два хлоридных иона, суммарный заряд которых нейтрализуют четыре однозарядных катиона [CuCl(Phen)2]+. Таким образом, в зависимости от комплексного аниона в I, II формируются различные по составу комплексные катионы Cu с 1,10-фенантролином.
Список литературы
Амбросов И.В., Алешин С.В., Алимбарова Л.М. и др. // Разработка и регистрация лекарственных средств. 2015. № 2. С. 144.
Сейфуллина И.И., Марцинко Е.Э. Координационные соединения германия(IV) с анионами лимонной, винной и ксиларовой кислот. Одесса: ОНУ, 2015. 148 с.
Сейфуллина И.И., Илюхин А.Б., Марцинко Е.Э. и др. // Журн. неорган. химии. 2014. Т. 59. № 4. С. 452 (Seifullina I.I., Ilyukhin A.B., Martsinko E.E. et al. // Russ. J. Inorg. Chem. 2014. V. 59. P. 298. https://doi.org/10.1134/ S0036023614040172).
Seifullina I.I, Martsinko E.E, Chebanenko E.A. et al. // Chem. J. Moldova. 2017. V. 12. № 2. P. 52.
Huan-Yu L., Fen-Ying W., Guo-Yong W. et al. // Acta Crystallogr. E. 2006. V. 62. P. m111.
Yang-Yang H., Li-Na X., Yan W. et al. // Polyhedron. 2013. V. 56. P. 152.
Vreshch O.V., Nesterova O.V., Kokozay V.N. et al. // Z. Anorg. Allg. Chem. 2009. V. 635. P. 2316.
Rusanova J.A., Kozachuka O.V., Dyakonenko V.V. // Acta Crystallogr. E. 2013. V. 69. P. m391.
Polyanskaya T.M., Drozdova M.K., Volkov V.V. // J. Struct. Chem. 2010. V. 51. № 6. P. 1139.
Seifullina, I.I., Martsinko, E.E., Afanasenko E.V. // Visn. Odes. nac. univ. Him. 2015. V. 20. № 4. P. 6.
Hamdani H.E, Amane M.E., Atmani Z., Haddad M. // J. Mater. Environ. Sci. 2016. V. 7. № 9. P. 3100.
Менчиков Л.Г., Игнатенко М.А. // Хим.-фарм. журн. 2012. Т. 46. № 11. С. 3.
Ключников Н.Г. Руководство по неорганическому синтезу. М.: Химия, 1965. 104 с.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Addison A.W., Rao N., Reedijk J. et al. // Dalton Trans. 1984. № 7. P. 1349.
Марцинко Е.Э., Сейфуліна И.И., Чебаненко Е.А. и др. // Вестник Одесского нац. ун-та. Химия. 2018. Т. 23. № 1. С. 6.
Миначева Л.Х., Сейфуллина И.И., Илюхин А.Б. и др. // Коорд. химия. 2013. Т. 39. № 11. С. 643 (Mi-nacheva L.K., Seifullina I.I., Ilyukhin A.B. et al. // Russ. J. Coord. Chem. 2013. V. 39. № 11. P. 751. doihttps://doi.org/ 10.1134/S1070328413110043).
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия