Координационная химия, 2019, T. 45, № 7, стр. 420-426
Комплексы Zn(II) и Сu(II) c аминопроизводными дезоксихолевой кислоты: синтез, структура, свойства
Т. Е. Кокина 1, 2, *, О. В. Саломатина 3, И. И. Попадюк 3, Л. А. Глинская 1, И. В. Корольков 1, 2, Л. А. Шелудякова 1, 2, М. И. Рахманова 1, Н. Ф. Салахутдинов 2, 3
1 Институт неорганической химии им. А.В. Николаева СО РАН
Новосибирск, Россия
2 Новосибирский национальный исследовательский государственный университет
Новосибирск, Россия
3 Новосибирский институт органической химии им. Н.Н. Ворожцова СО РАН
Новосибирск, Россия
* E-mail: kokina@niic.nsc.ru
Поступила в редакцию 07.12.2018
После доработки 29.01.2019
Принята к публикации 11.02.2019
Аннотация
Синтезированы комплексы [Zn(L)Cl2] (I), Cu(L)Cl2 ∙ H2O (II), Zn(L1)Cl2 ∙ 0.5H2O (III) и Cu(L1)Cl2 ∙ 0.5H2O (IV), где L и L1 – диаминопропилен- и диаминоэтиленпроизводные дезоксихолевой кислоты соответственно. Методом РСА (CIF file CCDC № 1875305) определена структура одноядерного комплекса I. Координационный полиэдр атома Zn Cl2N2 – искаженный тетраэдр. По данным РФА, кристаллы соединений III и IV изоструктурны. Методом ИК-спектроскопии показано, что комплексы II–IV имеют строение, подобное строению комплекса I. В твердой фазе соединения L и L1 обладают фотолюминесценцией в видимой области спектра (λmax = 440 и 415 нм соответственно). Комплексообразование с ионами Zn2+ не привело к изменению фотолюминесцентных свойств L и L1.
Изучение комплексообразования ионов металлов с органическими соединениями на основе веществ растительного и животного происхождения относится к актуальным направлениям координационной и бионеорганической химии [1, 2]. В последнее десятилетие внимание исследователей привлекают желчные кислоты и продукты их модификации, обладающие антипролиферативной, противоопухолевой, противомикробной и другими видами биологической активности [3–6]. Желчные кислоты, являющиеся метаболитами стероидного ряда, содержат гидроксильные и карбоксильные группы и могут выступать в качестве лигандов с образованием комплексов металлов, способных проявлять ценные физико-химические и биологические свойства [7, 8]. Так, комплексы Sn(IV) и Pt(II) с производными желчных кислот обладают противогрибковой и противоопухолевой активностью [9–11]. Введение дополнительных функциональных групп в различные положения стероидного остова позволяет значительно расширить круг новых веществ – производных желчных кислот, в том числе перспективных лигандов для получения координационных соединений разнообразного строения. В [12] описан синтез производных дезоксихолевой кислоты, содержащих в положении С(3) аминогруппы (алифатические и циклические); изучены цитотоксические свойства этих новых соединений. Результаты исследования показали, что некоторые аминопроизводные демонстрировали улучшенную антипролиферативную активность по сравнению с исходной дезоксихолевой кислотой. Изучение возможности комплексообразования с данными производными дезоксихолевой кислоты позволит получить новую группу комплексных соединений с перспективными свойствами.
Цель настоящей работы – синтез комплексов Zn(II) и Cu(II) с аминопроизводными дезоксихолевой кислоты – метиловым эфиром 3β-гидрокси-3α-((3-(диметиламино)пропиламино)метил)-12-оксо-5β-холан-24-овой кислоты (L) и метиловым эфиром 3β-гидрокси-3α-((2-(диметиламино)этиламино)метил)-12-оксо-5β-холан-24-овой кислоты (L1), а также исследование их строения и свойств. Выбор металлов обусловлен участием ионов этих металлов в физиологических процессах живых организмов. Для комплексов Zn(II) возможно проявление люминесцентных свойств, что делает их перспективными в качестве флуоресцентных хемосенсоров.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты L и L1 получали по методике [12]. Для синтеза комплексов использовали ZnCl2, CuCl2 ∙ ∙ 2H2O, изо-PrOH квалификации “ч. д. а.”, EtOH – ректификат.
Синтез [Zn(L)Cl2] (I). К раствору 0.052 г (0.1 ммоль) L в 4 мл EtOH постепенно при перемешивании добавляли раствор 0.014 г (0.1 ммоль) ZnCl2 в 1 мл EtOH. Полученный раствор перемешивали, затем испаряли растворитель до минимально возможного объема (~1–2 мл). Белый осадок отфильтровывали с отсасыванием на пористом стеклянном фильтре, промывали охлажденным изо-PrOH, высушивали в вакуумном эксикаторе. Выход 0.046 г (70%).
Синтез [Cu(L)Cl2] ∙ H2O (II). К раствору 0.052 г (0.1 ммоль) L в 4 мл EtOH постепенно при перемешивании добавляли раствор 0.034 г (0.2 ммоль) CuCl2 ∙ 2H2O в 3 мл EtOH. Полученный раствор перемешивали, затем испаряли растворитель до минимально возможного объема (~1–2 мл). Голубой осадок отфильтровывали с отсасыванием на пористом стеклянном фильтре, промывали охлажденным изо-PrOH, высушивали в вакуумном эксикаторе. Выход 0.030 г (45%).
Синтез [Zn(L1)Cl2] ∙ 0.5H2O (III). К раствору 0.050 г (0.1 ммоль) L1 в 2 мл EtOH постепенно при перемешивании добавляли раствор 0.014 г (0.1 ммоль) ZnCl2 в 2 мл EtOH. Полученный раствор перемешивали, затем испаряли растворитель до минимально возможного объема (~1–2 мл). Белый осадок отфильтровывали с отсасыванием на пористом стеклянном фильтре, промывали охлажденным изо-PrOH, высушивали в вакуумном эксикаторе. Выход 0.050 г (77%).
Синтез [Cu(L1)Cl2] ∙ 0.5H2O (IV). К раствору 0.050 г (0.1 ммоль) L1 в 4 мл смеси изо-PrOH–EtOH (1 : 1 по объему) постепенно при перемешивании добавляли раствор 0.034 г (0.2 ммоль) CuCl2 ∙ 2H2O в 2 мл изо-PrOH. Полученный раствор перемешивали, затем испаряли растворитель до минимально возможного объема (~1–2 мл). Голубой осадок отфильтровывали с отсасыванием на пористом стеклянном фильтре, промывали охлажденным изо-PrOH, высушивали в вакуумном эксикаторе. Выход 0.040 г (60%).
Монокристаллы соединения I, пригодные для РСА, выращивали медленным испарением раствора, полученного при синтезе комплекса I.
Микроанализы на C, H, N выполняли на анализаторе Euro EA 3000. ИК-спектры регистрировали в области 4000–80 см–1на ИК-Фурье-спектрометрах ScimitarFTS 2000 и Vertex 80. Образцы готовили прессованием с KBr для области 4000–400 см–1 и со спектроскопическим полиэтиленом для области 500–80 см–1.
Рентгенофазовый анализ (РФА) поликристаллов соединения I проводили на дифрактометре Shimadzu XRD-7000 (CuKα-излучение, Ni-фильтр, диапазон 5°–50° 2θ, шаг 0.03° 2θ, накопление 1 с). Образцы для исследования готовили следующим образом. Поликристаллы истирали в агатовой ступке в присутствии гептана; полученную суспензию наносили на полированную сторону стандартной кварцевой кюветы; после высыхания гептана образец представлял собой тонкий ровный слой (толщина ∼100 мкм). Дифрактограммы индицировали по данным исследования монокристаллов.
РСА. Для монокристаллов комплекса I параметры элементарный ячейки и интенсивности рефлексов измерены при низкой температуре (150 К) на автодифрактометре Bruker X8 Apex CCD, оснащенном двухкоординатным детектором, по стандартной методике (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор). Кристаллографические характеристики, детали рентгеновского дифракционного эксперимента и уточнение структуры I приведены в табл. 1. Структура решена прямым методом и уточнена полноматричным МНК по F 2 в анизотропном для неводородных атомов приближении по комплексу программ SHELXTL [13]. Позиции всех атомов H определены из разностных синтезов Фурье и включены в уточнение в изотропном приближении. Значения основных межатомных расстояний и валентных углов приведены в табл. 2.
Таблица 1.
Кристаллографические характеристики, детали эксперимента и уточнения структуры комплекса I
| Параметр | Значение |
|---|---|
| М | 655.03 |
| Сингония | Триклинная |
| Пр. гр. | P1 |
| a, Å | 6.5682(7) |
| b, Å | 7.3866(7) |
| c, Å | 18.728(2) |
| α, град | 99.495(3) |
| β, град | 91.224(3) |
| γ, град | 114.96(1) |
| V, Å3 | 808.26(16) |
| Z; ρ(выч.), мг/см3 | 1; 1.346 |
| μ, мм–1 | 0.962 |
| Размеры кристалла, мм | 0.22 × 0.13 × 0.06 |
| Область сканирования по θ, град | 4.44 –61.56 |
| Число измеренных отражений | 15 343 |
| Число независимых отражений | 9454 |
| Rint | 0.0509 |
| Число отражений с I > 2σ(I) | 6544 |
| Число уточняемых параметров | 367 |
| GOOF по F 2 | 0.921 |
| R-фактор (I > 2σ(I)) | R1 = 0.0526, wR2 = 0.0729 |
| R-фактор (по всем Ihkl) | R1 = 0.0955, wR2 = 0.0849 |
| Остаточная электронная плотность (max/min) e/Å3 | 0.60/–0.69 |
| Абсолютный структурный параметр | 0.046(8) |
Таблица 2.
Основные межатомные расстояния (d, Å) и валентные углы (ω, град) в структуре комплекса I*
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Zn(1)–N(1) | 2.047(4) | С(3)–C(26) | 1.519(6) |
| Zn(1)–N(2) | 2.057(4) | C(10)–C(19) | 1.548(6) |
| Zn(1)–Cl(1) | 2.202(1) | C(13)–C(18) | 1.542(6) |
| Zn(1)–Cl(2) | 2.268(1) | C(17)–C(20) | 1.531(6) |
| N(1)–C(30) | 1.479(6) | C(20)–C(21) | 1.532(7) |
| N(1)–C(31) | 1.485(6) | C(20)–C(22) | 1.538(6) |
| N(1)–C(29) | 1.496(5) | C(22)–C(23) | 1.540(7) |
| N(2)–C(27) | 1.490(6) | C(23)–C(24) | 1.488(7) |
| N(2)–C(26) | 1.493(6) | C(27)–C(28) | 1.529(6) |
| O(1)–C(3) | 1.436(5) | C(28)–C(29) | 1.526(6) |
| O(2)–C(12) | 1.216(5) | O(3)–C(25) | 1.445(6) |
| O(3)–C(24) | 1.343(6) | O(4)–C(24) | 1.211(6) |
| Угол | ω, град | Угол | ω, град |
| N(1)Zn(1)N(2) | 101.0(2) | N(1)Zn(1)Cl(2) | 108.8(1) |
| N(1)Zn(1)Cl(1) | 115.2(1) | N(2)Zn(1)Cl(2) | 103.1(1) |
| N(2)Zn(1)Cl(1) | 110.3(1) | Cl(1)Zn(1)Cl(2) | 116.7(1) |
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1875305); deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk/data_request/cif, а также могут быть получены у авторов.
Спектры фотолюминесценции (ФЛ) и возбуждения люминесценции (ВЛ) измеряли на спектрофлуориметре Fluorolog-3 (Horiba Jobin Yvon) с 450 W ксеноновой лампой и двойным монохроматором для поглощения и испускания. Спектры возбуждения записывали от 300 до 500 нм и корректировали на спектральный диапазон интенсивности лампы. Спектры эмиссии записывали от 400 до 700 нм и корректировали на отклик монохроматоров и детектора с использованием спектров коррекции, предоставляемых изготовителем. Первую и вторую гармонику источника возбуждения блокировали с использованием фильтров.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При взаимодействии хлоридов Zn(II) и Cu(II) с L и L1 в среде EtOH получены комплексы I–IV с соотношением М : L = 1 : 1. Синтез комплексов Zn(II) проводили при стехиометрическом соотношении исходных реагентов, а для получения комплексов Cu(II) требуется избыток соли металла.
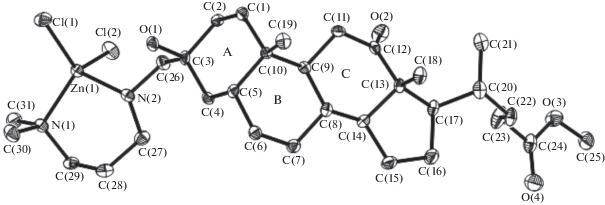
Кристаллическая структура I состоит из изолированных молекул одноядерного комплекса (рис. 1). Атом Zn координирует два атома N бидентатно-хелатного лиганда L, а также два атома Cl в цис-положении. В результате координации L замыкается шестичленный хелатный цикл ZnN2C3, имеющий конформацию кресла: атомы Zn(1) и С(28) отклоняются от плоскости четырех других атомов С на –0.786(4) и 0.732(5) Å соответственно. Полиэдр ZnCl2N2 – искаженный тетраэдр. Значение параметра τ4, характеризующего геометрию координационного полиэдра (КЧ 4), равно 0.91 [14]. Значения длин связей Zn–N, Zn–Cl и величины валентных углов в I сопоставимы с аналогичными значениями в комплексах Zn(II) с производными алифатических диаминов [15–20]. В молекуле комплекса I стероидный фрагмент состоит из конденсированных алициклов (трех шестичленных (А, B, С) и пятичленного). Три шестичленных цикла имеют общие ребра С(5)–C(10) и С(8)–C(9) (рис. 1). Конформация этих циклов – кресло: атомы С(3) и С(10) в А, С(5) и С(8) в В, С(9) и С(13) в С отклоняются от плоскостей четырех других атомов С на 0.646(5) и –0.656(4), 0.671(5) и –0.654(5), 0.631(5) и –0.780(5) Å соответственно. Циклы А и В в комплексе I находятся в цис-сочленении (атом водорода в положении 5 имеет β-конфигурацию). Пятичленный алицикл (D) имеет с шестичленным циклом С общее ребро С(13)–C(14). Конформация цикла D – конверт с отклонением атома С(13) от плоскости четырех других атомов С на –0.651(5) Å.
Рис. 1.
Строение молекулы комплекса I c нумерацией неводородных атомов, атомы Н опущены для ясности, эллипсоиды представлены с 50%-ной вероятностью.
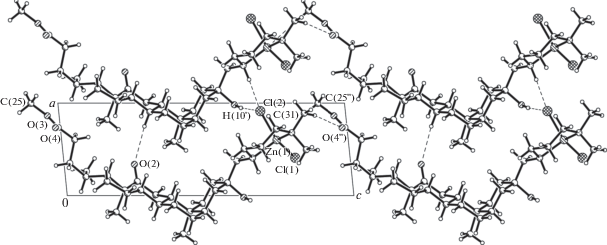
На рис. 2 представлена проекция кристаллической структуры I на плоскость (010). Молекула комплекса с помощью слабых контактов С…O (C(31)…O(4") 3.404(7) Å) взаимодействует с трансляционно идентичной молекулой с образованием зигзагообразной цепочки вдоль оси с. Изгиб наблюдается между двумя циклами А и В, плоские фрагменты в них располагаются под двугранным углом 81.0(2)°. На элементарную ячейку приходится одна такая цепочка, следующая – трансляционно идентична. Кроме того, кратчайшие расстояния между соседними молекулами находятся на уровне ван-дер-ваальсовых взаимодействий: Cl(2)···O(1) 3.298(4) и Cl(2)···N(2) 3.371(4) Å. Расстояния Zn···Zn между цепочками составляют 6.5682(7) Å вдоль оси а и 7.3866(7) Å по оси b.
Рис. 2.
Упаковка молекул в кристаллической структуре комплекса I в проекции на плоскость (010). Пунктиром показаны межмолекулярные контакты.
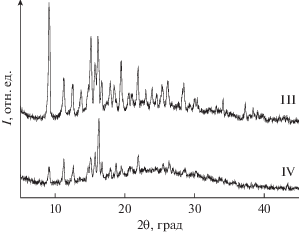
РФА соединения I показал идентичность монокристалла и синтезированной поликристаллической фазы. Порошковый образец однофазный. Сравнение порошковых дифрактограмм комплексов III и IV, имеющих одинаковый состав, показало изоструктурность кристаллов этих соединений (рис. 3).
В ИК-спектрах L, L1 и комплексов I–IV идентифицированы полосы, отвечающие колебаниям ν(OH), ν(NH), ν(С=О) (табл. 3). По сравнению с ИК-спектрами свободных лигандов L и L1 в спектрах комплексов I–IV наблюдается низкочастотный сдвиг полосы ν(NH), что свидетельствует о координации донорной группы NH. Эти данные согласуются с РСА для комплекса I. Незначительные изменения положения полос ν(OH) и ν(С=О) говорят об отсутствии координационных связей с участием данных функциональных групп в комплексах I–IV и вызваны, по-видимому, наличием другой системы межмолекулярных контактов в структурах комплексов по сравнению с L и L1. В диапазоне 600–100 см–1 в ИК-спектрах I–IV обнаружены полосы, относящиеся к ν(М–Cl) и ν(М–N) (табл. 3). Положение этих полос близко к положению аналогичных полос в ИК-спектре одноядерного комплекса хлорида Zn(II) c 2,2'-диметилпропан-1,3-диамином, имеющего, по данным РСА, тетраэдрический координационный полиэдр ZnN2Cl2 [15]. Следовательно, на основании данных ИК-спектроскопии можно предположить, что строение комплексов II–IV подобно строению одноядерного комплекса I с координационным узлом MN2Cl2, который образуется за счет координации атомов N бидентатно-циклических аминопроизводных дезоксихолевой кислоты.
Таблица 3.
Основные колебательные частоты в ИК-спектрах L, L1 и комплексов I–IV
| Отнесение | см–1 | |||||
|---|---|---|---|---|---|---|
| L | I | II | L1 | III | IV | |
| ν(OH) | 3440 пл, 3375 пл | 3483 | 3450 пл, 3390 пл, 3325 пл | 3500, 3386 |
3442 | 3388 |
| ν(NH) | 3246 | 3241 | 3169 | 3278 | 3228 | 3168 |
| ν(C=O) | 1740, 1697 | 1737, 1670 | 1739, 1705 | 1737, 1699 | 1737, 1704 | 1736, 1704 |
| ν(M–N) | 458 | 490 | 466 | 474 | ||
| ν(M–Cl) | 332, 282 | 367, 337 | 331, 283 | 349, 311 | ||
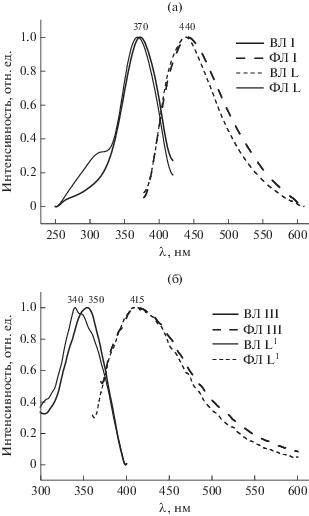
В спектрах ВЛ твердых образцов L и I (рис. 4а) имеется полоса в видимой области спектра с λmax = = 370 нм. В спектрах ВЛ соединений L1 и III наблюдается полоса с положением максимума при 340 и 350 нм соответственно (рис. 4б). На основании этих данных мы выбрали длины волн возбуждения, равные 370 нм для записи спектров ФЛ L, I и 350 нм – для L1, III. Положения максимумов полос в спектрах ФЛМ свободного лиганда L и комплекса I совпадают и находятся при 440 нм. Подобный характер спектров ФЛ наблюдается и для соединений L1 и III с λmax при 415 нм. Полученные данные свидетельствуют об отсутствии влияния комплексообразования с ионами Zn2+ на люминесцентные свойства L и L1.
Рис. 4.
Нормированные спектры возбуждения люминесценции и фотолюминесценции твердых фаз соединений L, I (а) и L1, III (б) (λвозб. = 370 и 350 нм соответственно).
В результате проведенного исследования показана возможность получения координационных соединений металлов с аминопроизводной дезоксихолевой кислоты. Синтезированы одноядерные комплексы Zn(II) и Cu(II) с диаминопропилен- и диаминоэтиленпроизводными дезоксихолевой кислоты. Методом РСА, РФА и ИК-спектроскопии установлено строение новых соединений, изучены люминесцентные свойства L, L1, I, III.
Список литературы
Семенов А.А. Очерки химии природных соединений. Новосибирск: Наука, 2000. 664 с.
Толстикова Т.Г., Толстиков А.Г., Толстиков Г.А. Лекарства из растительных веществ. Новосибирск: Гео, 2010. 214 с.
Zimber A., Gespach C. // Anticancer Agents Med. Chem. 2008. V. 8. № 5. P. 540.
Попадюк И.И., Саламатина О.В., Салахутдинов Р.Ф. // Успехи химии. 2017. Т. 86. № 5. С. 388.
Sharma R., Majer F., Peta V.K. et al. // Bioorg. Med. Chem. 2010. V. 18. P. 6886.
Popadyuk I.I., Markov A.V., Salomatina O.V. et al. // Bioorg. Med. Chem. 2015. V. 23. P. 5022.
Chakrabarty A., Chatterjee S., Maitra U. // J. Mater. Chem. C. 2013. V. 1. P. 2136.
Tripathi K., Kumar D.A.J., Siva T. // Orient. J. Chem. 2010. V. 26. № 3. P. 983.
Shaheen F., Ali S., Rosario S., Shah N.A. // J. Coord. Chem. 2014. V. 67. № 10. P. 1851.
Lampronti I., Bianchi N., Zuccato C. et al. // Bioorg. Med. Chem. 2006. V. 14. P. 5204.
Barbara C., Orlandi P., Bocci G. et al. // Eur. J. Pharm. 2006. V. 549. P. 27.
Popadyuk I.I., Markov A.V., Babich V.O. et al. // Bioorg. Med. Chem. Lett. 2017. V. 27. P. 3755.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Yang L., Powell D.R., Houser R.P. // Dalton Trans. 2007. № 9. P. 955.
Cariati F., Ciani G., Menabue L. et al. // Inorg. Chem. 1983. V. 22. P. 1897.
Li Y., Lai Y.-H., Mok K.F., Drew M.G.B. // Inorg. Chim. Acta. 1999. V. 285. P. 31.
Costas M., Anda C., Llobet A. et al. // Eur. J. Inorg. Chem. 2004. P. 857.
Nayab S., Jeong J.H. // Polyhedron. 2013. V. 59. P. 138.
Metz A., Plothe R., Glowacki B. et al. // Eur. J. Inorg. Chem. 2016. P. 4974.
Lee Y.-M., Kwon M.-A., Kang S. K. et al. // Inorg. Chem. Commun. 2003. V. 6. P. 197.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия