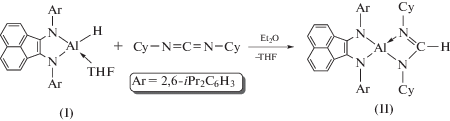Координационная химия, 2019, T. 45, № 9, стр. 539-545
Реакции аценафтендииминового гидрида алюминия с 1,3-дициклогексилкарбодиимидом и 2,6-ди-трет-бутил-4-метилфенолом
В. Г. Соколов 1, *, Т. С. Копцева 1, М. В. Москалев 1, Е. В. Баранов 1, И. Л. Федюшкин 1
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
* E-mail: sokolov@iomc.ras.ru
Поступила в редакцию 27.03.2019
После доработки 22.04.2019
Принята к публикации 25.04.2019
Аннотация
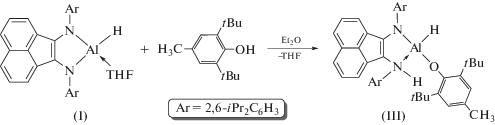
Реакция[(Dpp-Bian)AlH(THF)] (I) (Dpp-Bian = 1,2-бис[(2,6-ди-изо-пропилфенил)имино]аценафтен) с 1,3-дициклогексилкарбодиимидом (DCC) сопровождается восстановлением связи С=N карбодиимида и образованием комплекса [(Dpp-Bian)Al(DCC(H))] (II). При взаимодействии гидрида I с 2,6-ди-трет-бутил-4-метилфенолом связь Al–H сохраняется и образуется амидо-аминный комплекс [(Dpp-BianH)Al(H)(OC6H2-2,6-трет-Bu2-4-Me)] (III). В соединениях II и III дииминовый лиганд восстановлен до дианиона. Новые диамагнитные соединения II и III охарактеризованы методами ИК-, ЯМР-спектроскопии, элементным анализом и РСА (СFА files CCDC № 1903665 (II) и 1903666 (III)).
Гидриды алюминия интенсивно применяются промышленностью в каталитических системах Циглера–Натта при полимеризации и олигомеризации α-олефинов, синтезе стереорегулярных диеновых каучуков [1, 2]. Кроме того, они являются эффективными реагентами для получения халькогенидов алюминия [3–8], алюмоксанов [7, 9], а также используются в качестве восстановителей [10]. В частности, важный класс гидридов алюминия представлен комплексами, где фрагмент Al–H хелатирован N,N-лигандами, реакционная способность которых изучена достаточно подробно [11–17]. Взаимодействиям упомянутых производных с соединениями, содержащими как подвижный атом водорода, так и кратные связи уделяется особое внимание ввиду их аналогичности элементарным стадиям каталитических циклов функционализации ненасыщенных органических молекул. Например, были изучены реакции β-дикетиминатных гидридов алюминия с водой [7], фенолами, спиртами [18–21], органическими кислотами [5, 20, 22–25], аминами и тиолами [19, 26–28], стехиометрические восстановительные процессы ненасыщенных соединений, содержащих C=X (X = N, O, S), N=N или C≡N-фрагменты [9, 29–35], трансформация амидинатных [36] и β-дикетиминатных [37] гидридов в ацетилениды. Кроме того, продемонстрирована возможность активации связей O–H и N–H бис(имино)пиридиновым моногидридом алюминия [(PhI2P2−)AlH] (PhI2P = 2,6-(2,6-изо-Pr2C6H3N=CPh)2C5H3N) [38, 39], а также формирование алюмоксанов [{(PhHI2P−)AlH}2(µ-O)] и [{(PhHI2P−)Al(OH)}2(µ-O)] соответственно при взаимодействии с одним эквивалентом воды или ее избытком [40].
Недавно мы впервые получили гидриды алюминия с анион-радикальными и дианионными аценафтен-1,2-дииминовыми лигандами: [(Dpp-Bian)Al(H)2Li(THF)3], [{Dpp-Bian(H2)}Al(H)2Li(Et2O)2], [(Dpp-Bian)AlH(THF)] (I), [(Dpp-Bian)AlH(Cl)] и [(Dpp-Bian)AlH(Me)] (Dpp-Bian = 1,2-бис[(2,6-ди-изо-пропилфенил)имино]аценафтен) [41, 42]. Исследованы реакции комплекса [(Dpp-Bi-an)Al(H)2Li(THF)3] с бензофеноном (выделен и охарактеризован продукт [(Dpp-Bian)Al(H) (OCHPh2)Li(THF)2]) и 2,6-ди-трет-бутил-4-метилфенолом (образуется фенолят [(Dpp-B-ian)Al-(H)(OC6H2-2,6-трет-Bu2-4-Me)][Li(THF)4]) [41]. Однако по отношению к таким субстратам, как PhC≡CH, Me3SiC≡CH и изо-Pr2NH, данный гидрид оказался инертным [41].
В настоящей работе мы сообщаем о молекулярной структуре, спектральных характеристиках комплексов [(Dpp-Bian)Al(DCC(H))] (II) и [(Dpp-BianH)Al(H)(OC6H2-2,6-трет-Bu2-4-Me)] (III), полученных взаимодействием производного I с 1,3-дициклогексилкарбодиимидом (DCC) и с 2,6-ди-трет-бутил-4-метилфенолом соответственно.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все синтезированные соединения чувствительны к кислороду и влаге, поэтому все манипуляции по их синтезу, выделению и идентификации выполняли в вакууме с использованием техники Шленка или в атмосфере азота (Glovebox M. Braun). Dpp-Bian получали конденсацией аценафтенхинона и 2,6-ди-изо-пропиланилина (оба Aldrich) в ацетонитриле. Диэтиловый эфир сушили и хранили над натрийбензофеноном. Растворитель отбирали конденсацией в вакууме непосредственно перед использованием. Дейтеробензол (Aldrich) сушили над натрийбензофеноном и отбирали конденсацией в вакууме в трубки для регистрации спектров ЯМР, содержащие образцы исследуемых соединений. Соединение I получали по методике [41].
Синтез [(Dpp-Bian)Al(DCC(H))] (II). К раствору 0.75 г (1.25 ммоль) соединения I в эфире (20 мл) добавляли 0.253 г (1.25 ммоль) DCC. Смесь перемешивали 15 мин при 50°С. После охлаждения до комнатной температуры полученный синий раствор концентрировали (5 мл) и выдерживали в течение 24 ч при 10°С. Выпавшие синие кристаллы соединения II отделили от раствора декантацией, промывали холодным эфиром и высушивали в вакууме. Выход 0.46 г (64%). Тпл > 193 (разл.).
Спектр ЯМР 1Н (200 МГц; C6D6; 298 К; δ, м.д. (J, Гц)): 7.61 (с., 1Н), 7.30 (с., 6Н), 7.08 (д., 2Н), 6.87 (м., 2Н), 6.20 (д., 2Н, J = 6.8), 3.95 (септ., 4Н, J = 6.8), 2.78 (уш. с., 2Н), 1.60–1.42 (м., 9Н), 1.33 (д., 12Н, J = 6.8), 1.24 (д., 12Н, J = 6.8), 0.97 (уш. с., 10Н).
ИК-спектр (ν, cм–1): 1913 сл, 1856 сл, 1787 сл, 1655 ср, 1616 сл, 1591 сл, 1564 сл, 1539 с, 1513 с, 1438 сл, 1321 с, 1261 ср, 1220 с, 1193 сл, 1179 сл, 1135 сл, 1119 ср, 1079 сл, 1056 сл, 998 сл, 961 сл, 939 с, 925 с, 829 сл, 844 сл, 813 ср, 801 сл, 764 с, 723 ср, 686 ср, 667 с, 622 сл, 603 сл.
Синтез [(Dpp-BianH)Al(H)(OC6H2-2,6-трет-Bu2-4-Me)] (III). К раствору 0.51 г (0.85 ммоль) соединения I в эфире (20 мл) добавляли 0.18 г (0.85 ммоль) 2,6-ди-трет-бутил-4-метилфенола. Смесь нагревали в течение 20 мин при 60°C. Полученный фиолетовый раствор упаривали до объема 5 мл и выдерживали в течение 24 ч при 10°С. Выпавшие красно-фиолетовые кристаллы соединения III отделяли от раствора декантацией, промывали холодным эфиром и высушивали в вакууме. Выход 0.6 г (74%). Тпл > 201 (разл.).
Спектр ЯМР 1Н (200 МГц; C6D6; 298 К; δ, м.д. (J, Гц)): 7.40 (с., 1Н), 7.35–7.18 (м, 4Н), 7.15–7.07 (м., 4Н), 7.07–6.97 (м., 2Н), 6.92–6.74 (м., 2Н), 6.28 (д, 1Н, J = 6.8), 6.24 (д., 1Н, J = 6.8), 3.99–3.69 (м., 3Н), 3.50 (септ., 1Н, J = 6.8), 2.30 (с., 3Н), 1.49 (с., 18Н), 1.48–1.39 (м., 9Н), 1.16–1.05 (м., 6Н), 0.91 (д., 3Н, J = 6.8), 0.59 (д., 3Н, J = 6.8), 0.52 (д., 3Н, J = 6.8).
ИК-спектр (ν, cм–1): 3244 с, 1900 с, 1593 ср, 1534 с, 1351 сл, 1321 сл, 1296 сл, 1256 с, 1213 сл, 1190 сл, 1157 сл, 1126 ср, 1109 сл, 1070 ср, 1056 сл, 1039 сл, 1028 ср, 979 сл, 948 сл, 932 ср, 910 ср, 885 с, 859 сл, 847 сл, 821 ср, 804 с, 780 сл, 773 сл, 758 с, 688 сл, 665 сл, 638 сл, 623 сл, 610 ср, 601 сл, 578 с, 549 ср, 512 сл.
ИК-спектры снимали на спектрометре ФСМ-1201 в области 450–4000 см–1 (суспензии в вазелиновом масле). Спектры ЯМР 1H регистрировали на спектрометре Bruker DPX-200 (200 МГц). Температуры плавления определяли в запаянных вакуумированных капиллярах. Элементный анализ выполняли сжиганием образцов в кислороде по методу Прегля.
РСА II и III. Пригодные для РСА кристаллы соединений II и III получали кристаллизацией из диэтилового эфира. Выбранные для анализа кристаллы покрывали минеральным маслом (Aldrich) и фиксировали на стеклянном капилляре, затем помещали в холодный поток азота дифрактометров Agilent Xcalibur Eos (II) и Super Nova Atlas (III). В данных дифрактометрах экспериментальные наборы интенсивностей (МоКα- (II) и СuКα- (III) излучения, ω-сканирование) интегрированы по программам CrysAlisPro [43]. SCALE3 ABSPACK [44] использована для введения поправок на поглощение. Структуры расшифрованы методом “dual-space” по программе SHELXT [45]. Неводородные атомы уточнены полноматричным МНК по $F_{{hkl}}^{{\text{2}}}$ в анизотропном приближении с помощью программных пакетов SHELXTL [46] для II и OLEX2 [47] для III. Атомы водорода помещены в геометрически рассчитанные положения и уточнены в модели наездника. Исключение составляют атомы водорода карбодиимидных фрагментов в II, а также на атомах N(2) и Al(2) в III, найденные из разностного синтеза Фурье электронной плотности и уточненные изотропно. В ассиметричной части кристаллической ячейки II, помимо двух молекул комплекса [(Dpp-Bian)-Al(DCC(H))], найдены две сольватные молекулы диэтилового эфира в общем положении. Одна из молекул Et2O разупорядочена по двум положениям. Основные кристаллографические характеристики и параметры рентгеноструктурных экспериментов для II и III приведены в табл. 1, некоторые длины связей и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур II и III
| Параметр | Значение | |
|---|---|---|
| II | III | |
| Брутто-формула | C49H63N4Al ∙ (C2H5)2O | C51H65N2OAl |
| М | 809.13 | 749.03 |
| Сингония | Моноклинная | Моноклинная |
| Пр. гр. | P21/n | P21/n |
| Температура, К | 110(2) | 150(2) |
| Длина волны, Å | 0.71073 | 1.54184 |
| a, Å | 19.4515(2) | 10.6712(2) |
| b, Å | 22.1172(3) | 24.1470(4) |
| c, Å | 22.1641(3) | 17.3371(3) |
| β, град | 95.298(1) | 96.479(2) |
| V, Å3 | 9494.5(2) | 4438.85(14) |
| Z | 8 | 4 |
| ρ(выч.), г/см3 | 1.132 | 1.121 |
| μ, мм–1 | 0.084 | 0.676 |
| F(000) | 3520 | 1624 |
| Размер кристалла, мм | 0.69 × 0.46 × 0.34 | 0.26 × 0.18 × 0.15 |
| Область измерений по θ, град | 2.96–28.00 | 3.15–73.74 |
| Интервалы индексов | –25 ≤ h ≤ 25, –29 ≤ k ≤ 29, –29 ≤ l ≤ 29 |
–10 ≤ h ≤ 13, –29 ≤ k ≤ 29, –21 ≤ 1 ≤ 18 |
| Наблюдаемых отражений | 167 442 | 18 187 |
| Независимых отражений (Rint) | 22 886 (0.0539) | 8683 (0.0287) |
| Отражений с I > 2σ(I) | 16 724 | 6925 |
| Поправка на поглощение (макс/мин) | 0.978/0.959 | 1.000/0.303 |
| Ограничения/параметры | 68/1139 | 6/541 |
| GOOF | 1.060 | 1.025 |
| R1/wR2 (I > 2σ(I)) | 0.0505/0.1283 | 0.0441/0.1096 |
| R1/wR2 (по всем отражениям) | 0.0781/0.1412 | 0.0588/0.1211 |
| Δρmax/Δρmin, e Å–3 | 0.443/–0.485 | 0.260/–0.234 |
Таблица 2.
Некоторые длины связей (Å) и валентные углы (град) в соединениях II и III
| II | III | ||
|---|---|---|---|
| Связь | d, Å | Связь | d, Å |
| Al–N(1) | 1.8281(12) | Al–H(1) | 1.47(2) |
| Al–N(2) | 1.8345(12) | Al–O(1) | 1.716(2) |
| Al–N(3) | 1.9311(13) | Al–N(1) | 1.883(2) |
| Al–N(4) | 1.8886(12) | Al–N(2) | 2.071(2) |
| N(1)–C(1) | 1.400(2) | N(1)–C(1) | 1.367(2) |
| N(2)–C(2) | 1.408(2) | N(2)–C(2) | 1.469(2) |
| C(1)–C(2) | 1.379(2) | C(1)–C(2) | 1.373(2) |
| N(3)–C(37) | 1.321(2) | N(2)–H(2) | 0.79(2) |
| N(4)–C(37) | 1.325(2) | ||
| Угол | ω, град | Угол | ω, град |
| N(1)AlN(2) | 93.83(5) | H(1)AlO(1) | 112.1(7) |
| N(3)AlN(4) | 70.31(5) | N(1)AlN(2) | 88.69(5) |
| N(1)AlN(3) | 124.01(6) | N(1)AlH(1) | 120.9(7) |
| N(1)AlN(4) | 118.49(6) | N(2)AlH(1) | 105.2(8) |
| N(2)AlN(3) | 120.64(6) | N(1)AlO(1) | 116.24(6) |
| N(2)AlN(4) | 132.75(6) | N(2)AlO(1) | 109.85(5) |
| N(3)C(37)N(4) | 112.46(13) | ||
Структуры II и III депонированы в Кембриджском банке структурных данных (CCDC № 1903665 (II) и 1903666 (III); www.ccdc.cam.ac.uk/structures).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Мы продемонстрировали, что гидриды алюминия можно стабилизировать как дианионом Dpp-Bian, так и его анион-радикалом [41, 42]. Предварительные исследования реакционной способности полученных комплексов показывают, что, несмотря на их химическую инертность в сравнении с другими гидридами алюминия, в том числе содержащими редокс-неактивные амидные лиганды, они могут служить восстанавливающими реагентами для ненасыщенных субстратов, а также активировать связи O–H в фенолах.
Реакция соединения I с 1,3-дициклогексилкарбодиимидом протекает с присоединением последнего по связи Al–H в диэтиловом эфире при 50°С в течение 15 мин. Продукт реакции II выделен в виде синих кристаллов при концентрировании раствора (схема 1 ):
Схема 1 .
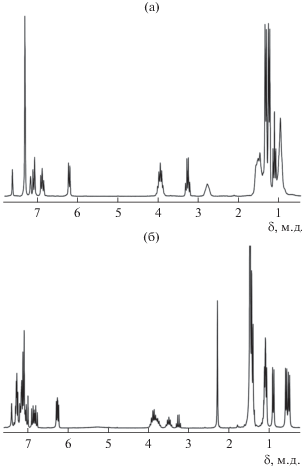
Спектр ЯМР 1H соединения II (рис. 1а) в дейтеробензоле содержит сигналы протонов метильных групп 2,6-изо-Pr2C6H3-заместителей: два дублета при 1.24 (12Н) и 1.33 (12Н) м.д., а также септет метиновых протонов (3.95 (4Н) м.д.). Дублеты при 6.20 (2Н) и 7.08 (2Н) м.д., а также сигналы при 6.87 (2Н) и 7.30 (6Н) м.д. относятся к ароматическим протонам нафталинового фрагмента и фенильных заместителей при атомах азота. Протон на центральном атоме углерода карбодиимида представлен синглетом при 7.61 (1Н) м.д., а сигналы циклогексильных заместителей при атомах азота – мультиплетом в диапазоне 1.42–1.60 (9Н) м.д. и уширенными синглетами 0.97 (10Н) и 2.78 (2Н) м.д. Квартет 3.26 м.д. и триплет 1.11 м.д. относятся к протонам диэтилового эфира, из которого были получены кристаллы.
С 2,6-ди-трет-бутил-4-метилфенолом (1 : 1) гидрид I реагирует по связи Al–N, подобно алкильному производному [(Dpp-Bian)AlEt(Et2O)] [48] и бис(имино)пиридиновым гидридам алюминия [38, 39]. Это говорит о более высокой основности связи Al–N по сравнению со связью A–H. Реакция сопровождается изменением цвета раствора с синего на фиолетовый и приводит к образованию комплекса III. Соединение III выделено из эфира в виде красно-фиолетовых кристаллов с выходом 74% (схема 2 ):
Схема 2 .
В ИК-спектре комплекса III колебания связи Al–H проявляются в виде интенсивной полосы при 1900 см–1, что близко к таковому значению для исходного гидрида I (1864 см–1) [41]. Полоса при 3244 см–1 соответствует колебаниям связи N–H. Для сравнения: полоса валентных колебаний N–H связей в комплексе [{Dpp-Bian- (H)}AlEt{O(2,6-трет-Bu2-4-MeC6H2)}] проявляется при 3238 см–1 [48].
В спектре ЯМР 1H соединения III (рис. 1б) присутствуют сигналы несимметричного лиганда Dpp-Bian: дублеты 0.52 (3Н), 0.59 (3Н), 0.91 (3Н) м.д., два мультиплета в диапазонах 1.05–1.16 (6Н) и 1.39–1.48 (9Н) м.д., септет 3.50 (1Н) и два перекрывающихся сигнала 3.69–3.99 (3Н) м.д. изопропильных групп 2,6-изо-Pr2C6H3-заместителей. Также два дублета 6.24 (1Н) и 6.28 (1Н) м.д. и два мультиплета 6.74–6.92 (2Н) и 6.97–7.07 (2Н) м.д. протонов нафталиновой части. Сигналы ароматических протонов 2,6-изо-Pr2C6H3-заместителей и ароксильного лиганда 2,6-трет-Bu2-4-MeC6H2O лежат в диапазонах 7.07–7.15 (4Н) и 7.18–7.35 (4Н) м.д. Синглеты 1.49 (18Н) и 2.30 (3Н) м.д. соответствуют трет-бутильным и метильной группам. Синглет 7.40 (1Н) соответствует протону при атоме азота.
Согласно данным РСА, II и III представляют собой мономерные четырехкоординационные комплексы алюминия (рис. 2). Анализ длин связей в металлоциклах комплексов II и III указывает на дианионное состояние лигандов Dpp-Bian в них (С(1)–С(2) 1.379(2) Å в II и 1.373(2) Å в III). В комплексе II длины связей N(1)–C(1) и N(2)–C(2) близки и составляют соответственно, 1.400(2) и 1.408(2) Å. Аналогичные значения наблюдаются в комплексе метилалюминия с дианионом Dpp-B-ian, [(Dpp-Bian)AlMe(Et2O)], где расстояния N(1)–C(1) и N(2)–C(2) равны 1.407(4) и 1.409(4) Å соответственно [49]. В комплексе III связи N(1)–C(1) и N(2)–C(2) существенно различаются и составляют 1.367(2) и 1.469(2) Å, что вызвано наличием протона на атоме N(2). Также различается распределение длин связей Al–NBIAN в обоих комплексах: в II они выравнены (1.8281(12) и 1.8345(12) Å), а в III дифференцированы (1.883(2) и Al–N(2) 2.071(2) Å).
Рис. 2.
Молекулярная структура II (a) и III (б). Тепловые эллипсоиды 30%-ной вероятности. Атомы водорода не показаны (за исключением H(1) и H(2) в III).
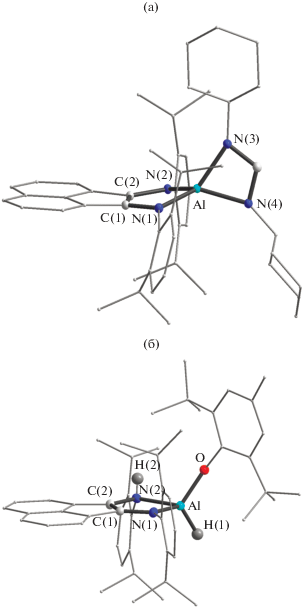
Наблюдается различная геометрия металлоцикла AlN(1,2)C(1,2) в II и III. В комплексе II данный металлоцикл неплоский; угол перегиба по линии N(1)···N(2) составляет ~14°. Атом алюминия заметно выходит из плоскости фрагмента N(1,2)C(1,2) на ~0.3 Å. В комплексе III аналогичный металлоцикл практически плоский. Угол перегиба по линии N(1)···N(2) составляет 3.5°, отклонение атома Al от плоскости N(1,2)C(1,2) 0.086 Å.
В молекуле комплекса II атомы металлоцикла, образованного карбодиимидом, располагаются в одной плоскости, практически перпендикулярной плоскости Dpp-Bian лиганда (двугранный ~82°). Длины связей Al–N(3) 1.9311(13) Å и Al–N(4) 1.8886(12) Å сопоставимы, как и расстояния N(3)–C(37) 1.321(2) Å и N(4)–C(37) 1.325(2) Å.
В соединении III – ароксигидридном комплексе алюминия – связь Al–H в гидриде III (1.47(2) Å) короче таковых в исходном комплексе I (1.53(2) Å) и феноляте [(Dpp-Bian)Al(H)(OC6H2-2,6-трет-Bu2-4-Me)][Li(THF)4] (1.537(16) Å) [41], но близка к расстоянию Al–H в β-дикетиминатном производном [Dpp-NacNac)Al(H)(OC6H2-2,4,6-Me)] (1.50(2) Å) [21]. Расстояние Al–O в соединении III (1.716(1) Å) близко к таковому для комплексов [(Dpp-Bian)Al(H)(OC6H2-2,6-трет-Bu2-4-Me)][Li(THF)4] (1.7495(10) Å) [41] и [(Dpp-NacNac)Al(H)(OC6H2-2,4,6-Me)] (1.696(2) Å) [21], но заметно меньше, чем в арилоксипроизводном [(2,6-трет-Bu2-4-Me-C6H2O)AlH2 · NMe3] (1.762(4) Å) [50]. Расстояние N(2)–H(2) (0.79(2) Å) лежит в интервале характерных значений для комплексов алюминия с лигандом Dpp-Bian (0.78–0.91 Å) [48].
Таким образом, мы показали, что координационное окружение атома алюминия в виде редокс-активного дииминового лиганда оказывает существенное влияние на нуклеофильность гидрид-иона в комплексе [(Dpp-Bian)AlH(THF)] (I). С одной стороны, соединение I способно восстанавливать кратные связи, подобно описанному нами ранее гидриду [(Dpp-Bian)Al(H)2Li(THF)3] [42], что продемонстрировано реакцией производного I с 1,3-дициклогексилкарбодиимидом. C другой стороны, реакция комплекса I с 2,6-ди-трет-бутил-4-метилфенолом указывает на то, что основность связей метал–азот в гидриде I выше, чем основность связи метал–водород, в отличие от соединения [(Dpp-Bian)Al(H)2Li(THF)3], реагирующего с 2,6-ди-трет-бутил-4-метилфенолом с протонолизом связи Al–H. Подобная реакционная способность по отношению к кислым субстратам также наблюдается у комплексов [(Dpp-Bian)AlEt(Et2O)] [48] и бис(имино)пиридиновых гидридов алюминия [38, 39].
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Ziegler K., Holzkamp E., Breiland H. et al. // Angew. Chem. 1955. V. 67. № 19. P. 541.
Natta G.J. // Polym. Sci. 1955. V. 16. № 82. P. 143.
Jancik V., Peng Y., Roesky H.W. et al. // J. Am. Chem. Soc. 2003. V. 125. № 6. P. 1452.
Yang Z., Ma X., Jancik V. et al. // Inorg. Chem. 2006. V. 45. № 8. P. 3312.
Yang Z., Ma X., Oswald R.B. et al. // J. Am. Chem. Soc. 2006. V. 128. № 38. P. 12406.
Cui C., Roesky H.W., Hao H. et al. // Angew. Chem. Int. Ed. 2000. V. 39. № 10. P. 1815.
González-Gallardo S., Jancik V., Cea-Olivares R. et al. // Angew. Chem. 2007. V. 46. № 16. P. 2895.
Jancik V., Moya Cabrera M.M., Roesky H.W. et al. // Eur. J. Inorg. Chem. 2004. V. 2004. № 17. P. 3508.
Peng Y., Bai G., Fan H. et al. // Inorg. Chem. 2004. V. 43. № 4. P. 1217.
Yow S., Gates S.J., White A.J.P., Crimmin M.R. // Angew. Chem. 2012. V. 51. № 50. P. 12559.
Liu Y., Li J., Ma X. et al. // Coord. Chem. Rev. 2018. V. 374. P. 387.
Bourget-Merle L., Lappert M.F., Severn J.R. // Chem. Rev. 2002. V. 102. № 9. P. 3031.
Uhl W., Jana B. // Chem. Eur. J. 2008. V. 14. № 10. P. 3067.
Rascón-Cruz F., Huerta-Lavorie R., Jancik V. et al. // Dalton Trans. 2009. № 7. P. 1195.
Uhl W., Jana B. // J. Organomet. Chem. 2009. V. 694. № 7–8. P. 1101.
Harder S., Spielmann J. // Chem. Commun. 2011. V. 47. № 43. P. 11945.
Yang Z., Zhong M., Ma X. et al. //Angew. Chem. Int. Ed. 2015. V. 54. № 35. P. 10225.
Hao P., Yang Z., Li W. et al. // Organometallics. 2015. V. 34. № 1. P. 105.
Yang Z., Hao P., Liu Z. et al. // Organometallics. 2012. V. 31. № 17. P. 6500.
Hao P., Yang Z., Ma X. et al. // Dalton Trans. 2012. № 43. P. 13520.
Keyes L.K., Todd A.D., Giffin N.A. et al. // RSC Adv. 2017. № 59. P. 37315.
Yang Z., Hao P., Liu Z. et al. // J. Organomet. Chem. 2014. V. 751. P. 788.
Hao P., Yan J., Yang Z. et al. // Chin. J. Inorg. Chem. 2014. № 30. P. 2811.
Hao P., Yang Z., Ma X., Li J. // Chin. J. Inorg. Chem. 2013. № 29. P. 1909.
Yang Z., Hao P., Liu Z. et al. // Z. Anorg. Allg. Chem. 2013. V. 639. № 14. P. 2618.
Zhu H., Yang Z., Magull J. et al. // Organometallics. 2005. V. 24. № 26. P. 6420.
Ma X., Hao P., Li J. et al.// Z. Anorg. Allg. Chem. 2013. V. 639. № 3–4. P. 493.
Kumar S.S., Singh S., Hongjun F. et al. // Organometallics. 2004. V. 23. № 26. P. 6327.
Bartoli G., Bartolacci M., Cortese M. et al. // Eur. J. Org. Chem. 2004. V. 2004. № 11. P. 2359.
Jegier J.A., Gladfelter W.L. // Coord. Chem. Rev. 2000. V. 206–207. P. 631.
Uhl W. // Coord. Chem. Rev. 2008. V. 252. № 15–17. P. 1540.
Uhl W., Layh M., Rhotert I. et al. // Z. Naturforsch. B. 2013. V. 68. P. 503.
Uhl W., Hepp A., Westenberg H. et al. // Organometallics. 2010. V. 29. № 6. P. 1406.
Lin C.Y., Tsai C.F., Chen H.J. et al. // Chem. Eur. J. 2006. V. 12. P. 3067.
Chu C., Yang Y., Zhu H. // Sci. China Chem. 2010. V. 53. № 9. P. 1970.
Duchateau R., Meetsma A., Teuben J.H. // Chem. Commun. 1996. № 2. P. 223.
Chai J., Jancik V., Singh S. et al. // J. Am. Chem. Soc. 2005. V. 127. № 20. P. 7521.
Myers T.W., Berben L.A. // J. Am. Chem. Soc. 2013. V. 135. № 27. P. 9988.
Sherbow T.J., Carr C.R., Saisu T. et al. // Organometallics. 2016. V. 35. № 1. P. 9.
Myers T.W., L.A. Berben // Organometallics. 2013. V. 32. № 22. P. 6647.
Sokolov V.G., Koptseva T.S., Moskalev M.V. et al. // Russ. Chem. Bull. Int. Ed. 2017. V. 66. № 9. P. 1569.
Sokolov V.G., Koptseva T.S., Dodonov V.A. et al. // Russ. Chem. Bull. Int. Ed. 2018. V. 67. № 12. P. 2164.
Data Collection, Reduction and Correction Program. CrysAlisPro 1.171.38.46 – Software Package. Rigaku OD, 2015.
SCALE3 ABSPACK: Empirical Absorption Correction. CrysAlisPro 1.171.38.46 – Software Package. Rigaku OD, 2015.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Sheldrick G.M. SHELXTL. Version 6.14. Structure Determination Software Suite; Madison (WI, USA): Bruker AXS, 2003.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Ap-pl. Cryst. 2009. V. 42. P. 339.
Moskalev M.V., Lukoyanov A.N., Baranov E.V., Fedushkin I.L. // Dalton Trans. 2016. V. 45. № 40. P. 15872.
Lukoyanov A.N., Fedushkin I.L., Schumann H., Hummert M. // Z. Anorg. Allg. Chem. 2006. V. 632. P. 1471.
Healy M.D., Mason M.R., Gravelle P.W. et al. // Dalton Trans. 1993. № 3. P. 441.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия