Координационная химия, 2020, T. 46, № 1, стр. 17-25
Координационные полимеры редкоземельных элементов на основе дицианамидного лиганда
Д. М. Ройтерштейн 1, 2, *, Л. Н. Пунтус 3, Е. А. Вараксина 4, И. В. Тайдаков 4, 5, К. А. Лысенко 5, 6, **
1 Институт нефтехимического синтеза им. А.В. Топчиева РАН
Москва, Россия
2 Институт органической химии им. Н.Д. Зелинского РАН
Москва, Россия
3 Институт радиотехники и электроники им. В.А. Котельникова РАН
Москва, Россия
4 Физический институт им. П.Н. Лебедева РАН
Москва, Россия
5 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
6 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: roiter@yandex.ru
** E-mail: kostya@xray.ineos.ac.ru
Поступила в редакцию 09.07.2019
После доработки 07.08.2019
Принята к публикации 15.08.2019
Аннотация
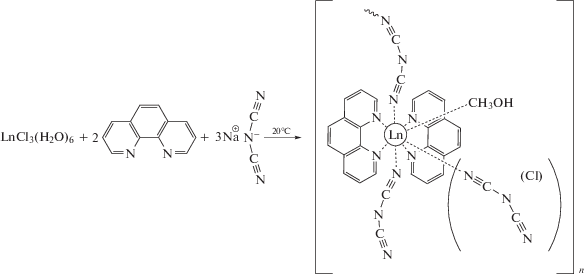
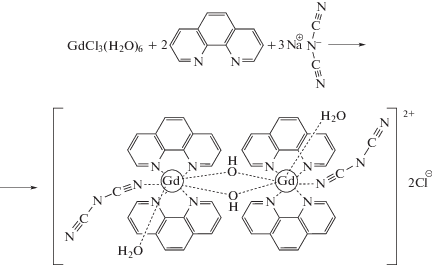
Применение дицианамидного и хелатирующего фенантролинового лигандов позволило полу-чить металлоорганические координационные полимеры европия и неодима [Ln(Phen)2{N(CN)2}3 –xClx(CH3OH)](CH3OH)y]∞ (Ln = Eu (I), Nd (II), где дицианамидный лиганд формирует 1D-цепи, а фенантролиновый лиганд обеспечивает упаковку 1D-полимера в кристаллической решетке. В аналогичных условиях для гадолиния получен биядерный комплекс [Gd(Рhen)2(μ-OH) {N(CN)2}(H2O)]2Cl2 (III), в котором дицианамидные лиганды координированы только с одним ионом гадолиния и не образуют полимерной цепи (CCDC CIF files № 1936378 (I), 1936379 (II), 1936377 (III)).
Металлоорганические координационные полимеры (МОКП) на основе редкоземельных элементов (РЗЭ) представляют значительный интерес как с фундаментальной точки зрения как примеры координационных соединений РЗЭ с необычным окружением, так и с прикладной, поскольку они могут служить основой для создания перспективных люминесцентных материалов [1, 2].
Комбинация люминесцентных свойств ионов лантанидов вместе с уникальными особенностями строения МОКП открывает новые возможности в дизайне новых люминесцентных материалов. Использование изоструктурных МОКП позволяет реализовать допирование их различными РЗЭ в заданных пропорциях для тонкой подстройки люминесцентных и магнитных свойств [2–4].
Цель настоящей работы – получение люминесцентных металлоорганических координационных полимеров, способных к эмиссии как в видимой, так и в ИК-областях. Получение таких полимеров обычно затруднено из-за легко протекающего тушения люминесценции группами, входящими в состав органического лиганда и способными к высокочастотным колебаниям (О–Н, N–H, C–H) [1].
В дизайне подобных координационных соединений особенно важен выбор лиганда, выступающего в роли линкера, осуществляющего “сборку” координационного полимера. Дицианамидный лиганд [N(CN)2]–, вследствие особенностей электронного и пространственного строения, а также отсутствия атомов водорода представляется оптимальным линкером для дизайна таких систем. Несмотря на очевидность выбора дицианамидного лиганда, способствующего формированию “мостиков” между катионами металлов, для построения МОКП, использование его в этих целях в координационной химии РЗЭ ограничено лишь небольшим числом примеров: [Nd{N(CN)2}3-(HMPTA)x]n (x = 2,3 [5]), [Ln{N(CN)2}3(H2O)(L)2] (Ln = Gd, L = бипиридил [6], фенантролин [7]; Ln = Sm, L = бипиридил [6]), [Ln{N(CN)2}2(H2O)3-(L)2]+[N(CN)2]–(L) (Ln = La, Pr, Sm; L = фенантролин) [6], [Ln{N(CN)2}3(H2O)2] (Ln = Eu, Tb [8]).
В настоящей работе мы сообщаем о получении гетеролигандных комплексов европия и неодима с дицианамидным и фенантролиновым лигандами, образующих 1D-координационные полимеры, их кристаллическом строении и фотофизических свойствах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гексагидраты хлоридов лантанидов LnCl3(H2O)6 (“х. ч.”) и дицианамид натрия (96%, Sigma-Aldrich) использовали без дальнейшей очистки. Метанол (“ч.”) абсолютировали кипячением над металлическим магнием, 9,10-фенантролин (Phen) (“ч. д. а.”, Chemapol) предварительно очищали возгонкой в вакууме.
Синтез [Eu(Phen)2{N(CN)2}3 – xClx(CH3OH)x]- (CH3OH) (I). К раствору EuCl3 ∙ 6H2O (0.183 г, 0.5 ммоль) в 4 мл сухого метанола при перемешивании добавляли раствор дицианамида натрия (0.134 г, 1.5 ммоль) в 4 мл сухого метанола, перемешивали в течение 1 ч. К полученной реакционной смеси при интенсивном перемешивании добавляли раствор Phen в сухом метаноле (0.180 г, 1.0 ммоль), смесь нагревали до кипения, затем перемешивали при комнатной температуре 5 ч. Раствор отделяли от осадка и медленно упаривали до объема ~1 мл. Образовавшиеся кристаллы отделяли от раствора и высушивали в вакууме. Выход I 0.253 г (68%).
| Найдено, %: | C 48.69; | H 1.68; | N 23.78. |
| Для C30.81H20.76N12.43O1.19Cl0.19Eu | |||
| вычислено, %: | C 49.79; | H 2.80; | N 23.39. |
Синтез [Nd(Phen)2{N(CN)2}3 – xClx(CH3OH)x]- (CH3OH) (II) выполняли по методике, аналогичной для I, исходя из NdCl3 ∙ 6H2O (0.359 г, 1.0 ммоль), дицианамида натрия (0.268 г, 3.0 ммоль) и Phen (0.360 г, 2.0 ммоль). Выход II 0.353 г (48%).
Попытка получить в аналогичных условиях соответствующий гадолиниевый комплекс привела к смеси соединений и единственным выделенным продуктом оказался биядерный комплекс [Gd(Рhen)2(μ-OH){N(CN)2}(H2O)]2Cl2 (III), очевидно, образовавшийся вследствие гидролиза, вызванного действием координационно-связанной воды из исходного гексагидрата хлорида гадолиния. Из реакционной смеси выделили лишь несколько кристаллов III.
РСА монокристаллов I, II и III проведен на дифрактометре SMART APEX2 CCD (MoKα-излучение, графитовый монохроматор, ω-сканирование). Структуры расшифрованы прямым методом и уточнены МНК в анизотропном полноматричном приближении по $F_{{hkl}}^{{\text{2}}}.$ При уточнении I и II для атомов, отвечающих суперпозиции фрагментов N(CN)2 и Cl···HOCH3, применяли ограничения на позиционные и тепловые параметры. На конечной стадии уточнения ограничения на длины связей Ln–Cl и Ln–N (Ln = Eu, Nd) убраны, а заселенности для разупорядоченного фрагмента в I фиксированы. Заселенности аниона Cl– в I и II равны 0.19 и 0.55 соответственно. Анализ разностных Фурье синтезов в кристалле III показал, что центральный атом азота N(CN)2 разупорядочен по двум положениям с заселенностями 0.52 и 0.48. Атомы водорода для Phen и разупорядоченной молекулы CH3OH рассчитаны геометрически, тогда как для координированной молекулы спирта атом водорода локализован из разностных синтезов электронной плотности. Все расчеты проведены по комплексу программ SHELXTL PLUS [9]. Основные кристаллографические данные и параметры уточнения для соединения I–III приведены в табл. 1.
Таблица 1.
Кристаллографические данные и параметры уточнения для соединений I и II
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III | |
| Брутто формула | C30.81H20.76N12.43O1.19Cl0.19Eu | C30.45H22.20N11.35O1.55Cl0.55Nd | C56H54N14O8Cl2Gd2 |
| М | 742.83 | 735.56 | 1436.53 |
| T, K | 120 | 120 | 120 |
| Сингония | Триклинная | Триклинная | Триклинная |
| Пр. гр. | P1 | P1 | P1 |
| Z | 2 | 2 | 1 |
| a, Å | 8.640(3) | 8.6645(6) | 10.9608(14) |
| b, Å | 10.017(4) | 9.9103(7) | 11.0365(14) |
| c, Å | 18.605(8) | 18.8326(13) | 12.1296(15) |
| α, град | 96.331(11) | 96.4521(15) | 95.947(2) |
| β, град | 93.479(10) | 93.5244(16) | 103.215(2) |
| γ, град | 112.824(9) | 112.1397(14) | 100.012(2) |
| V, Å3 | 1465.7(10) | 1478.89(18) | 1390.9(3) |
| ρ(выч.), г см–3 | 1.683 | 1.652 | 1.715 |
| μ, см–1 | 22.08 | 18.54 | 25.28 |
| F(000) | 737 | 732 | 714 |
| 2θmax, град | 58 | 58 | 55 |
| Число измеренных отражений | 9135 | 17 940 | 6257 |
| Число независимых отражений | 7616 | 7856 | 6257 |
| Число отражений с I > 2σ(I) | 6692 | 6610 | 5792 |
| Количество уточняемых параметров | 422 | 427 | 376 |
| R-факторы (I > 2σ(I)) | R1 = 0.0427, wR2 = 0.0957 | R1 = 0.0384, wR2 = 0.0790 | R1 = 0.0317, wR2 = 0.0752 |
| R-факторы (по всем отражениям) | R1 = 0.0499, wR2 = 0.1006 | R1 = 0.0513, wR2 = 0.0847 | R1 = 0.0371, wR2 = 0.0786 |
| GOОF | 1.029 | 0.982 | 1.084 |
| Остаточная электронная плотность (max/min), e Å–3 | 1.429/–1.320 | 1.309/–1.728 | 1.817/–0.874 |
Координаты атомов и другие параметры структур депонированы в Кембриджском банке структурных данных (№ 1936378 (I), 1936379 (II); 1936377 (III) deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk/data_request/cif).
Спектры люминесценции регистрировали на спектрометре Horiba-Jobin-Yvon Fluorolog FL 3-22, оснащенном в качестве источника возбуждения 450 Вт непрерывной ксеноновой лампой и фотоумножителем R-928. Времена жизни возбужденных состояний ионов РЗЭ измеряли в максимумах их спектров эмиссии и усредняли по результатам как минимум трех измерений. Для обработки данных использовали пакет программ Origin 8.6.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Взаимодействие растворов хлоридов европия и неодима LnCl3 ∙ 6H2O (Ln = Eu, Nd) в сухом метаноле с 3 экв. дицианамида натрия и 2 экв. Phen привело к образованию гетеролигандного комплекса переменного состава [Ln(Phen)2- {N(CN)2}3 –xClx(CH3OH)]n (Ln = Eu (I), Nd (II) с выходами 68 и 48% соответственно. Перекристаллизация из горячего абсолютного метанола позволила получить монокристаллические образцы I и II.
Строение полученных комплексов установлено методом PCA, и их можно рассматривать как продукты сокристаллизации трис-дицианамидного комплекса РЗЭ с бисдицианамидхлоридным в соотношении (~4 : 1) для I и (~1 : 1) для II.
В изоструктурных комплексах I и II один из дицианамидных лигандов выступает в качестве мостикового, объединяя молекулы в 1D-координационный полимер, цепочки которого направлены вдоль кристаллографической оси а (рис. 1). Из-за наличия мостикового аниона ${\text{N}}({\text{CN}})_{{\text{2}}}^{--}$ ион РЗЭ в кристалле имеет КЧ 9, а его координационный полиэдр можно описать как одношапочную квадратную антипризму. Роль двух концевых анионов ${\text{N}}({\text{CN}})_{{\text{2}}}^{--}$ в супрамолекулярной организации 1D-координационных полимеров существенно различается. Один из них (N(8N)–N(9N)) вовлечен в образование достаточно прочных водородных связей CH3O(1S)–H· · · N(9N)C(О(1S)· · · N(9N) 2.793(2) Å), приводящих к образованию слоев с покрытием, образованным фенантролиновыми лигандами. Второй лиганд ${\text{N}}({\text{CN}})_{{\text{2}}}^{--}$ (N(2N)–N(3N)) фактически не образует прочных взаимодействий за исключением контактов С–Н···N. По-видимому, именно такой характер взаимодействий и приводит к тому, что для данного лиганда наблюдается суперпозиция анионов Cl– и ${\text{N}}({\text{CN}})_{{\text{2}}}^{--}$ (рис. 2). Замена аниона ${\text{N}}({\text{CN}})_{{\text{2}}}^{--}$ на хлорид-ион не приводит к появлению полостей в кристаллах I и II, поскольку Сl– локализован вместе с дополнительной сольватной молекулой метанола, вовлеченной во взаимодействие С···OH (рис. 2). Необходимо отметить, что соотношение ${\text{N}}({\text{CN}})_{{\text{2}}}^{--}$ : Сl– в I и II не является функцией радиуса иона РЗЭ. При попытках получения координационного полимера, не содержащего хлорид-ион, мы изучили ряд кристаллов, в каждом из которых наблюдалась указанная выше суперпозиция, однако соотношение ${\text{N}}({\text{CN}})_{{\text{2}}}^{--}$ : Сl– оказывалось разным и выбор именно данных образцов диктовался исключительно качеством дифракционных массивов. Исходя из этого можно предположить, что для данного типа комплексов наблюдается широкий диапазон соотношения ${\text{N}}({\text{CN}})_{{\text{2}}}^{--}$ : Сl–, при котором сохраняется указанный тип упаковки.
Рис. 1.
Общий вид комплексов I и II, иллюстрирующий звено 1D-координационного полимера, в представлении атомов эллипсоидами колебаний (p = 50%). Ион Cl– и сольватная молекула CH3OH не показаны. Основные длины связей: Eu(1)–O(1S) 2.422(3), Eu(1)–N(9NA) 2.483(4), Eu(1)–N(8N) 2.491(4), Eu(1)–N(4N) 2.495(4), Eu(1)–N(2N) 2.523(12), Eu(1)–N(1) 2.591(4), Eu(1)–N(10) 2.641(4), Eu(1)–N(10A) 2.701(4), Eu(1)–N(1A) 2.702(3), Eu(1)–Cl(1) 2.703(9) Å в I и Nd(1)–O(1S) 2.480(3), Nd(1)–N(2N) 2.533(15), Nd(1)–N(4N) 2.533(3), Nd(1)–N(8N) 2.541(3), Nd(1)–N(9NA) 2.544(3), Nd(1)–N(1) 2.642(3), Nd(1)–N(10) 2.669(3), Nd(1)–N(1A) 2.731(3), Nd(1)–N(10A) 2.739(3), Nd(1)–Cl(1) 2.833(2) Å в II.
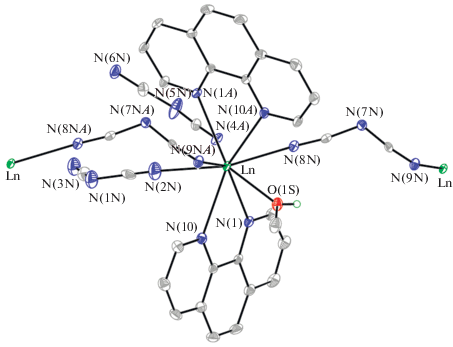
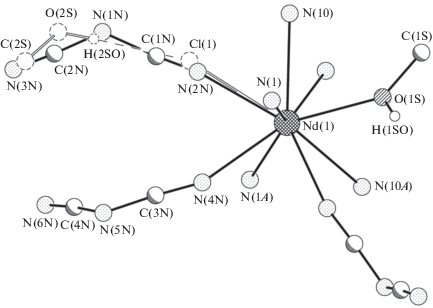
Рис. 2.
Схема, иллюстрирующая наложение фрагментов Cl–···HOCH3 и N(CN)2 в кристалле II. Атомы углерода фенантролиновых лигандов не показаны.
Помимо Н-связей, объединяющих 1D-цепи в слои, в кристаллах I и II, также реализуется стекинг-взаимодействие фенантролиновых лигандов с расстоянием между плоскостями циклов ~3.4 Å. Интересно, что стекинг-взаимодействие реализуется только для одного лиганда, тогда как для второго аналогичные расстояния превышают сумму ван-дер-ваальсовых радиусов. При этом именно фенантролиновый лиганд (N(1)–N(10)), вовлеченный в стекинг-взаимодействие, образует более прочные связи (2.642(3)– 2.669(3) Å по сравнению с 2.731(3)–2.739(3) Å в II.
Принимая во внимание, что указанные расстояния иона РЗЭ влияют на эффективность сенсибилизации люминесценции, можно сделать вывод, что стекинг-взаимодействие не только может приводить к появлению дополнительных состояний [10, 11], но и увеличивать эффективность связывания иона лантанида с лигандом.
Полного замещения хлорид иона в координационной сфере комплекса не удается достичь даже при проведении реакции в течение более продолжительного времени и использования 5% избытка дицианамида натрия. Вероятно, нуклеофильность дицианамидного лиганда недостаточна для исчерпывающего замещения хлоридного лиганда. В случае гадолиния единственным выделенным продуктом оказался биядерный комплекс [Gd(Рhen)2(μ-OH){N(CN)2}(H2O)]2Cl2 (III).
Строение III также установлено методом РСА. В отличие от I и II комплекс III построен в виде димера с мостиковыми гидроксильными группами, дицианамидные лиганды координированы только с одним ионом гадолиния и не образуют полимерной цепи (рис. 3). Соединение III кристаллизуется в виде сольвата с четырьмя молекулами метанола. Комплекс III в кристалле расположен в центре симметрии. Координационный полиэдр иона гадолиния – искаженная квадратная антипризма. Внешний хлорид-анион образует водородные связи с мостиковой группой ОН (O···Cl 3.251(3) Å) и сольватными молекулами метанола и координированной воды (O···Cl 3.119(3)–3.213(5) Å). Данная разделенная ионная пара за счет водородных связей O–H···N, образованных молекулами воды и дицианамидным лигандом (O···N 2.782(5) Å), объединяется в Н-связанные цепи. Интересной особенностью комплекса III является укороченный внутримолекулярный контакт между фенантролиновыми лигандами (расстояние между плоскостями лигандов 3.401 Å, кратчайший С···С контакт 3.542(4) Å), что позволяет предположить реализацию в III внутримолекулярного стекинг-взаимодействия.
Рис. 3.
Общий вид комплекса III в представлении атомов эллипсоидами тепловых колебаний (p = 50%). Основные длины связей: Gd(1)–O(1) 2.258(3), Gd(1)–O(1A) 2.300(3), Gd(1)–O(1S) 2.411(3), Gd(1)–N(2N) 2.501(3), Gd(1)–N(1A) 2.579(3), Gd(1)–N(1) 2.601(3), Gd(1)–N(2A) 2.640(4), Gd(1)–N(2) 2.640(4), Gd(1)…Gd(1) 3.7046(5) Å.

Известно, что в силу особенностей электронного строения 4f-элементов непосредственное возбуждение иона Ln3+ обычно не позволяет наблюдать интенсивной люминесценции [12]. Поэтому для сенсибилизации люминесценции ионов РЗЭ обычно используют органический лиганд, координированный с ионом Ln3+ и способный осуществить передачу энергии поглощенного электромагнитного излучения с лиганда на ион Ln3+ (“эффект антенны”) [13]. В полученных комплексах I и II в качестве “антенны” может выступать как дицианамидный линкер, так и фенантролиновый. Известна люминесценция как фенантролиновых [14], так и гомолигандных дицианамидных [8] комплексов РЗЭ.
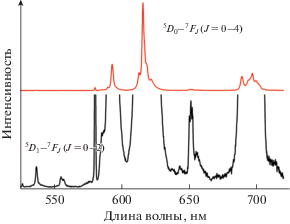
Спектр люминесценции комплекса европия I содержит узкие линии, соответствующие характеристическим переходам иона Eu3 + 5D0 → 7FJ (J = 0–4) и 5D1 → 7FJ (J = 0–2) переходы (pис. 4). Запрещенный правилами отбора электронный переход 5D0–7F0 (область 575–585 нм) представлен одной слабой симметричной линией, что указывает на присутствие одного типа окружения иона европия. Кинетика затухания люминесценции описывается моноэкспоненциальным законом, что также свидетельствует о наличии только одного центра люминесценции. Времена жизни уровня 5D0 составили 0.60 ± 0.02 мс, что хорошо согласуется с установленным составом координационной сферы. В магнитно-дипольном переходе 5D0–7F1 (область 590–600 нм) спектра люминесценции комплекса I наблюдаeтся только одна относительно широкая линия. В центросимметричном окружении магнито-дипольный переход 5D0–7F1 является преобладающим, и отношение интегральных интенсивностей переходов 5D0–7F2 : 5D0–7F1 < 1, тогда как искажение симметрии окружения иона европия приводит к увеличению интенсивности перехода 5D0–7F2. Вычисленное отношение для комплекса равно ~4.5, что обнаруживает симметрию зарядового окружения иона европия, значительно удаленную от центра инверсии. В частности, этот параметр в случае β-дикетонатов европия 14–20. Количество Штарковских компонент остальных переходов 5D0–7FJ (J = 2–4) также близко к максимально возможному, что говорит о сильном искажении симметрии иона. В то же время относительно небольшие общие расщепления переходов свидетельствуют об аксиальном расположении зарядов, что согласуется с данными РСА анализа.
Рис. 4.
Спектры люминесценции комплекса I. Черный спектр получен с увеличенной интенсивностью. λвозб = 340 нм.
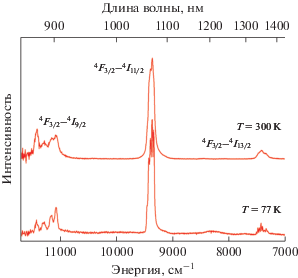
Также были получены спектры люминесценции комплекса неодима II, демонстрирующие люминесценцию в ближнем ИК-диапазоне с наиболее интенсивным переходом 4F3/2–4I11/2 (1050–1100 нм) (рис. 5).
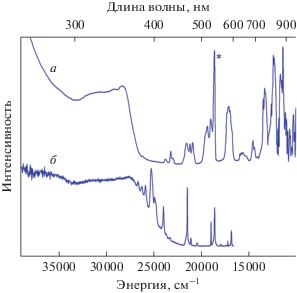
Согласно концепции сенсибилизации люминесценции, энергия поглощенная лигандом передается через синглетное (1ππ*) и триплетное (3ππ*) состояния к возбужденным резонансным уровням иона лантанида. Спектры возбуждения люминесценции комплексов I и II обнаруживают в дополнение к узким полосам f–f-переходов иона Ln3+ широкие полосы лигандов в области 250–400 нм (рис. 6). Основываясь на спектральных данных для изученных ранее комплексов лантанидов с 1,10-фенантролином, полосу с максимумом при 350 нм (28 570 см–1) можно отнести к состоянию S1 фенантролинового лиганда (pис. 6). Сравнение спектров возбуждения люминесценции изоструктурных комплексов Eu и Nd обнаруживает дополнительную широкую полосу с максимумом 400 нм (25 000 см–1), которая отсутствует в случае неодима. Длинноволновый край этой полосы простирается почти до 500 нм. Выполненное сравнение позволяет интерпретировать эту полосу как полосу переноса заряда лиганд–металл (LMCT).
Положение полосы переноса заряда можно оценить, используя следующее выражение, справедливое для большого числа соединений:
(1)
${{E}_{{{\text{CTS}}}}} \approx 30\,{\kern 1pt} 000[{{\chi }_{{{\text{opt}}}}}({\text{X}}) - {{\chi }_{{{\text{uncorr}}}}}({\text{M}})]\,\,{\text{c}}{{{\text{м}}}^{{--1}}},$где χopt(X) – оптическая электроотрицательность лиганда, χuncorr(M) – электроотрицательность иона лантанида без учета корреляции спина. Оптическая электроотрицательность в ряду галогенидов меняется аналогично электроотрицательности Полинга. Поскольку энергия LMCT-состояния была определена экспериментально, используя χuncorr(Eu) = 1.9925, получено значение χopt(X), равное 2.83. Ранее данную методику мы использовали для определения оптической электроотрицательности лиганда для комплексов хлоридов европия с фенантролином [15]. Было показано, что LMCT-состояние обусловлено переносом заряда от аниона хлора к иону Eu3+. В рассматриваемых дициамидных комплексах также можно предположить, что максимальный вклад в LMCT-состояние принадлежит группам N(CN)2. Действительно, дицианамидный лиганд в комплексах I и II выступает в роли анионного лиганда, аналогичного галогенид иону в родственных фенантролиновых комплексах РЗЭ [15]. Таким образом, дицианамид, являясь псевдогалогеном, должен характеризоваться оптической электроотрицательностью, сопоставимой с электроотрицательностью хлора (3.1), что мы обнаружили исходя из оцененной величины χopt(X) в I.
Таким образом, в результате проведенного нами исследования получены металлоорганические координационные полимеры с дицианамидными линкерами и фенантролиновыми лигандами – эффективными сенсибилизаторами люминесценции ионов лантанидов видимого и ближнего ИК-диапазонов.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Cui Y.J., Chen B.L., Qian G.D. // Coord. Chem. Rev. 2013. V. 273–274. P. 76.
Yang J., Yue Q., Li G.-D. et al. // Inorg. Chem. 2006. V. 7. P. 2857.
Guo H., Zhu Y., Qiu S. et al. // Adv. Mater. 2010. V. 22. P. 4190.
Dang S., Zhang J.-H., Sun Z.-M. // J. Mater. Chem. 2012. V. 22. P. 8868.
Капшук А.А., Скопенко В.В. // Коорд. химия. 1986. Т. 12. № 3. С. 380.
Wu A.-Q., Zheng F.-K., Chen W.-T et al. // Inorg. Chem. 2004. V. 43. P. 4839.
Zhang L.-F., Kou J.-Y., Kou H.-Z. et al. // Jiegou Huaxue (Chin. J. Struct. Chem.). 2005. V. 24. P. 1049.
Nag A., Schmidt P.J., Schnick W. // Chem. Mater. 2006. V. 18. P. 5738.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Nelyubina Y.V., Puntus L.N., Lyssenko K.A. // Chem. Eur. J. 2014. V. 20. P. 2860.
Puntus L.N., Lyssenko K.A., Pekareva I.S., Bunzli J.-C.G. // J. Phys. Chem. B. 2009. V. 113. P. 9265.
de Bettencourt-Dias A. Luminescence of Lanthanide Ions in Coordination Compounds and Nanomaterials. Hoboken: A. Wiley, 2014. Ch. 1. P. 1.
Weissman S.I. // J. Chem. Phys. 1942. V. 10. P. 214.
Wu A.-Q., Zheng F.-K., Chen W.-T. et al. // Inorg. Chem. 2004. V. 43. P. 4839.
Puntus L.N., Lyssenko K.A., Antipin M.Y., Bünzli J.-C.G. // Inorg. Chem. 2008. V. 47. P. 11095.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия