Координационная химия, 2020, T. 46, № 1, стр. 3-16
Синтез координационных полимеров из гетерометаллических карбоксилатных комплексов с хелатирующими N-донорными лигандами
М. А. Шмелев 1, *, Н. В. Гоголева 1, Д. А. Макаров 1, М. А. Кискин 1, И. А. Якушев 1, 2, Ф. М. Долгушин 3, Г. Г. Александров 1, Е. А. Вараксина 3, 4, И. В. Тайдаков 3, 4, 5, Е. В. Александров 6, 7, А. А. Сидоров 1, И. Л. Еременко 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
3 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
4 Физический институт им. П.Н. Лебедева РАН
Москва, Россия
5 Московский физико-технический институт
(национальный исследовательский университет)
Долгопрудный, Россия
6 Самарский национальный исследовательский университет им. акад. С.П. Королева
Самара, Россия
7 Самарский государственный технический университет
Самара, Россия
* E-mail: shmelevma@yandex.ru
Поступила в редакцию 08.07.2019
После доработки 14.08.2019
Принята к публикации 15.08.2019
Аннотация
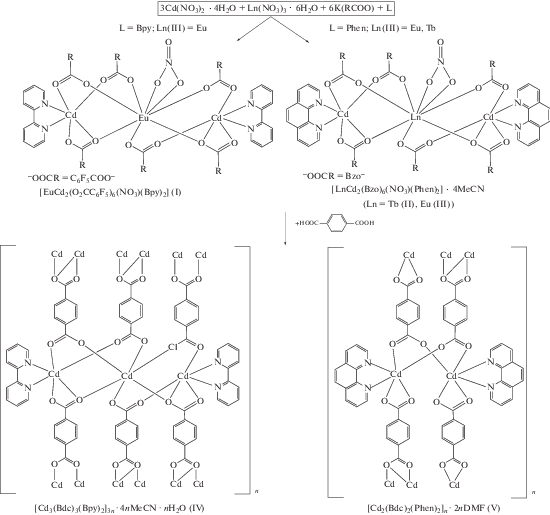
Получены новые трехъядерные Cd−Ln молекулярные комплексы состава [EuCd2(O2CC6F5)6- (NO3)(Bipy)2] (I, Bipy = 2,2'-бипиридин) и [LnCd2(Bzo)6(NO3)(Phen)2] · 4MeCN (Ln = Tb(II), Eu(III), Bzo = анион 3,5-ди-трет-бутилбензойной кислоты, Phen = 1,10-фенантролин), для которых определена структура по данным РСА (СIF files CCDC № 1938125 (I), 1938124 (II)) или РФА (III), а также изучены их фотолюминесцентные свойства. Взаимодействие I и II с терефталевой кислотой (H2Bdc) сопровождается деструкцией гетерометаллических молекул с образованием 2D-координационных полимеров состава [Cd3(Bbdc)3(Bipy)2]3n · 4nMeCN · nH2O (IV), [Cd2(Bdc)2(Phen)2]n · 2nDMF (V) (СIF files CCDC № 1938126, 1937492 соответственно).
Интерес к комплексам 4f-металлов вызван возможностью получать ярко люминесцирующие соединения, которые могут иметь широкий спектр применения, например в качестве компонентов LED и OLED устройств, а также флуоресцентных меток в биохимии и медицине [1–5]. Высокая эффективность эмиссии комплексов лантанидов по сравнению с неорганическими материалами определяется присутствием в их составе ароматических лигандов, способных поглощать внешнее излучение и передавать энергию в результате внутрисистемных переносов на люминесцирующие уровни 4f-иона [6, 7]. Особую роль в процессах возбуждения и эмиссии комплексов ионов 4f-элементов играют химическая “комплементарность” и электронно-оптические характеристики ароматического лиганда, такие как коэффициент экстинкции, область поглощения, энергия триплетного состояния [8, 9]. Среди с-оединений, обладающих высоким квантовым выходом фотолюминесценции, можно выделить карбоксилатные комплексы 4f-металлов [10–16]. Управление фотолюминесцентными свойствами карбоксилатов лантанидов может быть реализовано за счет варьирования заместителя при карбоксилатной группе аниона кислоты (–O2CR), введения дополнительного ароматического лиганда (L) в координационную сферу иона металла, а также получения гетерометаллических комплексов с диамагнитными ионами переходных металлов (M) в дополнение к вышеозначенным способам [10, 15]. Последний подход дает возможность сформировать устойчивый металлоостов, {L–M–(O2CR)x–Ln} или {L–M–(O2CR)x–Ln–(O2CR)x–M–L}, в котором можно блокировать координационную сферу 4f-иона от молекул воды и производить замену органической составляющей. Такие d-4f-гетероядерные молекулы представляют интерес в качестве прекурсоров для направленного синтеза металл-органических координационных полимеров (МОКП) поскольку все карбоксилатные лиганды могут быть замещены на анионы поликарбоновых ароматических кислот, а нейтральные молекулы – на N-донорные мостиковые лиганды.
Ранее было показано, что замещение триметилацетатных анионов (Piv) в молекулярных комплексах [Co2Gd(NO3)(Piv)6(Py)2] и [Li2M2(Piv)6(Py)2] (M = Co, Zn; Py = пиридин) на терефталатные (Bdc) или бифенилдикарбоксилатные (Bpdc) и замещение монодентатно связанного пиридина на его бидентатно-мостиковые производные приводит к образованию Li–3d или 3d–Ln 2D- или 3D-координационных полимеров, частично или полностью сохраняющих в составе гетерометаллический металлоостов [16–18]. На первый взгляд осуществить замещение только части лигандов с сохранением строения металлоостова проще. Это подтверждается примерами 1D- и 2D-координационных полимеров состава [Fe2NiO(Piv)6(L)]n (Piv– = анион пивалиновой кислоты; L = трис(4-пиридил)триазин; 2,6-бис(3-пиридил)-4-(4-пиридил)пиридин; N-(бис-2,2-(4-пиридилоксиметил)-3-(4-пиридилокси)пропил)пиридон-4; 4-(N,N-диэтиламино)фенил-бис-2,6-(4-пиридил)пиридин; трис(4-пиридил)триазин) или [{Fe2NiO(Piv)6}8- {L2}12] (L2 = 4-(N,N-диметиламино)фенил-2,6-бис(4-пиридил)пиридин), ранее полученных нами за счет замещения монодентатных N-донорных лигандов на бидентатно-мостиковые в комплексе [Fe2NiO(Piv)6(HPiv)3] [19, 20]. Известны примеры сохранения металлоостова при замещении пивалатных анионов в соединении [Cu2(Piv)4(НPiv)2] на β-нафтоатные с образованием комплекса состава [Cu2(βNaph)4(MeCN)2] [21]. В состав двух-, трех- или тетраядерных молекулярных гетерометаллических комплексов с линейным металлоостовом входит от 5 до 10 анионов монокарбоновых кислот. Таким образом, замещение этих анионов на мостиковые анионы дикарбоновой кислоты может привести к формированию пятисвязанного металлофрагмента. Такого количества мостиковых лигандов уже достаточно для формирования 3D-полимерных структур.
Цель настоящей работы – получение новых молекулярных Cd−Ln гетерометаллических комплексов, растворимых в органических растворителях, и исследование их стабильности в условиях синтеза МОКП с дикарбоновой кислотой (терефталевой). Интерес к Cd−Ln карбоксилатным комплексам связан с малой изученностью этих соединений и очевидной перспективностью получения на их основе фотолюминесцентных материалов, с другой стороны, известны на данный момент только единичные примеры комплексов Cd−Ln с анионами монокарбоновых кислот [22–25]. Растворимость соединений в органических растворителях может быть достигнута за счет использования анионов 3,5-ди-трет-бутилбензойной или пентафторбензойной кислот [14, 26, 27]. В данной работе дополнительные N-донорные мостиковые лиганды при синтезе МОКП не были использованы, поскольку в состав получаемых молекулярных Cd−Ln комплексов входили хелатирующие лиганды, 2,2'-дипиридил (Bipy) или 1,10-фенантролин (Phen), которые в случае сохранения металлоостова способны участвовать в усилении люминесценции 4f-ионов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом новых комплексов, выполняли на воздухе с использованием диметилформамида (DMF, “ч.”), ацетонитрила (≥99.5%) и этанола (“х. ч.”). Для получения новых соединений использовали следующие реагенты: Cd(NO3)2 · 4H2O (99+%, Acros Organics), Eu(NO3)3 · 6H2O (99.99%, Ланхит), Tb(NO3)3 · 6H2O (99.99%, Ланхит), КОН (“ч. д. а.”), 3,5-ди-трет-бутилбензойную кислоту (HBzo, 99%, Alfa Aesar), пентафторбензойную кислоту (HO2CC6F5, 99%, P&M Invest), терефталевую кислоту (H2Bdc, 99%, Acros Organics), Bipy (99%, Alfa Aesar), Phen (99%, Alfa Aesar).
ИК-спектры соединений регистрировали на ИК-спектрофотометре с Фурье-преобразованием Spectrum 65 (Perkin Elmer) методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 4000–400 см–1. Спектры люминесценции измеряли с помощью спектрофлуориметра Fluorolog FL3-22 (Horiba-Jobin-Yvon), оснащенного ксеноновой лампой мощностью 450 Вт и стандартным фотоумножителем PMT R-928. Для измерения кинетических зависимостей затухания люминесценции использовали ксеноновую лампу-вспышку. Все спектры корректировали с учетом аппаратной функции прибора. Элементный анализ выполняли на CHNS-анализаторе EuroЕА 3000 (EuroVector). Рентгенофазовый анализ (РФA) проведен на дифрактометре Bruker D8 Advance (CuKα, λ = 1.54060 Å, Ni-фильтр, LYNXEYE детектор, геометрия на отражение).
Синтез [EuCd2(O2CC6F5)6(NO3)(Bipy)2] (I). К раствору Cd(NO3)2 · 4H2O (0.100 г, 0.324 ммоль) в 10 мл этанола добавляли раствор KO2CC6F5 (0.163 г, 0.649 ммоль) в 10 мл этанола, полученный при взаимодействии KOH (0.036 г, 0.649 ммоль) и HO2CC6F5 (0.138 г, 0.649 ммоль). Реакционную смесь перемешивали в течение 10 мин при 70°С и отфильтровывали от образовавшегося белого осадка KNO3. К полученному фильтрату добавляли раствор Eu(NO3)3 · 6H2O (0.049 г, 0.108 ммоль) в 10 мл MeCN, навеску Bipy (0.051 г, 0.324 ммоль) и перемешивали полученную смесь в течение 10 мин при 70°С. Полученный бесцветный раствор выдерживали при комнатной температуре. Образовавшиеся через 6 сут бесцветные кристаллы, пригодные для РСА, отделяли от маточного раствора декантацией, промывали холодным ацетонитрилом (T ≈ 5°C), и высушивали на воздухе. Выход соединения I 0.128 г (58.8% в расчете на Eu(NO3)2 · 6H2O).
ИК-спектр (НПВО; ν, см–1): 3188 c, 1653 ср, 1593 сл, 1519 сл, 1488 сл, 1477 сл, 1442 сл, 1397 сл, 1367 сл, 1318 ср, 1286 ср, 1181c, 1161 cp, 1121 c, 1101 сл, 1062 c, 1043 c, 1018 cp, 989 сл, 932 сл, 828 сл, 763 сл, 734 сл, 698 сл, 649 сл, 627 сл, 582 cp, 479 cp, 458 c, 442 c, 425 c.
Синтез [TbCd2(Bzo)6(NO3)(Phen)2] · 4MeCN (II). К раствору Cd(NO3)2 · 4H2O (0.100 г, 0.324 ммоль) в 10 мл этанола добавляли раствор KBzo (0.176 г, 0.649 ммоль) в 10 мл этанола, полученный при взаимодействии KOH (0.036 г, 0.649 ммоль) и HBzo (0.151 г, 0.649 ммоль). Реакционную смесь перемешивали в течение 10 мин при 70°С и отфильтровывали от образовавшегося белого осадка KNO3. К полученному фильтрату добавляли раствор Tb(NO3)3 · 6H2O (0.050 г, 0.108 ммоль) в 10 мл MeCN, навеску Phen (0.058 г, 0.324 ммоль) и перемешивали в течение 10 мин при 70°С. Полученный бесцветный раствор выдерживали при комнатной температуре. Образовавшиеся через 3 сут бесцветные кристаллы, пригодные для РСА, отделяли от маточного раствора декантацией, промывали холодным ацетонитрилом (T ≈ 5°C), и высушивали на воздухе. Выход соединения II 0.185 г (78.1% в расчете на Tb(NO3)3 · 6H2O)
.ИК-спектр (НПВО; ν, см–1): 1622 сл, 1607 сл, 1591 сл, 1556 с, 1541 с, 1531 с, 1496 сл, 1477 ср, 1461 ср, 1429 с, 1375 о.с, 1361 о.с, 1344 ср, 1284 ср, 1246 ср, 1223 сл, 1201 ср, 1160 сл, 1147 ср, 1125 сл, 1103 ср, 1089 ср, 1049 ср, 994 ср, 969 сл, 950 сл, 922 сл, 896 ср, 890 ср, 864 ср, 855 ср, 847 с, 822 с, 792с, 780 сл, 748 ср, 740 ср, 726 с, 707 с, 641 ср, 603 сл, 578 ср, 547 ср, 534 ср, 510 сл, 489 ср, 473 ср, 420 ср, 414 ср, 406 с.
Синтез [EuCd2(Bzo)6(NO3)(Phen)2] · 4MeCN (III) выполняли по аналогичной методике для комплекса II при использовании 0.049 г (0.108 ммоль) Eu(NO3)3 · 6H2O вместо Tb(NO3)3 · 6H2O. Выход соединения III составил 0.200 г (84.5% в расчете на Eu(NO3)3 · 6H2O).
ИК-спектр (НПВО; ν, см–1): 1629 сл, 1608 сл, 1595 сл, 1557 ср, 1539 с, 1531 с, 1515 сл, 1499 сл, 1477 сл, 1458 ср, 1429 ср, 1391 с, 1361 с, 1342 с, 1288 ср, 1247 сл, 1223 сл, 1203 ср, 1159 сл, 1150 ср, 1125 сл, 1101 сл, 1086 сл, 1048 ср, 993 ср, 969 сл, 951 сл, 925 сл, 895 сл, 863 сл, 845 сл, 821 сл, 791 ср, 747 сл, 730 с, 702 с, 639 сл, 578 ср, 532 сл, 488 сл, 469 сл, 434 сл, 426 ср, 419 сл, 403 с.
Синтез [Cd3(Bdc)3(Bipy)2]3n · 4nMeCN · nH2O (IV). К раствору комплекса I (0.0109 г, 0.0046 ммоль) в 3 мл DMF добавляли раствор H2Bdc (0.0027 г, 0.0163 ммоль) в 2 мл DMF. Полученную реакционную смесь помещали в автоклав с тефлоновым вкладышем и постепенно нагревали до температуры 110°C (скорость нагрева 5°C/ч), выдерживали при 110°С в течение 24 ч и постепенно охлаждали до 40°C (скорость охлаждения 1°C/ч). Образовавшиеся бесцветные кристаллы отфильтровывали и высушивали на воздухе. Выход соединения IV 0.004 г (42.1% в расчете на комплекс I).
ИК-спектр (ν, см–1): 2819 сл, 2546 сл, 1676 ср, 1648 ср, 1597 с, 1576 ср, 1520 ср, 1487с, 1441 ср, 1424 ср, 1376 с, 1366 ср, 1282с, 1174сл, 1156 сл, 1105 с, 1063 сл, 1019 ср, 1017 ср, 991 с, 928 ср, 880 ср, 824 ср, 782 ср, 700 ср, 674 сл, 661 ср, 647 ср, 565 ср, 529 ср, 506 ср, 470 ср, 451 ср, 418 сл.
Синтез [Cd2(Bdc)2(Phen)2]n · 2nDMF (V). К раствору комплекса II (0.0126 г, 0.0053 ммоль) в 3 мл DMF добавляли раствор H2Bdc (0.0031 г, 0.0185 ммоль) в 2 мл DMF. Полученную реакционную смесь помещали в автоклав с тефлоновым вкладышем и постепенно нагревали до температуры 100°C (скорость нагрева 4°C/ч), выдерживали при 100°C в течение 48 ч и постепенно охлаждали до 30°C (скорость охлаждения 1°C/ч). Образовавшиеся бесцветные кристаллы отфильтровывали и высушивали на воздухе. Выход соединения V 0.003 г (58.7% в расчете на комплекс II).
ИК-спектр (ν, см–1): 1662 с, 1592 с, 1550 с, 1517 ср, 1504 ср, 1433 ср, 1381 с, 1282 ср, 1144 ср, 1089 ср, 1019 ср, 1018 сл, 986 с, 929 ср, 864 ср, 832 с, 745 с, 724с, 695 с, 661ср, 639 ср, 521ср, 437 сл, 428 ср, 418 с.
РСА монокристаллов соединений I, II и IV выполнен на дифрактометре Bruker Apex II, оборудованном CCD-детектором (MoKα, λ = 0.71073 Å, графитовый монохроматор) [28]. Для всех соединений введена полуэмпирическая поправка на поглощение по программе SADABS [29]. Структуры расшифрованы прямыми методами и уточнены полноматричным МНК в анизотропном приближении для всех неводородных атомов. Атомы водорода при атомах углерода органических лигандов генерированы геометрически и уточнены в модели “наездника”. Расчеты проведены по комплексу программ SHELX [30]. Геометрия полиэдров металлов определена с использованием программы SHAPE 2.1 [31–33].
Данные рентгеновской дифракции для комплекса V получены на рентгеновском пучке станции “Белок” Курчатовского центра синхротронного излучения в Национальном исследовательском центре “Курчатовский институт” в режиме φ-сканирования с использованием CCD детектора Rayonix SX165 при 100 K (λ = 0.79373 Å). Первичное индексирование, уточнение параметров, интегрирование отражений, учет поглощения производили с использованием программного пакета XDS [34, 35]. Структура расшифрована прямыми методами и уточненa полноматричным МНК по F 2 с параметрами анизотропного приближения для всех неводородных атомов. Атомы водорода помещены в рассчитанные положения и уточнены в модели “наездника” с Uизо(H) = = 1.5Uэкв(C) для метильных групп и 1.2Uэкв(C) для остальных атомов водорода. Расчеты выполнены с помощью программного комплекса SHELXTL [30].
Кристаллографические параметры и детали уточнения структур I, II, IV, V приведены в табл. 1. Структурные данные соединений I, II, IV, V депонированы в Кембриджском банке структурных данных (CCDC № 1938125, 1938124, 1938126, 1937492 соответственно); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Таблица 1.
Кристаллографические параметры и детали уточнения структур I, II, IV и V
| Параметр | Значение | |||
|---|---|---|---|---|
| I | II | IV | V | |
| М | 2017.56 | 2370.25 | 3607.94 | 1059.62 |
| Т, K | 150(2) | 150(2) | 120(2) | 100(2) |
| Сингония | Триклинная | Моноклинная | Моноклинная | Моноклинная |
| Пр. гр. | Р$\bar {1}$ | P2/n | P21/n | P21/с |
| a, Å | 11.9120(12) | 15.9414(11) | 14.9097(18) | 11.905(2) |
| b, Å | 15.7124(16) | 13.5408(10) | 31.816(4) | 19.283(4) |
| c, Å | 18.3125(19) | 27.531(2) | 15.8052(19) | 18.462(4) |
| α, град | 84.631(2) | 90 | 90 | 90 |
| β, град | 79.311(2) | 94.9220(10) | 111.911(2) | 98.60(3) |
| γ, град | 77.053(2) | 90 | 90 | 90 |
| V, Å3 | 3277.5(6) | 5920.9(7) | 6955.9(15) | 4190.6(15) |
| Z | 2 | 2 | 2 | 4 |
| ρ(выч.), г см3 | 2.044 | 1.330 | 1.723 | 1.680 |
| μ, мм–1 | 1.746 | 1.011 | 1.432 | 1.460 |
| θmax, град | 28.26 | 28.68 | 25.999 | 30.98 |
| Tmin/Tmax | 0.622/0.903 | 0.580/0.746 | 0.780/0.945 | 0.779/0.892 |
| Число измеренных рефлексов | 34 568 | 41 028 | 44 079 | 69 367 |
| Число независимых рефлексов | 16 145 | 15 104 | 13 686 | 9551 |
| Число рефлексов с I > 2σ(I) | 13 035 | 9975 | 6933 | 8372 |
| Rint | 0.0318 | 0.0735 | 0.152 | 0.0484 |
| Число уточняемых параметров | 1036 | 692 | 916 | 578 |
| GOOF | 1.078 | 1.000 | 1.003 | 1.063 |
| R1 (I > 2σ(I)) | 0.0338 | 0.0629 | 0.0534 | 0.0339 |
| wR2 (I > 2σ(I)) | 0.0808 | 0.1610 | 0.0878 | 0.0945 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
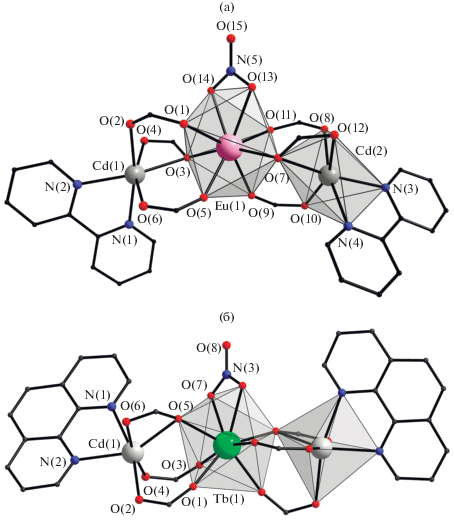
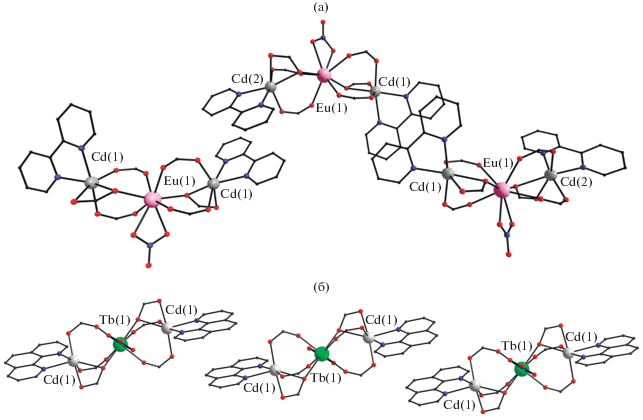
Взаимодействие калиевых солей HO2CC6F5 или HBzo, нитратов кадмия(II) и лантанида(III) (Eu, Tb) в присутствии хелатирующего N-донорного лиганда L, а также Bipy или Phen (KO2CR : Cd : : Ln : L = 6 : 3 : 1 : 3) привело к образованию молекулярных трехъядерных гетерометаллических соединений состава [EuCd2(O2CC6F5)6(NO3)(Bipy)2] (I), [LnCd2(Bzo)6(NO3)(Phen)2] · 4MeCN (Ln = Tb (II), Eu (III)) (рис. 1, схема 1 ).
Рис. 1.
Строение комплексов I (а) и II (б) (пентафторфенильные, ди-трет-бутилфенильные заместители, атомы водорода и сольватные молекулы не показаны).
Подбор условий для синтеза МОКП на основе исходных соединений I, II и терефталевой кислоты (варьирование температуры реакции Т от 50 до 130°C, скорости охлаждения и нагрева от 1 до 20°C/ч, времени выдержки при максимальной T от 12 до 80 ч) не позволил выделить гетерометаллические продукты, комплексы-прекурсоры подвергались деструкции и кристаллизовались слоистые координационные полимеры Cd(II) состава [Cd3(Bdc)3-(Bipy)2]3n · 4nMeCN · nH2O (IV) и [Cd2(Bdc)2- (Phen)2]n · 2nDMF (V) (схема 1 ).
Схема 1 .
Соединения I–III имеют схожее строение трехъядерной молекулы, где центральный атом Ln связан с каждым концевым атомом Cd(II) одним хелатно-мостиковым и двумя мостиковыми карбоксилатными анионами –O2CR (Eu–O 2.353(3)–2.433(2), Cd–O 2.212(3)–2.529(2), Cd(1)···Eu(1) 3.903(5), Cd(2)···Eu(1) 3.933(6), Cd···Cd 7.546(8) Å для I; Tb–O 2.284–2.482, Cd–O 2.208(5)–2.543(4), Cd(1)···Tb(1) 3.7805, Cd(2)···Tb(1) 3.7805, Cd···Cd 7.550(8) Å для II). Атомы кадмия в I–III достраивают свое окружение до искаженного октаэдрического за счет координации двух атомов N хелатирующего лиганда (Cd–N 2.268(3)–2.305(4) Å в I; Cd–N 2.354(5)–2.376(5) Å в II). Центральный атом РЗЭ достраивает свое окружение до искаженного тетрагонально-антипризматического за счет связывания двух атомов О нитрат-аниона (Eu–O 2.469(3)–2.478(2) Å в I; Tb–O 2.482 Å в II). Факт изоструктурности комплексов II и III подтвержден данными РФА.
В молекуле I наблюдается значительное искажение линейной геометрии металлоостова, тогда как в случае комплекса II металлоостов Cd–Ln–Cd практически линеен (угол CdLnCd составляет 148.65(7)° и 173.87(10)° в I и II соответственно). Плоскости координированных ароматических лигандов в одном молекулярном фрагменте соединений I и II повернуты друг относительно друга под углом 55.67° и 41.00° соответственно.
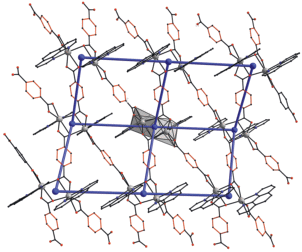
В кристалле I и II наблюдается близкая к параллельной ориентация ароматических фрагментов N‑донорных лигандов соседних молекул комплексов, что может свидетельствовать о π-стекинг-взаимодействиях (рис. 2) (расстояние между плоскостями N-донорного лиганда и двугранный угол между ними равны 3.56–3.70 Å и 0.23°–2.34° для I и 3.30 Å и 0.0° для II соответственно).
Рис. 2.
Фрагмент кристаллической упаковки соединений I (а) и II (б) (пентафторфенильные, ди-трет-бутилфенильные заместители, атомы водорода и сольватные молекулы не показаны).
В литературе описан только один пример сходного с I–III трехъядерного Cd−Ln карбоксилата, сочетающего анионы бензойной кислоты и Phen [24]. Для соединений 3d-металлов подобная структура устойчива, и синтезировано большое количество молекулярных комплексов с металлоостовом {M2Ln} для широкого спектра металлов: M = Zn(II) [15, 36, 37], Co(II) [38, 39] Ni(II) [38], Cu(II) [38].
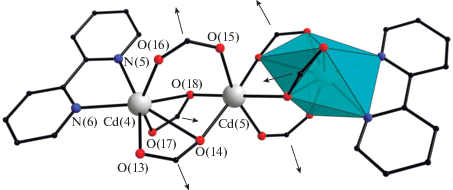
Кристаллическая структура соединения IV представляет собой металлоорганический каркас, построенный на основе шестисвязаного линейного трехъядерного узла {Cd3(Bdc)3Bipy2} (рис. 3). В структуре IV присутствуют два кристаллографически независимых трехъядерных фрагмента, один из которых (Cd(1)–Cd(2)–Cd(3)) находится в общем положении, а второй (Cd(4)–Cd(5)Cd(4)1 – x, 1 – y, 1 – z) занимает частную позицию на центре инверсии. В обоих фрагментах центральный атом Cd связан с терминальными атомами Cd одной хелатно-мостиковой и двумя мостиковыми карбоксилатными группами трех терефталат-анионов (Cd–O 2.164(6)–2.551(6) Å). Терминальные атомы Cd достраивают свое окружение до искаженного октаэдрического за счет координации хелатно связанной молекулы N-донорного лиганда (Cd–N 2.313(8)–2.357(7) Å). Атомы металла в трехъядерных фрагментах находятся на одной линии (углы Cd)(1)Cd(2)Cd(3) и Cd(4)Cd(5)Cd(4)1 – x, 1 – y, 1 – z составляют 172.28(3)° и 180.0° соответственно) с расстояниями Сd···Cd 3.547(1)–3.656(1) Å, что свидетельствует об отсутствии взаимодействий металл–металл.
Рис. 3.
Строение шестисвязанного фрагмента {Cd3(Bdc)3(Bipy)2} в IV (стрелками отмечены направления полимеризации при мостиковой координации Bdc; атомы водорода, фениленовые заместители и сольватные молекулы не показаны).
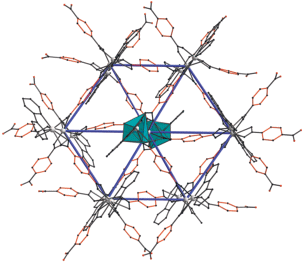
Каждый трехъядерный узел {Cd3(Bdc)3(Bipy)2} в IV связан с шестью соседними аналогичными фрагментами шестью терефталатными мостиками, что приводит к формированию слоистой структуры параллельной кристаллографической плоскости (1 0 –1) c распространенным топологическим мотивом гексагональной сетки hxl [40–43] (рис. 4). Сочетание шестисвязанной координации узлов с треугольными кольцами делает сетку плотной и устойчивой к искажениям в волнистую форму. Одновременно терминальные молекулы Bipy заполняют треугольные кольца и выступают из полимерного слоя, ограничивая проницаемость отдельного слоя и сближение слоев друг к другу. Толщина слоя соответствует длине фрагмента {Cd3(Bdc)3(Bipy)2}. В упаковке структуры IV между полимерными слоями локализованы две сольватные молекулы ацетонитрила, одна из которых разупорядочена по двум положениям, и сольватная молекула воды с половинной заселенностью.
Рис. 4.
Проекция фрагмента полимерного слоя IV вдоль плоскости (1 0 –1) (фенильные фрагменты Bdc– выделены красным цветом, кадмий – серым, базовая сетка топологии hxl показана синим; атомы водорода и сольватные молекулы опущены для ясности).
Координационные полимеры на основе шестисвязанного блока {M3(Bdc)3(Bipy)2} и топологии hxl описаны только для Mn(II) [44, 45] и Ni(II) [46], причем данные МОКП синтезированы при использовании неорганических солей соответствующих металлов. Тогда как в случае координационных полимеров Cd с терефталевой кислотой и 2,2'-дипиридилом характерно формирование полимеров различной размерности на основе моноядерного фрагмента {Cd(Bdc)(H2O)(Bipy)} [47–49] или {Cd(Bdc)(Bipy)} [50], которые синтезированы при непосредственном взаимодействии солей кадмия с Bipy и H2Bdc. Координационные полимеры на основе фрагмента {Cd3(Bdc)3(L)2} синтезированы для ряда монодентатных, мостиковых и хелатирующих лигандов: DMF [51, 52], бромид анион [53], 2-метилбензимидазол в сочетании с DMF [54], 4,4'-дипиридил [55], 1-(1-метилнафтил)имидазол [56]), 2,2'-диимидазол [57], N-метил-2,2'-биимидазол [58].
Фрагмент {Cd3(Bipy)2(CO2)6} ранее наблюдался в каркасном координационном полимере [Cd3(Bipy)2- (Cpt)2]n · 2nH2O (Cpt3– = (4-карбоксилфенокси)терефталат-анион) [59], слоистых структурах [Cd3(Bipy)2(H2O)2(Tst)2] · 2H2O (Tst3– = 2,2',2''-(1,3,5-триазин-2,4,6-триилтрисульфандиил)триацетат-анион) [60] и [Cd3(Bipy)2(Me3Btc)2] (Me3Btc3– = = 2,4,6-триметилбензол-1,3,5-трикарбоксилат-анион) [61] с мотивом 3,6-координированной сетки kgd и [Cd3(Bipy)2(Hcpmb)2] (Hcpmb6– = = 1,2,3,4,5,6-гексакис(3-карбоксилатфеноксиметил) бензол-анион) с топологией 4-координированной сетки sql [62] и цепочках [Cd3(Bipy)2(HSdb)- (Sdb)] (Sdb2– = 4,4'-сульфонил-дибензоат-анион) и [Cd3(Bipy)2(Cpp)2] (Cpp3– = 3-(2-карбоксилатофенокси)фталат-анион) [63]. Из изосетчатых структур с топологией hxl и фрагментом {M3(Bipy)2- (CO2)6} обнаружены только [Mn3(Bipy)2(2-NH2Bdc)3] [64] и [Zn3(Bipy)2(Pdsda)3] (Pdsda = 2,2'-(1,4-фенилендисульфандиил)диацет-анион) [65], в то время как фрагменты {Cd3(L)2(CO2)6} (L = вода, диметиламин, диметилформамид, диэтилформамид) найдены в серии изосетчатых слоев со следующими анионами: 2-аминотерфталат [66], бифенил-4,4'-дикарбоксилат [67], 4,4'-(2,3,6,7-тетраметоксиантрацен-9,10-диил)дибензоат [68], 4,4'-диазин-1,2-диилдибензоат [69]. Таким образом, соединение IV можно назвать первым представителем изосетчатого ряда с топологией hxl и узловым фрагментом {Cd3(Bipy)2(CO2)6}.
Аналог соединения V описан в [70], однако уточненные измерения параметров элементарной ячейки выявили удвоение параметра b (9.668(2) → → 19.283(4) Å), сопровождающееся увеличением ее объема относительно опубликованного ранее (2134.0(9) → 4190.6(15) Å3), что вызвано существующим разупорядочением молекул кристаллизационного растворителя (ДМФА) и приводит структуру к пр. гр. P21/c.
Комплекс V построен на основе биядерного фрагмента {Cd2Bdc2Phen2} (рис. 5), связанного четырьмя анионами терефталевой кислоты в слой (рис. 6). Каждый атом Cd координирует пять атомов O трех терефталат-анионов и два атома N молекулы Рhen. В димерном фрагменте {Cd2Bdc2Phen2} две молекулы Phen располагаются близко друг к другу, вступая в π–π-взаимодействия и формируя волнистый профиль координационных слоев в кристаллической упаковке V.
Рис. 5.
Строение четырехсвязанного молекулярного фрагмента {Cd2(Bdc)2(Phen)2} в V (стрелками отмечены направления полимеризации при мостиковой координации Bdc; атомы водорода, фениленовые заместители и сольватные молекулы не показаны).
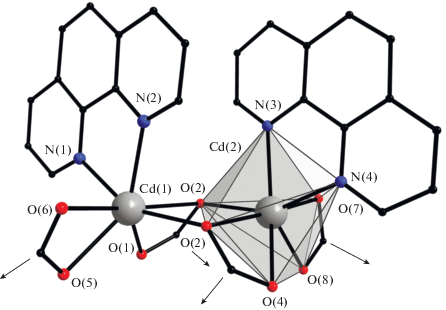
Рис. 6.
Проекция фрагмента полимерного слоя V вдоль плоскости ac (фенильные фрагменты Bdc– выделены красным цветом, кадмий – серым, базовая сетка топологии hxl показана синим; атомы водорода и сольватные молекулы опущены для ясности).
Волнистая форма слоев делает невозможной их абсолютно плотную укладку, и поэтому в кристаллической упаковке полимера V вдоль кристаллографической оси a между слоями присутствуют занятые разупорядоченными молекулами ДМФА каналы с радиусом от 1.17 до 1.82 Å [71].
Мотив связывания биядерных фрагментов мостиковыми анионами терефталевой кислоты в координационных слоях подчиняется топологии первой по встречаемости среди слоистых координационных полимеров 4-координированной тетрагональной сетки sql (рис. 6) [41–43, 71]. В целом ряд изосетчатых соединений с узловым биядерным фрагментом {Cd2((O2C)2R)2Phen2} и лигандами различной длины (от аниона янтарной до 1,2-этилен-бис(4-бензойной кислот)), выполняющими роль практически прямых мостиков, включает 11 примеров [72] (табл. 2), найденных с помощью топологических коллекций ToposPro, https://topcryst.com/. Интересны следующие особенности этого ряда соединений, которые ранее не были описаны в литературе. Среди них два соединения (FIPGUH и JAYYIS) имеют тот же лигандный состав, что и соединение V. Тем не менее JAYYIS является геометрическим изомером соединения V и FIPGUH: лиганды Phen в димерном фрагменте располагаются на максимальном удалении друг от друга и заполняют прямоугольные окна соседних слоев, отчего между ними отсутствуют доступные для миграции каналы. Интересно отметить, что при аналогичной конфигурации лигандов Phen димерного фрагмента в [Cd(Pba)(Phen)] (MATJEY, MATJEY01) большая длина лиганда обеспечивает присутствие доступных для миграции каналов, но в поперечном по отношению к слоям направлении.
Таблица 2.
Изосетчатые соединения топологии sql с узловым биядерным фрагментом {Cd2((O2C)2R)2Рhen2}
| Соединение | Рефкод в CSD | Литература |
|---|---|---|
| Cd(Аdp)(Рhen) · 3H2O | QETCIC | 73 |
| Cd(Bdc)(Phen) · 0.5H2O | JAYYIS | 74 |
| Cd(Bdc)(Phen) · DMF | FIPGUH | 70 |
| Cd(Cmf)(Phen) · C2H4(OH)2 | KADHEE | 75 |
| Cd(Fmr)(Phen) | JEFTOE | 76 |
| Cd(Ndc)(Phen) | WEWLOB | 77 |
| Cd(Ndc)(Phen) · 0.5H2O | WUHZAC | 78 |
| Cd(Pba)(Phen) | MATJEY | 79 |
| Cd(Pba)(Phen) · 2H2O | MATJEY01 | 80 |
| Cd(Suc)(Phen) | DIFFAA | 81 |
| [Cd2(Bpea)(Bdc)(Phen)2][Cd(Bdc)(Phen)] · 2H2O | WAFKUK | 82 |
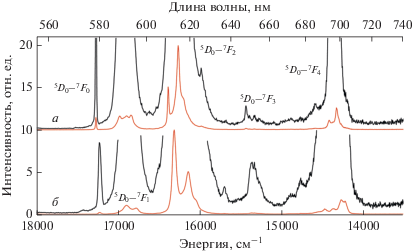
Спектры фотолюминесценции комплексов кадмия-европия I и III, регистрируемые при комнатной температуре (рис. 7), характерны для излучения иона Eu3+ при переходе от уровня 5D0 до уровней 7FJ (J = 0–4). Одиночная симметричная линия синглетного перехода 5D0–7F0 и моноэкспоненциальное поведение кривых затухания люминесценции указывают на наличие только одного типа люминесцирующих металлоцентров в соединениях I и III. Скорость излучательного перехода магнитного диполя 5D0–7F1 практически не зависит от координационного окружения иона европия(III). Напротив, наиболее интенсивный переход 5D0–7F2 оказывается чрезвычайно чувствительным к искажениям геометрии координационного полиэдра европия(III). В комплексах I и III отношения интегральных интенсивностей перехода 5D0–7F2 к магнитному дипольному переходу 5D0–7F1, равные 3.4 и 7.6 соответственно, указывают на небольшое отклонение симметрии металлоцентра Eu3+ от центра инверсии, что согласуется с данными РСА [83].
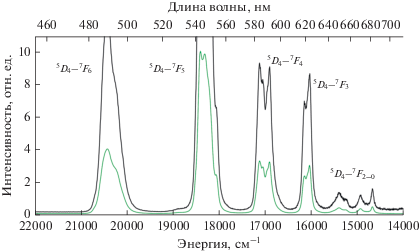
В спектрах люминесценции образца II при комнатной температуре регистрируются линии излучения, которые можно приписать переходам 5D0–7FJ (J = 0–6) иона тербия(III) (pис. 8). При этом переходы 5D0–7F2–0 демонстрируют очень низкую интенсивность, а наиболее интенсивным является переход 5D0–7F5, составляя 52% от общей интегральной интенсивности.
В спектрах возбуждения образцов комплексов I–III, полученных при регистрации люминесценции ионов лантанидов присутствуют широкие полосы, соответствующие возбуждению органических лигандов, а также узкие полосы, относящиеся к f–f-переходам ионов лантанидов (рис. 9).
Рис. 9.
Спектры возбуждения комплексов I (а), III (б), II (в), λэмис = 615, 615, 545 нм соответственно, T = 300 K.
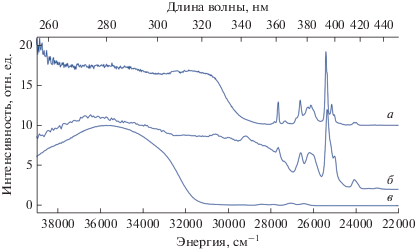
Широкополосное возбуждение комплекса I простирается до 330 нм и имеет два максимума при 280 и 315 нм, связанные с n-, π–π*- и S0–S1-переходами 2,2'-бипиридильных лигандов соответственно. Пентафторбензойный лиганд также может участвовать в процессах поглощения и переноса энергии. Интенсивные f–f-переходы европия(III) указывают на неэффективный перенос энергии лиганд–металл, вызванный высоким положением триплетного уровня. Разница энергий между состоянием T1 лиганда Bipy [84] и уровнем 5D0 иона Eu3+ составляет около 5690 см–1, в то время как, согласно эмпирическим правилам, оптимальный энергетический разрыв должен лежать в диапазоне 2000–2500 см–1 [85, 86].
Прямое возбуждение иона европия(III) в комплексе III оказывается более эффективным, чем сенсибилизация органическими лигандами. Напротив, тербий(III)-содержащий комплекс II демонстрирует выраженный антенный эффект. Широкополосное возбуждение комплекса II возможно до 310 нм с максимумом при 280 нм, соответствующим уровню S1 аниона Bzo. Спектр возбуждения III содержит дополнительно широкую полосу с максимумом при 350 нм, отвечающую состоянию S1 Phen. По всей видимости, возбуждение иона тербия(III) через анион карбоновой кислоты Bzo происходит намного эффективнее, чем через Phen из-за обратного переноса энергии последнему.
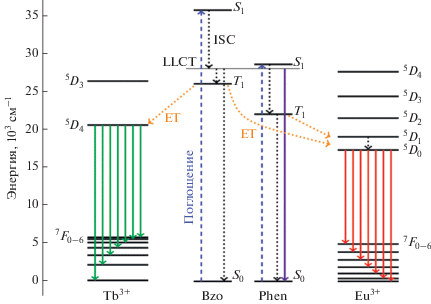
Спектры люминесценции комплексов II и III содержат слабые широкополосные переходы, вызванные переносом заряда с лиганда на лиганд (LLCT) в d-блоке (рис. 10) [24]. Энергетический уровень состояния LLCT находится между уровнями S1 и T1 лиганда Bzo, что способствует более эффективному внутрисистемному переносу энергии излучения (рис. 11).
Рис. 10.
Спектры фотолюминесценции комплексов II (а) и III (б) (λвозб = 280 нм, T = 300 K). На спектрах показаны LLCT переходы d-блока.
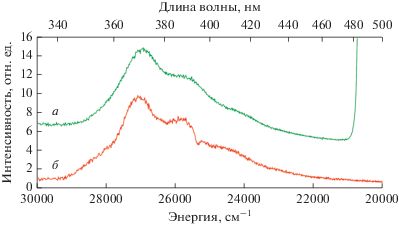
Рис. 11.
Упрощенная диаграмма переноса энергии в комплексах II и III. ISC – внутрисистемный переход, ET – перенос энергии от лиганда к иону лантанида, LLCT – состояние с переносом заряда с лиганда на лиганд.
Чрезвычайно большое время жизни люминесценции τobs возбужденных состояний ионов лантанидов при Т = 300 К во всех комплексах I–III обусловлено отсутствием высокочастотных осциллирующих связей во внутренней координационной сфере ионов лантанидов (τobs составляет 2.15 ± 0.05 (I), 1.63 ± 0.03 (II), 1.41 ± 0.03 мс (III)). Несмотря на неэффективный перенос энергии от органических лигандов к иону европия(III) в комплексах I и III, все соединения демонстрируют яркую металлоцентрированную люминесценцию.
Таким образом синтезированы Cd(II)–Ln(III) гетерометаллические молекулярные комплексы пентафторбензойной и 3,5-ди-трет-бутилбензойной кислот состава [EuCd2(O2CC6F5)6(NO3)- (Bpy)2] (I), [LnCd2(Bzo)6(NO3)(Phen)2] · 4MeCN (Ln(III) = Tb (II), Eu (III)). Показано, что металлоостов соединений I и II в реакциях с терефталевой кислотой подвергается деструкции и в качестве кристаллических продуктов выделены гомометаллические комплексы [Cd3(Bdc)3(Bipy)2]3n · 4nMeCN · · nH2O (IV) и [Cd2(Bdc)2(Phen)2]n · 2nDMF (V). Можно отметить, что в сравнении с триметилацетатом Co−Gd [16], где наблюдалась частичная лишь деструкция комплекса [Co2Gd(Piv)6(NO3)- (Py)], описанные Cd−Ln комплексы менее устойчивы. Комплексы IV и V представляют собой координационные полимеры слоистой структуры, в которых биядерный или трехъядерный мономерные фрагменты связаны мостиковыми анионами дикарбоновых кислот. Исследования люминесценции показали, что все соединения демонстрируют яркую металлоцентрированную люминесценцию с большим временем жизни люминесценции.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Huang C.-H. Rare Earth Coordination Chemistry: Fundamentals and Applications. John Singapore (Asia): Wiley and Sons, 2010.
Bünzli J.C.G., Eliseeva S.V. // Chem. Sci. 2013. V. 4. P. 1939.
Yan Y. Photofunctional Rare Earth Hybrid Materials. Singapore: Springer Singapore, 2017.
Tropiano M., Kenwright A.M., Faulkner S. // Chem. Eur. J. 2015. V. 21. № 15. P. 5697.
Binnemans K. // Chem. Rev. 2009. V. 109. P. 4283.
Weissman S.I. // J. Chem. Phys. 1942. V. 10. P. 214.
Rausch J., Lorenz V., Hrib C.G. et al. // Inorg. Chem. 2014. V. 53. № 21. P. 11662.
Heine J., Müller-Buschbaum K. // Chem. Soc. Rev. 2013. V. 42. № 24. P. 9232.
Cui Y., Yue Y., Qian G., Chen B. // Chem. Rev. 2012. V. 112. № 2. P. 1126.
Goldberg A.A., Kiskin M., Nikolaevskii S., et al. // Chem. Asian J. 2016. V. 11. P. 604.
Łyszczek R., Kula A., Gładysz-Płaska A. et al. // J. Anal. Appl. Pyrolysis. 2011. V. 33. P. 347.
Utochnikova V.V., Kotova O.V., Vaschenko A.A. et al. // Adv. Mater. Sci. Eng. 2012. V. 2012. Article ID 809028.
Evstifeev I.S., Efimov N.N., Varaksina E.A. et al. // Eur. J. Inorg. Chem. 2017. № 22. P. 2892.
Kalyakina A.S., Utochnikova V.V., Bushmarinov I.S. et al. // Chem. Eur. J. 2015. V. 21. P. 17921.
Егоров Е.Н., Кискин М.А., Сидоров А.А. и др. // Изв. АН. Сер. хим. 2013. № 10. С. 2141.
Sapianik A.A., Lutsenko I.A. et al. // Russ. Chem. Bull. 2016. V. 65. № 11. P. 2601.
Sapianik A.A., Kiskin M.A., Samsonenko D.G. et al. // Polyhedron. 2018. V. 145. P. 147.
Sapianik A.A., Zorina-Tikhonova E.N. et al. // Inorg. Chem. 2017. V. 56. № 3. P. 1599.
Sotnik S.A., Polunin R.A., Kiskin M.A. et al. // Inorg. Chem. 2015. V. 54. № 11. P. 5169.
Dorofeeva V.N., Kolotilov S.V. et al. // Chem. Eur. J. 2012. V. 18. № 16. P. 5006.
Goldberg A.E., Kiskin M.A., Nikolaevskii S.A. et al. // Russ. J. Coord. Chem. 2015. V. 41. № 3. P. 182. https://doi.org/10.1134/S1070328415120015
Chi Yu-Xian, Niu Shu-Yun, Wang Zhao-Long et al. // Gaodeng Xuexiao Huaxue Xuebao (Chem. J. Chin. Univ.). 2008. V. 29. P. 1081.
Chi Yu-Xian, Niu Shu-Yun, Zhao-Long Wang et al. // Eur. J. Inorg. Chem. 2008. № 14. P. 2336.
Chi Yu-Xian, Liu Yu-Qian, Xiao-Shuang Hu et al. // Z. Anorg. Allg. Chem. 2016. V. 642. № 1. P. 73.
Chi Yu-Xian, Niu Shu-Yun, Jing Jin et al. // Dalton Trans. 2009. № 37. P. 7653.
Егоров Е.Н., Кискин М.А., Сидоров А.А., Еременко И.Л. // Изв. АН. Сер. хим. 2013. № 8. С. 1924.
Николаевский С.А., Кискин М.А., Старикова А.А. и др. // Изв. АН. Сер. хим. 2016. С. 2812.
SMART (control) and SAINT (integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
Krause L., Herbst-Irmer R., Sheldrick G.M. et al. // J. Appl. Cryst. 2015. V. 48. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Alvarez S., Llunell M. // Dalton Trans. 2000. № 19. P. 3288.
Alvarez S., Avnir D., Llunell M., Pinsky M. // New J. Chem. 2002. V. 26. P. 996.
Casanova D., Llunell M., Alemany P., Alvarez S. // Chem. Eur. J. 2005. V. 11. P. 1479.
Kabsch W. // Acta Crystallogr. D. 2010. V. 66. P. 125.
Kabsch W. // Acta Crystallogr. D. 2010. V. 66. P. 133.
Bin Wu // J. Coord. Chem. 2008. V. 61. P. 2558.
Chi Yu-Xian, Niu Shu-Yun, Ru Wang et al. // J. Lumin. 2011. V. 131. P. 1707.
Бурковская Н.П., Орлова Е.В., Кискин М.А. и др. // Изв. АН. Сер. хим. 2011. С. 2442.
Yan Zhu, Feng Luo, Xue-Feng Feng et al. // Aust. J. Chem. 2013. V. 66. P. 75.
Blatov V.A., Shevchenko A.P., Proserpio D.M. // Cryst. Growth Des. 2014. V. 14. P. 3576.
O’Keeffe M., Peskov M.A., Ramsden S.J., Yaghi, O.M. // Acc. Chem. Res. 2008. V. 41. P. 1782.
Mitina T.G., Blatov V.A. // Cryst. Growth Des. 2013. V. 13. P. 1655.
Carlucci L., Ciani G., Proserpio D.M. et al. // Chem. Rev. 2014. V. 114. P. 7557.
Lu Xiao-Ming, Li Pei-Zhou, Wang Xiu-Teng et al. // Polyhedron. 2008. V. 27. P. 2402.
Gomez V., Corbella M., Mautner F.A. et al. // Polyhedron. 2012. V. 45. P. 185.
Yong Bok Go, Xiqu Wang, Anokhina E.V., Jacobson A.J. // Inorg. Chem. 2005. V. 44. P. 8265.
Hong-Bin Xu, Zhong-Min Su, Kui-Zhan Shao et al. // Inorg. Chem. Commun. 2004. V. 7. P. 260.
Prajapati R., Mishra L., Kimura K., Raghavaiah P. // Polyhedron. 2009. V. 28. P. 600.
Wang Xiao-Li, Yang Guo-Dong, Dai Jing-Cao // Jiegou Huaxue (Chin. J. Struct. Chem.). 2009. V. 28. P. 1480.
Li Xiu-Mei, Niu Yan-Ling, Wang Qing-Wei et al. // Jiegou Huaxue (Chin. J. Struct. Chem.). 2007. V. 26. P. 537.
Burrows A.D., Cassar K., Duren T. et al. // Dalton Trans. 2008. P. 2465.
Song Gao, Rui Qing Fan, Xin Ming Wang et al. // J. Mater. Chem. A. 2015. V. 3. P. 6053.
Ju-Hsiou Liao, Wei-Chia Huang // Inorg. Chem. Commun. 2006. V. 9. P. 1227.
Xiaoqing Guo, Miao Wang, Xuefang Gu et al. // J. Coord. Chem. 2016. V. 69. № 11–13. P. 1819.
Jing-Cao Dai, Xin-Tao Wu, Sheng-Min Hu et al. // Eur. J. Inorg. Chem. 2004. P. 2096.
Qing-Xiang Liu, Xiao-Jun Zhao, Xiu-Mei Wu et al. // Inorg. Chem. Commun. 2008. V. 11. P. 809.
Bao-Hui Ye, Bing-Bing Ding, Yan-Qin Weng, Xiao-Ming Chen // Cryst. Growth Des. 2005. V. 5. P. 801.
Li-Ning Yang, Yan-Xiang Zhi, Jia-Hui Hei et al. // J. Coord. Chem. 2011. V. 64. P. 2912.
Yu Wu, Jian Wu, Bin Xie et al. // J. Lumin. 2017. V. 192. P. 775.
Chengjuan Li, Yanqiang Peng, Suna Wang et al. // J. Solid State Chem. 2011. V. 184. P. 1581.
Jie Guo, Liang-Liang Zhang, Hai-Yan He et al. // Acta Crystallogr. C. 2011. V. 67. P. 387.
Hong-Mei Zhang, Jin Yang, Ying-Ying Liu et al. // Cryst-EngComm. 2015. V. 17. P. 3181.
Fen-Yan Lian, Fei-Long Jiang, Da-Qiang Yuan et al. // CrystEngComm. 2008. V. 10. P. 905.
Chao-Jun He, Wei-Yang Wang, Yu-Fang Wang // Z. Anorg. Allg. Chem. 2013. V. 639. P. 994.
Jian-Ling Yin, Yun-Long Feng, You-Zhao Lan // Inorg. Chim. Acta. 2009. V. 362. P. 3769.
Xin-Ping Kang, Zhe An // Synth. React. Inorg., Met.-Org., Nano-Met. Chem. 2015. V. 45. P. 1352.
Fernandez B., Beobide G., Sanchez I. et al. // CrystEngComm. 2016. V. 18. P. 1282.
Liangliang Zhang, Fuling Liu, Yu Guo et al. // Cryst. Growth Des. 2012. V. 12. P. 6215.
Fernandez B., Seco J.M., Cepeda J. et al. // CrystEngComm. 2015. V. 17. P. 7636.
Xin Shi, Guangshan Zhu et al. // Cryst. Growth Des. 2005. V. 5. P. 207.
Blatova O.A., Golov A.A., Blatov V.A. // Z. Kristallogr. Cryst. Mater. 2018. P. 2143.
Alexandrov E.V., Shevchenko A.P., Blatov V.A. // Cryst. Growth Des. 2019. V. 19. P. 2604.
Du M., Jiang X.-J., Zhao X.-J. // Inorg. Chem. Commun. 2006. V. 9. P. 1199.
Thirumurugan A., Rao C.N.R. // J. Mater. Chem. 2005. V. 15. P. 3852.
Zhao Y., Lai Q., Lin Z. et al. // Solid State Sci. 2010. V. 12. P. 1404.
Lu J., Chu D.-Q., Yu J.-H. et al. // Inorg. Chim. Acta. 2006. V. 359. № 8. P. 2495.
Zhao B., Cheng P., Cui P. et al. // Z. Anorg. Allg. Chem. 2013. V. 639. P. 626.
Yang L., Qin C., Song B.-Q. et al. // CrystEngComm. 2015. V. 17. P. 4517.
Xu X., Zhang X., Liu X. et al. // CrystEngComm. 2012. V. 14. P. 3264.
Li G., Wang C., Zhang X. // J. Coord. Chem. 2013. V. 66. P. 1107.
Yu X., Ma Y., Lu Y. et al. // J. Coord. Chem. 2007. V. 60. P. 547.
Wang X.-L., Qin C., Wang E.-B. et al. // Angew. Chem. Int. Ed. 2004. V. 43. P. 5036.
Bünzli J.-C.G. Lanthanide Probes in Life, Chemical and Earth Sciences. Theory and Practice. Amsterdam: Elsevier, 1989. V. 5. P. 324.
Dobrokhotova Zh.V., Fomina I.G., Aleksandrov G.G. et al. // Russ. J. Inorg. Chem. 2009. V. 54. P. 680.
Sato S., Wada M. // Bull. Chem. Soc. Jpn. 1970. V. 43. P. 1955.
Latva M., Takalo H., Mukkala V.-M. et al. // Lumin. J. 1997. V. 75. № 2. P. 149.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия