Координационная химия, 2020, T. 46, № 11, стр. 706-712
Строение и нековалентные взаимодействия монослоев дисульфида молибдена в слоистом органо-неорганическом соединении с тетраметилгуанидином
И. Е. Ушаков 1, А. С. Головешкин 1, Н. Д. Лененко 1, Р. У. Таказова 1, М. Г. Езерницкая 1, А. А. Корлюков 1, В. И. Зайковский 2, 3, А. С. Голубь 1, *
1 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
2 Институт катализа им. Г.К. Борескова СO РАН
Новосибирск, Россия
3 Новосибирский государственный университет
Новосибирск, Россия
* E-mail: golub@ineos.ac.ru
Поступила в редакцию 14.03.2020
После доработки 01.04.2020
Принята к публикации 08.04.2020
Аннотация
Cлоистое соединение c регулярно чередующимися монослоями MoS2 и N,N,N',N'-тетраметилгуанидина (TMG) получено в результате взаимодействия монослоевых дисперсий дисульфида молибдена, содержащих анионные частицы (MoS2)x–, с протонированными молекулами TMG. Совокупностью методов рентгенофазового анализа, адаптированного для турбостратно-разупорядоченных систем, ПЭМВР, ИК-Фурье спектроскопии и квантово-химических расчетов методом функционала плотности установлено, что в соединении стабилизируется структура слоев MoS2 с октаэдрически координированными атомами молибдена, образующими цепочки Mo–Mo связей. Между монослоями MoS2 и молекулами TMG реализуются нековалентные связывающие взаимодействия, которые включают CH…S, NH…S и N…S контакты с преобладающим вкладом в энергетику связывания контактов первого типа (СIF file CCDC № 1990439).
Дисульфид молибдена – один из наиболее востребованных слоистых материалов, который существует в природе и выпускается промышленно. Благодаря уникальным структурным и физико-химическим свойствам, он применяется в нефтехимических катализаторах [1], смазках [2], используется в перспективных разработках тонкослойных электронных устройств [3], электрокатализаторов [4], накопителей энергии [5], биосенсоров [6], биоактивных препаратов [7]. Внедрение в межслоевое пространство кристаллов MoS2 органических молекул является эффективным средством модифицирования структурных свойств этого материала, включая изменение типа координации атомов молибдена c серой в его слоях (тригональная призма – октаэдр), и может быть использовано для влияния на проводящие и каталитические свойства материала [4, 5].
Выявление структурообразующих взаимодействий в слоистых органо-неорганических соединениях дисульфида молибдена – важная задача для их направленного дизайна. Из-за турбостратного характера наложения гетерослоев в частицах соединений MoS2, получение необходимой структурной информации требует применения комплексного подхода, включающего моделирование дифракционных картин турбостратно-разупорядоченных систем по Уферу [8] и квантово-химическую оптимизацию структурных моделей [9, 10]. За последние годы с использованием этого подхода было определено строение слоистых соединений MoS2 c несколькими типами азотсодержащих органических молекул и установлено, что важную роль в стабилизации пространственной структуры этих соединений, в том числе октаэдрической координации в полиэдре MoS6, необходимой для ряда применений, играют водородные связи между атомами серы слоев MoS2 и органическими гостями. Например, в случае интеркалированных катионов тетраалкиламмония, слабые взаимодействия CH…S, единственно доступные для этих соединений специфические взаимодействия с сульфидными слоями, определяют положение молекул относительно нанорельефа сульфидных слоев, заставляя катионы располагаться в наноуглублениях на поверхности слоя [9]. Эти же взаимодействия, как установлено, ответственны за расположение в наноуглублениях рельефа и молекул алкилендиаминов, тогда как наклон данных молекул относительно сульфидных слоев обусловлен образованием сильных водородных связей NH…S с обоими соседними слоями сульфида [11].
Ранее была определена атомная структура и связывающие контакты для слоистых соединений MoS2, содержащих в качестве доноров сильной водородной связи только амино(аммониевые)группы NH2(${\text{NH}}_{3}^{ + }$) [11]. В этой связи изучение взаимодействий MoS2 c другими NH-донорами и оценка влияния их геометрии на архитектуру соединений представляет несомненный интерес.
В настоящей работе получено новое слоистое соединение (TMG)0.13MoS2 (I), содержащее протонированные молекулы N,N,N',N'-тетраметилгуанидина (TMG), охотно образующего сильные водородные связи с различными анионами [12, 13], определено его строение и проанализированы энергетические характеристики связывающих контактов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез (TMG)0.13MoS2 (I) выполняли взаимодействием монослоевой дисперсии LiMoS2 с протонированными молекулами TMG аналогично родственным соединениям MoS2, описанным ранее [10, 11]. Для этого вначале получали соединение LiMoS2 обработкой природного порошкообразного MoS2 (марки ДМ-1, Скопинский завод) избытком 1.6 М раствора н-бутиллития в гексане (Aldrich) при 20°С в течение одной недели с последующей промывкой гексаном и высушиванием в вакууме. Затем диспергировали 0.1000 г (5.99 ммоль) LiMoS2 в 100 мл раствора, содержащего 0.1721 г (15.0 ммоль) TMG (Aldrich) в воде, подкисленной HCl, при барботировании аргоном и ультразвуковой обработке. Реакционную смесь перемешивали на магнитной мешалке в течение 2 ч, образовавшийся осадок соединения отфильтровывали, промывали 3 раза водой и высушивали в вакууме. Выход 0.9960 г (95%). Состав соединения определяли по данным элементного анализа.
| Найдено, %: | С 4.43; | H 1.25, | N 3.02; | Mo 54.70. |
| Для (С5H14N3)0.13S2Mo | ||||
| вычислено, %: | C 4.46; | H 1.04; | N 3.12; | Mo 54.83. |
Снимки просвечивающей электронной микроскопии высокого разрешения (ПЭМВР) получали на приборе JEM-2200FS (JEOL Ltd.) с предельным разрешением по линиям 0.1 нм при ускоряющем напряжении 200 кВ. Для исследования образцы помещали на перфорированные углеродные подложки, закрепленные на стандартных медных сетках, и затем помещали в камеру электронного микроскопа. Фурье-фильтрацию и анализ снимков HRTEM с определением величины межплоскостных расстояний проводили с помощью программы Digital Micrograph 3.6.5 (Gatan Inc.).
ИК-Фурье-спектры нарушенного полного внутреннего отражения (НПВО) снимали на ИК-Фурье-спектрометре Vertex 70v (Bruker, Germany), используя приставку для НПВО “PIKE” (США) с алмазным рабочим элементом. Спектры измеряли в вакууме в спектральном диапазоне 4000–400 см–1 с разрешением 4 см–1. Необходимые поправки вводили с помощью спектральной программы Omnic 8 (Nicolet, USA).
Дифрактометрическое исследование соединения проводили с помощью дифрактометра Bruker D8 Advance Vario (Bruker AXS), оснащенного рентгеновской трубкой с медным анодом, германиевым монохроматором и позиционно чувствительным детектором Lynx-Eye в геометрии пропускания рентгеновского излучения через образец. Шаг съемки 0.01° 2θ; интервал съемки 6°–90° 2θ. Моделирование дифрактограммы проводили по программе TOPAS 5 (Bruker AXS). Основные структурные характеристики слоистого соединения приведены в табл. 1.
Таблица 1.
Структурные параметры слоистого соединения (TMG)0.13MoS2
| Параметр* | Значение |
|---|---|
| Пр. гр. | P1 |
| a, Å | 5.685(9) |
| b, Å | 3.208(5) |
| c, Å | 10.19(1) |
| Кратчайшие расстояния Mo–Mo, Å | 2.806(10); 3.208(5); 3.751(11) |
| Угол MoMoMo в зигзагах, град | 69.7(3) |
| S–S Δɀ1, Δɀ2, Å | 3.440(12), 2.201(12) |
| Перепад высоты нанорельефа слоев, Å | 0.620(12) |
| Cдвиг слоев MoS2, Å | |
| вдоль оси a вдоль оси b | 3.411(6) 2.438(6) |
| Rwp, % | 3.267 |
Координаты атомов и другие параметры структуры депонированы в Кембриджском банке структурных данных (CCDC № 1990439; https:// www.ccdc.cam.ac.uk/structures).
Квантово-химический расчет проводили с помощью программы VASP версия 5.3 [14, 15]. Оптимизацию координат атомов проводили с использованием обменно-корреляционного функционала PBE и базисного набора плоских волн (максимальная кинетическая энергия – 545 эВ) и дисперсионной поправки Grimme D3 [16]. Для описания остовных электронов использовали “жесткие” потенциалы PAW (projected augmented wave) [17] (размер области описываемой псевдоволновой функции наименьший). Расчетную функцию электронной плотности получали c использованием максимальной кинетической энергии 1360 эВ. Топологический анализ выполняли с помощью программы AIM, входящей в комплекс программ ABINIT [18].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Как известно, сборка соединений в водной монослоевой дисперсии MoS2, содержащей отрицательно заряженные монослоевые частицы (MoS2)x–, приводит к формированию слоистых структур с чередованием этих анионных монослоев с монослоями органических катионов (A+) по уравнению (1) [10]. В случае участия в сборке высокоосновного TMG (pKa 13) в роли катионов может выступать только протонированная форма его молекул (TMGH+), которая доминирует в растворе в широком интервале pH.
(1)
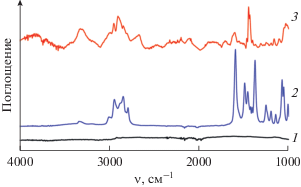
$\begin{gathered} {{\left[ {{\text{L}}{{{\text{i}}}^{ + }} + {{{\left( {{\text{Mo}}{{{\text{S}}}_{{\text{2}}}}} \right)}}^{{x - }}} + \left( {1--x} \right){\text{O}}{{{\text{H}}}^{--}}} \right]}_{{{\text{aq}}}}} + x{{{\text{A}}}^{ + }} \to \\ \to {{\left( {{{{\text{A}}}^{ + }}} \right)}_{x}}{{\left( {{\text{Mo}}{{{\text{S}}}_{{\text{2}}}}} \right)}^{{x - }}}. \\ \end{gathered} $Встраивание молекул TMG в органо-неорганическое соединение подтверждается как данными элементного анализа, так и спектрами FTIR-ATR (рис. 1). В спектре соединения I отчетливо видны основные полосы исходного TMG, хотя соотношение интенсивностей между спектрами существенно различно. Различия могут быть связаны с искажением пространственной структуры молекулы TMG при встраивании в соединение, взаимодействием с поверхностью слоев сульфида и другими физическими факторами. Отметим, что в спектрах чистого TMG и I в области колебаний ν(NH) проявляются полосы при 3323 и 3300 см–1 соответственно, обусловленные колебаниями свободной (или слабосвязанной) группы NH (TMG) или ${\text{NH}}_{{\text{2}}}^{ + }$ (I). При этом в обоих случаях отсутствует широкое поглощение в области 3400–2700 см–1, характерное для соответствующей группы, вовлеченной в сильную водородную связь [19].
Из этого, в частности, следует, что в соединении с MoS2 катионы TMGH+ не ассоциированы ни с молекулами нейтрального TMG, ни с молекулами воды.
Исследование соединения I методом просвечивающей электронной микроскопии позволило установить, что оно осаждается из дисперсий в виде пластинчатых частиц, типичная боковая проекция частицы показана на рис. 2. Они образованы пакетами из регулярно расположенных слоев МоS2 с уширенными (по сравнению с фазой чистого MoS2) межслоевыми промежутками, что обусловлено интеркалированием молекул “гостя”, как и в случае ранее изученных соединений MoS2 c органическими молекулами [10, 11, 20]. Как видно из микроснимков, периодичность в расположении слоев, определенная по Фурье-образам фрагментов структуры и по профилю интенсивности в направлении, перпендикулярном слоям, составляет 9.6–1.1 Å. Эти значения хорошо согласуются с данными порошковой рентгеновской дифракции, которая фиксирует увеличение межслоевой периодичности в гибридной структуре с 6.15 Å (исходный MoS2, пр. гр. P63/mmc, дифрактограмма полностью соответствует JCPDS-77-1716) до 10.2 Å (рис. 3).
Рис. 2.
Микроснимок ПЭМВР фрагмента структуры I (1), его FFT образ (2) и профиль интенсивности вдоль линии (3).
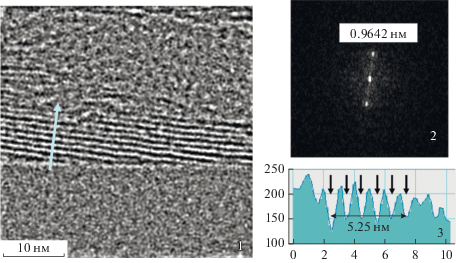
Рис. 3.
Экспериментальные дифрактограммы исходного MoS2 (1) и (TMG)0.13MoS2 (2) (черные точки), а также расчетная дифрактограмма (красная линия) и разностная кривая (серая линия) слоистого соединения (2).
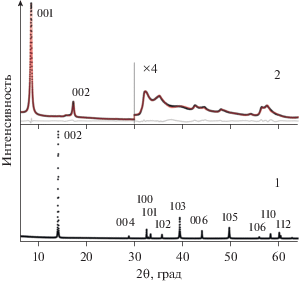
Как видно из рис. 3, на дифрактограмме соединения присутствуют базальные 00l отражения, положение которых обусловлено межслоевым расстоянием между слоями MoS2, а также hk0-зона (в области 2θ > 30°) с набором ассиметричных уширенных рефлексов, типичных для двумерно-упорядоченных структур с турбостратным наложением слоев, например слоистых глин [8]. Дифракционный профиль был смоделирован, как описано ранее [9, 10, 20], с использованием сверхячейки Уфера [8], имеющей периодичность вдоль оси с (перпендикулярно слоям MoS2), увеличенную в 20 раз по сравнению с межслоевым расстоянием в соединении. Ячейка (пр. гр. P1) содержала два слоя MoS2 c ассоциированными органическими молекулами, что дало возможность выявить корреляции в наложении слоев [10]. Ритвельдовское уточнение модели позволило определить структуру слоев MoS2, их систематические сдвиги друг относительно друга и расположение органических молекул (рис. 4, 5). Основные структурные характеристики соединения приведены в табл. 1.
Рис. 4.
Структура I в проекции вдоль оси b (a) и вдоль оси a (б). Показаны короткие контакты CH…S и NH…S с указанием расстояния и энергии взаимодействия (ккал/моль).
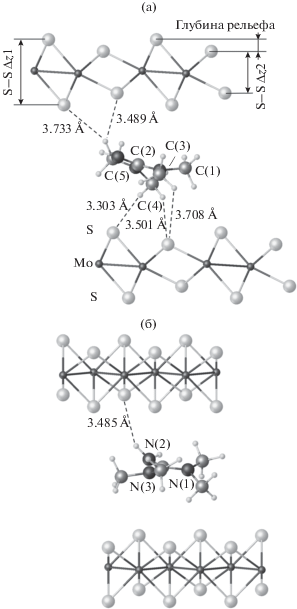
Полученные данные свидетельствуют о том, что геометрия монослоя MoS2 в соединении I соответствует модификации 1T, которая наблюдалась в ранее изученных MoS2-органических соединениях [9, 10, 20]. Она отличается от обычной модификации 2H, характерной для природного молибденита, как октаэдрической координацией молибдена с серой (вместо тригонально-призматической), так и неэквивалентностью расстояний Mo–Mo, обусловленной образованием цепочек из атомов молибдена в плоскости слоя сульфида, а также гофрировкой подрешетки атомов серы (pис. 4, 5). Гофрировка возникает из-за образования наноразмерных выступов и углублений, распространяющихся по поверхности монослоя MoS2 вдоль оси b. В изученном соединении перепад высот рельефа составляет 0.62 Å, что превышает в ~1.5 раза типичную величину этого параметра для ранее исследованных соединений MoS2 c органическими гостями [10, 11, 20]. Кроме того, можно отметить большие величины систематических сдвигов монослоев MoS2 друг относительно друга, возникающие при сборке частиц слоистого соединения I по сравнению с соединениями, изученными ранее. Так, сдвиг слоев по оси а ячейки Уфера составляет ~3.41 Å (или 2.27 Å с учетом величины параметра a), тогда как для других соединений абсолютные величины сдвигов не превышали 1 Å. Оба этих факта свидетельствуют о подстраивании геометрии монослоев MoS2 под геометрию координирующих с ними молекул для обеспечения наиболее эффективного связывания.
Плоскость гуанидинового фрагмента молекул TMG расположена под небольшим наклоном по отношению к слоям MoS2 (19°), при этом группа NH2 направлена в сторону атома серы, находящегося в наноуглублении на поверхности слоя. Метильные заместители также проявляют тенденцию занимать позиции над углублениями слоя сульфида, к которому данный заместитель наиболее приближен.
Для выявления связывающих взаимодействий в соединении I на основе полученных структурных данных была построена модель гипотетического упорядоченного кристалла, в котором турбостратность в наложении слоев отсутствовала. Для этого, по аналогии с ранее изученными соединениями этого типа [10, 11, 20], частично заселенные позиции были равномерно заполнены катионами в соответствии с их содержанием, избегая коротких контактов между молекулами (рис. 5). Состав такой периодической структуры, (TMG)1/6MoS2, близок к экспериментально найденной стехиометрии соединения I. Модель описана с помощью триклинной ячейки, параметры которой (a = 6.523, b = 9.6297, c = 10.467 Å, α = 94.20°, β = 98.77°, γ = = 119.78°) связаны с параметрами ячейки Уфера, использованной для уточнения структуры, следующими соотношениями: $\bar {a}$ = ${{\bar {a}}_{{ref}}}$ – ${{\bar {b}}_{{ref}}}$, $\bar {b}$ = 3${{\bar {b}}_{{ref}}}$, $\bar {с}$ = ${{\bar {с}}_{{ref}}}$/N + ${\bar {S},}$ где индексами ref обозначены параметры ячейки, в которой проводилось уточнение, ${\bar {S}}$ – вектор сдвига слоев.
Для оптимизации геометрии соединения I и вычисления функции расчетного распределения электронной плотности (ρ(r)) были проведены квантово-химические расчеты DFT (PBE-D3/PW). Анализ полученного распределения согласно теории Бейдера “Атомы в молекулах” выявил критические точки (КТ) (3, –1) на связевых путях в соединении. Свойства КТ связей внутри слоев MoS2 и между ними и молекулами TMG приведены в табл. 2. Важно отметить, что внутри слоя MoS2 расчет фиксирует появление КТ, соответствующих образованию связей Mo–Mo, которые отсутствуют в исходном MoS2 с тригонально-призматической координацией Mo–S [21]. Обращает на себя внимание также неэквивалентность длин и энергетических характеристик КТ связей Mo–S, что обусловлено образованием рельефной поверхности слоя S–Mo–S с выступами и углублениями.
Таблица 2.
Характеристики связевых критических точек (3, –1) в (TMG)1/6MoS2*
| Взаимодействие | Число взаимодействий | Расстояние между атомами, Å | ρ(r) | ∇2ρ(r) | Ge(r) | Ve(r) | He(r) |
|---|---|---|---|---|---|---|---|
| Mo…Mo | 6 | 2.843 | 0.064711 | 0.105991 | 0.047635 | –0.06877 | –0.02114 |
| Mo…S | 18 | 2.421 | 0.095457 | 0.179022 | 0.087113 | –0.12947 | –0.04236 |
| Mo…S | 18 | 2.485 | 0.083042 | 0.138066 | 0.068426 | –0.10233 | –0.03391 |
| NH…S | 2 | 3.485–3.843 | 0.009366 | 0.024927 | 0.005555 | –0.00488 | 0.000677 |
| N…S | 3 | 3.451–3.843 | 0.005796 | 0.016889 | 0.003391 | –0.00256 | 0.000831 |
| CH…S | 16 | 3.489–4.120 | 0.006541 | 0.018876 | 0.003875 | –0.00303 | 0.000844 |
Энергии нековалентных взаимодействий с участием катионов TMG (Econt) были оценены с использованием корреляции Эспинозы–Молинса–Лекомта между плотностью потенциальной энергии КТ и энергией связи [22, 23]. Полученные значения Econt приведены в табл. 3. Согласно расчетам, общая энергия взаимодействия катион–MoS2 составляет 20.7 ккал/моль, и доминирующий вклад в нее (~73%) вносят относительно слабые взаимодействия CH…S, характеризующиеся средней энергией контакта ~1 ккал/моль. Надо отметить, что значительный вклад алифатических фрагментов в стабилизацию структуры соединений MoS2 наблюдался и для других гостевых молекул, участвующих в нескольких конкурирующих видах связывания со слоями MoS2. Так, вклад взаимодействий CH…S в стабилизацию структуры соединений MoS2 c молекулами алкилендиаминов достигал 20–60% в зависимости от геометрии диамина, причем наибольший вклад обеспечивала разветвленная структура типа тетраметилэтилендиамина [11]. Очевидно, что такому связыванию способствует встраивание алкильных заместителей в углубления нанорельефа, что обеспечивает увеличение числа контактов CH…S. Это является важным фактором, влияющим на упаковку органических молекул между слоями дисульфида молибдена.
Таблица 3.
Энергия связывающих нековалентных взаимодействий (Econt) катионов TMGH+ (ккал/моль на моль катиона)
| Тип связи | Количество контактов | Econt |
|---|---|---|
| CH…S | 16 | 15.2 |
| NH…S | 2 | 3.1 |
| N…S | 2 | 2.4 |
| Катион…MoS2 | 20 | 20.7 |
Менее значительный энергетический вклад в стабилизацию соединения (~16%), согласно расчетным данным, вносят водородные связи NH2-группы. Наиболее сильная связь с энергией 2.51 ккал/моль характеризуется расстоянием H‒S 2.540 Å и углом NHS 153°. Еще меньший вклад (~11%) обеспечивает участие в связывании p-электронов сопряженной системы связей катионного гуанидиниевого фрагмента, что, по-видимому, обусловлено экранированием атомов азота метильными заместителями, препятствующими образованию коротких контактов N…S.
Таким образом, в результате взаимодействия отрицательно заряженных монослоевых частиц (MoS2)x– с катионными протонированными молекулами TMG нами получено гетерослоистое соединение I с регулярно чередующимися органическими (TMG) и неорганическими (MoS2) слоями. Исследование соединения с использованием ПЭМВР, ИК-Фурье-спектроскопии, моделирования порошковых дифрактограмм турбостратно-разупорядоченных соединений и квантово-химических расчетов позволило определить строение слоев MoS2 и гостя. Найдено, что, благодаря встраиванию TMG между слоями MоS2, в этих слоях стабилизируется структура с октаэдрически координированными атомами молибдена, образующими цепочки связей Mo–Mo, которая отличается от наиболее устойчивой модификации MoS2 с тригонально-призматической координацией; это согласуется с результатами исследований других MoS2-органических соединений. С помощью расчетного распределения электронной плотности были выявлены и проанализированы по Бейдеру связывающие взаимодействия внутри сульфидных слоев и между ними и молекулами TMG. Установлено, что нековалентные взаимодействия TMG-MoS2 включают контакты CH…S, NH…S и N…S с преобладающим вкладом в энергетику связывания контактов первого типа. Полученные данные, как можно ожидать, будут полезны для направленного структурного дизайна органо-неорганических соединений на основе дисульфида молибдена.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Startsev A.N., Zakharov I.I. // Russ. Chem. Rev. 2003. V. 72. P. 517.
Tannous J., Dassenoy F., Lahouij I. et al. // Tribol. Lett. 2011. V. 41. P. 55.
Jariwala D., Howell S.L., Chen K.-S. et al. // Nano Lett. 2016. V. 16. P. 497.
Benck J.D., Hellstern T.R., Kibsgaard J. et al. // ACS Catal. 2014. V. 4. P. 3957.
Yoo H.D., Li Y., Liang Y. et al. // ChemNanoMat. 2016. V. 2. P. 688.
Kalantar-zadeh K., Ou J.Z. // ACS Sensors. 2016. V. 1. P. 5.
Yin F., Anderson T., Panwar N. et al. // Nanotheranostics. 2018. V. 2. P. 371.
Ufer K., Roth G., Kleeberg R. et al. // Z. Krist. 2004. V. 219. P. 519.
Goloveshkin A.S., Lenenko N.D., Zaikovskii V.I. et al. // RSC Adv. 2015. V. 5. P. 19206.
Goloveshkin A.S., Lenenko N.D., Zaikovskii V.I. et al. // Langmuir. 2015. V. 31. P. 8953.
Ushakov I.E., Goloveshkin A.S., Lenenko N.D. et al. // Cryst. Growth Des. 2018. V. 18. P. 5116.
Dong K., Zhang S., Wang J. // Chem. Commun. 2016. V. 52. P. 6744.
Berg R.W., Riisager A., Buu O.N.V. et al. // J. Phys. Chem. A. 2010. V. 114. P. 13175.
Kresse G., Furthmüller J. // Comput. Mater. Sci. 1996. V. 6. P. 15.
Kresse G., Furthmüller J. // Phys. Rev. B. 1996. V. 54. P. 11169.
Grimme S. // J. Comp. Chem. 2006. V. 27. P. 1787.
Kresse G., Joubert D. // Phys. Rev. B. 1999. V. 59. P. 1758.
Gonze X., Beuken J.-M., Caracas R. et al. // Comput. Mater. Sci. 2002. V. 25. P. 478.
Galezowski W., Jarczewski A., Stanczyk M. et al. // Faraday Trans. 1997. V. 93. P. 2515.
Goloveshkin A.S., Bushmarinov I.S., Korlyukov A.A. et al. // Russ. J. Inorg. Chem. 2017. V. 62. P. 729. https://doi.org/10.1134/S0036023617060080
Naumov N.G., Korlyukov A.A., Piryazev D.A. et al. // Russ. Chem. Bull. 2013. V. 62. P. 1852.
Espinosa E., Molins E., Lecomte C. // Chem. Phys. Lett. 1998. V. 285. № 3–4. P. 170.
Espinosa E., Lecomte C., Molins E. // Chem. Phys. Lett. 1999. V. 300. P. 745.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия