Координационная химия, 2020, T. 46, № 11, стр. 653-662
ЭПР радиационно-наведенных азотных центров в гидроксиапатите: новые подходы для изучения электрон-ядерных взаимодействий
Ф. Ф. Мурзаханов 1, *, Г. В. Мамин 1, М. А. Гольдберг 2, А. В. Кнотько 3, М. Р. Гафуров 1, **, С. Б. Орлинский 1
1 Казанский (Приволжский) федеральный университет
Казань, Россия
2 Институт металлургии и материаловедения им. А.А. Байкова РАН
Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: murzakhanov.fadis@yandex.ru
** E-mail: marat.gafurov@kpfu.ru
Поступила в редакцию 11.04.2020
После доработки 16.05.2020
Принята к публикации 19.05.2020
Аннотация
Исследованы радиационно-наведенные примесные азотные центры (${\text{NO}}_{3}^{{2 - }}$) в наноразмерных порошках синтетического гидроксиапатита (ГА) методами импульсного электронного парамагнитного резонанса (ЭПР) и импульсного двухчастотного ЭПР – ядерного магнитного резонанса (ЯМР), детектируемого по двойному электрон-электронному резонансу (ДДЯМР). Идентифицированы сигналы ЭПР, обусловленные взаимодействием электрона ${\text{NO}}_{3}^{{2 - }}$ с ядрами окружения (1H, 14N, 31P), определены параметры сверхтонкого и квадрупольного взаимодействий электрона с ядрами 14N. Продемонстрирована возможность применения метода ДДЯМР в Х-диапазоне сверхвысоких частот (νСВЧ ≈ 9 ГГц) при комнатных температурах для получения детальной информации об особенностях электрон-ядерных взаимодействий в ГА.
В последнее десятилетия наблюдается новый виток интереса к материалам на основе фосфатов кальция (ФК) биогенного и синтетического происхождений, что обусловлено развитием технологий тканевой инженерии и распространенностью ФК в биологических объектах [1–3]. Ряд разнохарактерных по своему проявлению патологических заболеваний (опухолевые, сердечно-сосудистые и др.) могут быть связаны с образованием и наличием органоминеральных отложений в различных органах и тканях человеческого организма [4], а главной неорганической фазой патогенной кальцификации коллагеновых, мышечных, костной и зубной тканей является фосфат кальция, который с определенной степенью приближения относят к гидроксиапатиту (ГА) c химической формулой Ca10(PO4)6(OH)2, как правило, слабо закристаллизованному и нестехиометрическому из-за присутствия значительных количеств посторонних ионов [5–8]. Некоторые из этих ионов входят в кристаллическую решетку апатита, другие же только адсорбируются на его поверхности [9].
Эволюция технологий в области тканевой инженерии связана с разработками материалов нескольких поколений – от биоинертных до остекондуктивных, стимулирующих остеосинтез [10, 11]. Модифицированные синтетические ГА, помимо биомедицинских приложений, могут использоваться как высокоэффективные абсорбенты нитратов из почвы и грунтовых вод [12], подложки для катализаторов [13] и др. Селективная антиопухолевая активность нанокристаллов ГА продемонстрирована в [14, 15].
Несмотря на большое количество проведенных исследований, многие важные вопросы, относящиеся к анионным и катионным замещениям в ГА, остаются изученными недостаточно, а данные многих работ противоречивы. Наиболее противоречивая информация связана с самой возможностью допирования наночастиц, формами вхождения и местами локализации примесей в биоминералах и синтетических образцах, а также сопряжена с проблемой выбора подходящего аналитического метода для детектирования наличия примесных структур.
Для изучения природных и синтетических ГА методами ЭПР часто в качестве парамагнитных зондов используются центры, возникающие под действием ионизирующего излучения. В облученных образцах методы ЭПР и двойного электрон-ядерного резонанса (ДЭЯР) позволили идентифицировать значительное количество неорганических радикалов: ${\text{O}}_{3}^{ - },$ ${\text{CO}}_{3}^{ - },$ ${\text{CO}}_{3}^{{3 - }},$ ${\text{CO}}_{2}^{ - },$ ${\text{CO}},$ ${\text{PO}}_{4}^{ - }{\text{\;}}$ и ${{{\text{H}}}^{0}}{\text{\;}}$ [16]. При этом необходимо отметить, что природа радиационных сигналов ЭПР в других ФК остается слабоизученной [2, 9, 17].
Развитие техники ЭПР с применением различных расчетных методик позволяет открывать новые аспекты использования сигнальных парамагнитных зондов. В группе ЭПР Казанского федерального университета было показано, что изменение спектральных характеристик ЭПР-сигналов от карбонатных радикалов в органоминеральных отложениях может использоваться для характеристики степени кальцификации стенок сосудов при атеросклерозе [18]. Используя более высокую чувствительность методов ЭПР в сильных магнитных полях, в атеросклеротических бляшках (АСБ) были обнаружены ионы марганца Mn2+, релаксационные характеристики которых (время поперечной электронной релаксации) коррелируют со стабильностью АСБ [19]. Было также обнаружено, что карбонизация синтезированных нано- и микрочастиц ГА ведет к уменьшению азотсодержащих примесей, внедряющихся в структуру ГА при популярном способе синтеза образцов из растворов NH4OH и HNO3 [20].
Среди большого ряда парамагнитных центров, играющих значительную (активную и сигнальную) роль в жизнедеятельности живых организмов, процессах метаболизма, а также имеющих широкую область практических и потенциальных применений, азотсодержащие радикалы имеют особое значение [21]. Стабильные нитроксильные радикалы (НР) и спиновые ловушки на их основе эффективно применяются в качестве парамагнитных зондов для изучения разнообразных молекулярных систем в жидком и твердом состояниях начиная с 1960-х гг. [22, 23]. Незаменимы НР как спиновые метки в изучении методами двойного электрон-электронного резонанса (ДЭЭР) структур различных биомолекул [24–27]. Однако, несмотря на длительное изучение азотсодержащих центров, многие детали их структуры, динамики, свойств и участия в метаболических процессах остаются слабоизученными. Так, до недавнего времени нитраты (${\text{NO}}_{3}^{ - }$) и нитриты (${\text{NO}}_{2}^{ - }$) рассматривались исключительно как инертные конечные продукты метаболизма окислов азота NO, либо как токсичные и канцерогенные составляющие, попадающие в организм по пищевой цепи. За последние десятилетия накопились достаточно убедительные свидетельства того, что данные анионы в крови и тканях живых организмов должны рассматриваться как необходимые для хранения азота пулы, т.е. нитраты и нитриты активно участвуют в цикле превращения азота и его соединений в живых организмах по механизму, комплиментарному к признанному в физиологии животных и растений с использованием NO-синтазы [28]. Исследования доказывают, что введение неорганического нитрата (${\text{NO}}_{3}^{ - }$) оказывает противовоспалительное действие и ведет к стабилизации АСБ, в то время как влияние нитритов не выражено [29]. Важный для химии тропосферы открытый более 130 лет назад азотный радикал NO3 является классическим примером “провала” приближения Борна–Оппенгеймера для его описания. Спектр поглощения, электронная структура, фотохимические свойства этого радикала до сих пор до конца непонятны, вынуждая прибегать к все более изощренным теоретическим и экспериментальным методам его изучения [30, 31]. Неожиданно высокие экспериментальные значения коэффициента усиления сигналов ЯМР 1H за счет эффекта динамической поляризации ядер (ДПЯ) в водных растворах НР в сильных магнитных полях [32] и открытие ДПЯ с использованием азот-координированных порфириновых комплексов ванадия в нефтяных системах [33] заставляют пересмотреть устоявшиеся модели расчетов динамических характеристик азотсодержащих центров в водных и нефтедисперсных средах. Идентификации и новым аспектам в исследовании различных азотных центров в алмазах и наноалмазах методами ЭПР посвящен ряд работ В.В. Минина [34, 35].
В ряде наших предыдущих публикаций было показано, что радиационно-наведенный нитратный радикал ${\text{NO}}_{3}^{{2 - }}$ можно использовать в качестве эффективного спинового зонда для изучения структуры и химического состава при модификации порошковых микро- и нанообразцов ГА и других ФК различными анионами и катионами (например, ионами ${\text{CO}}_{3}^{{2 - }}$ [22], Mn2+ [36, 37], Pb2+ [38], Al3+ [39]) методами ЭПР и ДЭЯР. Спектроскопические и релаксационные характеристики ${\text{NO}}_{3}^{{2 - }}$ изменяются при содопировании ГА и уменьшении размеров частиц. Комбинацией методов мультичастотного стационарного и импульсного ЭПР, ДЭЯР на ядрах 1H и 31P, расчетами в рамках теории функционала плотности мы определили структуру и местоположение радиационно-наведенного нитратного радикала ${\text{NO}}_{3}^{{2 - }}$ в образцах ГА. Показано, что величину сверхтонкого взаимодействия электрона стабильного радикала ${\text{NO}}_{3}^{{2 - }}$ с собственным ядром азота можно использовать для идентификации дислокации нитрат-ионов в кристаллической решетке ГА [40].
В настоящей работе представлены результаты исследований радиационно-наведенных азотных центров ${\text{NO}}_{3}^{{2 - }}$ в синтетических порошках ГА методом ДЭЭР-детектируемого ЯМР (ДДЯМР, ан-гл. ELDOR detected NMR – EDNMR) при комнатной температуре в трехсантиметровом X-диапазоне. Насколько известно авторам настоящей работы, ДДЯМР не применялся ранее для исследования подобных систем. Более того, в большинстве известных приложений импульсный ДДЯМР используется на более высоких частотах и при низких температурах для лучшего спектрального разрешения и самой возможности наблюдения сигнала импульсного ЭПР [41–43]. Поскольку импульсный ДДЯМР не является стандартной ЭПР-методикой физико-химического анализа веществ, часть исследования представляет собой краткое теоретическое введение в сущность техники ДДЯМР, необходимое для понимания полученных результатов.
МАТЕРИАЛЫ И МЕТОДЫ
Синтез ГА выполняли методом осаждения из водных растворов: в раствор нитрата кальция вводили раствор фосфата аммония и аммиак. Осаждение вели при pH 11.5 ± 0.5. Расчеты компонентов проводили в соответствии с реакцией (1):
(1)
$\begin{gathered} 10{\text{Ca}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{2}} + 6{{\left( {{\text{N}}{{{\text{H}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{\text{HP}}{{{\text{O}}}_{4}} + 8{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH}} = \\ = {\text{С}}{{{\text{а}}}_{{{\text{10}}}}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{6}}}}{{\left( {{\text{OH}}} \right)}_{2}} + 20{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{N}}{{{\text{O}}}_{3}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Образовавшийся осадок подвергали процессу старения в течение 21 сут для увеличения степени кристаллизации апатитовой фазы, затем отфильтровывали и сушили при 60°C.
Полученные материалы исследовали методами рентгенофазового анализа (РФА, Rigaku D/max-2500), ИК-спектроскопии (Nikolet Avatar), растровой электронной микроскопии для определения морфологии и размера частиц (РЭМ, CrossBeam 1540 EsB, Carl Zeiss). Согласно данным РФА, порошок однофазный, пики соответствуют ГА (карточка PDF #09-0432) с пр. гр. P63/m. Данные ИК-спектроскопии подтверждают формирование апатитовой структуры. В ИК-спектрах (ν, см–1) присутствуют полосы поглощения групп ν$({\text{O}}{{{\text{H}}}^{ - }})$ при 3575 и 630, а также фосфатных групп дуплета ν4$\left( {{\text{PO}}_{4}^{{3 - }}} \right)$ при 570 и 610, широкого триплета ν2$\left( {{\text{PO}}_{4}^{{3 - }}} \right)$ при 420–480, пиков ν1$\left( {{\text{PO}}_{4}^{{3 - }}} \right)$ при 962 и ν$\left( {{\text{PO}}_{4}^{{3 - }}} \right)$ при 875, а также дуплета ν3$\left( {{\text{PO}}_{4}^{{3 - }}} \right)$ при 1095 и 1040. Нитратные группы ν$\left( {{\text{NO}}_{3}^{ - }} \right)$ представлены полосами поглощения высокой интенсивности при 830, а также дуплетом при 1395 и 1370, связанным с сохранением следов NH4NO3 как побочного продукта синтеза и адсорбцией ${\text{NO}}_{3}^{ - }$ на поверхности ГА. Исследование РЭМ показало, что материалы сформированы частицами округлой и овальной морфологии размером 10–20 нм, которые образуют плотные агломераты.
Эксперименты по ЭПР проводили на спектрометре фирмы Bruker серии Elexsys E580 в X-диапазоне (νСВЧ = 9.6 ГГц) при комнатной температуре (T = 297 K). Измерения осуществляли в импульсном режиме [44]. Регистрацию спектра ЭПР производили с помощью детектирования интегральной интенсивности электронного спинового эха (ЭСЭ) в зависимости от величины магнитного поля B0. Использовали импульсную последовательность Хана: π/2–τ–π–τ–ЭСЭ, где задержка между импульсами τ = 200 нс, а длительность импульса π/2 равна 16 нс. Для определения времени спин‑спиновой релаксации (T2) также использовали последовательность Хана. В данном случае измеряли интегральную интенсивность ЭСЭ при фиксированном B0 в зависимости от τ, которое увеличивалось с шагом 4 нс до необходимой величины. Время спин-решеточной релаксации (T1) определяли с помощью последовательности “инверсия–восстановление”: π–Tза-держки–π/2–τ–π–τ–ЭСЭ. При измерении T1 регистрировали интегральную интенсивность ЭСЭ при фиксированном B0 в зависимости от времени Tзадержки, которое варьировали от 1.5 мкс (с шагом в 256 нс) до момента полного восстановления исходной амплитуды сигнала ЭСЭ.
Для создания стабильных парамагнитных центров, отсутствующих в номинально чистом материале, применяли рентгеновское облучение образца с использованием установки УРС-55 (U = 55 кВ, I = 18 мА, вольфрамовый антикатод) при комнатной температуре в течение 1 ч с расчетной дозой облучения в 30 кГр. Симуляцию спектров ЭПР осуществляли с помощью пакета прикладных программ Matlab с дополнительным модулем Easyspin [45].
Метод ДДЯМР реализовывали на ЭПР-спектрометре Bruker Elexsys E580 в Х-диапазоне (νсвч1 или νнабл = 9.59 ГГц, B0 ≈ 0.34 T) при T = 297 K. Для осуществления двойных электрон-электронных переходов, лежащих в основе метода ДДЯ-МР, использовали импульсный ELDOR модуль E580-400U и диэлектрический кольцевой резонатор ER 4118X-MD5. Модуль E580-400U необходим для генерации и протяжки второй независимой микроволновой частоты (νсвч2 или νнакач) в диапазоне от 9.3 до 10 ГГц. Резонатор ER 4118X-MD5, благодаря регулируемой добротности, позволяет оптимизировать ширину полосы резонансных частот в соответствии со специфическими требованиями эксперимента.
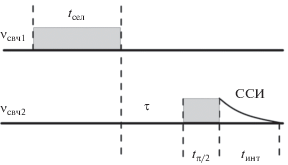
Для достижения высокой разрешающей способности длительность селектирующего импульса (tсел) выбирали равной 6 мкс, что соответствует полосе возбуждения в спектре ЭПР с ∆B = 0.47 Гс. Длительность детектирующего импульса (tπ/2) равна 300 нс при регистрации сигнала свободной индукции (ССИ, англ. free induction decay – FID) (рис. 1).
Для увеличения чувствительности и минимизации возможности возникновения различных артефактов выбрали следующие параметры регистрации: время интегрирования tинт = 250 нс; интервал между импульсами τ = 3 мкс (добротность резонатора Q = 200 на частоте ν = 9.59 ГГц, мертвое время ≈200 нс).
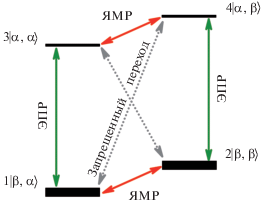
ДДЯМР для S = 1/2 и I = 1/2. Рассмотрим сверхтонкое взаимодействие (СТВ) в системе, состоящей из электрона (S = 1/2) и магнитного ядра (I = 1/2). Данная конфигурация будет характеризоваться четырехуровневой системой: 1 = |β, α〉, 2 = |β, β〉, 3 = |α, α〉, 4 = |α, β〉, где первый индекс в скобке – проекция спина электрона, а второй – проекция ядерного спина (рис. 2).
Указанная спиновая система описывается следующим гамильтонианом:
(2)
$\hat {H} = {{{\omega }}_{s}}{{\hat {S}}_{z}} + {{{\omega }}_{{\text{I}}}}{{\hat {I}}_{z}} + A{{\hat {S}}_{z}}{{\hat {I}}_{z}} + B{{\hat {S}}_{z}}{{\hat {I}}_{x}},$где первые два слагаемых – электронное и ядерное зеемановское взаимодействие, оставшиеся два слагаемых – компоненты аксиального СТВ. A и B связаны с величинами СТВ в канонических положениях A|| = Azz, A⊥ = Axx = Ayy через соответствующие выражения: A = A||cos2θ + A⊥sin2θ, B = (A|| – A⊥)sinθcosθ, где θ – угол между кристаллической осью с и магнитным поле B0.
На рис. 2 отмечены три вида переходов: i) разрешенные ЭПР-переходы 1 → 3 и 2 → 4 с частотами ν13 и ν24 соответственно (вероятность таких переходов, как правило, высока, правило отбора ∆Ms = ±1, ∆MI = 0); ii) запрещенные ЭПР-переходы (∆Ms = ±1, ∆MI = ±1, ±2) 1 → 4 и 2 → 3 с частотами ν14 и ν23 соответственно (вероятность таких переходов, как правило, мала); iii) разрешенные ЯМР-переходы (∆Ms = 0, ∆MI = ±1) 1 → 2 и 3 → 4 с частотами ν12 и ν34 соответственно (вероятность таких переходов велика при соответствующем радиочастотном воздействии).〉
Эксперимент по ДДЯМР заключается в переносе электронной поляризации между разрешенными уровнями 1–3 или 2–4 на уровни, соответствующие разрешенным переходам ЯМР 1–2 или 3–4, тем самым изменяя интенсивность поглощения ЭПР-сигнала. Первый селектирующий импульс с изменяющейся частотой необходим для возбуждения запрещенных переходов с поворотом спиновой намагниченности на угол π. Второй детектирующий импульс при фиксированной частоте (частоте наблюдения) необходим для возбуждения разрешенных ЭПР-переходов с соответствующим углом поворота спиновой намагниченности на π/2. Длительность селектирующего и детектирующего импульсов значительно отличаются друг от друга, что связано с существенной разницей между величинами вероятности запрещенных (If) и разрешенных (Ia) переходов. Оптимальный угол поворота селектирующим импульсом определяется как:
(3)
${{{\beta }}_{{\text{f}}}} = {{{\omega }}_{1}}{{t}_{{{\text{сел}}}}}{{\left( {{{I}_{{\text{f}}}}} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}} = {{{\beta }}_{0}}{{\left( {{{I}_{{\text{f}}}}} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$где ω1/2π = geμeB1/h, β0 = ω1tсел – угол поворота в случае If = 1.
Из-за существующей зависимости угла поворота намагниченности от вероятности перехода величина селектирующего импульса составляет десятки, а то и сотни микросекунд. Длительность же детектирующего импульса редко достигает 1 мкс, так как Ia$ \gg $ If. Селектирующий импульс, вызывая переходы между запрещенными переходами 1–4 или 2–3, изменяет заселенность данных уровней, а также параллельно выравнивает поляризацию между уровнями 1–3 и 2–4.
Детектирование обычно осуществляется на микроволновой частоте для одного из разрешенных ЭПР переходов, в то время как частота селектирующего импульса изменяется в широком диапазоне. Таким образом, спектр ДДЯМР представляет из себя зависимость интегральной интенсивности разрешенного ЭПР перехода от частоты селектирующего импульса. При совпадении частоты селектирующего импульса с частотой одного из запрещенных переходов наблюдается уменьшение сигнала ЭПР разрешенного перехода.
Величина провала в спектре ДДЯМР зависит от вероятности разрешенных и запрещенных переходов, которые определяются как:
где η = (1/2)(ηα – ηβ), ηα = arctg[–B/(A + 2ωI)], ηβ = arctg[–B/(A – 2ωI)].
Коэффициент глубины провала записывается как:
(5)
$h{\text{\;}} = {\text{\;}}1 - {{I}_{{\text{a}}}}{\text{cos}}\left( {{{{\beta }}_{0}}{{{\left( {{{I}_{{\text{f}}}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}} \right) - {{I}_{{\text{f}}}}{\text{cos}}\left( {{{{\beta }}_{0}}{{{\left( {{{I}_{{\text{a}}}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}} \right).$Из (5) можно заключить следующее: i) чем выше степень аксиальной анизотропии СТВ, тем выше вероятность запрещенных переходов, и, следовательно, эффект ДДЯМР будет более выраженным; ii) в случае, когда величина СТВ соизмерима или практически равна ларморовской частоте ядра, то вероятность запрещенного перехода будет столь же высокой, как и у разрешенного перехода ЭПР; iii) в канонических ориентациях при θ = 0° и θ = 90° параметр η = 0, обращая в ноль вероятность запрещенного перехода.
Выражение (5) при неоднородной ширине линии ЭПР учитывает тот факт, что при частотном возбуждении спинового пакета селектирующим или детектирующим импульсом можно перекрыть как разрешенные, так и запрещенные переходы. Член пропорциональный cos(β0(If)1/2) соответствует запрещенному переходу, резонансному с частотой селектирующего импульса. Поскольку детектирующий импульс подается на частоте разрешенного перехода, его интенсивность учитывается умножением на Ia. Член пропорциональный cos(β0(Ia)1/2) представляет собой случай, когда разрешенный переход находится в резонансе с частотой селектирующего импульса. В этом случае наблюдаемый переход является запрещенным, что учитывается множителем If [46, 47].
ДДЯМР азотных радикалов (S = 1/2 и I = 1). Спиновая система радиационно-наведенного нитратного радикала ${\text{NO}}_{3}^{{2 - }}$ (как и НР) описывается с использованием квантовых чисел: S = 1/2 и I = 1 (для ядер 14N). По сравнению с (2) спиновый гамильтониан: дополняется квадрупольным взаимодействием:
(6)
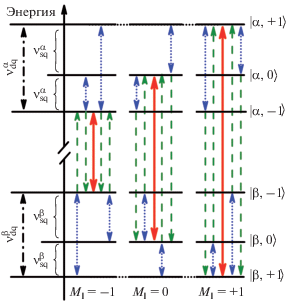
$\hat {H} = {{g}_{{\text{e}}}}{{\beta }_{{\text{e}}}}{{B}_{0}}\hat {S} - {{g}_{{\text{n}}}}{{\beta }_{{\text{n}}}}{{B}_{0}}\hat {I} + \hat {S}A\hat {I} + \hat {I}P\hat {I},$где ge и gn – тензоры электронного и ядерного спектроскопического расщепления, βe и βn – электронный и ядерный магнетон, A и P – тензоры сверхтонкого и квадрупольного взаимодействия. На рис. 3 представлены уровни энергии рассматриваемой спиновой системы в предположении А > 2νI (νI – ларморовская частота ядра азота при фиксированном поле B0). С каждым из трех разрешенных переходов ЭПР связаны еще четыре запрещенных перехода, вероятность которых из-за смешивания уровней может отличаться от нуля.
Рис. 3.
Схема расщепления энергетических уровней в магнитном поле для спиновой системы с S = 1/2 и I = 1. Случай для А > 2νI. Сплошные линии (красные) – разрешенные ЭПР-переходы, штриховые линии (зеленые) – запрещенные ЭПР-переходы, пунктирные линии (синие) – переходы ЯМР [46]).
В первом порядке теории возмущения с учетом А > 2νI для переходов ДДЯМР получим следующие выражения:
(7а)
${\nu }_{{{\text{sq}}1}}^{{\alpha }} = {A \mathord{\left/ {\vphantom {A 2}} \right. \kern-0em} 2} - {\text{\;}}{{{\nu }}_{{\text{I}}}} - {\text{\;}}{{3P} \mathord{\left/ {\vphantom {{3P} 2}} \right. \kern-0em} 2},$(7г)
${\nu }_{{{\text{sq}}1}}^{{\beta }} = {A \mathord{\left/ {\vphantom {A 2}} \right. \kern-0em} 2} + {\text{\;}}{{{\nu }}_{{\text{I}}}} - {\text{\;}}{{3P} \mathord{\left/ {\vphantom {{3P} 2}} \right. \kern-0em} 2},$(7д)
${\nu }_{{{\text{sq}}2}}^{{\beta }} = {A \mathord{\left/ {\vphantom {A 2}} \right. \kern-0em} 2} + {\text{\;}}{{{\nu }}_{{\text{I}}}} + {\text{\;}}{{3P} \mathord{\left/ {\vphantom {{3P} 2}} \right. \kern-0em} 2},$где индексы sq и dq обозначают одноквантовые (single quantum) и двухквантовые (double quantum) переходы соответственно.
Отсюда, используя данные выражения и экспериментальные значения переходов в частотных спектрах ДДЯМР, можно напрямую, с точностью до знака, определить величину квадрупольного расщепления [48, 49]:
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
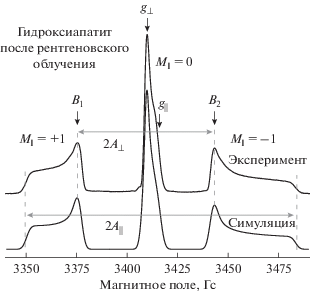
Спектр импульсного ЭПР порошкового образца ГА после рентгеновского облучения представлен на рис. 4. Сигнал обусловлен наличием в образце радиационно-наведенного нитратного радикала ${\text{NO}}_{3}^{{2 - }}$ аксиальной симметрии, описываемого спиновым гамильтонианом [40] имеет вид:
(9)
$\begin{gathered} \hat {H} = {{g}_{{||}}}\beta {{B}_{z}}{{{\hat {S}}}_{z}} + {{g}_{ \bot }}\beta \left( {{{B}_{x}}{{{\hat {S}}}_{x}} + {{B}_{y}}{{{\hat {S}}}_{y}}} \right) + \\ + \,\,{{A}_{{||}}}{{{\hat {S}}}_{z}}{{{\hat {I}}}_{z}} + {{A}_{ \bot }}\left( {{{{\hat {S}}}_{x}}{{{\hat {I}}}_{x}} + {{{\hat {S}}}_{y}}{{{\hat {I}}}_{y}}} \right). \\ \end{gathered} $Рис. 4.
Спектр ЭПР азотного радикала в матрице ГА, полученный с помощью детектирования интегральной интенсивности ЭСЭ, в зависимости от B0. Нижняя кривая – симуляция экспериментального спектра.-
Параметры спектра ЭПР азотного радикала в ГА представлены ниже:
Выраженная анизотропия g- и А-тензоров для разных ориентаций внешнего магнитного поля в порошковом спектре позволяет спектрально разрешить ориентации нанокристаллов от параллельного (c || B0) до перпендикулярного (c ⊥ B0).
Поскольку релаксационные характеристики играют одну из ключевых ролей для успешного осуществления эксперимента по ДДЯМР (в методе используются длинные импульсные последовательности и длинные импульсы), на всех компонентах спектра ЭПР, представленного на рис. 4 (соответствующих переходам с MI = 0 и ±1), были измерены времена T1 и T2. Как оказалось, для всех переходов T2 = 3 ± 0.3 мкс, что позволило осуществить детектирование сигнала ДДЯМР при комнатной температуре. Относительно короткое время продольной релаксации T1 = 30 ± 1.2 мкс позволяет устанавливать величину повторения импульсных последовательностей Tповт = 5T1 ≈ ≈ 150 мкс для возможности накопления сигнала и увеличения соотношения сигнал/шум за относительно небольшой интервал времени проведения эксперимента.
Вид спектра ДДЯМР зависит от квантового числа MI. В наших измерениях значения B0 фиксировали на перпендикулярной ориентации сверхтонкой структуры (СТС), обозначенных стрелками на рис. 4 как B1 и B2, для увеличения соотношения сигнал/шум отдельно для каждого перехода СТС с MI равными +1 и –1 соответственно.
На обзорных спектрах, представленных на рис. 5, в области ±6 и ±14.8 МГц наблюдаются сигналы, соответствующие ларморовским частотам фосфора 31P (I = 1/2) и водорода 1H (I = 1/2) при B0 ≈ 0.34 T. Данные сигналы стоило ожидать, поскольку водород и фосфор являются структурными элементами ГА и свидетельствуют о том, что изученные азотные примеси внедряются в кристаллическую решетку ГА. Отсутствие дополнительных структур или подрасщеплений для данных ядер говорит о недостаточной разрешающей способности метода ДДЯМР, по крайней мере при комнатной температуре в X-диапазоне. Детальное исследование СТВ азотного радикала с ядрами 31P и 1H в ГА методами ДЭЯР, спектры которых регистрировались при T < 100 K, представлено в [40].
Рис. 5.
Обзорный спектр ДДЯМР для двух разных переходов СТС с MI = +1 (a) и –1 (б) в магнитных полях B1 и B2 соответственно (см. рис. 4).
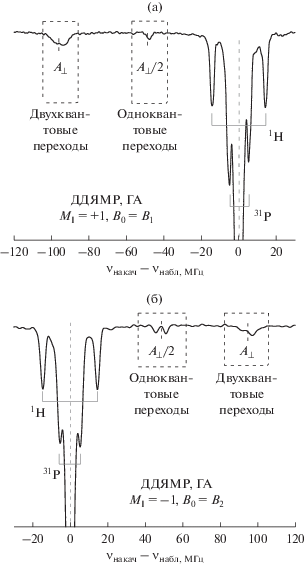
Наибольший интерес вызывают сигналы, наблюдающиеся при частоте ν = ±47.5 и ±95 МГц. Из представленных выше расчетов для различных электрон-электронных переходов (7a)–(7е), а также известных величин СТВ (см. выше) следует, что данные переходы вызваны анизотропным сверхтонким взаимодействием неспаренного электрона с ядром азота, для которого величина СТВ A превосходит ларморовскую частоту ядер 14N (νлармора = 1.04 МГц для B0 ≈ 0.34 T), что приводит к локализации сигнала в областях половины (для одноквантовых переходов с ∆MI = ±1) и целой величины СТВ (для двухквантовых переходов с ∆MI = ±2).
При детальном рассмотрении спектра в области ∆ν > 0 (MI = –1) для одноквантового перехода наблюдается дополнительное расщепление (рис. 6).
Рис. 6.
Спектры ДДЯМР для одноквантовых перех-одов, представленных на рис. 5 с MI = +1 (a) и MI = –1 (б).
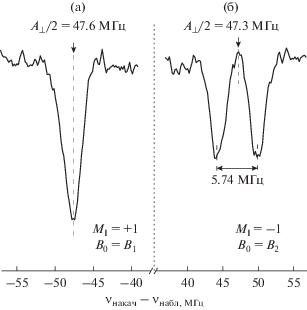
Центры линий, представленных на рис. 6, с высокой точностью совпадают по величине с A⊥/2, определенной из спектра ЭПР. Используя выражения для одноквантовых переходов (7a), (7б), (7г), (7д), приходим к выводу, что наблюдаемое расщепление возникает из-за наличия квадрупольного момента у ядер 14N. Если предположить, что тензоры A и P в (6) являются коллинеарными, то величина (и знак) квадрупольного расщепления рассчитывается достаточно легко. Используя выражение (8б) мы получаем, что P⊥ = 1.2 МГц. Величина ларморовской частоты азота при B0 ≈ 0.34 T соизмерима с квадрупольным расщеплением. Поэтому для линии СТС с MI = +1 из-за взаимной компенсации дополнительные расщепления отсутствуют.
Одним из доказательств того факта, что расщепление линии для одноквантового перехода действительно вызвано квадрупольным взаимодействием, является наличие у P угловой зависимости вида
(10)
$P\left( {\theta } \right){\text{\;}} = {\text{\;}}P\left( {3{\text{co}}{{{\text{s}}}^{2}}{\theta \;}--{\text{\;}}1} \right).$Анизотропный спектр ЭПР и достаточно узкий спектр возбуждения позволяют провести измерение “угловой зависимости” квадрупольного расщепления. В соответствии с ориентационной зависимостью константы СТВ A, величина расщепления, как видно из рис. 7, заметно изменяется (табл. 1), подтверждая высказанное предположение.
Рис. 7.
Спектры ДДЯМР для одноквантовых переходов при изменении B0 от начальных значений B1 для MI = +1 (a) и B2 для MI = –1 (б), соответствующих строго перпендикулярной ориентации (A⊥), в направлении параллельной ориентации (A||).
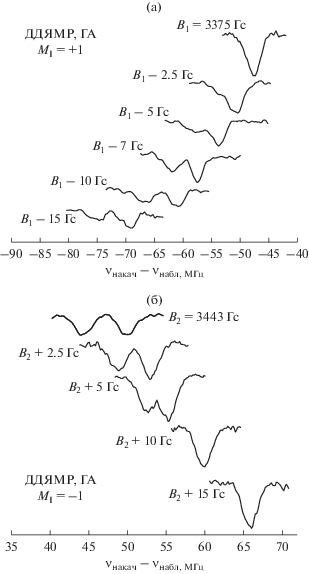
Таблица 1.
Величины расщепления в спектрах одноквантовых переходов ДДЯМР в зависимости от B0
| Величина фиксированного магнитного поля относительно B0 | Величина расщепления одноквантового перехода |νsq2 – νsq1| , МГц |
|
|---|---|---|
| B1 – ∆B; ∆ν < 0 (MI = +1) | B2 + ∆B; ∆ν > 0 (MI = –1) | |
| B0 = B1, 2 | 0 | 5.7 |
| B0 = B1, 2 ± 2.5 Гс | ~0.5 | 4.1 |
| B0 = B1, 2 ± 5 Гс | 3.83 | 2.5 |
| B0 = B1, 2 ± 10 Гс | 5.53 | 0 |
| B0 = B1, 2 ± 15 Гс | 5.58 | 0 |
Вероятно, анизотропия A и P являются причиной уширения спектра ДДЯМР для центрального перехода СТС с MI = 0, где присутствуют сигналы от всех ориентаций нанокристаллов ГА, что делает его малоинформативным. Детальная расчетная модель и интерпретация угловой зависимости P требует дальнейших исследований, поскольку данные из табл. 1 позволяют допустить, что тензоры A и P, как в случае петропорфиринов [50], неколлинеарны.
Таким образом, из исследования радиационно-наведенных примесных азотных центров ${\text{NO}}_{3}^{{2 - }}$ в порошках синтетического ГА методами импульсного ЭПР и ДДЯМР определены параметры сверхтонкого и впервые квадрупольного взаимодействия электрона с ядрами 14N: A|| = = 187 МГц, A⊥ = 95 МГц, P = 1.2 МГц. Возможность наблюдения разрешенных спектров ДДЯМР обусловлена хорошей локализацией азотного центра (в позиции фосфата, см. [38]), отсутствием разброса по g, A и градиенту электрического поля. Длинное время фазовой когерентности T2 ≈ 3 мкс позволяет увеличить длительность импульсов для возбуждения спиновых пакетов в более узком частотном диапазоне. Благодаря анизотропии А-тензора ориентационно-селективные измерения были проведены в X‑диапазоне. Указанные факторы способствуют наблюдению спектров ДДЯМР в точно определенной (выбранной) ориентации с крайне малым угловым разбросом при T = 297 K. Полученные данные необходимы для полного понимания особенностей электронной структуры спинового зонда и будут использованы для изучения влияния локальных нарушений структуры исходной матрицы при допировании ГА различными катионами.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Habraken W., Habibovic P., Epple M. et al. // Mater. Today. 2016. V. 19. № 2. P. 69.
Insley G., Suzuki O. Octacalcium Phosphate Biomaterials: Understanding of Bioactive Properties and Application. Cambridge: Woodhead Publishing, 2019. P. 374.
Сафронова Т.В., Путляев В.И. // Наносистемы: физика, химия, математика. 2013. Т. 4. № 1. С. 24.
Bazin D., Daudon M. // J. Spectr. Imaging. 2019. V. 8. P. a16.
Гилинская Л., Григорьева Т., Окунева Г. и др. // Журн. структур. химии. 2003. Т. 44. № 4. С. 678 (Gilinskaya L.G., Grigorieva T.N., Okuneva G.N. et al. // J. Struct. Chem. 2003. V. 44. № 4. С. 622).
Гилинская Л., Григорьева Т., Окунева Г. и др. // Журн. cтруктур. химии. 2003. Т. 44. № 5. С. 882 (Gilinskaya L.G., Okuneva G.N., Vlasov Y.A. // J. Struct. Chem. 2003. V. 44. № 5. Р. 813).
Гилинская Л., Григорьева Т., Окунева Г. и др. // Журн. cтруктур. химии. 2003. Т. 44. № 6. С. 1122 (Gilinskaya L.G., Rudina N.A., Okuneva G.N. et al. // J. Struct. Chem. 2003. V. 44. № 6. P. 1038).
Голованова О.А., Кутузова Ю.А. // Вест. Омского ун-та. 2016. Т. 1. № 79. С. 56.
Gabbasov B., Gafurov M., Starshova A. et al. // J. Magn. Magn. Mater. 2019. V. 470. P. 109.
Hui J., Wang X. // Inorg. Chem. Front. 2014. V. 1. № 3. P. 215.
Баринов С.М. // Успехи химии. 2010. Т. 79. № 1. С. 15 (Barinov S.M. // Russ. Chem. Rev. 2010. V. 79. № 1. С. 13).
Islam M., Mishra P.C., Patel R. // J. Environ. Manage. 2010. V. 91. № 9. P. 1883.
Rivera-Muñoz E.M. // Biomedical Engineering – Frontiers and Challenges / Ed. Fazel R. Rijeka: InTech, 2011. P. 75.
Chu S.H., Feng D.F., Ma Y.B. et al. // Int. J. Nanomed. 2012. V. 7. P. 3659.
Iafisco M., Delgado-Lopez J. M., Varoni E.M. et al. // Small. 2013. V. 9. № 22. P. 3834.
Fattibene P., Callens F. // Appl. Radiat. Isot. 2010. V. 68. № 1. P. 2033.
Shurtakova D., Yavkin B., Gafurov M. et al. // Magn. Reson. Solids. 2019. V. 21. № 1. Art. № 19105.
Абдульянов В.А., Галиуллина Л.Ф., Галявич А.С. и др. // Письма в ЖЭТФ. 2008. Т. 88. № 1. С. 75 (Abdul’yanov V.A., Galiullina L.F., Galyavich A.S. et al. // JETP Lett. 2008. V. 88. № 1. P. 69).
Chelyshev Y., Gafurov M., Ignatyev I. et al. // Biomed. Res. Int. 2016. V. 2016. № 3706280. P. 1.
Biktagirov T., Gafurov M., Mamin G. et al. // J. Phys. Chem. A. 2014. V. 118. № 8. P. 1519.
Лысак В.В. Микробиология. Учебное пособие. Минск: БГУ, 2007. С. 430.
Бучаченко А.Л., Вассерман А.М. Стабильные радикалы. Электронное строение, реакционная способность и применение. М: Химия, 1973. С. 408.
Usachev K.S., Klochkova E.A., Golubev A.A. et al. // SN Appl. Sci. 2019. V. 1. № 5. P. 442.
Qin P.Z., Warncke K. // Methods in Enzymology. Netherlands: Elsevier, 2015. V. 563. P. 702.
Qin P.Z., Warncke K. // Methods in Enzymology. Netherlands: Elsevier, 2015 V. 564. Pt. B. P. 634.
Schiemann O., Prisner T.F. // Q. Rev. Biophys. 2007. V. 40. № 1. P. 1.
Дзюба С.А. // Успехи химии. 2007. Т. 76. № 8. С. 752 (Dzuba S.A. // Russ. Chem. Rev. 2007. V. 76. № 8. P. 699).
Panesar N. // Nat. Rev. Drug Discov. 2008. V. 7. № 8. P. 710.
Khambata R.S., Ghosh S.M., Rathod K.S. et al. // Proc. Natl. Acad. Sci. USA. 2017. V. 114. № 4. P. E550.
Wayne R.P., Barnes I., Biggs P. et al. // Atmos. Environ. Pt A. General Topics. 1991. V. 25. № 1. P. 1.
Stanton J.F. // J. Chem. Phys. 2007. V. 126. № 13. P. 134309.
Denysenkov V., Prandolini M.J., Gafurov M. et al. // Phys. Chem. Chem. Phys. 2010. V. 12. № 22. P. 5786.
Gizatullin B., Gafurov M., Vakhin A. et al. // Energy Fuels. 2019. V. 33. № 11. P. 10923.
Осипов В.Ю., Шамес А.И., Ефимов Н.Н. и др. // ФТТ. 2018. Т. 60. № 4. С. 719 (Osipov V.Y., Shames A.I., Efimov N.N. et al. // Phys. Solid State. 2018. V. 60. № 4. P. 723).
Осипов В.Ю., Шахов А.И., Ефимов Ф.М. и др. // ФТТ. 2017. Т. 59. № 6. С. 1125 (Osipov V.Y., Shakhov F.M., Efimov N.N. et al. // Phys. Solid State. 2017. V. 59. № 6. P. 1146).
Gafurov M., Biktagirov T., Mamin G. et al. // Phys. Chem. Chem. Phys. 2015. V. 17. № 31. P. 20331.
Rau J.V., Fadeeva I.V., Fomin A.S. et al. // ACS Biomater. Sci. Eng. 2019. V. 5. № 12. P. 6632.
Yavkin B.V., Mamin G.V., Orlinskii S.B. et al. // Phys. Chem. Chem. Phys. 2012. V. 14. № 7. P. 2246.
Goldberg M., Gafurov M., Makshakova O. et al. // J. Phys. Chem. B. 2019. V. 123. № 43. P. 9143.
Gafurov M., Biktagirov T., Mamin G. et al. // Appl. Magn. Reson. 2014. V. 45. № 11. P. 1189.
Cox N., Nalepa A., Lubitz W. et al. // J. Magn. Reson. 2017. V. 280. P. 63.
Aliabadi A., Zaripov R., Salikhov K. et al. // J. Phys. Chem. B. 2015. V. 119. № 43. P. 13762.
Кулик Л.В. Дис. докт. физ.-мат. наук. Новосибирск: Ин-т хим. кинетики и горения СО РАН, 2011. 262 с.
Schweiger A., Jeschke G. Principles of Pulse Electron Paramagnetic Resonance. Oxford: Oxford Univ. Press, 2001. P. 478.
Stoll S., Schweiger A. // J. Magn. Reson. 2006. V. 178. № 1. P. 42.
Goldfarb D. // Emagres. 2007. V. 6. № 1. P. 101.
Wili N., Richert S., Limburg B. et al. // Phys. Chem. Chem. Phys. 2019. V. 21. № 22. P. 11676.
Florent M., Kaminker I., Nagarajan V. et al. // J. Magn. Reson. 2011. V. 210. № 2. P. 192.
Jeschke G., Spiess H.W. // Chem. Phys. Lett. 1998. V. 293. № 1−2. P. 9.
Gracheva I.N., Gafurov M.R., Mamin G.V. et al. // Magn. Reson. Solids. 2016. V. 18. № 1. Art. № 16102.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия