Координационная химия, 2020, T. 46, № 12, стр. 758-769
Синтез, структура и свойства координационных соединений меди(II) с основаниями шиффа на основе ароматических карбонильных соединений и гидразидов карбоновых кислот
О. Данилеску 1, И. Булхак 1, С. Шова 2, Г. Новицкий 3, П. Боурош 4, *
1 Институт химии
Кишинев, Республика Молдова
2 Институт макромолекулярной химии им. П. Пони
Яссы, Румыния
3 Национальный центр научных исследований Франции
Гренобль, Франция
4 Институт прикладной физики
Кишинев, Республика Молдова
* E-mail: bourosh.xray@phys.asm.md
Поступила в редакцию 02.01.2020
После доработки 28.02.2020
Принята к публикации 25.03.2020
Аннотация
Представлены результаты синтеза, спектральных (ИК) и структурных исследований методом РСА пяти биядерных и одного тетраядерного комплексов меди(II): [Cu2(H2L1)2](SO4)2 ∙ 4H2O (I), [Cu2(L1)2] · · 2MeOH · 0.5EtOH (II), [Cu2(L1)2] · 1.2EtOH · 5.4H2O (III); [Cu2(L2)2] · H2O (IV), [Cu2(L2)2] · 0.1H2O (V) и [Cu4(HL2)4(OH)2](NO3)2 ∙ 6.75H2O (VI), где H2L1 – 2,6-диацетилпиридин бис(изоникотиноилгидразон), H2L2 – 2,6-диацетилпиридин бис(никотиноилгидразон) (СIF files CCDC № 1967853 (I), 1967858 (II), 1967854 (III), 1967855 (IV), 1967856 (V) и 1967857 (VI)). В биядерных комплексах I–V со структурой двойной спирали оба лиганда координированы хелатно-мостиковым способом (3 + 3) к различным атомам металла; координационный полиэдр центральных атомов – искаженная тетрагональная бипирамида – образован донорными атомами N4O2. В тетраядерном комплексном катионе VI четыре атома меди объединены четырьмя тетрадентатными монодепротонированными лигандами (HL2)– и двумя мостиковыми ОН– группами. Каждый атом металла в VI имеет при этом тетрагонально-пирамидальную координацию, в которой органический лиганд координирован тридентатно к одному атому металла и монодентатно, вовлекая концевой гетероатом азота – к другому (3 + 1).
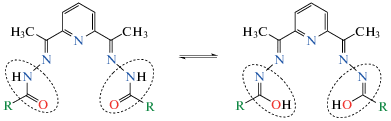
Производные 2,6-диацетилпиридина представляют интерес благодаря разнообразной и ярко выраженной биологической активности [1, 2], а также высокой комплексообразующей способности [3–7]. В частности, 2,6-диацетилпиридин бис(изоникотиноилгидразон) (H2L1) и 2,6-диацетилпиридин бис(никотиноилгидразон) (H2L2) имеют по девять донорных атомов, способных участвовать в образовании координационных связей с металлами, семь из которых – атомы азота, а два – атомы кислорода, при этом эти лиганды в соединениях могут находиться в различных таутомерных формах и разных степенях депротонирования (схема 1 ).
Схема 1 .
В ранее опубликованных нами работах представлен синтез и структурные исследования комплексов Co(II), V(II), V(IV) и Fe(III) с продуктами конденсации 2,6-диацетилпиридина с гидразидами изо- и никотиновых кислот [8–10]. В настоящей работе представлены результаты синтеза, спектральных (ИК) и структурных исследований методом РСА шести новых комплексов Cu(II), пяти биядерных и одного тетраядерного: [Cu2(H2L1)2](SO4)2 ∙ 4H2O (I), [Cu2(L1)2] · 2MeOH · · 0.5EtOH (II), [Cu2(L1)2] · 1.2EtOH · 5.4H2O (III); [Cu2(L2)2] · H2O (IV), [Cu2(L2)2] · 0.1H2O (V) и [Cu4(HL2)4(OH)2](NO3)2 ∙ 6.75H2O (VI), где H2L1 – 2,6-диацетилпиридин бис(изоникотиноилгидразон) и H2L2 – 2,6-диацетилпиридин бис(никотиноилгидразон). Соединения I и VI – ионные, так как органические лиганды координированы к металлу в нейтральной и монодепротонированной форме соответственно, остальные – молекулярные комплексные соединения, в которых органические лиганды – дважды депротонированы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза использовали коммерческие реактивы и растворители “x. ч.” без дополнительной очистки. H2L1 и H2L2 получали по методике [11, 12].
Синтез [Cu2(H2L1)2](SO4)2 ∙ 4H2O (I). В 20 мл смеси этанол–вода (1 : 1.22 по объему) растворяли 0.25 г (1.00 ммоль) CuSO4 ∙ 5H2O (раствор 1). В 10 мл метанола растворяли 0.16 г (1.00 ммоль) 2,6-диацетилпиридина (раствор 2), а в 12 мл метанола – 0.28 г (2 ммоля) гидразида изоникотиновой кислоты (раствор 3). При постоянном перемешивании к раствору 1 одновременно прибавляли растворы 2 и 3. Реакционную массу зелено-коричневого цвета нагревали с обратным холодильником в течении 4 ч при 60°С, после чего раствор отфильтровывали и оставляли на воздухе при комнатной температуре для кристаллизации. Через сутки образовывались кристаллы темно-коричневого цвета I, пригодные для РСА. Кристаллы растворимы в воде, метаноле, этаноле, ДМФА и нерастворимы в диэтиловом эфире. Выход 21.6% (по пентагидрату сульфата меди(II)).
| Найдено, %: | C 42.11; | H 3.73; | N 16.30; | Cu 10.75. |
| Для C42H46N14O16S2Cu2 | ||||
| вычислено, %: | C 42.24; | H 3.88; | N 16.42; | Cu 10.64. |
ИК (ν, cм–1): 3400 сл, 3228 сл, 2548 сл, 1657 сл, 1636 сл, 1593 сл, 1538 ср, 1486 с, 1461 сл, 1416 сл, 1360 с, 1298 сл, 1222 сл, 1150 с, 1096 ср, 1037 о. с, 972 сл, 929 сл, 901 сл, 843 ср, 812 ср, 753 ср, 711 сл, 686 ср, 646 сл, 608 с, 552 сл, 519 сл, 493 сл, 452 сл, 426 сл.
Синтез [Cu2(L1)2] · 2MeOH · 0.5EtOH (II) и [Cu2(L1)2] · 1.2EtOH · 5.4H2O (III). В смеси диметилформамид–метанол–этанол (1 : 1.5 : 1.5 по объему) (8 мл) суспендировали 0.05 г (0.2 ммоля) CuSO4 · 5H2O и 0.08 г (0.2 ммоля) H2L1. Синтез проводили в автоклавах с тефлоновым вкладышем (10 мл) при повышенном давлении. Реакционную смесь нагревали до 80°C и выдерживали 48 ч. Коричневый осадок отфильтровывали, промывали небольшим количеством смеси диметилформамид–метанол–этанол, а маточный раствор оставляли для кристаллизации на воздухе. Через сутки образовывались кристаллы темно-коричневого цвета, пригодные для РСА. Кристаллы нерастворимы в метаноле, этаноле, ДМФА и в диэтиловом эфире.
ИК (ν, cм–1): 3414 сл, 3065 сл, 2930 сл, 1657 ср, 1602 сл, 1566 сл, 1486 о. с, 1457 ср, 1412 сл, 1370 о. с, 1360 о. с, 1314 ср, 1296 сл, 1260 сл, 1224 сл, 1160 ср, 1134 сл, 1097 сл, 1056 с, 1012 ср, 930 сл, 914 сл, 851 ср, 838 сл, 817 ср, 759 ср, 670 с, 668 сл, 530 сл, 583 сл, 491 сл, 437 сл, 406 сл.
Синтез [Cu2(L2)2] · H2O (IV) и [Cu2(L2)2] · 0.1H2O (V). В смеси диметилформамид–метанол–этанол (1 : 1.5 : 1.5 по объему) (8 мл) суспендировали 0.05 г (0.2 ммоля) CuSO4 · 5H2O и 0.08 г (0.2 ммоля) H2L2. Синтез проводили в автоклавах с тефлоновым вкладышем (10 мл) при повышенном давлении. Реакционную смесь нагревали до 80°C и выдерживали 48 ч. Коричневый осадок отфильтровывали, промывали небольшим количеством смеси диметилформамид–метанол–этанол, фильтрат оставляли для кристаллизации на воздухе, в котором через сутки образовывались кристаллы темно-коричневого цвета, пригодные для РСА. Кристаллы нерастворимы в метаноле, этаноле, ДМФА и в диэтиловом эфире.
ИК (ν, cм–1): 3382 сл, 3075 сл, 2336 сл, 2053 сл, 1655 ср, 1580 ср, 1558 сл, 1495 с, 1460 ср, 1409 сл, 1369 о.с, 1316 ср, 1260 сл, 1193 сл, 1162 ср, 1094 ср, 1052 ср, 1031 ср, 927 сл, 910 сл, 814 ср, 737 ср, 715 сл, 699 ср, 672 сл, 638 ср, 618 ср, 603 ср, 501 сл, 486 сл, 459 сл, 430 сл, 405 сл.
Синтез [Cu4(HL2)4(OH)2](NO3)2 ∙ 6.75H2O (VI). В 20 мл смеси этанол–вода (1 : 1.25 по объему) растворяли 0.06 г (0.25 ммоля) Cu(NO3)2 ∙ 3H2O (раствор 1). В 4 мл метанола растворяли 0.04 г (0.25 ммоля) 2,6-диацетилпиридина (раствор 2), а в 10 мл метанола – 0.07 г (0.5 ммоля) гидразида никотиновой кислоты (раствор 3). При постоянном перемешивании к раствору 1 одновременно прибавляли растворы 2 и 3. Смесь кипятили с обратным холодильником при непрерывном перемешивании в течении 4 ч, после чего раствор отфильтровывали и оставляли на воздухе при комнатной температуре для кристаллизации. После 4 сут из раствора выпадали кристаллы темно-коричневого цвета, пригодные для РСА. Кристаллы растворимы в воде, метаноле, этаноле, ДМФА и нерастворимы в диэтиловом эфире. Выход 4% (по тригидрату нитрата меди(II)).
| Найдено, %: | C 47.20; | H 4.16; | N 19.20; | Cu 11.75. |
| Для C84H87.50N30O22.75Cu4 | ||||
| вычислено, %: | C 47.15; | H 4.14; | N 19.64; | Cu 11.88. |
ИК (ν, cм–1): 3380 сл, 3248 сл, 1751 сл, 1667 ср, 1629 сл, 1610 сл, 1596 сл, 1560 сл, 1534 ср, 1507 ср, 1474 сл, 1369 о. с, 1323 о. с, 1297 о. с, 1260 ср, 1201 сл, 1164 ср, 1147 ср, 1130 ср, 1164 ср, 1032 сл, 1007 сл, 992 сл, 925 сл, 909 сл, 822 ср, 748 сл, 732 ср, 699 ср, 677 сл, 620 сл, 573 сл, 540 сл, 509 сл, 482 сл, 469 сл, 452 сл, 440 сл, 407 сл.
РСА. Экспериментальные данные для I–VI получены при комнатной температуре на дифрактометре Xcalibur E (графитовый монохроматор, Mo-Kα излучение). Определение параметров элементарной ячейки и обработка экспериментальных данных выполнены с использованием программы CrysAlis Oxford Diffraction Ltd. [13]. Структура соединений определена прямыми методами и уточнена методом наименьших квадратов в анизотропном полноматричном варианте для неводородных атомов по программе SHELX-97 [14]. Позиции атомов водорода молекул воды получены из разностных синтезов Фурье, а остальных – рассчитаны геометрически и все уточнены изотропно в модели “жесткого тела” c Uэфф = 1.2 Uэкв или 1.5 Uэкв соответствующих атомов O, N и C. Соединение IV не удалось получить в виде монокристаллов; экспериментальные данные получены с двойника, который не удалось разделить, поэтому R фактор не удалось снизить. Кристаллографические данные и характеристики эксперимента структур I–VI приведены в табл. 1, некоторые межатомные расстояния и валентные углы соединений – в табл. 2, геометрические параметры внутри- и межмолекулярных водородных связей (МВС) – в табл. 3.
Таблица 1.
Кристаллографические данные, характеристики эксперимента и параметры уточнения структуры I–VI
| Параметр | Значение | |||||
|---|---|---|---|---|---|---|
| I | II | III | IV | V | VI | |
| Брутто-формула | C42H46N14O16S2Cu2 | C45H45N14O6.5Cu2 | C44.4H50.3N14O10.6Cu2 | C42H36N14O5Cu2 | C42H34.2N14O4.1Cu2 | C84H87.5N30O22.75Cu4 |
| M | 1194.13 | 1013.03 | 1076.77 | 943.93 | 927.72 | 2135.50 |
| T | 293 | 293 | 293 | 293 | 293 | 293 |
| Сингония | Орторомбическая | Моноклинная | Орторомбическая | Моноклинная | Триклинная | Моноклинная |
| Пр. гр. | Ccca | C2/c | Pban | C2/c | P1 | C2/c |
| a, Å | 15.8155(15) | 24.4341(12) | 15.4326(12) | 22.500(5) | 14.0736(8) | 30.8824(16) |
| b, Å | 27.0863(16) | 14.3518(5) | 14.1841(9) | 16.017(5) | 14.7059(10) | 17.1598(7) |
| c, Å | 13.4684(9) | 15.4733(7) | 13.9323(8) | 15.519(5) | 22.6625(11) | 22.3395(10) |
| α, град | 90 | 90 | 90 | 90 | 108.326(5) | 90 |
| β, град | 90 | 114.108(4) | 90 | 133.53(2) | 90.609(4) | 116.861(6) |
| γ, град | 90 | 90 | 90 | 90 | 110.675(6) | 90 |
| V, Å3 | 5769.6(8) | 4952.8(4) | 3049.7 | 4055(2) | 4126.5(5) | 10561.1(8) |
| Z | 4 | 4 | 2 | 4 | 2 | 4 |
| ρ(выч.), г/см3 | 1.375 | 1.359 | 1.173 | 1.546 | 1.493 | 1.343 |
| μ, мм–1 | 0.883 | 0.920 | 0.756 | 1.115 | 1.093 | 0.874 |
| F(000) | 2456 | 2092 | 1115 | 1936 | 1900 | 4398 |
| Размеры кристалла, мм | 0.15 × 0.12 × 0.06 | 0.42 × 0.32 × 0.06 | 0.50 × 0.20 × 0.08 | 0.44 × 0.22 × 0.1 | 0.4 × 0.1 × 0.04 | 0.2 × 0.15 × 0.05 |
| Область θ, град | 2.983–25.042 | 3.003–25.050 | 3.22–24.99 | 3.09–24.99 | 2.87–25.05 | 3.02–25.05 |
| Интервалы индексов отражений | –11 ≤ h ≤ 18, –17 ≤ k ≤ 32, –8 ≤ l ≤ 16 |
–18 ≤ h ≤ 29, –15 ≤ k ≤ 17, –18 ≤ l ≤ 13 |
–8 ≤ h ≤ 18, –16 ≤ k ≤ 11, –16 ≤ l ≤ 11 |
–26 ≤ h ≤ 26, –13 ≤ k ≤ 19, –18 ≤ l ≤ 18 |
–16 ≤ h ≤ 16, –16 ≤ k ≤ 17, –26 ≤ l ≤ 18 |
–27 ≤ h ≤ 36, –20 ≤ k ≤ 17, –26 ≤ l ≤ 17 |
| Число измеренных / независимых рефлексов | 5201/2340 (Rint = 0.0685) |
8293/4361 (Rint = 0.0271) |
6584/2689 (Rint = 0.0334) |
10 601/3566 (Rint = 0.1346) |
22 450/14 562 (Rint = 0.0423) |
18 589/9320 (Rint = 0.0465) |
| Заполнение, % | 91.3 | 99.4 | 99.4 | 99.6 | 99.5 | 99.6 |
| Число рефлексов с I > 2σ(I) | 1040 | 3110 | 1824 | 1620 | 8026 | 4030 |
| Число уточняемых парметров | 200 | 312 | 190 | 291 | 1121 | 671 |
| GOOF | 1.001 | 1.001 | 1.007 | 1.000 | 1.002 | 1.005 |
| R факторы (I > 2σ(I)) |
R1 = 0.0840, wR2 = 0.1753 |
R1 = 0.0533, wR2 = 0.1529 |
R1 = 0.0722, wR2 = 0.2508 |
R1 = 0.1516, wR2 = 0.3563 |
R1 = 0.0664, wR2 = 0.1063 |
R1 = 0.0758, wR2 = 0.2065 |
| R факторы (по всему массиву) | R1 = 0.1861, wR2 = 0.2000 |
R1 = 0.0807, wR2 = 0.1697 |
R1 = 0.1027, wR2 = 0.2748 |
R1 = 0.2514, wR2 = 0.4295 |
R1 = 0.1372, wR2 = 0.1261 |
R1 = 0.1475, wR2 = 0.2235 |
| Δρmax/ρmin, e Å–3 | 0.442, –0.314 | 0.653, –0.336 | 0.636, –0.465 | 3.153, –1.715 | 0.948, –0.706 | 1.066, –0.382 |
Таблица 2.
Межатомные расстояния и валентные углы в координационных полиэдрах структуры I–VI
| Связь | d, Å | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| I | II | III | IV | V | VI | |||||
| Cu(1) | Cu(2) | Cu(3) | Cu(4) | Cu(1) | Cu(2) | |||||
| Cu(1)–O(1) | 2.034(4) | 1.996(3) | 2.037(3) | 2.006(9) | 2.144(3) | 2.133(3) | 2.000(4) | 1.996(3) | ||
| Cu(1)–N(3) | 1.929(6) | 1.923(3) | 1.934(4) | 1.940(10) | 1.962(4) | 1.962(4) | 1.922(4) | 1.916(4) | ||
| Cu(1)–N(4) | 2.501(5) | 2.350(3) | 2.452(4) | 2.213(9) | 2.687(4) | 2.709(4) | 2.275(4) | 2.328(5) | 2.068(6) | 2.071(7) |
| Cu(1)–O(2)*/O(2) | 2.079(3) | 2.109(9) | 1.979(3) | 1.985(4) | 2.138(3) | 2.060(3) | 1.967(5) | 1.987 (6) | ||
| Cu(1)–N(4)*/N(4) | 2.576(3) | 2.630(9) | 2.179(4) | 2.233(4) | 2.642(4) | 2.702(4) | ||||
| Cu(1)–N(5)*/N(5) | 1.936(3) | 1.994(9) | 1.920(4) | 1.923(4) | 1.956(4) | 1.959(4) | 1.921(6) | 1.915(6) | ||
| Cu(1)–N(1)* | 1.991(6) | 1.978(6) | ||||||||
| Cu(1)–O(1)OH | 2.309(5) | 2.304(5) | ||||||||
| Угол | ω | |||||||||
| I | II | III | IV | V | VI | |||||
| Cu(1) | Cu(2) | Cu(3) | Cu(4) | Cu(1) | Cu(2) | |||||
| O(1)Cu(1)O(1)*/O(2)* | 118.1(3) | 117.04(12) | 117.7(2) | 109.9(4) | 108.59(15) | 115.05(15) | 113.02(14) | 120.33(15) | ||
| O(1)Cu(1)N(3) | 79.6(2) | 79.86(12) | 79.63(15) | 80.2(4) | 77.79(15) | 77.64(15) | 77.91(15) | 79.02(16) | ||
| O(1)Cu(1)N(3)*/N(5)* | 104.4(2) | 101.57(11) | 104.86(15) | 97.2(4) | 113.37(15) | 112.20(15) | 98.37(16) | 97.93(16) | ||
| O(1)Cu(1)N(4) | 150.29(13) | 152.87(10) | 151.76(10) | 157.1(4) | 148.87(12) | 147.81(12) | 154.55(14) | 150.96(14) | ||
| O(1)Cu(1)N(4)* | 78.29(16) | 78.13(11) | 79.33(13) | 78.5(3) | 88.10(15) | 84.67(14) | 76.87(14) | 74.68(13) | ||
| N(3)Cu(1)N(3)*/N(5)* | 172.5(4) | 170.90(12) | 171.5(2) | 169.8(4) | 168.70(18) | 170.12(17) | 170.10(18) | 170.19(17) | ||
| N(3)Cu(1)N(4) | 72.08(18) | 75.13(11) | 73.99(12) | 78.8(4) | 71.16(15) | 71.03(15) | 76.51(17) | 74.89(17) | ||
| N(3)Cu(1)N(4)* | 102.88(18) | 99.21(11) | 100.14(12) | 97.2(3) | 104.77(17) | 103.78(16) | 98.72(15) | 99.72(15) | ||
| N(3)Cu(1)O(2)* | 108.40(12) | 111.5(4) | 95.21(16) | 97.11(15) | 111.85(15) | 110.34(17) | ||||
| N(4)Cu(1)N(4)* | 99.3(2) | 95.53(10) | 95.40(18) | 95.2(3) | 94.51(14) | 95.56(14) | 98.08(14) | 95.11(13) | ||
| N(4)Cu(1)N(5)*/N(5) | 101.53(11) | 101.9(4) | 97.74(15) | 99.10(15) | 103.63(16) | 104.20(16) | 81.3(2) | 79.7(3) | ||
| N(4)Cu(1)O(2)*/O(2) | 81.29(11) | 86.4(4) | 76.98(14) | 76.76(14) | 84.30(14) | 82.67(15) | 159.6(2) | 160.2(2) | ||
| O(2)*Cu(1)N(4)* | 150.20(10) | 150.9(3) | 156.41(14) | 154.09(14) | 148.93(12) | 147.98(14) | ||||
| O(2)*/O(2)Cu(1)N(5)*/N(5) | 79.10(11) | 78.6(4) | 79.83(17) | 79.68(17) | 79.62(17) | 80.08(17) | 78.5(2) | 80.7(3) | ||
| N(4)*Cu(1)N(5)* | 72.49(11) | 72.6(3) | 78.21(18) | 77.14(18) | 71.40(15) | 70.54(14) | ||||
| N(1)*Cu(1)O(2) | 92.8(2) | 93.1(2) | ||||||||
| N(1)*Cu(1)N(4) | 105.4(2) | 104.1(3) | ||||||||
| N(1)*Cu(1)N(5) | 159.5(2) | 159.4(3) | ||||||||
| N(1)*Cu(1)O(1)OH | 100.1(2) | 101.2(2) | ||||||||
| O(1)OHCu(1)O(2) | 91.56(18) | 87.37(19) | ||||||||
| O(1)OHCu(1)N(4) | 94.21(19) | 98.7(2) | ||||||||
| O(1)OHCu(1)N(5) | 98.7(2) | 98.2(2) | ||||||||
Таблица 3.
Геометрические параметры водородных связей в I–VI
| D–H∙∙∙A | Расстояние, Å | Угол DHA, град |
Симметрическое преобразование для А | ||
|---|---|---|---|---|---|
| D–H | H∙∙∙A | D···A | |||
| I | |||||
| N(1)–H(1)∙∙∙O(4) | 0.86 | 1.76 | 2.59(1) | 163 | –x + 1/2, –y + 1/2, –z + 1 |
| N(1)–H(1)∙∙∙O(2) | 0.86 | 1.88 | 2.69(1) | 157 | x, y – 1/2, –z + 1 |
| N(1)–H(1)∙∙∙O(5) | 0.86 | 2.36 | 2.99(2) | 130 | –x + 1/2, –y + 1/2, –z + 1 |
| O(1w)–H(1)∙∙∙O(3w) | 0.85 | 1.84 | 2.69(4) | 172 | x, –y + 1, z + 1/2 |
| O(1w)–H(2)∙∙∙O(2) | 0.83 | 1.93 | 2.76(3) | 175 | x, y, z |
| O(1w)–H(2)∙∙∙O(5) | 0.83 | 2.65 | 3.26(3) | 131 | x, y, z |
| O(2w)–H(1)∙∙∙O(2w) | 0.81 | 2.03 | 2.81(6) | 161 | –x + 1, y, –z + 1/2 |
| O(2w)–H(2)∙∙∙O(5) | 0.84 | 2.16 | 2.83(4) | 137 | x, y, z |
| O(2w)–H(2)∙∙∙O(2) | 0.84 | 2.23 | 3.03(3) | 158 | x, y, z |
| O(3w)–H(1)∙∙∙O(1w) | 0.84 | 1.89 | 2. 56(4) | 137 | –x + 1, y, –z + 1/2 |
| O(3w)–H(1)∙∙∙O(3w) | 0.84 | 2.28 | 2.98(5) | 142 | –x + 1, –y + 1, –z |
| O(3w)–H(2)∙∙∙O(5) | 0.74 | 2.37 | 3.02(3) | 149 | x, y, z |
| O(4w)–H(1)∙∙∙O(4w) | 0.80 | 2.56 | 3.35(6) | 175 | –x + 1, –y + 1, –z |
| O(4w)–H(2)∙∙∙O(3) | 0.93 | 1.99 | 2.69(3) | 131 | x, y, z |
| II | |||||
| O(1M)–H(1)∙∙∙N(7) | 0.82 | 2.12 | 2.934(7) | 171 | x, y, z |
| III | |||||
| O(1w)–H(1)∙∙∙N(1) | 0.88 | 2.01 | 2.884(7) | 176 | x, y, z |
| O(1w)–H(2)∙∙∙O(2w) | 0.83 | 1.93 | 2.758(9) | 175 | x, y, z |
| O(2w)–H(1)∙∙∙O(1E) | 0.88 | 2.02 | 2.67(2) | 130 | x, y, z |
| O(2w)–H(2)∙∙∙O(1E) | 0.85 | 1.90 | 2.67(3) | 149 | –x + 3/2,y, –z + 1 |
| O(1E)–H(1)∙∙∙O(1E) | 0.85 | 2.32 | 3.17(5) | 178 | –x + 3/2,y, –z + 1 |
| IV | |||||
| O(1w)–H(1)∙∙∙O(1) | 0.87 | 2.25 | 2.98(3) | 141 | –x + 2,y, –z + 1/2 |
| O(1w)–H(1)∙∙∙O(2) | 0.87 | 2.10 | 2.52(2) | 110 | x, y, z |
| V | |||||
| O(1w)–H(1)∙∙∙O(1B) | 0.90 | 2.37 | 3.27(3) | 179 | x, y + 1, z |
| O(1w)–H(2)∙∙∙N(6C) | 1.08 | 2.27 | 3.36(3) | 176 | x, y, z |
| VI | |||||
| O(1)OH–H(1)∙∙∙O(1B) | 0.73 | 2.15 | 2.710(6) | 135 | x, y, z |
| O(1)OH–H(1)∙∙∙O(1A) | 0.73 | 2.39 | 2.836(7) | 122 | x, y, z |
| N(2A)–H∙∙∙O(2) | 0.86 | 2.50 | 3.154(1) | 134 | –x + 2, y, –z + 1/2 |
| N(2B)–H∙∙∙O(3) | 0.86 | 2.37 | 3.220(1) | 173 | x, y, z |
| O(1w)–H(1)∙∙∙N(7B) | 0.86 | 2.05 | 2.911(2) | 178 | x, y, z |
| O(1w)–H(2)∙∙∙O(3) | 0.85 | 1.89 | 2.738(2) | 178 | x + 1/2, y + 1/2, z |
| O(2w)–H(1)∙∙∙O(2w) | 0.80 | 1.89 | 2.69(4) | 175 | x, y, z |
| O(2w)–H(2)∙∙∙O(2B) | 0.81 | 2.23 | 3.034(2) | 169 | x, y, z |
| O(3w)–H(1)∙∙∙N(7A) | 0.99 | 1.97 | 2.951(2) | 176 | x, y, z |
| O(4w)–H(1)∙∙∙O(1w) | 0.69 | 1.91 | 2.61(3) | 179 | x, –y + 1, z – 1/2 |
| O(4w)–H(2)·∙∙O(6w) | 0.89 | 2.06 | 2.95(4) | 172 | x, y, z |
| O(5w)–H(1)∙∙∙O(7w) | 0.85 | 2.37 | 3.07(3) | 139 | x, y, z |
| O(6w)–H(1)∙∙∙O(9w) | 0.90 | 2.19 | 2.86(3) | 130 | x, –y + 1, z – 1/2 |
| O(7w)–H(1)∙∙∙O(5w) | 0.96 | 2.08 | 2.97(3) | 154 | x, y, z |
| O(8w)–H(1)∙∙∙O(4w) | 0.85 | 1.95 | 2.80(3) | 180 | x, y, z |
Позиционные и тепловые параметры для структур I–VI депонированы в КБСД (CCDC № 1967853 (I), 1967858 (II), 1967854 (III), 1967855 (IV), 1967856 (V) и 1967857 (VI); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Наблюдаемые в ИК-спектре соединения I широкие полосы поглощения средней и слабой интенсивности в области 2500–2325 и 2200–1800 cм–1 связаны, вероятно, с миграцией протонов от N(2) и N(2)* к гетероциклическим атомам азота (N(1) и N(1)*) концевых пиридиновых колец и образованием фрагментов PyH+ [15, 16]. Смещение полосы поглощения ν(C=O) + ν(CN) в спектрах соединений I–V в длинноволновую область до 1657 и 1636 cм–1 указывает на участие карбонильной группы в координации к металлу [8] и таким образом на стабилизацию органических лигандов в кетонной форме [17]. В ИК-спектре II–V полосы поглощения средней и высокой интенсивности при 1457 и 1360 cм–1 (II и III), 1460 и 1369 cм–1 (IV и V) соответствуют деформационным колебаниям групп CH3 (δасим(CH3) и δсим(CH3) соответственно) [16]. В ИК-спектрах комплексов II и III наблюдаются полосы поглощения, которые можно отнести к внеплоскостным колебаниям δ(С–Н) ароматических колец: полосы поглощения при 759 cм–1 для трех смежных атомов водорода (1,3-тип замещения) и при 817 cм–1 – для двух смежных атомов водорода (1,4-тип замещения) [17, 18]. В ИК-спектрах комплексов IV и V внеплоскостные колебания δ(С–Н) для трех смежных атомов водорода проявляются при 737 cм–1, а для изолированного атома водорода – при 814 cм–1 [17, 18].
В ИК-спектре VI наблюдаются следующие значимые полосы поглощения: 3380 cм–1, соответствующая валентным колебаниям (ν(OH) + ν(NH)), 1667 cм–1, обусловленная валентными колебаниями карбонильной группы (ν(C=O)), 1629 cм–1 – ν(C=Nазомет.) и сильное поглощение в области 1260–1380 cм–1 – ν(${\text{NO}}_{3}^{ - }$) [16, 19], 1474 cм–1 – δaсим(CH3) и 1368 cм–1 – δсим(CH3) [16]. В ИК-спектре четырехъядерного комплексного соединения (VI) наблюдаются полосы поглощения при 732 и 822 cм–1, которые отнесены к δ(С–Н) ароматических колец для 1,3- и 1,4-типов замещения соответственно [17, 18].
В результате использования различных методов синтеза были получены как молекулярные комплексы меди(II) (II–V), так и комплексные соединения ионного типа (I и VI). В соединениях II–V к атому металла координируются бис-депротонированные органические лиганды (L1)2– или (L2)2–, в I к атому металла координируются нейтральные органические лиганды H2L1 (I), в VI – монодепротонированные (НL2)–. В ионных соединениях (I и VI) заряды комплексных катионов компенсированы внешнесферными неорганическими анионами ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ или ${\text{NO}}_{{\text{3}}}^{ - }$ соответственно.
Взаимодействием H2L1 с сульфатом меди(II) в смеси этанол–вода–метанол получено соединение I, кристаллизующееся в орторомбической пр. гр. Ccca (табл. 1). Структура ионная и состоит из двухъядерных комплексных катионов [Cu2(H2L1)2]4+ с симметрией D2 (рис. 1а), анионов ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }},$ разупорядоченных вокруг двойной оси и кристаллизационных молекул H2O в соотношении 1 : 2 : 4 соответственно. Комплексный катион имеет структуру двойной спирали (рис. 1б), в которой нейтральные органические лиганды H2L1 координируются гексадентатно хелатно-мостиковым способом к двум атомам металла, при этом мостиковым является центральный атом N(4) лиганда. Симметричный координационный полиэдр атомов металла имеет форму искаженной тетрагональной бипирамиды и образован набором донорных атомов N4O2. Межатомные расстояния Cu(1)–O(1), Cu(1)–N(3) и Cu(1)–N(4) равны 2.033(4), 1.930(6) и 2.502(7) Å соответственно (табл. 2). Расстояние Cu(1)···Cu(1)* в двухъядерном катионе равно 3.239(3) Å. Каждый нейтральный лиганд H2L1 координируется к обоим атомам металла, формируя четыре пятичленных металлоцикла двух типов (CuOCNN и CuNCCN), два из них – с одним атомом металла и два – со вторым. Подобный cпособ координирования этих лигандов ранее найден и в биядерных комплексах Cu(II) [12, 20], Co(II) [21], Ni(II) [5, 22] и Zn(II) [23] с лигандами этого класса. На основе различных стерических соображений и анализа синтезов Фурье сделан вывод о том, что атом водорода, который должен был быть локализован при атоме азота гидразинового фрагмента в H2L1, стабилизирован при атоме азота конечного гетероцикла (N(1)). Известно, что угол CNC в пиридиновых фрагментах чувствителен к протонированию [24, 25], поэтому значение валентного угла CNC при атоме азота в концевом пиридиновом цикле в I, который больше 120° (∠CNC 122.1(7)°) также подтверждает переход протона и формирование фрагмента PyH+.
Рис. 1.
Структура комплексного катиона [Cu2(H2L1)2]4+ с частичной нотацией атомов (для ясности второй лиганд нарисован тонкими линиями) (а); структура двойной спирали для комплексного катиона [Cu2(H2L1)2]4+ (б).
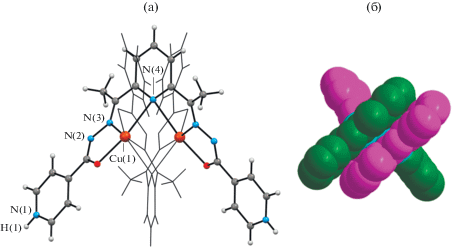
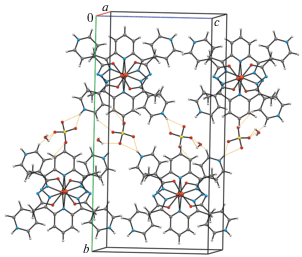
Анализ кристаллической структуры показал, что комплексные катионы и анионы ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ связаны между собой в слои, параллельные плоскости bc, как МВС N–H∙∙∙O, так и более слабыми С–H∙∙∙O (табл. 3, рис. 2), а молекулы воды с последними и между собой – МВС O(w)–H∙∙∙O, O(w)–H∙∙∙O(w) и C–H∙∙∙O(w).
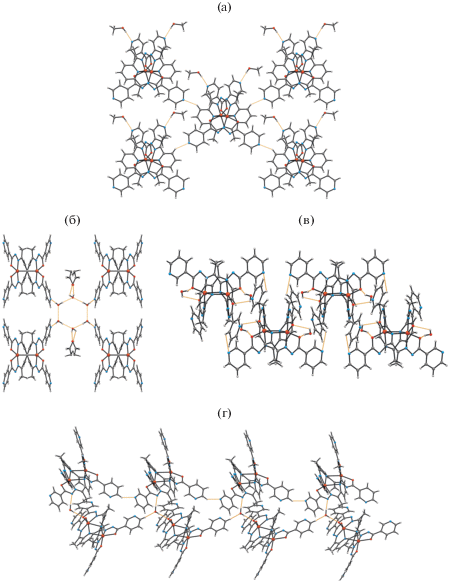
При использовании сольвотермального метода синтеза соединений при взаимодействий H2L1 или H2L2 с сульфатом меди(II) получены по два сольватоморфа состава [Cu2(L1)2] · 2MeOH · · 0.5EtOH (II), [Cu2(L1)2] · 5.4H2O · 1.2EtOH (III) и [Cu2(L2)2] · H2O (IV) и [Cu2(L2)2] · 0.1H2O (V). Соединения II–IV кристаллизуются в более симметричных пространственных группах орторомбической или моноклинной сингонии, а V – в триклинной пр. гр. P$\bar {1}$ (табл. 1). В элементарной ячейке последнего стабилизированы два крис-та-ллогрaфически независимых несимметричных комплекса. Строение молекулярных комплексов [Cu2(L1)2] и [Cu2(L2)2] в II–V подобно найденому в комплексном катионе I (рис. 3), однако, в них к атому металла органические лиганды (L1/2)2– координируются в дважды депротонированной кето-форме. Координационные полиэдры атомов металла в II–V имеют также форму искаженной тетрагональной бипирамиды и образованы донорными атомами N4O2, принадлежащими двум различным лигандам. Межатомные расстояния Cu(1)–O(1)/O(2), Cu(1)–N(3)/N(5) и Cu(1)–N(4)/N4* равны в среднем 2.106, 1.942 и 2.459 Å соответственно (табл. 2). Расстояние Cu(1)···Cu(1)* в молекулярном комплексе II равно 3.315(1), в III – 3.300(2), в IV – 3.278(3), а в V расстояние Cu(1)···Cu(2) 3.280(1) и Cu(3)···Cu(4) 3.318(1) Å.
Рис. 3.
Структура биядерных молекулярных комплексов [Cu2(L1)2] в II (a), в III (б) и [Cu2(L2)2] в IV (в), одного кристаллографически независимого комплекса в V (г) с частичной нотацией атомов.
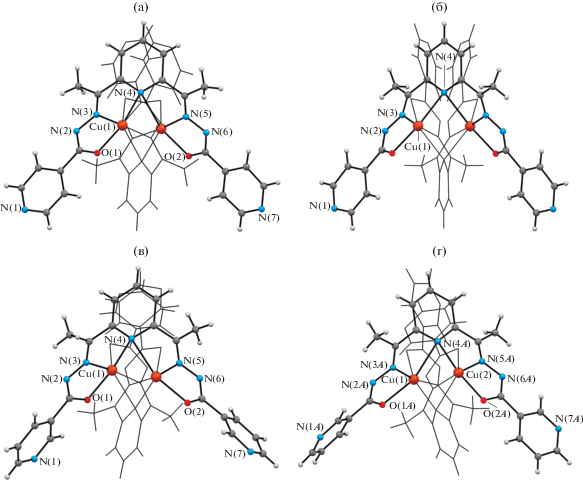
Анализ кристаллических структур показал, что в II молекулярные комплексы связаны между собой в цепочки слабыми МВС С–H∙∙∙N(1), молекулы метанола объединены с ними связями О–H∙∙∙N(7), а молекулы этанола расположены в полостях между ними (табл. 3, рис. 4а); в III можно выделить как МВС O(w)–H∙∙∙N между молекулами воды и комплексами, так и МВС, образованные между кристаллизационными молекулами воды и этанола (рис. 4б); в IV комплексы связаны с молекулами воды МВС O(w)–H∙∙∙О и слабыми С–H∙∙∙O(w) (рис. 4в); в V можно выделить слабые МВС С–H∙∙∙N(7)/N(7), С–H∙∙∙О(1)/О(2), которые объединяют молекулярные комплексы в кристалле, и слабые МВС С–H∙∙∙O(1)/N(6) и С–H∙∙∙О(1w), связывающие остатки воды с комплексами (рис. 4г).
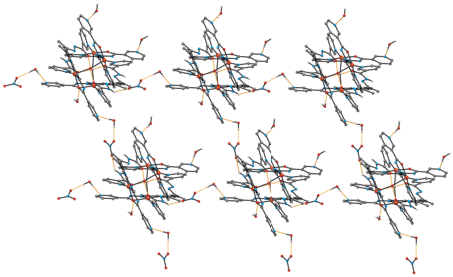
В результате синтеза из системы Cu(NO3)2 ∙ ∙ 3H2O–2,6-диацетилпиридин–гидразид никотиновой кислоты в молярном соотношении 1 : 1 : 2 соответственно, получено соединение [Cu4(HL2)4- (OH)2](NO3)2 ∙ 6.75H2O · (VI), которое кристаллизуется в моноклинной пр. гр. C2/c. При этом молекулы воды локализованы в девяти позициях с различной степенью занятости. Соединение имеет ионную структуру и состоит из четырехъядерных комплексных катионов [Cu4(HL2)4(OH)2]2+ с симметрией C2 (рис. 5а), анионов ${\text{NO}}_{{\text{3}}}^{ - }$ и кристаллизационных молекул H2O. В комплексном катионе четыре иона меди(II) связаны четырьмя монодепротонированными лигандами (HL2)–, при этом к каждому атому металла координируются два органических лиганда, один из которых – донорными атомами O(2)N(5)N(4), другой – концевым атомом N(1) пиридинового гетероцикла. Эти четыре атома расположены в основании квадратно-пирамидального полиэдра металла, а дополняет его атом О мостикового аниона ОН–. Межатомные расстояния Cu(1)–O(2), Cu(1)–N(4), Cu(1)–N(5), Cu(1)–N(1) и Cu(1)–O(1)ОН равны в среднем 1.977, 2.069, 1.918, 1.985 и 2.306 Å соответственно (табл. 2). В результате (HL2)– является тетрадентатным хелатно-мостиковым лигандом, который координируется тридентатно к одному атому металла через набор донорных атомов ONN, образуя два пятичленных металлоцикла по способу, найденному в I–V, а одним концевым атомом N гетероцикла N(1) – монодентатно к другому атому металла. В отличие от найденного в I локализованного атома Н у концевого атома N гетероцикла органического лиганда, в VI стабилизирована другая таутомерная форма последнего и оставшийся атом Н в результате депротонирования локализован у атома N азометиновой группы (N(2)). Расстояния Cu(1)···Cu(2) и Cu(1)···Cu(2)* в катионе равны 4.298(4) и 9.092(1) Å соответственно.
Рис. 5.
Структура четырехъядерного комплексного катиона [Cu4(HL2)4(OH)2]2+ с частичной нотацией атомов (а); структура четвертной спирали для четырехъядерного комплексного катиона [Cu4(HL2)4(OH)2]2+ (б).
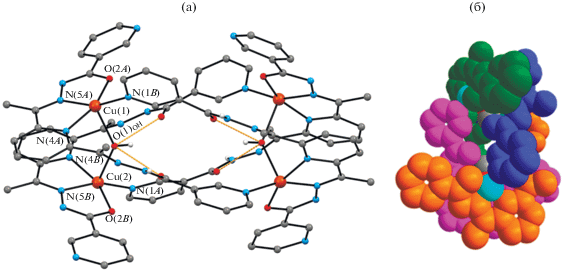
Анализ сложной системы водородных связей показал, что четырехъядерный комплексный катион стабилизирован внутримолекулярными водородными связями O(1)ОН–H∙∙∙O(1А)/O(1B) (табл. 3), а комплексные катионы и анионы ${\text{NO}}_{{\text{3}}}^{--}$ посредством молекул воды связаны между собой в слои МВС O(w)–H∙∙∙O и O(w)–H∙∙∙N (табл. 3, рис. 6) и более слабыми С–H∙∙∙O как между катионами, так и между катионами и анионами. Остальные молекулы воды объединены в основном между собой МВС O(w)–H∙∙∙O(w) и cвязаны с основным остовом структуры посредством O(w)–H∙∙∙O/N, C–H∙∙∙O(w).
В двухъядерных комплексах Cu(II) координирующие агенты H2L1 и H2L2 играют роль мостиковых лигандов, и не исключено проявление магнитного взаимодействия между атомами меди. Проявление магнитного взаимодействия, а именно антиферромагнитного, было упомянуто только в случае биядерного комплекса никеля(II) [22].
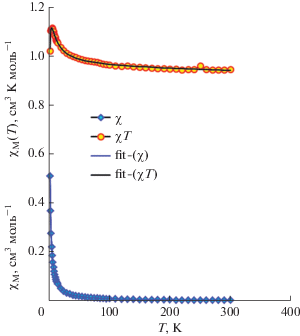
Данные измерений магнитной восприимчивости (χM) для координaционного двухъядерного соединения [Cu2(H2L1)2](SO4)2 ∙ 4H2O выполняли на поликристаллическом продукте в магнитном поле с индукцией 0.1 Т в интервале 300–2 K, а изотермы намагниченности измеряли при 2 К в диапазоне с индукцией 0–5 Т (рис. 7).
Все данные были скорректированы с учетом вклада держателя образца и констант Паскаля. Константы магнитного взаимодействия и факторы gCu были получены путем анализа зависимости χMT(T) и χM(T). Анализ проводился с учетом температурно-независимого парамагнетизма (ТНП), вклада парамагнитных примесей (ρ), а также межмолекулярных взаимодействий (zJ) по выражению:
На рис. 7 показана зависимость магнитной восприимчивости от температуры для соединения I. При 300 K произведение χMT имеет значение 0.94 см3 K моль–1, что хорошо согласуется с теоретическим значением для двух атомов Cu(II) (d9, S = 1/2) с g = 2.24. При понижении температуры χMT непрерывно увеличивается, достигая максимального значения 1.107 см3 К моль–1 при 4 К. Такое поведение указывает на существованиe ферромагнитного взаимодействия между двумя парамагнитными центрами. Резкое снижение χMT после 4 К объясняется наличием межмолекулярного взаимодействия между двухъядерными комплексами в твердом состоянии.
На основании результатов структурного исследования магнитное поведение координационного соединения I может быть смоделировано на основе изотропного гамильтониана, который описывает взаимодействие между двумя спинами, S1 = S2= 1/2
Теоретические значения магнитной восприимчивости могут быть определены следующим аналитическим решением, представленным выражением:
Наилучшее совпадение теоретических и экспериментальных значений (R = 1.57 × 10–6) было получено для следующего набора переменных параметров: J = 3.38(6) см–1, g = 2.251(2), zJ' = = ‒0.243(3) см–1 и TIP = –6.49 × 10–5 см3 К моль–1, где zJ' – вклад межмолекулярного взаимодействия, рассчитанный на основании восприимчивости [26–28]:
Вклад парамагнитных примесей принимает очень малые значения и не был учтен с целью уменьшения количества переменных параметров.
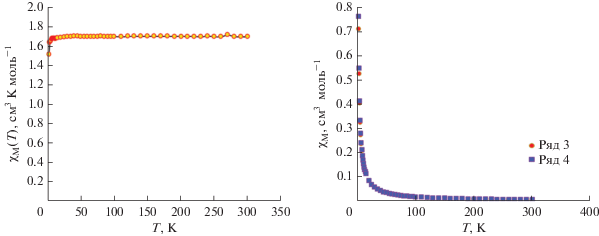
Для четырехъядерного соединения VI измерения магнитной восприимчивости при 0.1 и 1.0 Т в зависимости от температуры, а также измерения, основанные на магнитном поле, указывают на отсутствие магнитного взаимодействия (незначительное взаимодействие) между ионами меди(II) (рис. 8). После 4 К наблюдается небольшое снижение значения χMT(Т), что, вероятно, это результат присутствия межмолекулярного взаимодействия. Указанное экспериментальное значение 1.70 см3 К моль–1 при 300 К соответствует четырем ионам Cu(II) с g = 2.13. Отсутствие магнитного взаимодействия коррелирует с большими расстояниями между атомами меди(II) (Cu(1)∙∙∙Cu(2) 4.298 Å) и наличием мостика OH–, объединяющего два иона меди(II) вдоль координаты 5 координационного многогранника (тетрагональной пирамиды) на относительно большом расстоянии (рис. 8).
Согласно температурной зависимости магнитной восприимчивости (2–300 K) ионы меди(II) с S = 1/2 слабо взаимодействуют между собой (2J = = –0.05(1) см–1, g = 2.15(2)). Слабое магнитное взаимодействие для кластера Сu4 подтверждено измерениями магнитной восприимчивости в зависимости от поля (0–5 Т), которое объясняется более длинными связями между ионами меди Cu(1) и Cu(2) и кислородом О(1) мостиковых групп OH–.
Список литературы
Bottari B., Maccari R., Monforte F. et al. // Bioorg. Med. Chem. 2001. V. 9. P. 2203.
Carcelli M., Ianelli S., Pelagatti P., Pelizzi G. // Inorg. Chim. Acta. 1999. V. 292. P. 121.
Neto B.A.D., Viana B.F.L., Rodrigues T.S. et al. // Dalton Trans. 2013. V. 42. P. 11497.
Panja A., Campana C., Leavitt C. et al. // Inorg. Chim. Acta. 2009. V. 362. P. 1348.
Naskar S., Mishra D., Blake A.J., Chattopadhyay Sh.K. // Struct. Chem. 2007. V. 18. № 2. P. 217.
Naskar S., Mishra D., Chattopadhyay Sh.K., Corbella M. et al. // Dalton Trans. 2005. V. 14. P. 2428.
Naskar S., Corbella M., Blake A.J., Chattopadhyay Sh.K. // Dalton Trans. 2007. V. 11. P. 1150.
Bulhac I., Deseatnic-Ciloci A., Bourosh P. et al. // Chem. J. Mold. 2016. V. 11. P. 39.
Bourosh P., Bulhac I., Mîrzac A. et al. // Russ. J. Coord. Chem. 2016. V. 42. P. 157. https://doi.org/10.1134/S1070328416030015
Bulhac I., Danilescu O., Rija A. et al. // Russ. J. Coord. Chem. 2017. V. 43. P. 21. https://doi.org/10.1134/S1070328417010018
Mazza P., Orcesi M., Pelizzi C. et al. // J. Inorg. Biochem. 1992. V. 48. P. 251.
Koziol A.E., Palenik R.C., Palenik G.J., Wester D.W. // Inorg. Chim. Acta. 2006. V. 359. P. 2569.
CrysAlis RED, O.D.L. Version 1.171.34.76. 2003.
Sheldrick G. // Acta Crystallogr. A. 2008. V. 64. № 1. P. 112.
Беллами Л. // Инфракрасные спектры сложных молекул. М.: ИЛ, 1963, 590 с.
Тарасевич Б.Н. ИК спектры основных классов органических соединений. Справочные материалы. М., 2012. 54 с.
Наканиси К. Инфракрасные спектры и строение органических соединений. М.: Мир, 1965. 216 с.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. 541 с.
Накамото К. ИК спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991. 535 с.
Yano T., Tanaka R., Nishioka T. et al. // Chem. Commun. 2002. P. 1396.
Glatz G., Kempe R. // Z. Kristallogr. NCS. 2008. V. 223. № 3. P. 313.
Paolucci G., Stelluto S., Sitran S. et al. // Inorg. Chim. Acta. 1992. V. 193. № 1. P. 57.
Bino A., Cohen N. // Inorg. Chim. Acta. 1993. V. 210. P. 11.
Bis J.A., Zaworotko M.J. // Crystal Growth Des. 2005. V. 5. № 3. P. 1169.
Cowan J.A., Howard J.A.K., McIntyre G.J. et al. // Acta Crystallogr. B. 2003. V. 59. P. 794.
Kahn O. Molecular Magnetism. New York (WI, Cambridge): VCH Publishers. Inc., 1993. 396 p.
O’Connor C.J. // Prog. Inorg. Chem. 1982. V. 29. P. 203.
Myers B.E., Berger L., Friedber S.A. // J. Appl. Phys. 1969. V. 40. P. 1149.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия