Координационная химия, 2020, T. 46, № 12, стр. 733-737
Обратимый фазовый переход в структуре MoO2Cl2(Dme) с сохранением сингонии и пространственной группы кристалла
А. В. Чураков 1, *, К. А. Руфанов 2
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Марбургский университет им. Филиппа
Марбург, Федеративная Республика Германия
* E-mail: churakov@igic.ras.ru
Поступила в редакцию 24.04.2020
После доработки 29.04.2020
Принята к публикации 07.05.2020
Аннотация
Обнаружен и исследован полностью обратимый фазовый переход в соединении MoO2Cl2(Dme) с сохранением сингонии и пространственной группы кристалла. Этот переход также сопровождается удвоением параметра элементарной ячейки и протекает без разрушения монокристалла. Определены кристаллические структуры комплекса MoO2Cl2(Dme) при 160 (I) и 150 К (II) (CIF files CCDC № 1997752 и 1997751 соответственно).
В последнее время физико-химические процессы в кристаллических фазах, протекающие без разрушения монокристаллов (single-crystal-to-single-crystal transformations, SCSC), привлекают повышенное внимание исследователей, поскольку они открывают перспективы создания принципиально новых устройств, таких как объемные 3D-модули записи информации [1] или фотопереключатели [2]. Среди прочих интенсивно исследуются фотохимические реакции [3], спиновые переходы [4], процессы лигандной изомеризации [5] и лигандного обмена в пористых структурах [6]. Фазовые переходы второго рода в кристаллах, вызываемые изменениями температуры или давления, также довольно часто протекают без потери кристалличности и габитуса [7, 8]. Одним из наиболее распространенных методов определения параметров этих переходов служит мониторинг дифракционной картины монокристаллов, хотя зачастую ее изменения не носят ярко выраженного характера и требуются трудоемкие измерения зависимостей параметров элементарной ячейки от температуры или давления [9, 10]. Нас заинтересовали случаи, когда изменения дифракционных картин при фазовых переходах резко выражены и легко определяются визуально [11]. Последнее происходит при таких фазовых переходах, где изменение симметрии кристалла сопровождается исчезновением–появлением скользящих элементов симметрии или кратным увеличением параметров элементарной ячейки, поскольку это приводит к исчезновению–появлению систематических погасаний [12].
В настоящей статье исследован обратимый фазовый переход в монокристалле комплекса MoO2Cl2(Dme) в интервале 150–160 К. Установлены две его структуры при 160 (I) и 150 K (II).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали безводный Na2MoO4, полученный прокаливанием кристаллогидрата Na2MoO4 ⋅ 2H2O в сушильном шкафу при 120–140°C в течение 6 ч, а также коммерчески доступный Me3SiCl 98% чистоты (Aldrich), подвергавшийся дополнительной осушке путем кипячения над алюминиевой пудрой в течение 5 ч с последующей перегонкой в токе сухого аргона. Безводный диметиловый эфир этиленгликоля (Dme) 99.5% чистоты (Merck) применяли без дополнительной осушки.
ПМР и масс-спектры записывали на спектрометрах Varian VXR-400 и Varian CH-7aMAT соответственно (США).
Синтез MoO2Cl2(Dme) проводили по описанной ранее методике [13]. Выход целевого продукта 20.0 г (69%). Кристаллы, пригодные для РСА, получали перекристаллизацией из сухой смеси ацетона с 20% Dme.
Спектр ПМР (CDCl3; δ, м.д.): 3.95 с. (4H, CH2O–), 4.00 с. (6H, –OCH3).
Масс-спектр (EI, 70 эВ): 200 (MH+-Dme), 165 (MH+-Dme-Cl), 90 (Dme).
РСА I и II выполнен на автоматическом дифрактометре Siemens 1K, мониторинг фазового перехода проведен на автоматическом дифрактометре Bruker SMART APEX II (оба – Германия) с использованием MoKα-излучения (λ = 0.71073 A, графитовый монохроматор) в режиме ω-сканирования. Учет поглощения введен по измерениям интенсивностей эквивалентных отражений [14]. Структуры I и II расшифрованы прямым методом и уточнены полноматричным анизотропным МНК по F 2 для всех неводородных атомов [15]. Все атомы водорода найдены из разностного синтеза Фурье и уточнены изотропно. Кристаллографические данные и результаты уточнения структур I и II приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические данные и детали уточнения структур I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Брутто-формула | C4H10O4Cl2Mo | C4H10O4Cl2Mo |
| М | 288.96 | 288.96 |
| Размер образца, мм | 0.40 × 0.30 × 0.20 | 0.35 × 0.20 × 0.10 |
| Сингония | Моноклинная | Моноклинная |
| Пр. гр. | P21/с | P21/с |
| Температура, К | 160 | 150 |
| a, Å | 7.1866(1) | 14.3460(3) |
| b, Å | 11.0595(1) | 11.1358(2) |
| c, Å | 13.7604(3) | 13.6587(2) |
| β, град | 117.653(1) | 117.932(1) |
| V, Å3 | 968.75(3) | 1927.84(6) |
| Z | 4 | 8 |
| ρ(выч.), г/см3 | 1.981 | 1.991 |
| μ(MoKα), мм–1 | 1.874 | 1.883 |
| F(000) | 568 | 1136 |
| Область θ, град | 2.49–27.49 | 1.61–27.47 |
| Всего отражений | 6871 | 13788 |
| Независимых отражений (Rint) | 2221 (0.0238) | 4418 (0.0286) |
| Число уточняемых параметров | 141 | 280 |
| R1 (I > 2σ(I)) | 0.0230 | 0.0259 |
| wR2 (все данные) | 0.0609 | 0.0715 |
| GOOF | 1.051 | 1.106 |
| Δρmin/Δρmax, e/Å3 | –0.507/0.574 | –0.457/0.777 |
Таблица 2.
Избранные длины связей (Å) и углы (град) для I и II
| Связи и углы | II (150 K) | I (160 К) | |
|---|---|---|---|
| молекула 1 | молекула 2 | Z' = 1 | |
| Mo=O | 1.688(2), 1.692(2) | 1.687(2), 1.691(2) | 1.686(2), 1.689(2) |
| Mo–Cl | 2.3501(7), 2.3692(7) | 2.3641(7), 2.3688(8) | 2.3580(8), 2.3621(7) |
| Mo–O | 2.297(2), 2.311(2) | 2.278(2), 2.304(2) | 2.2806(15), 2.303(2) |
| O=Mo=O | 104.75(10) | 104.84(12) | 104.77(10) |
| ClMoCl | 157.22(3) | 158.82(3) | 158.08(3) |
| OMoO | 70.61(6) | 70.71(6) | 70.94(6) |
Структуры I и II депонированы в Кембриджском банке структурных данных (КБСД № 1997752 и 1997751 соответственно; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Мы предприняли поиск в КБСД [16] полиморфных модификаций, отличающихся удвоением одного из параметров приведенной элементарной ячейки (с учетом возможных перестановок осей). Наше внимание привлекли структуры полиморфов вольфрамового комплекса WO2Cl2(Dme) – рефкоды KUDGIZ (monoclinic I) и KUDGIZ01 (monoclinic II). Первая из этих структур была исследована при комнатной температуре [17], вторая – при 120 К [18]. Авторы [18] обратили внимание на сходство параметров решетки для обоих полиморфов, но возможность фазового перехода ими не рассматривалась. В ходе предварительных исследований мы выяснили, что работать с WO2Cl2(Dme) весьма неудобно в силу его крайней неустойчивости к гидролизу. Было решено переключиться на молибденовый аналог, тем более что при комнатной температуре оба соединения изоструктурны [19].
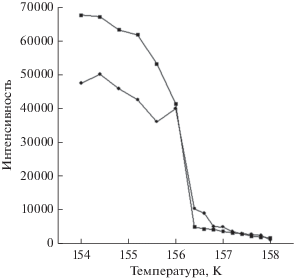
Были определены кристаллические структуры комплекса MoO2Cl2(Dme) при 160 K (I) и при 150 K (II). Оказалось, что структуры I и II относятся к одной сингонии и обладают одной и той же пространственной группой № 14, но различаются вдвое по величине параметра ячейки а (табл. 1), объему ячейки и количеству кристаллографически независимых молекул Z' (рис. 1 и 2 соответственно). Оказалось, что между этими температурами наблюдается полностью обратимый фазовый переход, происходящий без какой-либо заметной деградации качества монокристалла. Для определения точного положения момента перехода был проведен мониторинг интенсивностей ряда запрещенных для высокотемпературной фазы рефлексов (удваивающих отражений с нечетным индексом h для низкотемпературной модификации, рис. 3). Как видно, переход умещается в узкий интервал менее 1 К и сопровождается резким изменением интенсивностей систематических погасаний.
Рис. 1.
Кристаллографически независимая молекула в структуре I. Тепловые эллипсоиды приведены с 50%-ной вероятностью.
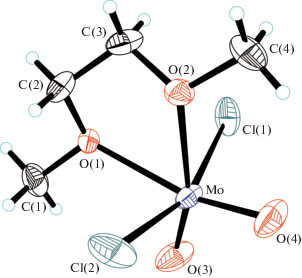
Рис. 2.
Обе кристаллографически независимых молекулы в структуре II. Тепловые эллипсоиды приведены с 50%-ной вероятностью.
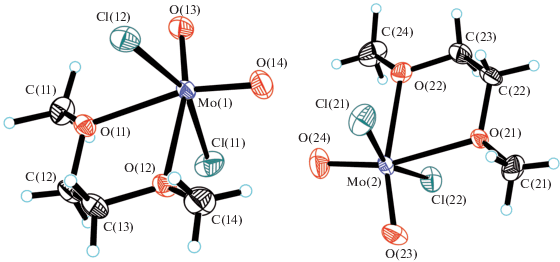
Молекулы комплекса в обеих модификациях расположены в общих положениях и представляют собой искаженные октаэдры с цис-расположением двоесвязанных терминальных атомов кислорода O=Mo и транс-расположением атомов хлора. Как видно из табл. 2, геометрические параметры комплекса очень мало изменяются в ходе фазового перехода.
Данный фазовый переход приводит к значительному взаимному смещению молекул. Так, в структуре I, кратчайшие межмолекулярные расстояния Mo···Mo составляют 5.59 и 6.00 Å, в то время как в II эти расстояния заметно больше – 5.71 и 6.06 Å.
В структуре I наблюдается укороченный межмолекулярный контакт метиленовой группы и терминального атома кислорода O=Mo с расстоянием Н···О, равным 2.50 Å, что может рассматриваться как С–Н···О водородная связь средней силы [20]. При охлаждении, в структуре II данный контакт значительно ослабляется (до 2.60 Å), но зато возникает несколько укороченных контактов С–Н···Cl (2.74–2.86 Å). По-видимому, данный фазовый переход происходит благодаря ослаблению одних, но одновременному усилению других слабых межмолекулярных взаимодействий С–Н···Х, которые в силу кооперативности являются для данного соединения структурообразующими.
Обнаружен и исследован полностью обратимый фазовый переход в структуре MoO2Cl2(Dme) с сохранением сингонии и пространственной группы кристалла и сопровождающийся удвоением параметра элементарной ячейки, протекающий без разрушения монокристалла. Показано, что переход умещается в узкий температурный интервал менее 1 К и сопровождается резким и легко визуально наблюдаемым изменением интенсивностей систематических погасаний. Это делает его весьма удобным для быстрой калибровки низкотемпературных приставок к дифрактометрам, тем более что точка перехода (156 К) расположена почти посередине температурного интервала 100–200 К в котором, по данным КБ-СД, сейчас производится съемка более чем половины монокристальных экспериментов.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Кузьмина Л.Г., Ведерников А.И., Громов С.П., Алфимов М.В. // Кристаллография. 2019. Т. 64. № 5. С. 677 (Kuz’mina L.G., Vedernikov A.I., Gromov S.P., Alfimov M.V. // Crystallogr. Rep. 2019. V. 64. № 5. P. 691). https://doi.org/10.1134/S1063774519050122
Marchivie M., Guionneau P., Howard J.A.K. et al. // J. Am. Chem. Soc. 2002. V. 124. № 2. P. 194. https://doi.org/10.1021/ja016980k
Huang S.-L., Andy-Hor T.S., Jin G.-X. // Coord. Chem. Rev. 2016. V. 346. P. 112. https://doi.org/10.1016/j.ccr.2016.06.009
Money V.A., Radosavljevic-Evans I., Halcrow M.A. et al. // Chem. Commun. 2003. P. 158. https://doi.org/10.1039/B210146G
Mikhailov A., Vuković V., Kijatkin C. et al. // Acta Crystallogr. B. 2019. V. 75. № 6. P. 1152. https://doi.org/10.1107/S205252061901357X
Manna B., Desai A.V., Kumar N. et al. // Cryst. Eng. Commun. 2015. V. 17. № 46. P. 8796. https://doi.org/10.1039/c5ce00139k
Yufit D.S., Chetina O.V., Howard J.A.K. // J. Mol. Struct. 2006. V. 784. № 1–3. P. 214. https://doi.org/10.1016/j.molstruc.2005.09.007
Spencer E.C., Angel R.J., Ross N.L. et al. // J. Am. Chem. Soc. 2009. V. 131. № 11. P. 4022. https://doi.org/10.1021/ja808531m
Вацадзе С.З., Гаврилова Г.В., Зюзькевич Ф.С. и др. // Изв. РАН. Сер. хим. 2016. № 7. С. 1761 (Vatsadze S.Z., Gavrilova G.V., Zyuz’kevich F.S. еt al. // Russ. Chem. Bull. 2016. V. 65. № 7. P. 1761). https://doi.org/10.1007/s11172-016-1508-7
Zaitsev K.V., Lam K., Poleshchuk O.Kh. et al. // Eur. J. Inorg. Chem. 2019. № 22. P. 2750. https://doi.org/10.1002/ejic.201900316
Leech M.A., J.A.K. Howard, S. Dahaoui et al. // Chem. Commun. 1999. № 22. P. 2245. https://doi.org/10.1039/a906876g
International Tables for Crystallography. Space-Group Symmetry / Ed. Hahn Th. Dordrecht (The Netherlands): Springer, 2005. V. A. 911 p.
Rufanov K.A., Zarubin D.N., Ustynyuk N.A. et al. // Polyhedron. 2001. V. 20. № 5. P. 379.
Sheldrick G.M. SADABS. Program for Scaling and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 1997.
Sheldrick G.M. // Acta. Crystallogr. A. 2008. V. 64. № 1. P. 112. https://doi.org/10.1107/S0108767307043930
Groom C.R., Bruno I.J., Lightfoot M.P., Ward S.C. // Acta Crystallogr. B. 2016. V. 72. № 2. P. 171. https://doi.org/10.1107/S2052520616003954
Dreisch K., Andersson C., Stålhandske C. // Polyhedron. 1991. V. 10. № 20–21. P. 2417. https://doi.org/10.1016/S0277-5387(00)86203-8
Davis M.F., Levason W., Light M.E et al. // Eur. J. Inorg. Chem. 2007. № 13. P. 1903. https://doi.org/10.1002/ejic.200700043
Kamenar B., Penavić M., Korpar-Čolig B., Marković B. // Inorg. Chim. Acta. 1982. V. 65. P. L245. https://doi.org/10.1016/S0020-1693(00)93562-X
Steiner T. // Crystallogr. Rev. 2003. V. 9. № 2–3. P. 177. https://doi.org/10.1080/08893110310001621772
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия