Координационная химия, 2020, T. 46, № 12, стр. 749-757
Связывание золота(III) из растворов тетраядерным дипропилдитиокарбаматом свинца(II), [Pb4{S2CN(C3H7)2}8] и хемосорбционный синтез двойного ионно-полимерного комплекса состава ([Au{S2CN(C3H7)2}2][PbCl3] ⋅ 1/2CH3–C6H5)n: гетероядерный (13C, 15N) CP-MAS ЯМР, структурная организация и принципы построения катионных и анионных полимерных цепей
А. В. Иванов 1, *, А. С. Заева 1, А. И. Смоленцев 2, 3
1 Институт геологии и природопользования ДВО РАН
Благовещенск, Россия
2 Институт неорганической химии им. А.В. Николаева СО РАН
Новосибирск, Россия
3 Новосибирский государственный университет
Новосибирск, Россия
* E-mail: alexander.v.ivanov@chemist.com
Поступила в редакцию 24.01.2020
После доработки 28.02.2020
Принята к публикации 11.03.2020
Аннотация
Данные CP-MAS ЯМР (13C, 15N) корректно отражают присутствие в структуре тетраядерного N,N-дипропилдитиокарбамата (PrDtc) свинца(II), [Pb4{S2CN(C3H7)2}8] (I) четырех неэквивалентных лигандов PrDtc, для которых выполнена оценка констант спин-спинового взаимодействия 3J(15N–207Pb). Методом MAS ЯМР 13С установлено, что хемосорбционное связывание AuCl3 из раствора (2 M HCl) дипропилдитиокарбаматом свинца(II) сопровождается полным перераспределением лигандов PrDtc между координационными сферами Pb(II) и Au(III) с образованием двойного комплекса [Au{S2CN(C3H7)2}2][PbCl3] (II). При кристаллизации из ацетона–толуола (3 : 1) последний был получен в сольватированной форме ([Au{S2CN(C3H7)2}2][PbCl3] ⋅ 1/2CH3C6H5)n (IIa), охарактеризованной методом РСА (CIF file CCDC № 1978947). Катионная часть соединения представлена нецентросимметричными комплексными ионами золота(III) состава [Au{S2CN(C3H7)2}2]+, которые парами неэквивалентных вторичных связей Au···S объединяются, формируя супрамолекулярную псевдополимерную цепь ([Au{S2CN(C3H7)2}2]+)n. Роль противоиона выполняет трихлороплюмбат(II)-анион в 1D-полимерной форме, {[Pb(μ2-Cl)3]–}n. Взаимодействие между анионными и катионными цепями за счет водородных связей C–H···Cl приводит к обособлению в кристаллической решетке каналов, заселенных сольватными молекулами толуола.
Несмотря на токсичность, свинец и его соединения находят широкое применение при изготовлении аккумуляторов, а также их можно использовать при создании высокоэффективных элементов солнечных батарей [1] и в качестве добавок в специальные сорта бетона для повышения степени защиты от γ-излучения [2]. Кроме того, выявлено положительное воздействие ионов Pb2+ на рост продуктивности бактерий Paenibacillus polymyxa в биосинтезе антибиотиков [3]. Дитиокарбаматы свинца(II) в практическом плане представляют интерес как прекурсоры пленочных и наноразмерных сульфидов свинца в одностадийных процессах термохимического синтеза [4–7] (кристаллический PbS обнаруживает полупроводниковые свойства, позволяющие использовать его при создании оптоэлектронных устройств). При этом структурно охарактеризованные к настоящему времени диалкил(алкилен)дитиокарбаматы свинца(II) общего состава [Pb(S2CNR2)2] (R = CH3 [8], C2H5 [9], C3H7 [10], изо-C3H7 [11, 12], C5H11 [13], цикло-C6H11 [14]; R2 = C2H5, изо-C3H7 [15], CH3, CH2–C6H5 [14, 16], C2H5, C6H5 [16], (CH2)4 [17]) относительно немногочисленны11.
Ранее для дитиокарбаматов постпереходных металлов (Tl+, Bi3+) мы обнаружили способность к эффективному связыванию золота(III) из растворов с образованием соответствующих гетерометаллических Au(III)−Bi(III) [19, 20] и Au(III)−Tl(III) [21, 22] комплексов. В продолжение этих исследований в настоящей работе, взаимодействием свежеосажденного тетраядерного дипропилдитиокарбамата свинца(II) [Pb4{S2CN(C3H7)2}8] (I) c раствором AuCl3/2 М HCl, в качестве индивидуальной формы связывания золота(III) получен двойной комплекс состава [Au{S2CN(C3H7)2}2][PbCl3] (II). Для сольватированной формы последнего, [Au{S2CN(C3H7)2}2]- [PbCl3] ⋅ 1/2CH3C6H5 (IIa), установлена ионно-полимерная структура, включающая чередование полимерных анионных цепочек ([PbCl3]–)n и псевдополимерных катионных цепочек ([Au{S2CN(C3H7)2}2]+)n. Соединения I и II охарактеризованы методом гетероядерной спектроскопии (13C, 15N) CP-MAS ЯМР.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходный N,N-дипропилдитиокарбамат натрия Na{S2CN(C3H7)2} · H2O получали взаимодействием эквимолярных масс (C3H7)2NH (Merck) с сероуглеродом (Merck) в щелочной среде [23].
Данные CP-MAS ЯМР 13С (δ, м.д.) для Na{S2CN(C3H7)2} · H2O: 208.3 (–S2CN=); 59.4, 57.9 (1 : 1, =NCH2–); 22.3, 21.5 (1 : 1, –CH2–); 12.6, 11.5 (1 : 1, –CH3) [24].
Синтез I, II, IIa. Тетраядерный комплекс свинца(II) I получали осаждением катионов Pb2+ из водной фазы дипропилдитиокарбаматом натрия [10] и идентифицировали по данным CP-MAS ЯМР 13C и 15N (δ, м.д.): 204.6, 202.5 (1 : 3, –S2CN=); 56.5, 55.4, 51.1 (1 : 1 : 2, =NCH2–); 22.6, 21.4, 21.1 (1 : 1 : 2, ‒CH2–); 13.8, 13.5, 13.1, 12.8, 12.3, 12.0, 11.6 (‒CH3); 144.1 (17)*, 141.4 (16)*, 139.6 (24)*, 138.3 (15)* (1 : 1 : 1 : 1, –S2CN=), где * – константы спин-спинового взаимодействия 3J(15N–207Pb), Гц.
Двойной комплекс Au(III)–Pb(II) II получали хемосорбционным связыванием золота(III) из раствора в твердую фазу свежеосажденным дипропилдитиокарбаматом свинца(II) по реакции
К 100 мг свежеосажденного [Pb4{S2CN(C3H7)2}8] приливали 5 мл раствора AuCl3/2 M HCl, содержащего 35.46 мг золота, и перемешивали в течение 1 ч на магнитной мешалке. Полученный серовато-желтый мелкокристаллический осадок отфильтровывали, промывали водой и высушивали на фильтре. Остаточное содержание золота в растворе определяли на атомно-абсорбционном спектрометре iCE 3000 (Thermo Electron Corporation, США). Степень связывания золота из раствора составила 93.6%. Хотя золото(III), связанное из раствора в твердую фазу (33.20 мг), определяет выход II в 94.4% (c ожидаемой массой комплекса 145.54 мг), экспериментально получили лишь 127.35 мг (82.6%).
По данным CP-MAS ЯМР 13С для II (δ, м.д.): 197.4, 195.0 (1 : 1, −S2CN=); 55.4, 53.7 (=NCH2−); 22.0 (−CH2−); 13.1, 11.8, 10.7 (−CH3).
ИК-спектр II (KBr; ν, см–1): 2967 с, 2930 ср, 2871 ср, 1551 о.с, 1464 ср, 1449 сp, 1439 сp, 1361 ср, 1308 сp, 1274 сл, 1252 с, 1194 ср, 1161 ср, 1103 ср, 1086 ср, 968 сл, 895 ср, 751 ср, 608 ср.
При получении монокристаллов для дифракционного эксперимента высушенный мелкокристаллический осадок комплекса Au(III)–Pb(II) растворяли в смеси ацетон–толуол (3 : 1). Прозрачные желтые игольчатые кристаллы катена-поли[три(μ2-хлоро)плюмбата(II)] бис(N,N-дипропилдитиокарбамато-S,S')золота(III) получали в сольватированной форме IIa в результате медленного испарения растворителей при комнатной температуре.
Спектры CP-MAS ЯМР 13C/15N регистрировали на спектрометре CMX-360 (Agilent/Varian/ Chemagnetics InfinityPlus) с рабочей частотой 90.52/36.48 МГц, сверхпроводящим магнитом (В0 = = 8.46 Тл) и Фурье-преобразованием. Использовали кросс-поляризацию (CP) с протонов: контактное время 1H−13C/1H−15N 2.00/1.25 мс. Подавление взаимодействий 13C−1H/15N−1H основывалось на эффекте декаплинга, при использовании радиочастотного поля на резонансной частоте протонов (359.96 МГц) [25]. Поликристаллические образцы I, II массой ~60/25 мг помещали в 4.0 мм керамический ротор из ZrO2. При измерениях ЯМР 13C/15N использовали вращение образцов под магическим углом (MAS) на частоте 5000–10 100/3750(1) Гц; число накоплений 6100–10 000/12 100; длительность протонных π/2-импульсов 4.5–5.0/5.0 мкс; интервал между импульсами 2.0/3.0 с. Изотропные хим. сдвиги, δ(13C)/δ(15N) даны относительно одной из компонент внешнего стандарта – кристаллического адамантана (δ = 38.48 м.д. относительно тетраметилсилана)/кристаллического NH4Cl (δ = 0.0 м.д., –341 м.д. в абсолютной шкале [26]) с поправкой на дрейф напряженности магнитного поля, частотный эквивалент которого составил 0.051/0.018 Гц/ч. Однородность магнитного поля контролировали по ширине (2.6 Гц) референсной линии адамантана.
ИК-спектры регистрировали на интерференционном ИК-спектрометре с Фурье-преобразованием ФСМ–1201 в диапазоне 400–4000 см–1 (таблетки с KBr). Управление прибором и обработку спектров осуществляли по программе FSpec (версия 4.0.0.2 для Windows, ООО Мониторинг, Россия).
РСА комплекса IIa выполнен c желтых игольчатых монокристаллов на дифрактометре Bruker-Nonius X8 Apex CCD (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) при 150(2) K. Сбор данных проведен по стандартной методике: φ- и ω-сканирование узких фреймов. Поглощение учтено эмпирически с использованием программы SADABS [27]. Структура определена прямым методом и уточнена методом наименьших квадратов (по F 2) в полноматричном анизотропном приближении неводородных атомов. Положения атомов водорода рассчитаны геометрически и включены в уточнение в модели “наездника”. Расчеты по определению и уточнению структуры выполнены по комплексу программ SHELXTL [27]. Основные кристаллографические данные и результаты уточнения структуры IIа приведены в табл. 1, основные длины связей и углы – в табл. 2.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структуры IIa
| Параметр | Значение |
|---|---|
| Брутто-формула | C17.5H32N2S4Cl3PbAu |
| М | 909.20 |
| Сингония | Орторомбическая |
| Пр. гр. | Pbcn |
| a, Å | 7.7670(7) |
| b, Å | 25.885(2) |
| c, Å | 28.276(2) |
| β, град | 90 |
| V, Å3 | 5684.9(8) |
| Z | 8 |
| ρ(выч.), г/см3 | 2.125 |
| μ, мм–1 | 11.655 |
| F(000) | 3416 |
| Размер кристалла, мм | 0.32 × 0.10 × 0.06 |
| Область сбора данных по θ, град | 1.73–27.70 |
| Интервалы индексов отражений | –10 ≤ h ≤ 10, –21 ≤ k ≤ 33, –36 ≤ l ≤ 33 |
| Измерено отражений | 32 209 |
| Независимых отражений (Rint) | 6581 (0.0335) |
| Отражений с I > 2σ(I) | 5311 |
| Переменных уточнения | 270 |
| GООF | 1.070 |
| R1, wR2 по F2 > 2σ(F2) | 0.0325, 0.0572 |
| R1, wR2 по всем отражениям | 0.0459, 0.0603 |
| Остаточная электронная плотность (min/max), e/Å3 | –2.350/1.776 |
Таблица 2.
Длины связей (d, Å), валентные (ω, град) и торсионные (φ, град) углы в структуре IIa*
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Катион | |||
| Au(1)–S(1) | 2.3403(13) | S(3)–C(8) | 1.730(5) |
| Au(1)–S(2) | 2.3474(12) | S(4)–C(8) | 1.737(5) |
| Au(1)–S(3) | 2.3297(12) | N(1)–C(1) | 1.307(6) |
| Au(1)–S(4) | 2.3492(13) | N(1)–C(2) | 1.479(7) |
| Au(1)∙∙∙S(1)a | 3.4378(14) | N(1)–C(5) | 1.480(6) |
| Au(1)∙∙∙S(4)b | 3.5686(14) | N(2)–C(8) | 1.311(6) |
| S(1)–C(1) | 1.738(5) | N(2)–C(9) | 1.482(6) |
| S(2)–C(1) | 1.725(5) | N(2)–C(12) | 1.484(7) |
| Анион | |||
| Pb(1)–Cl(1) | 2.7496(13) | Pb(1)–Cl(1)c | 3.0549(14) |
| Pb(1)–Cl(2) | 3.1920(13) | Pb(1)–Cl(2)c | 2.6830(12) |
| Pb(1)–Cl(3) | 2.7640(12) | Pb(1)–Cl(3)c | 3.1401(13) |
| Сольватная молекула толуола | |||
| С(15)–С(16) | 1.409(18) | С(16)–С(17) | 1.331(19) |
| С(15)–С(17) | 1.329(15) | С(15)–С(18) | 1.495(10) |
| Угол | ω, град | Угол | ω, град |
| Катион | |||
| S(1)Au(1)S(2) | 75.09(4) | Au(1)S(1)C(1) | 86.81(17) |
| S(1)Au(1)S(3) | 103.71(4) | Au(1)S(2)C(1) | 86.89(17) |
| S(1)Au(1)S(4) | 178.23(5) | Au(1)S(3)C(8) | 87.39(17) |
| S(2)Au(1)S(3) | 177.47(5) | Au(1)S(4)C(8) | 86.61(17) |
| S(2)Au(1)S(4) | 106.04(4) | S(1)C(1)S(2) | 111.2(3) |
| S(3)Au(1)S(4) | 75.11(4) | S(3)C(8)S(4) | 110.7(3) |
| Анион | |||
| Cl(1)Pb(1)Cl(2) | 81.34(4) | Cl(2)Pb(1)Cl(3)c | 112.35(3) |
| Cl(1)Pb(1)Cl(3) | 87.16(4) | Cl(3)Pb(1)Cl(1)c | 96.49(4) |
| Cl(1)Pb(1)Cl(1)c | 171.65(4) | Cl(3)Pb(1)Cl(2)c | 91.44(4) |
| Cl(1)Pb(1)Cl(2)c | 87.40(4) | Cl(3)Pb(1)Cl(3)c | 168.57(4) |
| Cl(1)Pb(1)Cl(3)c | 99.56(4) | Cl(1)cPb(1)Cl(2)c | 85.01(4) |
| Cl(2)Pb(1)Cl(3) | 77.65(4) | Cl(1)cPb(1)Cl(3)c | 75.68(3) |
| Cl(2)Pb(1)Cl(1)c | 106.75(3) | Cl(2)cPb(1)Cl(3)c | 79.72(4) |
| Cl(2)Pb(1)Cl(2)c | 164.62(4) | ||
| Сольватная молекула толуола | |||
| C(15)С(16)C(17) | 116.4(12) | C(16)С(15)C(17) | 124.1(15) |
| C(15)С(17)C(16) | 119.5(13) | C(16)С(15)C(18) | 118.0(16) |
| Угол | φ, град | Угол | φ, град |
| Au(1)S(1)S(2)C(1) | 177.3(3) | S(2)C(1)N(1)C(2) | 178.8(4) |
| Au(1)S(3)S(4)C(8) | –174.6(3) | S(2)C(1)N(1)C(5) | –0.6(7) |
| S(1)Au(1)C(1)S(2) | 177.5(3) | S(3)C(8)N(2)C(9) | –0.2(6) |
| S(3)Au(1)C(8)S(4) | –175.1(3) | S(3)C(8)N(2)C(12) | 178.4(4) |
| S(1)C(1)N(1)C(2) | –1.1(7) | S(4)C(8)N(2)C(9) | –178.7(4) |
| S(1)C(1)N(1)C(5) | 179.5(4) | S(4)C(8)N(2)C(12) | –0.1(7) |
Координаты атомов, длины связей, валентные углы и температурные параметры для комплекса IIa депонированы в Кембриджском банке структурных данных (CCDC № 1978947; deposit@ ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Спектр CP-MAS ЯМР 13C тетраядерного комплекса свинца(II) [Pb4{S2CN(C3H7)2}8] (I) обнаруживает резонансные сигналы групп >NC(S)S–, >N–CH2–, –CH2– и –CH3 в составе лигандов PrDtc (рис. 1а). Наиболее информативная область дитиокарбаматных групп включает два сигнала 13С, отношение интегральных интенсивностей которых, близкое к 1 : 3, указывает на присутствие четырех неравноценных лигандов в структуре I. Более высокая чувствительность спектроскопии CP-MAS ЯМР 15N к малым структурным различиям групп >NC(S)S– [24] позволила, в свою очередь, разрешить резонансные сигналы для каждого из четырех структурно неэквивалентных лигандов PrDtc комплекса I (рис. 2). Все четыре резонансных сигнала 15N (1 : 1 : 1 : 1) обсуждаемого спектра характеризуются наличием двух эквидистантных сателлитных сигналов, обусловленных присутствием в природном свинце нуклида 207Pb (I = 1/2; гиромагнитное отношение, γ = = 5.58046 × 107 рад/(Тл с)). Поскольку природное содержание 207Pb составляет 22.1 ат. %, для каждого из сигналов 15N характерна триплетная структура (с теоретическим отношением интегральных интенсивностей 1 : 7 : 1), которая проявляется за счет спин-спинового взаимодействия между ядрами 15N и 207Pb с константами 3J(15N–207Pb) = 15–24 Гц. Таким образом, совокупность полученных для соединения I данных CP-MAS ЯМР (13C, 15N) полностью согласуется со структурными данными для тетраядерного дипропилдитиокарбамата свинца(II) [10].
Рис. 1.
Спектры CP-MAS ЯМР 13C поликристаллических комплексов I (a) и II (б). Число накоплений/частота вращения образцов (Гц): 6100/5000 (а) и 10 000/10 100 (б).
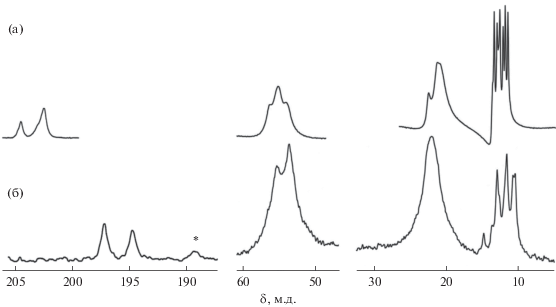
Рис. 2.
Спектр CP-MAS ЯМР 15N поликристаллического образца I: число накоплений/частота вращения образца (Гц): 12 100/3750.
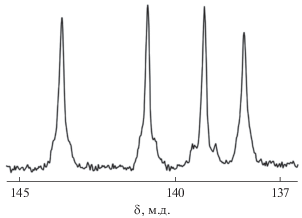
Аналогично соединению I в спектре CP-MAS ЯМР 13C комплекса [Au{S2CN(C3H7)2}2][PbCl3] (II) также наблюдаются резонансные сигналы соответствующих химических групп лигандов PrDtc (рис. 1б). Однако кардинальное уменьшение хим. сдвигов 13С групп >NC(S)S– в II (197.4 и 195.0 м.д.) по сравнению с исходным комплексом I (204.6 и 202.5 м.д.) прямо указывает на то, что получение II сопровождается полным перераспределением лигандов PrDtc в координационную сферу золота(III), как мы отмечали ранее при получении [Au{S2CN(C3H7)2}2]2[Cd2Cl6] (198.6 и 194.6 м.д.) [28] и [Au{S2CN(C3H7)2}2][AgCl2] (195.3 и 191.9 м.д.) [29]. Кроме того, два равноинтенсивных (1 : 1) сигнала 13С дитиокарбаматных групп в спектре II свидетельствуют о присутствии в его структуре одного нецентросимметричного или двух неэквивалентных центросимметричных катионов [Au{S2CN(C3H7)2}2]+. (Следует отметить, что в области дитиокарбаматных групп, связанных с золотом, присутствует также слабоинтенсивный сигнал 13C (189.8 м.д.; обозначен на рис. 1б звездочкой) примеси неидентифицированного соединения.)
Наиболее интенсивная полоса поглощения (1551 см–1) в ИК-спектре II, отражающая валентные колебания связи ν(C–N) в группах >NC(S)S– лигандов PrDtc, занимает промежуточное положение между диапазонами колебаний ординарных ν(C–N) при 1360–1250 см–1 и двойных связей ν(C=N) при 1690–1640 см–1, что прямо указывает на частично двойной характер связи C⋅⋅⋅N в дитиокарбаматных группах. При этом нужно отметить, что существенное смещение обсуждаемой полосы в высокочастотную область по сравнению с исходной натриевой солью Na{S2CN(C3H7)2} ⋅ H2O (1468 см–1 ν(C–N) [19]), полностью согласуется с имеющимися данными для комплексов, включающих S,S′-бидентатно координированные золотом(III) дитиокарбаматные лиганды [19, 30]. Полосы поглощения, обусловленные асимметричными (νas) и симметричными (νs) валентными колебаниями групп –C(S)S–, отмечены при 1161 и 968 см–1 соответственно [31]. В свою очередь, наиболее интенсивные полосы в диапазоне 2967–2871 см–1 отнесены к валентным колебаниям групп CH3– и –CH2– алкильных заместителей [32]: 2967 νas(СН3), 2871 νs(СН3), 2930 см–1 νas(СН2).
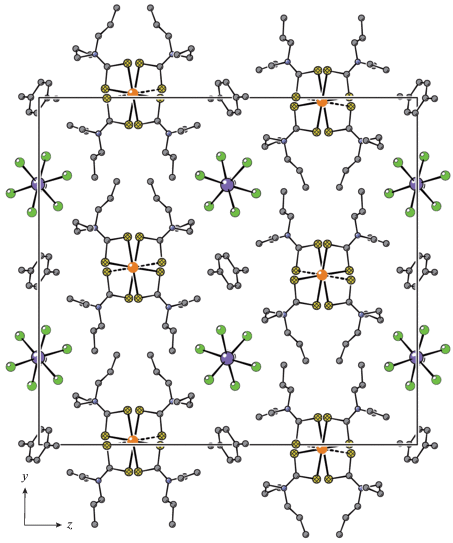
Структура сольватированной формы двойного ионно-полимерного комплекса золота(III)−свинца(II) установлена прямым методом РСА. В состав элементарной ячейки IIa входит восемь формульных единиц [Au{S2CN(C3H7)2}2][PbCl3] ⋅ 1/2CH3–C6H5 (рис. 3). Как и ожидалось из данных CP-MAS ЯМР 13C, катионная часть комплекса представлена нецентросимметричным комплексным ионом золота(III) состава [Au{S2CN(C3H7)2}2]+, включающим два неэквивалентных лиганда PrDtc. Координация одного из них близка к S,S'-изобидентатной (Au–S 2.3403 и 2.3474 Å), тогда как для второго в большей степени характерен S,S′-анизобидентатный способ связывания (Au–S 2.3297 и 2.3492 Å). Следствием бидентатной координации является формирование в обсуждаемом катионе двух плоских малоразмерных четырехчленных металлоциклов [AuS2C], объединяемых общим атомом золота: значения торсионных углов AuSSC и SAuCS близки к 180° (табл. 2); расстояния Au∙∙∙C 2.836–2.838 Å и S∙∙∙S 2.857–2.852 Å (суммы ван-дер-ваальсовых радиусов соответствующих пар атомов: 3.36 и 3.60 Å [33]). Существенно сближенные позиции атомов золота и углерода в циклических фрагментах [AuS2C] указывают на проявление транс-аннулярного взаимодействия между ними. Значения диагональных углов SAuS не сильно отклоняются от 180° (табл. 2), что указывает на копланарное расположение атомов в тетрагональном хромофоре [AuS4], обусловленное низкоспиновым внутриорбитальным dsp2-гибридным состоянием золота(III). Трапециедальное искажение обсуждаемого хромофора отражает неравенство его длинных сторон (3.673 и 3.752 Å) и соответствующее расположение тупых (91.00°, 90.59°) и острых (89.07°, 89.33°) внутренних углов.
Рис. 3.
Проекция структуры IIa на плоскость yz. Псевдополимерные ([Au{S2CN(C3H7)2}2]+)n и полимерные {[Pb(μ2-Cl)3]–}n цепочки ориентированы вдоль оси x.
Группировки C2NC(S)S в лигандах PrDtc практически плоские: торсионные углы SCNC близки 180° или 0° (табл. 2). При этом дитиокарбаматные группы характеризует большая прочность связей N−C(S)S (1.307 и 1.311 Å) в сравнении с N−CH2 (1.479–1.484 Å) (табл. 2). Обе эти особенности указывают на частично двойной характер формально ординарной связи N−C(S)S, что объясняется примешиванием sp2- к sp3-гибридному состоянию атомов азота и углерода.
Структурную самоорганизацию катионной подсистемы комплекса IIа определяют вторичные взаимодействия22 Au···S невалентного типа (рис. 4б). У каждого комплексного катиона [Au{S2CN(C3H7)2}2]+ в несимметричных взаимодействиях с двумя ближайшими соседями принимает участие триада атомов линейного структурного фрагмента [S(1)–Au(1)–S(4)] (рис. 4а), что приводит к образованию двух пар неэквивалентных вторичных связей: Au(1)···S(1)a, Au(1)a···S(1) 3.4378 Å и Au(1)···S(4)b, Au(1)b···S(4) 3.5686 Å (сумма ван-дер-ваальсовых радиусов атомов золота и серы 3.46 Å [33]). Результатом этих межкатионных взаимодействий является формирование супрамолекулярных псевдо-1D-полимерных цепей ([Au{S2CN(C3H7)2}2]+)n (угол Au(1)aAu(1)Au(1)b 177.172(9)°, межатомные расстояния Au(1)–Au(1)a 3.9140(5) Å и Au(1)–Au(1)b 3.8553(5) Å), направленных вдоль кристаллографической оси x (рис. 3).
Рис. 4.
Строение нецентросимметричного комплексного катиона [Au{S2CN(C3H7)2}2]+, эллипсоиды 50%-ной вероятности (а) и трехзвенный фрагмент супрамолекулярной псевдополимерной цепочки ([Au{S2CN(C3H7)2}2]+)n (б). Двойными пунктирными линиями показаны межкатионные вторичные связи Au···S; симметрические преобразования: a 1 – x, y, 1/2 – z; b –x, y, 1/2 – z; c 1 + x, y, z; d 2 – x, y, 1/2 – z.
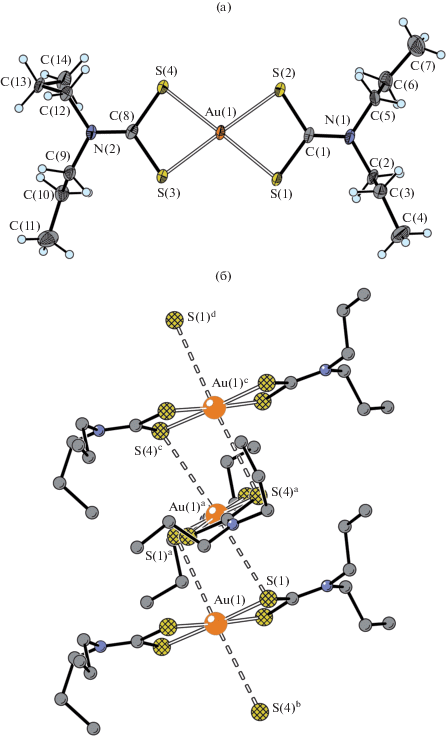
В обсуждаемых псевдополимерных цепях различие пространственной направленности чередующихся катионов может быть количественно охарактеризовано углом между биссекторальными плоскостями (разделяют бициклические фрагменты [CS2AuS2C] в соседних катионах), который близок к прямому (88.7(7)°). При этом угол между плоскостями, в которых лежат хромофоры [AuS4] соседних катионов, составляет 19.19(3)°. За счет вторичных связей Au···S атомы золота достраивают свой полигон до искаженного, сильно вытянутого октаэдра [AuS4+2] (угол S(1)a···Au(1)···S(4)b 176.98(3)°), в котором аксиальные атомы серы смещены с идеальных позиций, поскольку углы S(1)a···Аu(1)–C(8) 80.3(1)° и S(4)b···Au(1)–S(1) 81.70(4)° весьма существенно отклоняются от 90°.
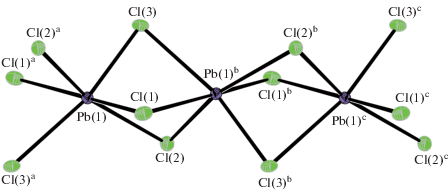
Анионная часть комплекса представлена 1D-полимерной формой три(μ2-хлоро)плюмбат(II)-иона {[Pb(μ2-Cl)3]–}n, в которой атомы свинца объединяются с каждым из двух ближайших соседей тремя неэквивалентными μ2-мостиковыми атомами хлора (рис. 5). Последние характеризуются асимметричной координацией к соседним атомам металла, образуя по две, существенно различающиеся длиной, связи Pb–Cl (табл. 2). Реализация обсуждаемых связей приводит к формированию зигзагообразной полимерной анионной цепочки (угол Pb(1)aPb(1)Pb(1)b составляет 175.746(6)°; межатомное расстояние Pb(1)–Pb(1)a 3.8862(4) Å), ориентированной вдоль кристаллографической оси x. Каждый атом свинца в цепочке по совокупности находится в шестерном окружении атомов хлора [PbCl6], формируя шесть неэквивалентных связей Pb–Cl, три из которых более короткие (2.6830–2.7640 Å), чем три другие (3.0549–3.1920 Å). Первые сопоставимы с суммой эмпирических ковалентных радиусов атомов свинца и серы (2.46 Å [35]); тогда как значительное ослабление вторых указывает на существенный вклад ионной составляющей в обсуждаемые связи [36]. Полиэдр металла может быть аппроксимирован сильно искаженным октаэдром [36, 37] или тригональной антипризмой, основания которой, определяемые атомами хлора Cl(1)–Cl(3) и Cl(1)a–Cl(3)a (рис. 5), не вполне параллельны: угол между соответствующими плоскостями составляет 38.75(4)°.
Рис. 5.
Трехзвенный фрагмент анионной полимерной цепочки ([PbCl3]–)n. Эллипсоиды 50%-ной вероятности; симметрические преобразования: ax – 1/2, 1/2 – y, –z; b 1/2 + x, 1/2 – y, –z; c 1/2 + x, y, z.
Взаимодействие между псевдополимерными катионными и полимерными анионными цепочками осуществляется за счет многочисленных водородных связей C–H···Cl (табл. 3). В результате этого пары катионных и анионных цепочек пространственно обособляют в кристаллической структуре IIa каналы, заселенные сольватными молекулами толуола. Обсуждаемые молекулы статистически распределены между двумя позициями с одинаковой заселенностью и характеризуются противоположной направленностью метильных заместителей (рис. 3).
Таблица 3.
Геометрические параметры водородных связей в комплексе IIa
| Контакт C–H···A | Расстояние, Å | Угол C–H···A, град |
||
|---|---|---|---|---|
| C–H | H···A | C···A | ||
| C(6)–H(6A)···Cl(1) | 0.99 | 2.71 | 3.632(6) | 155 |
| C(12)–H(12B)···Cl(1) | 0.99 | 2.94 | 3.677(5) | 132 |
| C(9)–H(9A)···Cl(2) | 0.99 | 2.86 | 3.628(5) | 135 |
| C(14)–H(14B)···Cl(2) | 0.98 | 2.88 | 3.658(6) | 137 |
| C(5)–H(5A)···Cl(3) | 0.99 | 2.75 | 3.652(5) | 152 |
| C(9)–H(9A)···Cl(3) | 0.99 | 2.82 | 3.622(5) | 139 |
| C(13)–H(13B)···Cl(3) | 0.99 | 2.93 | 3.836(5) | 153 |
Таким образом, в качестве индивидуальной формы связывания золота(III) тетраядерным дипропилдитиокарбаматом свинца(II) [Pb4{S2CN(C3H7)2}8] получен двойной Au(III)–Pb(II) комплекс, выделенный при кристаллизации из раствора в сольватированной ионно-полимерной форме, ([Au{S2CN(C3H7)2}2][PbCl3] ⋅ 1/2CH3–C6H5)n. В катионной подсистеме пары неэквивалентных вторичных связей Au···S объединяют нецентросимметричные комплексные ионы золота(III) в супрамолекулярную псевдополимерную цепочку ([Au{S2CN(C3H7)2}2]+)n. Трихлороплюмбат(II)-ион также представлен 1D-полимерной формой {[Pb(μ2-Cl)3]–}n. Система водородных связей C–H···Cl между катионными и анионными цепями способствует обособлению в кристаллической решетке каналов, заселенных структурно разупорядоченными сольватными молекулами толуола.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Dhar A., Dey A., Maiti P. et al. // Ionics. 2018. V. 24. № 4. P. 1227.
Hassan H.E., Badran H.M., Aydarous A., Sharshar T. // Nucl. Instr. Meth. B. 2015. V. 360. P. 81.
Raza W., Wu H., Xu Y., Qirong Sh. // J. Chem. Soc. Pak. 2011. V. 33. № 2. P. 193.
Nyamen L.D., Rajasekhar Pullabhotla V.S.R., Nejo A.A. et al. // Dalton Trans. 2012. V. 41. № 27. P. 8297.
Sathiyaraj E., Thirumaran S. // Spectrochim. Acta. A. 2012. V. 97. P. 575.
Lewis E.A, McNaughter P.D., Yin Zh. et al. // Chem. Mater. 2015. V. 27. № 6. P. 2127.
Chintso T., Ajibade P.A. // Mater. Lett. 2015. V. 141. P. 1.
Iwasaki H. // Acta Crystallogr. B. 1980. V. 36. № 9. P. 2138.
Iwasaki H., Hagihara H. // Acta Crystallogr. B. 1972. V. 28. № 2. P. 507.
Bharadwaj P.K., Arbuckle B.W., Musker W.K. // Inorg. Chim. Acta. 1988. V. 142. № 2. P. 243.
Ito M., Iwasaki H. // Acta Crystallogr. B. 1980. V. 36. № 2. P. 443.
Angeloski A., Gentle A.R., Scott J.A. et al. // Inorg. Chem. 2018. V. 57. № 4. P. 2132.
Afzaal M., Ellwood K., Pickett N.L. et al. // J. Mater. Chem. 2004. V. 14. № 8. P. 1310.
Akhtar J., Malik M.A., O’Brien P., Helliwell M. // J. Mater. Chem. 2010. V. 20. № 29. P. 6116.
Trindade T., O’Brien P., Zhang X.-m., Motevalli M. // J. Mater. Chem. 1997. V. 7. № 6. P. 1011.
Oluwalana A.E., Ajibade P.A. // J. Sulfur Chem. 2019. V. 41. № 2. P. 182.
Caruso F., Chan M.-L., Rossi M. // Inorg. Chem. 1997. V. 36. № 17. P. 3609.
Trindade T., Monteiro O.C., O’Brien P., Motevalli M. // Polyhedron. 1999. V. 18. № 8–9. P. 1171.
Иванов А.В., Герасименко А.В., Егорова И.В. и др. // Коорд. химия. 2018. Т. 44. № 4. С. 266 (Ivanov A.V., Gerasimenko A.V., Egorova I.V. et al. // Russ. J. Coord. Chem. 2018. V. 44. № 8. P. 518).https://doi.org/10.1134/S1070328418080043
Заева А.С., Иванов А.В., Герасименко А.В., Сергиенко В.И. // Журн. неорган. химии. 2015. Т. 60. № 2. С. 243 (Zaeva A.S., Ivanov A.V., Gerasimenko A.V., Sergienko V.I. // Russ. J. Inorg. Chem. 2015. V. 60. № 2. P. 203).https://doi.org/10.7868/S0044457X15020233
Иванов А.В., Бредюк О.А., Лосева О.В. // Журн. общ. xимии. 2018. Т. 88. № 7. С. 1180 (Ivanov A.V., Bredyuk O.A., Loseva O.V. // Russ. J. Gen. Chem. 2018. V. 88. № 7. P. 1470).https://doi.org/10.1134/S1070363218070198
Бредюк О.А., Лосева О.В., Иванов А.В. и др. // Коорд. химия. 2017. Т. 43. № 10. С. 602 (Bredyuk O.A., Loseva O.V., Ivanov A.V. et al. // Russ. J. Coord. Chem. 2017. V. 43. № 10. P. 638).https://doi.org/10.1134/S1070328417100013
Бырько В.М. Дитиокарбаматы. М.: Наука, 1984. 341 с.
Ivanov A.V., Antzutkin O.N. // Top. Curr. Chem. 2005. V. 246. P. 271.
Pines A., Gibby M.G., Waugh J.S. // J. Chem. Phys. 1972. V. 56. № 4. P. 1776.
Ratcliffe C.I., Ripmeester J.A., Tse J.S. // Chem. Phys. Lett. 1983. V. 99. № 2. P. 177.
APEX2 (version 1.08), SAINT (version 7.03), SADABS (version 2.11), SHELXTL (version 6.12). Madison (WI, USA): Bruker AXS Inc., 2004.
Rodina T.A., Ivanov A.V., Gerasimenko A.V. et al. // Polyhedron. 2012. V. 40. № 1. P. 53.
Корнеева Е.В., Смоленцев А.И., Анцуткин О.Н., Иванов А.В. // Изв. АН. Сер. хим. 2019. № 1. С. 40 (Korneeva E.V., Smolentsev A.I., Antzutkin O.N., Ivanov A.V. // Russ. Chem. Bull. Int. Ed. 2019. V. 68. № 1. P. 40). https://doi.org/10.1007/s11172-019-2413-7
Лосева О.В., Родина Т.А., Иванов А.В. и др. // Коорд. химия. 2018. Т. 44. № 5. С. 303 (Loseva O.V., Rodina T.A., Ivanov A.V. et al. // Russ. J. Coord. Chem. 2018. V. 44. № 10. P. 604). https://doi.org/10.1134/S107032841810007X
Yin H.D., Li F., Wang D. // J. Coord. Chem. 2007. V. 60. № 11. P. 1133.
Гремлих Г.У. Язык спектров. Введение в интерпретацию спектров органических соединений. М.: ООО “Брукер Оптик”, 2002. 93 с.
Bondi A. // J. Phys. Chem. 1964. V. 68. № 3. P. 441.
Alcock N.W. // Adv. Inorg. Chem. Radiochem. 1972. V. 15. № 1. P. 1.
Winter M. WebElements Periodic Table of the Elements. http://www.webelements.com
Corradi A.B., Bruni S., Cariati F. et al. // Inorg. Chim. Acta. 1997. V. 254. № 1. P. 137.
Ramalingam K., Rizzoli C., Rajaraman T., Prabu M. // Main Group Met. Chem. 2016. V. 39. № 5–6. P. 175.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


