Координационная химия, 2020, T. 46, № 12, стр. 738-748
Новые пространственно экранированные бис-о-бензохиноны с электронодонорными мостиковыми группами и биядерные катехолатные комплексы трифенилсурьмы(V) на их основе
С. Ю. Бухвалова 1, Э. Р. Жиганшина 1, Т. В. Астафьева 1, М. В. Арсеньев 1, Е. В. Баранов 1, С. А. Чесноков 1, А. И. Поддельский 1, *
1 Институт металлоорганической химии РАН им. Г.А. Разуваева
Нижний Новгород, Россия
* E-mail: aip@iomc.ras.ru
Поступила в редакцию 21.05.2020
После доработки 27.05.2020
Принята к публикации 08.06.2020
Аннотация
Синтезированы и охарактеризованы новые бис-о-бензохиноны состава (3,5-Q)-6-CH2O–(CH2)n–OCH2-6-(3,5-Q) (n = 2 (L1), 4 (L2), 6 (L3)) и (3,5-Q)-6-(CH2OCH2)3-6-(3,5-Q) (L4) (3,5-Q = 3,5-ди-трет-бутил-о-бензохинон) с различными мостиковыми группами на основе диолов. Реакцией окислительного присоединения SbPh3 с данными бис-о-бензохинонами получены биядерные бис-катехолатные комплексы трифенилсурьмы(V) Ph3Sb(3,5-Cat)-6-CH2O–(CH2)n–OCH2-6-(3,5-Cat)SbPh3 (I–III соответственно) и Ph3Sb(3,5-Cat)-6-(CH2OCH2)3-6-(3,5-Cat)SbPh3 (IV) (3,5-Cat = 3,5-ди-трет-бутил-катехолат). Молекулярное строение хинонов L1–L4 и бис-катехолатного комплекса I в кристаллическом состоянии установлены методом РСА (CIF files CCDC № 1998601 (L1), 1998602 (L2), 1998603 (L3), 1998604 (L4) и 1998605 (I ∙ н-пентан)).
Сурьмаорганические соединения – интересные объекты как координационной [1–8], так и органической химии [9–14], они имеют большой потенциал применения в медицине и фармакологии благодаря своим антимикробным, антипаразитарным и противоопухолевым свойствам [15–19]. Комплексы сурьмы(V) с редокс-активными лигандами о-хинонового типа привлекают внимание исследователей не только разнообразием структур, образуемых соединениями сурьмы(V) [20], но и рядом интересных свойств. Представители данного класса соединений способны обратимо присоединять молекулярный кислород [21–26], а также связывать галогенид-анионы, могут быть использованы в качестве флуоресцентных сенсоров на фторид-анионы [27–32] и др.
Координационная химия бис-о-хинонов интенсивно развивается в последние десятилетия [33–41], однако она остается заметно менее изученной, чем химия их моноядерных аналогов [42–45]. Для синтеза пространственно экранированных бис-пирокатехинов и о-бензохинонов с высокими препаративными выходами удобными структурными блоками являются полученные нами 4,6-ди-трет-бутил-2,3-дигидроксибензальдегид [46] и 4,6-ди-трет-бутил-3-(метоксиметил)пирокатехин [47]. Данное исследование – продолжение цикла работ, посвященных синтезу и свойствам олигомерных о-бензохинонов.
В настоящей статье мы описываем синтез и строение пространственно затрудненных бис-о-бензохинонов с гибкими мостиковыми группами на основе диолов, а также получение биядерных бис-катехолатных комплексов трифенилсурьмы(V) на их основе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованные растворители очищали по стандартным методикам [48]. Полученные в [49] бис-пирокатехины окисляли до бис-о-бензохинонов по нижеуказанной методике.
Синтез (3,5-Q)-6-CH2O–(CH2)n–OCH2-6-(3,5-Q) (n = 2 (L1), 4 (L2), 6 (L3)) и (3,5-Q)-6-(CH2OCH2)3-6-(3,5-Q) (L4) (3,5-Q = 3,5-ди-трет-бутил-о-бензохинон). К раствору соответствующего бис-пирокатехина (3 ммоль) в Et2O (40 мл) при интенсивном перемешивании добавляли раствор K3Fe(CN)6 (30 ммоль) и KOH (12 ммоль) в воде (100 мл). Реакционную смесь активно перемешивали в течение 45 мин. После этого смесь промывали водой (3 × 100 мл) и экстракт сушили над безводным сульфатом натрия. Растворитель упаривали, остаток бис-о-бензохинона перекристаллизовали из гексана (15 мл).
L1 – 6,6'-(этан-1,2-диил-бис(оксиметилен))-бис-(3,5-ди-трет-бутил-о-бензохинон): желто-зеленые кристаллы, Тпл = 148–150°C, выход 1.35 г (85%).
ИК-спектр (ν, см–1): 477 сл, 518 сл, 556 сл, 573 сл, 633 сл, 640 сл, 678 сл, 695 сл, 761 сл, 787 сл, 821 сл, 843 сл, 881 с, 923 сл, 950 сл, 964 сл, 996 с, 1022 сл, 1048 с, 1092 с, 1120 с, 1177 сл, 1220 с, 1248 с, 1261 сл, 1273 сл, 1294 с, 1332 ср, 1370 сл, 1391 сл, 1416 с, 1531 сл, 1538 сл, 1574 с, 1625 с, 1667 с, 1782 сл, 1790 сл, 2748 сл, 2759 сл, 3138 сл, 3245 сл, 3566 сл. ЯМР 1H (CDCl3; 400 МГц; δ, м.д.): 1.24 (с., 18Н, t-Bu), 1.37 (c., 18H, t-Bu), 3.63 (c., 4H, O–CH2–CH2–O), 4.45 (c., 4H, CH2–O), 7.07 (с., 2H, C6H1). ЯМР 13C (100 МГц; CDCl3; δ, м.д.): 29.06, 30.03, 35.37, 38.66, 62.43, 70.03, 132.56, 137.21, 148.49, 159.69, 179.53, 182.36.
L2 – 6,6'-(бутан-1,4-диил-бис(оксиметилен))-бис-(3,5-ди-трет-бутил-о-бензохинон): кристаллы красно-зеленого цвета, Тпл = 93–95°С, выход 1.37 г (86%).
ИК-спектр (ν, см–1): 482 сл, 516 сл, 534 сл, 578 сл, 647 сл, 679 сл, 792 сл, 843 сл, 875 сл, 925 сл, 949 сл, 984 с, 1011 с, 1028 сл,1052 сл, 1064 сл, 1180 сл, 1207 сл, 1220 с, 1256 сл, 1290 сл, 1323 с, 1405 сл, 1417 сл, 1497 с, 1531 сл, 1538 сл, 1584 с,1632 с, 1668 с, 2752 с, 2881 сл, 3247 сл, 3263 сл, 3851 сл. ЯМР 1H (400 МГц; CDCl3; δ, м.д.): 1.24 (с., 18Н, t-Bu), 1.38 (c., 18H, t-Bu), 1.62 (м., 4Н, O–CH2–CH2-CH2–CH2–O), 3.46 (м., 4H, O–CH2–CH2–CH2–CH2–O), 4.38 (c., 4H, CH2–O), 7.08 (с., 2H, C6H1). 1 ЯМР 3C (100 МГц; CDCl3; δ, м.д.): 26.51, 29.08, 30.04, 35.38, 38.64, 62.16, 70.67, 132.66, 137.19, 148.49, 159.53, 179.50, 182.34.
L3 – 6,6'-(гексан-1,6-диил-бис(оксиметилен))-бис-(3,5-ди-трет-бутил-о-бензохинон): кристаллы зеленого цвета, Тпл = 116–118°С, выход 1.37 г (86%).
ИК (ν, см–1): 482 сл, 516 сл, 527 сл, 550 сл, 578 сл, 643 сл, 657 сл, 697 сл, 792 сл, 818 сл, 840 сл, 876 сл, 896 сл, 925 сл, 949 сл, 979 сл, 1001 сл, 1013 с, 1034 сл, 1052 сл, 1069 сл, 1139 сл, 1163 сл, 1185 сл, 1222 сл, 1254 с, 1291 сл, 1323 с, 1406 сл, 1419 сл, 1497 с, 1533 сл, 1539 сл, 1584 с,1630 с, 1669 с, 1846 сл, 1980 сл, 2753 с, 2881 сл, 3250 сл, 3257 сл, 3854 сл.
ЯМР 1H (400 МГц; CDCl3; δ, м.д.): 1.24 (с., 18Н, t-Bu), 1.33 (м., 4Н, O–CH2–CH2–CH2–CH2–CH2–CH2–O), 1.39 (c., 18H, t-Bu), 1.56 (м., 4Н, O–CH2–CH2–CH2–CH2–CH2–CH2–O), 3.44 (т., 3J(H,H) = 6.6 Гц, 4H, O–CH2–CH2–CH2–CH2–CH2–CH2–O), 4.38 (c., 4H, CH2–O), 7.08 (с., 2H, C6H1). ЯМР 13C (100 МГц; CDCl3; δ, м.д.): 26.03, 29.08, 29.65, 30.00, 35.37, 38.66, 62.14, 70.95, 132.70, 137.21, 148.46, 159.54, 179.50, 182.34.
L4 – 6,6'-((окси-бис(этан-2,1-диил))-бис(оксиметилен))-бис-(3,5-ди-трет-бутил-о-бензохи-нон): кристаллы темно-зеленого цвета, Тпл = 88–90°С, выход 1.40 г (88%).
ИК (ν, см–1): 478 сл, 516 сл, 551 сл, 575 сл, 633 сл, 639 сл, 679 сл, 707 сл, 731 сл, 788 сл, 817 сл, 838 сл, 871 с, 906 сл, 926 сл, 936 сл, 981 сл, 1012 сл, 1052 с, 1105 сл, 1128 сл, 1139 сл, 1166 сл, 1175 сл, 1219 сл, 1254 с, 1292 сл, 1320 с, 1348 сл, 1409 с, 1420 сл, 1495 с, 1531 сл, 1537 сл, 1582 с, 1629 с, 1666 с, 1789 сл, 1915 сл, 1998 сл, 2749 с, 2759 сл, 3253 сл, 3258 сл, 3647 сл. ЯМР 1H (400 МГц; CDCl3; δ, м.д.): 1.23 (с., 18Н, t‑Bu), 1.38 (c., 18H, t-Bu), 3.61 (с., 8H, CH2), 4.46 (c., 4H, CH2), 7.07 (с., 2H, C6H1). ЯМР 13C (50 МГц; CDCl3; δ, м.д.): 29.05, 29.98, 35.36, 38.66, 62.46, 69.98, 70.34, 132.47, 137.20, 148.49, 159.77, 179.46, 182.30.
Синтез Ph3Sb(3,5-Cat)-6-CH2O–(CH2)n–OCH2-6-(3,5-Cat)SbPh3 (n = 2 (I), 4 (II), 6 (III)) и Ph3Sb(3,5-Cat)-6-(CH2OCH2)3-6-(3,5-Cat)SbPh3 (IV) (3,5-Cat = 3,5-ди-трет-бутил-катехолат) проводили в вакуумированных ампулах в отсутствие кислорода и влаги по методике [50]. Смешивали растворы трифенилсурьмы (0.176 г, 0.5 ммоль, 15 мл толуола) и соответствующего бис-о-бензохинона (0.25 ммоль, 15 мл толуола) в толуоле при комнатной температуре. Зеленый цвет растворов по мере протекания реакции постепенно пропадал и по окончании реакции цвет раствора становился желтым. После концентрирования растворов и выдерживания их при комнатной температуре в течение 24 ч выпавшие осадоки отфильтровывали и высушивали в вакууме. Комплексы представляют собой порошки светло-желтого цвета, устойчивые на воздухе.
I – 3,3'-(этан-1,2-диил-бис(оксиметилен))-бис-((4,6-ди-трет-бутил-катехолато)трифенилсурьма(V)). Использовали 134 мг (0.38 ммоль) трифенилсурьмы и 100 мг (0.19 ммоль) хинона L1. Выход продукта в виде мелкокристаллического порошка желтого цвета составил 198 мг (85%).
ИК-спектр (ν, см–1): 3071 сл, 3055 сл, 2953 с, 2923 с, 2853 с, 1708 сл, 1638 сл, 1631 сл, 1594 сл, 1578 сл, 1552 сл, 1463 с, 1434 c, 1413 с, 1406 с, 1413 с, 1378 с, 1365 сл, 1332 сл, 1317 сл, 1293 с, 1260 ср, 1241 с, 1211 сл, 1178 сл, 1160 сл, 1098 ср, 1090 ср, 1073 ср, 1059 ср, 1031 сл, 1005 ср, 997 ср, 962 с, 924 ср, 873 сл, 863 сл, 792 сл, 785 сл, 748 с, 732 с, 693 с, 656 сл, 625 ср, 594 сл, 564 сл, 533 сл, 513 сл, 454 с. ЯМР 1Н (400 МГц; CDCl3; δ, м.д.): 1.44 (с., 18Н, 2 t-Bu), 1.45 (с., 18H, 2 t-Bu), 3.89 (с., 4H, O–CH2–CH2–O), 4.94 (с., 4H, 2 Ar–CH2–О), 6.76 (с., 2H, 2 аром. C6H1), 7.37–7.47 (с., 18H, аром. SbPh3), 7.78–7.84 (м., 12H, аром. SbPh3). ЯМР 13С (100 МГц; CDCl3; δ, м.д.): 29.62, 32.76, 34.71, 35.91, 67.05, 69.99, 112.66, 118.45, 129.06, 131.01, 132.55, 135.18, 137.55, 138.03, 142.97, 148.03.
II – 3,3'-(бутан-1,4-диил-бис(оксиметилен))-бис-((4,6-ди-трет-бутил-катехолато)трифенилсурьма(V)). Использовали 127 мг (0.36 ммоль) трифенилсурьмы и 100 мг (0.18 ммоль) хинона L2. Выход продукта в виде светло-желтого порошка составил 180 мг (80%).
ИК-спектр (ν, см–1): 3051 сл, 2954 с, 2924 с, 2854 с, 2727 сл, 1594 сл, 1578 сл, 1552 сл, 1462 с, 1434 ср, 1411 ср, 1405 ср, 1377 ср, 1366 ср, 1352 ср, 1315 сл, 1291 ср, 1262 ср, 1241 ср, 1212 сл, 1192 сл, 1181 сл, 1156 сл, 1094 ср, 1063 ср, 1023 сл, 1008 сл, 997 ср, 961 ср, 871 сл, 860 сл, 783 сл, 760 сл, 748 ср, 734 с, 693 с, 666 сл, 656 сл, 624 ср, 564 сл, 532 сл, 514 сл, 492 ср. ЯМР 1Н (400 МГц; CDCl3; δ, м.д.): 1.40 (с., 18H, 2 t-Bu), 1.41 (с., 18H, 2 t-Bu), 1.75 (м., 4H, O–CH2–CH2–CH2–CH2–O), 3.61 (т., 3J(H,H) = 5.6 Гц, 4H, 2 O–CH2–СH2–СH2–СH2–O), 4.81 (с., 4H, 2 Ar–CH2–O), 6.71 (с., 2H, 2 аром. C6H1), 7.37–7.43 (м., 18H, аром. SbPh3), 7.74–7.81 (м., 12H, аром. SbPh3). 13С ЯМР (100 МГц; CDCl3; δ, м.д.): 27.16, 29.64, 32.70, 34.69, 35.88, 66.79, 70.98, 112.58, 118.64, 129.04, 131.01, 132.42, 135.21, 137.46, 138.07, 142.99, 148.00.
III – 3,3'-(гексан-1,6-диил-бис(оксиметилен))-бис-((4,6-ди-трет-бутил-катехолато)трифенилсурьма(V)). Использовали 120 мг (0.34 ммоль) трифенилсурьмы и 100 мг (0,17 ммоль) хинона L3. Выход продукта в виде желтого порошка составил 190 мг (87%).
ИК-спектр (ν, см–1): 3579 сл, 3057 сл, 3043 сл, 2954 с, 2924 с, 2854 с, 1961 сл, 1908 сл, 1886 сл, 1819 сл, 1773 сл, 1764 сл, 1644 ср, 1590 ср, 1578 ср, 1549 ср, 1479 ср, 1462 с, 1430 с, 1416 с, 1385 ср, 1377 ср, 1362 ср, 1333 ср, 1305 сл, 1289 с, 1258 ср, 1248 ср, 1240 ср, 1210 ср, 1184 ср, 1157 сл, 1081 с, 1075 с, 1052 с, 1024 сл, 1000 с, 961 ср, 950 ср, 912 ср, 875 ср, 861 ср, 818 сл, 792 сл, 765 сл, 748 ср, 737 с, 696 с, 679 сл, 662 сл, 626 сл, 613 сл, 511 сл, 482 сл, 456 ср.
1Н ЯМР (400 МГц; CDCl3; δ, м.д.): 1.36 (м., 4H, О–CH2–CH2–CH2–CH2–CH2–CH2–О), 1.40 (c., 18H, 2 t-Bu), 1.41 (c., 18H, 2 t-Bu), 1.63 (м., 4H, О–CH2–CH2–CH2–CH2–CH2–CH2–О), 3.58 (т., 3J(H,H) = 6.8 Гц, 4H, 2 O–CH2–CH2–CH2–CH2–CH2–CH2–О), 4.81 (c., 4H, 2 Ar-CH2-O), 6.71 (c., 2H, 2 аром. C6H1), 7.39–7.46 (м., 18H, аром. SbPh3), 7.77–7.82 (м., 12H, аром. SbPh3). 13С ЯМР (100 МГц; CDCl3; δ, м.д.): 26.51, 29.63, 30.11, 32.69, 34.69, 35.89, 66.72, 71.14, 112.72, 118.57, 129.03, 131.01, 132.43, 135.24, 137.39, 138.13, 143.10, 147.81.
IV – 3,3'-(окси-бис(этан-2,1-диилоксиметилен))-бис-((4,6-ди-трет-бутилкатехолато)трифенилсурьма(V)). Использовали 123 мг (0.35 ммоль) трифенилсурьмы и 100 мг (0,175 ммоль) хинона L4. Выход продукта в виде светло-желтого порошка составил 181 мг (81%).
ИК-спектр (ν, см–1): 3070 сл, 3055 сл, 2954 с, 2925 с, 2725 сл, 1463 с, 1435 ср, 1411 с, 1403 с, 1377 с, 1304 сл, 1288 ср, 1262 ср, 1242 сл, 1210 сл, 1160 сл, 1104 сл, 1078 ср, 1063 ср, 1022 сл, 997 ср, 961 сл, 863 сл, 787 сл, 782 сл, 748 сл, 733 ср, 693 ср, 622 сл, 564 сл, 533 сл, 511 сл, 440 с. ЯМР 1Н (400 МГц; CDCl3; δ, м.д.): 1.41 (с., 18H, 2 t-Bu), 1.42 (с., 18H, t-Bu), 3.65 (т., 3J(H,H) = 5.4 Гц, 4H, (Ar–CH2–O–CH2–CH2)2O), 3.76 (т., 3J(H,H) = 5.4 Гц, 4H, (Ar–CH2–O–CH2–CH2)2O), 4.92 (с., 4H, 2 Ar–CH2–O), 6.73 (с., 2H, 2 аром. C6H1), 7.39–7.48 (м., 18H, аром. SbPh3), 7.76–7.83 (м., 12H, аром. SbPh3). 13С ЯМР (100 МГц; CDCl3; δ, м.д.): 29.60, 32.69, 34.68, 35.89, 66.98, 69.73, 70.66, 112.65, 118.29, 129.05, 131.01, 132.53, 135.18, 137.58, 138.08, 142.94, 148.01.
Спектры ЯМР 1Н и 13С регистрировали на спектрометре BrukerAvance HD-400 (частота – 400 МГц, внутренний стандарт – тетраметилсилан, растворитель CDCl3), ИК-спектры – на Фурье-ИК-спектрометре ФСН-1201 (диапазон 400–4000 см–1, вазелиновое масло). Элементный анализ (С, H, Sb) проводили пиролитическим методом с гравиметрическим окончанием.
Кристаллы L1–L4, пригодные для анализа методом РСА, получали при медленной кристаллизации из раствора в н-гексане, комплекса I – из пентана в виде сольвата I ∙ н-пентан.
РСА. Сбор дифракционных данных кристаллов соединений L1–L4 и I проводили на монокристальном рентгеновском дифрактометре Bruker D8 Quest при 100 К. Экспериментальные наборы интенсивностей (МоKα-излучение, ω- и φ-сканирование) интегрированы по программе SAINT [51]. Структуры определены “dual-space” методом с помощью программы SHELXT [52] и уточнены полноматричным методом наименьших квадратов по $F_{{hkl}}^{2}$ в анизотропном приближении для всех неводородных атомов в программном комплексе SHELXTL [53]. Атомы водорода помещены в геометрически рассчитанные положения и уточнены изотропно. Учет поглощения проведен с помощью программы SADABS [54]. Один из о-хиноновых фрагментов в L4 и одно фенильное кольцо в каждом фрагменте Ph3Sb, а также мостик ‒CH2OCH2CH2OСН2– бис-катехолата в I разупорядочены по двум положениям. Рисунки молекулярных структур были созданы с помощью программы OLEX2 [55]. В кристалле соединения I в соотношении 1 : 1 к комплексу сурьмы найдена сольватная молекула пентана, разупорядоченная по двум общим положениям. Кристаллографические данные и параметры уточнения структур L1–L4 и I приведены в табл. 1.
Таблица 1.
Основные кристаллографические данные и параметры уточнения структур L1–L4 и I
| Параметр | L1 | L2 | L3 | L4 | I ∙ н-пентан |
|---|---|---|---|---|---|
| Брутто-формула | C32H46O6 | C34H50O6 | C36H54O6 | C34H50O7 | C73H88O6Sb2 |
| M | 526.69 | 554.74 | 582.79 | 570.74 | 1304.93 |
| T, K | 100(2) | 100(2) | 100(2) | 100(2) | 100(2) |
| Сингония | Триклинная | Моноклинная | Моноклинная | Триклинная | Триклинная |
| Пр. гр. | Р1 | C2/c | C2/c | Р1 | Р1 |
| a, Å | 9.8257(7) | 24.6406(15) | 25.692(14) | 9.5388(4) | 13.1643(4) |
| b, Å | 10.8671(8) | 11.7979(7) | 12.149(7) | 9.6584(4) | 14.9533(5) |
| c, Å | 14.0510(9) | 12.2934(7) | 11.919(6) | 18.9126(8) | 19.1987(6) |
| α, град | 100.406(3) | 90 | 90 | 84.952(2) | 68.5910(11) |
| β, град | 90.075(3) | 117.2994(9) | 116.315(7) | 87.143(2) | 71.1952(11) |
| γ, град | 90.420(4) | 90 | 90 | 68.646(2) | 72.1616(11) |
| V, Å3 | 1475.60(18) | 3175.7(3) | 3335(3) | 1616.20(12) | 3253.46(18) |
| Z | 2 | 4 | 4 | 2 | 2 |
| ρ(выч.), г/см3 | 1.185 | 1.160 | 1.161 | 1.173 | 1.332 |
| μ, мм–1 | 0.080 | 0.078 | 0.077 | 0.080 | 0.881 |
| F(000) | 572 | 1208 | 1272 | 620 | 1352 |
| 2θmax, град | 50.00 | 56.00 | 46.43 | 60.33 | 58.00 |
| Число измеренных/ независимых отражений | 6882/4950 | 16 600/3835 | 10 095/2352 | 24 305/9561 | 49 462/17 210 |
| Rint | 0.0377 | 0.0302 | 0.1303 | 0.0313 | 0.0269 |
| Число уточняемых параметров | 356 | 187 | 196 | 499 | 812 |
| R1, wR2 (I > 2σ(I)) | 0.0634, 0.1550 | 0.0383, 0.0994 | 0.0694, 0.1351 | 0.0519, 0.1221 | 0.0304, 0.0674 |
| R1, wR2 (по всем данным) | 0.0805, 0.1773 | 0.0460, 0.1029 | 0.1147, 0.1493 | 0.0795, 0.1356 | 0.0441, 0.0710 |
| GOOF по F 2 | 1.068 | 1.052 | 1.071 | 1.018 | 1.007 |
| Остаточная электронная плотность (max/min), e/Å3 | 0.290/–0.335 | 0.397/–0.192 | 0.237/–0.250 | 0.346/–0.282 | 0.915/–0.516 |
Структурные данные депонированы в Кембриджском центре кристаллографических данных (CCDC № 1998601 (L1), 1998602 (L2), 1998603 (L3), 1998604 (L4) и 1998605 (I ∙ н-пентан)); deposit@ccdc.cam.ac.uk; www: http://www.ccdc.cam.ac.uk.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Окисление бис-пирокатехинов, полученных ранее по реакции переэтерификации 4,6-ди-трет-бутил-3-(метоксиметил)пирокатехина диолами (1,2-этандиол, 1,4-бутандиол, 1,6-гександиол, диэтиленгликоль), с помощью феррицианида калия в щелочной среде (схема 1 ) приводит к образованию с высокими выходами соответствующих бис-о-бензохинонов L1–L4 с гибкими CH2O–R–OCH2 мостиковыми группами на основе диолов. Биядерные комплексы трифенилсурьмы(V) I–IV синтезированы по реакции окислительного присоединения бис-о-бензохинонов к трифенилсурьме(V) (схема 1 ). Такой способ получения комплексов облегчает выделение целевых соединений, поскольку при синтезе в большинстве случаев отсутствуют побочные продукты реакции, которых не избежать при получении комплексов по реакции замещения пирокатехинов с дибромидом трифенилсурьмы(V).
Схема 1 .
Бис-о-бензохиноны L1–L4 и бис-катехолатные комплексы I–IV выделены в индивидуальном виде и охарактеризованы с помощью ИК-, ЯМР-спектроскопии и элементного анализа. Для L1–L4 и I выращены монокристаллы, пригодные для РСА, и их строение подтверждено методом РСА.
По данным ЯМР 1Н рассматриваемые молекулы являются симметричными в растворе: синглеты трет-бутильных фрагментов наблюдаются при 1.23–1.24 и 1.37–1.39 м.д. для бис-о-хинонов (при 1.40–1.44 и 1.41–1.45 м.д. для катехолатов трифенилсурьмы), синглеты групп OCH2 при шестичленном углеродном кольце при 4.38–4.46 м.д. для бис-о-хинонов и 4.81–4.94 м.д. для катехолатов трифенилсурьмы, синглеты протонов в хиноновых кольцах соединений L1–L4 проявляются при 7.07–7.08 м.д., а синглеты соответствующих протонов в ароматических кольцах катехолатных лигандов в комплексах V–VIII наблюдаются при 6.71–6.76 м.д. Данные спектроскопии ЯМР 13С также подтверждают эквивалентность хиноновых фрагментов соединений L1–L4, как и катехолатных в комплексах I–IV: в спектрах бис-о-хинонов L1–L4 наблюдаются два сигнала атомов углерода карбонильных групп при 178–183 м.д., отсутствующие в спектрах комплексов I–IV; однако в этих спектрах появляются сигналы атомов углерода в диапазоне 100–130 м.д., соответствующие атомам углерода в ароматических кольцах.
В ИК-спектрах бис-о-хинонов присутствуют характерные полосы валентных колебаний двойных связей C=O в области 1650–1680 см–1. В комплексах I–IV данные полосы отсутствуют, но наблюдается набор полос в области 1170–1300 см–1, обусловленных валентными колебаниями одинарных связей C–O катехолатных лигандов, которых нет в спектрах бис-о-хинонов. Также ИК-спектры комплексов I–IV содержат полосы в области 620–650 см–1 и Sb–O в области 440–470 см–1, соответствующие валентным колебаниям связи Sb–CPh отсутствующие в соответствующих бис-о-хинонах.
Молекулярное строение L1–L4 и I в кристаллическом состоянии показано на рис. 1–5 соответственно. Наличие гибкого мостика между хиноновыми (в L1–L4) и катехолатными фрагментами (в I–IV) позволяет ожидать как развернутой формы (когда расстояние между фрагментами на конце мостика максимально), так и компактной формы (когда расстояние между фрагментами значительно меньше максимального) молекулы в кристалле.
Рис. 1.
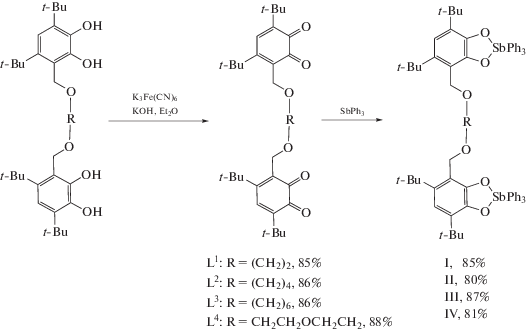
Молекулярное строение молекул А (a) и В (b) бис-о-бензохинона L1. Тепловые эллипсоиды 50%-ной вероятности. Атомы водорода не показаны. Основные длины связей и торсионный угол: в L1А – C(1)–O(1) 1.224(4), C(2)–O(2) 1.203(4), С(1)–С(2) 1.549(4), С(2)–С(3) 1.480(4), С(3)–С(4) 1.347(5), С(4)–С(5) 1.478(4), С(5)–С(6) 1.364(4), С(6)–С(1) 1.472(5), C(6)–C(15) 1.505(4), C(15)–O(3) 1.423(4), O(3)–C(16) 1.422(3), C(16)–C(16)* 1.500(7); в L1В – C(1)–O(1) 1.210(4), C(2)–O(2) 1.208(4), С(1)–С(2) 1.549(4), С(2)–С(3) 1.471(5), С(3)–С(4) 1.325(5), С(4)–С(5) 1.490(4), С(5)–С(6) 1.355(5), С(6)–С(1) 1.466(5), C(6)–C(15) 1.515(4), C(15)–O(3) 1.446(4), O(3)–C(16) 1.424(4), C(16)–C(16)* 1.520(6) Å и O(1)C(1)C(2)O(2) 2.6(5)° (L1А) и 6.3(5)° (L1В).
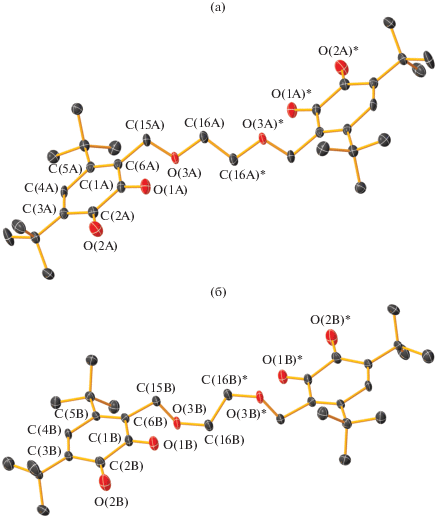
Рис. 2.
Молекулярное строение бис-о-бензохинона L2. Тепловые эллипсоиды 50%-ной вероятности. Атомы водорода не показаны. Основные длины связей и торсионный угол: C(1)–O(1) 1.2153(13), C(2)–O(2) 1.2168(12), С(1)–С(2) 1.5547(13), С(2)–С(3) 1.4713(14), С(3)–С(4) 1.3451(14), С(4)–С(5) 1.4853(13), С(5)–С(6) 1.3598(14), С(6)–С(1) 1.4768(14), C(6)–C(15) 1.5100(13), C(15)–O(3) 1.4313(12), O(3)–C(16) 1.4270(12), C(16)–C(17) 1.5174(16), C(17)–C(17)* 1.528(2) Å и O(1)C(1)C(2)O(2) 11.86(13)°.
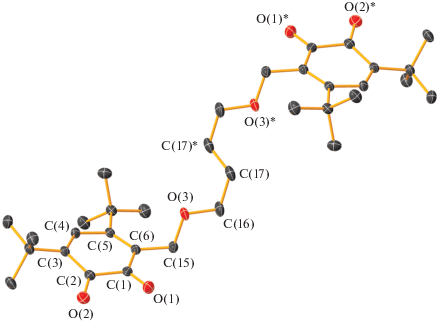
Рис. 3.
Молекулярное строение бис-о-бензохинона L3. Тепловые эллипсоиды 50%-ной вероятности. Атомы водорода не показаны. Основные длины связей и торсионный угол: C(1)–O(1) 1.210(4), C(2)–O(2) 1.205(4), С(1)–С(2) 1.517(5), С(2)–С(3) 1.461(5), С(3)–С(4) 1.337(5), С(4)–С(5) 1.470(5), С(5)–С(6) 1.342(5), С(6)–С(1) 1.458(5), C(6)–C(15) 1.476(5), C(15)–O(3) 1.409(4), O(3)–C(16) 1.421(4), C(16)–C(17) 1.489(5), C(17)–C(18) 1.513(5), C(18)–C(18)* 1.493(7) Å и O(1)C(1)C(2)O(2) 12.7(5)°.
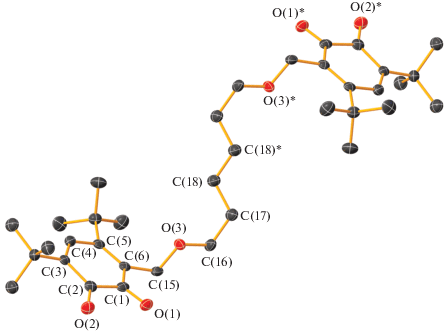
Рис. 4.
Молекулярное строение бис-о-бензохинона L4. Тепловые эллипсоиды 50%-ной вероятности. Атомы водорода не показаны. Основные длины связей и торсионные углы: C(1)–O(1) 1.2164(14), C(2)–O(2) 1.2145(14), С(1)–С(2) 1.5479(16), С(2)–С(3) 1.4731(15), С(3)–С(4) 1.3459(15), С(4)–С(5) 1.4822(15), С(5)–С(6) 1.3641(16), С(6)–С(1) 1.4751(16), C(6)–C(15) 1.5061(15), C(15)–O(3) 1.4256(14), O(3)–C(16) 1.4228(13), C(16)–C(17) 1.5002(17), C(17)–O(4) 1.4122(14), O(4)–C(18) 1.4204(15), C(18)–C(19) 1.4981(18), C(19)–O(5) 1.4248(15), O(5)–C(20) 1.4216(15), C(20)–C(21) 1.5092(18), C(21)–C(22) 1.335(5), C(22)–C(23) 1.478(5), C(23)–C(24) 1.304(4), C(24)–C(25) 1.490(3), C(25)–C(26) 1.565(3), C(26)–C(21) 1.4668(19), O(6)–C(25) 1.223(3), O(7)–C(26) 1.2135(17) Å и O(1)C(1)C(2)O(2) 6.5(2)°, O(6)C(25)C(26)O(7) 1.9(4)°.
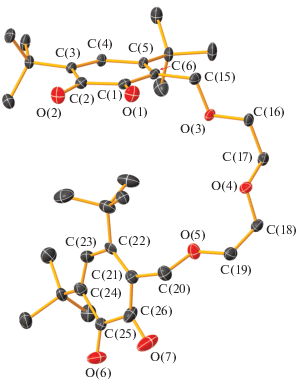
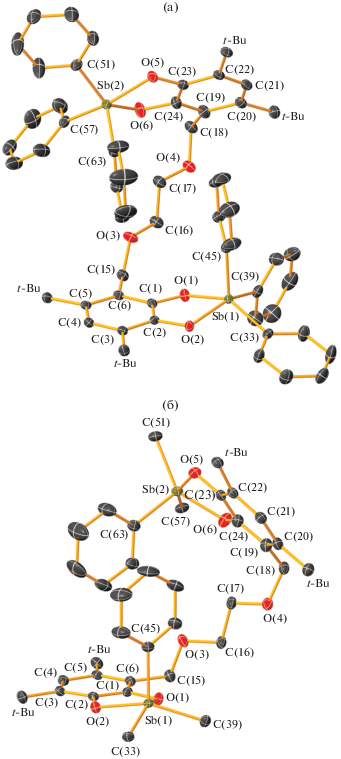
Рис. 5.
Молекулярное строение бис-катехолата трифенилсурьмы(V) I ∙ н-пентан с разных сторон (a, б). Тепловые эллипсоиды 50%-ной вероятности. Атомы водорода не показаны, t-Bu – трет-бутильные заместители. На рис. 5б не показаны атомы углерода четырех фенильных групп (кроме атомов C(33), C(39), C(51) и C(57), связанных с центральным атомом сурьмы). Основные длины связей и валентные углы: Sb(1)–O(1) 2.0196(13), Sb(1)–O(2) 2.0453(13), Sb(1)–C(33) 2.1416(19), Sb(1)–C(39) 2.139(2), Sb(1)–C(45) 2.093(4), Sb(2)–O(5) 2.0417(13), Sb(2)–O(6) 2.0150(15), Sb(2)–C(51) 2.135(2), Sb(2)–C(57) 2.140(4), Sb(2)–C(63) 2.102(2), O(1)–C(1) 1.359(2), O(2)–C(2) 1.364(2), O(3)–C(16) 1.430(2), O(3)–C(15) 1.435(2), O(4)–C(17) 1.423(2), O(4)–C(18) 1.430(2), O(5)–C(23) 1.357(2), O(6)–C(24) 1.369(2), C(1)–C(2) 1.397(3), C(1)–C(6) 1.392(3), C(2)–C(3) 1.393(3), C(3)–C(4) 1.403(3), C(4)–C(5) 1.398(3), C(5)–C(6) 1.408(3), C(6)–C(15) 1.507(3), C(16)–C(17) 1.510(3), C(18)–C(19) 1.526(3), C(19)–C(24) 1.400(3), C(19)–C(20) 1.418(3), C(20)–C(21) 1.390(3), C(21)–C(22) 1.398(3), C(22)–C(23) 1.392(3), C(23)–C(24) 1.396(3) Å и O(1)Sb(1)C(33) 147.74(7)°, O(2)Sb(1)C(39) 149.67(7)°, O(5)Sb(2)C(57) 156.9(3)°, O(6)Sb(2)C(51) 142.98(7)°.
По данным РСА обнаружено, что в кристаллической ячейке бис-о-хинона L1 находятся две независимые молекулы (рис. 1a и 1б), отличающиеся геометрией мостика –CH2OCH2CH2OСН2– между о-хиноновыми фрагментами. Обе эти молекулы симметричны с центром инверсии в середине связей С(16А)–С(16А)* и С(16В)–С(16B)* соответственно. В отличие от соединения L1 в L2–L4 кристаллическая ячейка содержит только одну независимую молекулу. Молекулы соединений L2 и L3 (рис. 2 и 3) симметричны с центром инверсии в середине связей С(17)–С(17)* и С(18)–С(18)* соответственно. Молекула соединения L4 (рис. 4) симметрией не обладает. Геометрические характеристики редокс-активных фрагментов в L1–L4 соответствуют значениям, характерным для о-хинонов [46, 47, 50, 56] (С–О (1.203(4)–1.224(4) Å) и С–С в шестичленных циклах (1.304(4)–1.364(4) и 1.458(5)–1.565(3) Å) (табл. 1). В соединениях L1–L4 хиноновые фрагменты неплоские: атомы С(1)–С(6) выходят из плоскости на расстояния 0.004–0.189 Å, атомы О(1) и О(2) – на 0.053–0.451 Å. Расстояния между хиноновыми фрагментами (для расчета были взяты центроиды между атомами углерода хинонового кольца и атомами кислорода соответствующих карбонильных групп) планомерно увеличивается при увеличении длины мостика и составляет 10.22(1) Å (А) и 10.67(1) Å (В), 12.35(1) Å, 13.44(1) Å для соединений L1–L3 соответственно. В отличие от соединений L1–L3 молекула L4 имеет свернутую конформацию вследствие реализации внутримолекулярного π…H-взаимодействия между хиноновым кольцом С(1–6) и атомом водорода заместителя t-Bu при атоме С(22). Двугранный угол между о-хиноновыми плоскостями составляет 81.6°, а расстояние между центрами хиноновых фрагментов – 7.83(2) Å.
В отличие от исходного L1, в молекуле которого о-хиноновые фрагменты максимально отдалены друг от друга, в молекуле комплекса I (рис. 5) бис-катехолатный лиганд имеет свернутую конформацию аналогично молекуле L4. Расстояние между центрами катехолатных фрагментов составляет 8.24(1) Å, что значительно меньше, чем в L1. Вероятно, это обусловлено наличием внутримолекулярных π–π- и H–π-взаимодействий между PhC(45)…PhC(63) и PhC(45)–H…CatC(19–24), PhC(63)–H…CatC(1–6) соответственно. Атомы кислорода О(1,2) и О(5,6) катехолатных фрагментов направлены в противоположные стороны, угол разворота составляет ~164°. Двугранный угол между плоскостями О(1,2)С(1–6) и О(5,6)С(19–24) составляет ~54°.
Оба атома сурьмы имеют искаженную тетрагонально-пирамидальную геометрию; для Sb(1) и Sb(2) τ = 0.03 и 0.17 соответственно (τ = 0 для идеальной тетрагональной пирамиды и τ = 1 для идеальной тригональной бипирамиды [57]). В металлоцикле, содержащем атом Sb(1), атомы кислорода O(1) и O(2) катехолатного фрагмента и атомы углерода C(33) и C(39) двух фенильных групп лежат в основании пирамиды, а углерод C(45) третьей фенильной группы занимает апикальное положение. Апикальная связь Sb–C короче, чем экваториальные на 0.046 и 0.049 Å соответственно. Атом сурьмы выходит из плоскости основания пирамиды на 0.529 Å, углы между экваториальными и аксиальным заместителями лежат в интервале 99.1(2)°–110.0(2)°. Связи Sb–O(Cat) дифференцированы незначительно, связь Sb(1)–O(1) короче Sb(1)–O(2) на 0.026 Å. В металлоцикле, содержащем атом Sb(2), атомы кислорода O(5) и O(6) катехолатного фрагмента и атомы углерода C(51) и C(57) двух фенильных групп лежат в основании пирамиды, а углерод C(63) третьей фенильной группы занимает апикальное положение. Апикальная связь Sb–C короче, чем экваториальные на 0.033 и 0.038 Å. Атом сурьмы выходит из плоскости основания пирамиды на 0.496 Å, углы между экваториальными и аксиальным заместителями лежат в интервале значений 96.77(7)°–108.01(8)°. Связь Sb(2)–O(6) на 0.027 Å короче Sb(2)–O(5).
Пятичленные металлоциклы в обоих случаях неплоские. Угол перегиба по линии О…О по отношению к плоскости катехолатного лиганда составляет 15.0° для цикла, содержащего атом Sb(1), и 17.5° – для цикла, содержащего Sb(2).
Геометрические характеристики редокс-активных фрагментов (С–О (1.357(2)–1.369(2) Å) и С–С в шестичленных циклах (1.390(3)–1.418(3) Å) соответствуют значениям, характерным для катехолатных комплексов [50, 58–66].
Таким образом, синтезированы и охарактеризованы новые бис-о-бензохиноны с мостиковыми группами –CH2–O(CH2)nO–CH2– (n = 2, 4, 6) и –CH2–O(CH2)2O(CH2)2O–CH2– между хиноновыми фрагментами. На их основе получены новые биядерные катехолатные комплексы трифенилсурьмы(V). Молекулярное строение всех бис-о-бензохинонов и одного биядерного бис-катехолатного комплекса трифенилсурьмы(V) Ph3Sb(3,5-Cat)-6-CH2O–(CH2)2–OCH2-6-(3,5-Cat)SbPh3 в кристаллическом состоянии установлено с помощью РСА. В отличие от исходного бис-о-бензохинона молекула бис-катехолата трифенилсурьмы находится в свернутой конформации, атомы кислорода катехолатных фрагментов направлены в противоположные стороны вследствие внутримолекулярных π–π- и H–π-взаимодействий.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Levason W., Reid G. Comprehensive Coordination Chemistry II / Eds. McCleverty J.A., Meyer T.J. Elsevier, 2003. P. 465.
Jones C. // Coord. Chem. Rev. 2001. V. 215. P. 151.
Shiragami T., Matsumoto J., Inoue H., Yasuda M. // J. Photochem. Photobiol. C. 2005. V. 6. P. 227.
Lo Y.-H., Gabbaï F.P. // Organometalics. 2018. V. 37. № 15. P. 2500.
You D., Yang H., Sen S., Gabbaï F.P. // J. Am. Chem. Soc. 2018. V. 140. № 30. P. 9644.
Jones J.S., Gabbaï F.P. // Chem. Eur. J. 2017. V. 23. № 5. P. 1136.
Jones J.S., Gabbaï F.P. // Acc. Chem. Rev. 2016. V. 49. P. 857.
Liu R.-C., Ma Y.-Q., Yu L. et al. // Appl. Organomet. Chem. 2003. V. 17. P. 662.
You D., Smith J.E., Sen S., Gabbaï F.P. // Organometallics. 2020. Articles ASAP. https://doi.org/10.1021/acs.organomet.0c00193
Sen S., Ke I.-Sh., Gabbaï F.P. // Organometallics. 2017. V. 36. № 21. P. 4224.
You D., Gabbaï F.P. // J. Am. Chem. Soc. 2017. V. 139. № 20. P. 6843.
Pan B., Gabbaï F.P. // J. Am. Chem. Soc. 2014. V. 136. № 27. P. 9564.
Huang Y. // Acc. Chem. Res. 1992. V. 25. P. 182.
Finet J.P. Ligand Coupling Reactions with Heteroatomic Compounds. N.Y.: Pergamon, 1998.
Hadjikakou S.K., Ozturk I.I., Banti C.N. et al. // J. Inorg. Biochem. 2015. V. 153. P. 293.
Reglinski J. // The Chemistry of Arsenic, Antimony and Bismuth / Ed. Norman N.C. London: Blackie, 1998.
Wormser U., Nir I. // Chemistry of Organic Arsenic, Antimony and Bismuth Compounds / Ed. Patai S. Wiley, New York, 1994. P. 715.
Ge R., Sun H. // Acc. Chem. Res. 2007. V. 40. P. 267.
Sharma P., Perez D., Cabrera A. et al. // Acta Pharmacol. Sin. 2008. V. 29. № 8. P. 881.
Poddel’sky A.I. // Antimony: Characteristics, Compounds and Applications / Ed. Razeghi M. N.Y.: Nova Science Publishers, 2012. P. 271.
Abakumov G. A., Poddel’sky A. I., Grunova E. V. et al. // Angew. Chem. Int. Ed. 2005. V. 44. P. 2767.
Cherkasov V. K., Abakumov G.A., Grunova E.V. et al. // Chem. Eur. J. 2006. V. 12. № 14. P. 3916.
Poddel’sky A.I., Smolyaninov I.V., Kurskii Yu.A. et al. // J. Organomet. Chem. 2010. V. 695. № 8. P. 1215.
Poddel’sky A.I., Kurskii Yu.A., Piskunov A.V. et al. // Appl. Organomet. Chem. 2011. V. 25. № 3. P. 180.
Fukin G.K., Baranov E.V., Jelsch C. et al. // J. Phys. Chem. A. 2011. V. 115. № 29. P. 8271.
Fukin G.K., Baranov E.V., Poddel’sky A.I. et al. // Chem. Phys. Chem. 2012. V. 13. № 17. P. 3773.
Kumar A., Yang M., Kim M. et al. // Organometallics. 2017. V. 36. № 24. P. 4901.
Christianson A.M., Gabbaï F.P. et al. // Organometallics. 2017. V. 36. № 16. P. 3013.
Christianson A.M., Rivard E., Gabbaï F.P. // Organometallics. 2017. V. 36. № 14. P. 2670.
Hirai M., Gabbaï F. P. // Angew. Chem. Int. Ed. 2015. V. 54. P. 1205.
Chen C.-H., Gabbaï F.P. // Angew. Chem. Int. Ed. 2017. V. 56. P. 1799.
Wade C.R., Ke I.-S., Gabbaï F.P. // Angew. Chem. Int. Ed. 2012. V. 51. P. 478.
Абакумов Г.А., Неводчиков В. И., Дружков Н.О. и др. // Изв. АН. Сер. хим. 1997. № 4. С. 804 (Abakumov G.A., Nevodchikov V.I., Druzhkov N.O. et al. // Russ. Chem. Bull. V. 46 № 4. P. 771). https://doi.org/10.1007/BF02495211
Bencini A., Daul C. A., Dei A. et al. // Inorg. Chem. 2001. V. 40. № 7. P. 1582.
Shultz D.A. // Comment. Inorg. Chem. 2002. V. 23. P. 1.
Пискунов А.В, Черкасов В.К., Дружков Н.О. и др. // Изв. АН. Сер. хим. 2005. Т. 54. № 7. С. 1580 (Piskunov A.V., Cherkasov V.K., Druzhkov N.O. et al. // Russ. Chem. Bull. 2005. V. 54. № 7. P. 1627). https://doi.org/10.1007/s11172-006-0014-8
Poddel’sky A.I., Piskunov A.V., Druzhkov N.O. et al. // Z. Anorg. Allg. Chem. 2009. V. 635. P. 2563.
Arsenyev M.V., Astaf’eva T.V., Baranov E.V. et al. // Mendeleev Commun. 2018. V. 28. P. 76.
Куропатов В.А., Клементьева С.В., Поддельский А.И. и др. // Изв. АН. Сер. хим. 2010. № 9. С. 1652 (Kuropatov V.A., Klementieva S.V., Poddel’sky A.I. et al. // Russ. Chem. Bull. 2010. V. 59. P. 1698). https://doi.org/10.1007/s11172-010-0299-5
Поддельский А.И., Смолянинов И.В., Вавилина Н.Н. и др. // Коорд. химия. 2012. Т. 38. № 4. С. 296 (Poddel’sky A.I., Smolyaninov I.V., Vavilina N.N. et al. // Russ. J. Coord. Chem. 2012. V. 38. P. 284). https://doi.org/10.1134/S1070328412040094
Арсеньев М.В., Охлопкова Л.С., Поддельский А.И. и др. // Коорд. химия. 2018. Т. 44. № 1. С. 71 (Arsen’ev M.V., Okhlopkova L.S., Poddel’skii A.I. et al. // Russ. J. Coord. Chem. 2018. V. 44. P. 162). https://doi.org/10.1134/S1070328418020021
Pierpont C.G. // Coord. Chem. Rev. 2001 V. 216–217. P. 99.
Pierpont C.G. // Coord. Chem. Rev. 2001 V. 219–221. P. 415.
Zanello P., Corsini M. // Coord. Chem. Rev. 2006. V. 250. P. 2000.
Бубнов М.П., Пискунов А.В., Золотухин А.А. и др. // Коорд. химия. 2020. Т. 46. № 4. С. 204 (Bubnov M.P., Piskunov A.V., Zolotukhin A.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 4. P. 224). https://doi.org/10.1134/S107032842003001X
Arsenyev M.V., Baranov E.V., Shurygina M.P. et al. // Mendeleev Commun. 2016. V. 26. P. 552.
Arsenyev M.V., Baranov E.V., Fedorov A.Yu. et al. // Mendeleev Commun. 2015. V. 25. P. 312.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. С. 437.
Zhiganshina E.R., Arsenyev M.V., Shavyrin A.S. et al. // Mendeleev Commun. 2019. V. 29. P. 91.
Poddel’sky A.I., Arsenyev M.V., Astaf’eva T.V. et al. // J. Organomet. Chem. 2017. V. 835. P. 17.
SAINT. Data Reduction and Correction Program. Version 8.38A. Madison (WI, USA): Bruker AXS, 2017.
Sheldrick G.M. // Acta Crystallog. A. 2015. V. 71. P. 3.
Sheldrick G.M. SHELXTL. Version 6.14. Structure Determination Software Suite. Madison (WI, USA): Bruker AXS, 2003.
Sheldrick G.M. SADABS. Version 2012/1. Bruker/Siemens Area Detector Absorption Correction Program. Madison (WI, USA): Bruker AXS, 2012.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339.
Абакумов Г.А., Черкасов В.К., Кочерова Т.Н. и др. // Изв. АН. Сер. химия. 2007. № 9. С. 1786 (Abakumov G.A., Cherkasov V.K., Kocherova T.N. et al. // Russ. Chem. Bull. 2007. V. 56. P. 1849).https://doi.org/10.1007/s11172-007-0287-6
Addison A.W., Rao T.N., Reedijk J. et al. // Dalton Trans. 1984. P. 1349.
Brown S.N. // Inorg. Chem. 2012. V. 51. P. 1251.
Poddel’sky A.I., Baranov E.V., Fukin G.K. et al. // J. Organomet. Chem. 2013. V. 733. P. 44.
Poddel’sky A.I., Smolyaninov I.V., Berberova N.T. et al. // J. Organomet. Chem. 2015. V. 789–790. P. 8.
Poddel’sky A.I., Smolyaninov I.V., Fukin G.K. et al. // J. Organomet. Chem. 2016. V. 824. P. 1.
Poddel’sky A.I., Astaf’eva T.V., Smolyaninov I.V. et al. // J. Organometal. Chem. 2018. V. 873. P. 57.
Poddel’sky A.I., Smolyaninov I.V., Fukin G.K. et al. // J. Organometal. Chem. 2018. V. 867. P. 238.
Okhlopkova L.S., Poddel’sky A.I., Smolyaninov I.V. et al. // J. Organometal. Chem. 2019. V. 897. P. 32.
Охлопкова Л.С., Смолянинов И.В., Баранов E.В., Поддельский А.И. // Коорд. химия. 2020. Т. 46. № 7. С. 410 (Okhlopkova L.S., Smolyaninov I.V, Baranov E.V., Poddel’sky A.I. // Russ. J. Coord. Chem. 2020. V. 46. P. 466). https://doi.org/10.1134/S1070328420060081
Поддельский А.И., Охлопкова Л.С., Мещерякова И.Н. и др. // Коорд. химия. 2019. Т. 45. № 2. С. 120 (Poddel’skii A.I., Okhlopkova L.S., Meshcheryakova I.N. et al. // Russ. J. Coord. Chem. 2019. V. 45. P. 133). https://doi.org/10.1134/S1070328419010093
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия