Координационная химия, 2020, T. 46, № 12, стр. 715-722
Моноядерные комплексы Cu(II), Zn(II), Co(II) с анионами 2-фуранкарбоновой кислоты и 2,2'-Bpy: синтез, строение и биологическая активность
И. А. Луценко 1, *, Д. С. Ямбулатов 1, М. А. Кискин 1, Ю. В. Нелюбина 2, П. В. Примаков 2, О. Б. Беккер 3, А. А. Сидоров 1, И. Л. Еременко 1
1 Институт общей и неорганической химии им. Н.С. Курнакова PAH
Москва, Россия
2 Институт элементорганических соединений им. А.Н. Несмеянова PAH
Москва, Россия
3 Институт общей генетики им. Н.И. Вавилова PAH
Москва, Россия
* E-mail: irinalu05@rambler.ru
Поступила в редакцию 01.04.2020
После доработки 08.04.2020
Принята к публикации 22.04.2020
Аннотация
Взаимодействием ацетатов меди(II) и цинка(II) с анионами 2-фуранкарбоновой кислоты (HFur) и 2,2'-бипиридином (Bpy) в ацетонитриле получены моноядерные комплексы состава [М(Fur)2(Bpy)- (H2O)] (М = Cu (I), Zn (II)). В аналогичной реакции с использованием ZnCl2 вместо Zn(OAc)2 · 2H2O получен комплекс [Zn(Fur)2(Bpy)] (III). Комплекс кобальта(II) [Co(Fur)2(Bpy)] (IV) получен в реакции триметилацетата кобальта, HFur и Bpy. Строение моноядерных комплексов определено методом РСА (CIF files CCDC № 1993168 (I), 1993169 (II), 1993170 (III), 1993171 (IV)). Изучена биологическая активность in vitro для I, III и IV в отношении непатогенного микобактериального штамма Mycolicibacterium smegmatis. Установлено, что I и III проявляют высокую биологическую активность и перспективны для дальнейших исследований на противотуберкулезную активность.
Известно, что в медицинской практике зачастую применяются лекарственные препараты, в состав которых входят координационные соединения различных ионов металлов [1–4]. Так, при лечении онкологических заболеваний применяют лекарства на основе производных ионов платины(II) (например, цис-платин и его аналоги), а в случае лечения анемии применяются производные железа. Существует большое количество лекарственных препаратов с ионами цинка, ртути, серебра и других металлов, обладающих различными антисептическими свойствами [4, 5]. Поэтому использование комплексов металлов в качестве компонентов лекарств нельзя назвать необычным.
Одно из направлений развития противотуберкулезных исследований связано с поиском новых биологически активных молекул для решения проблемы резистентности Mycobacterium tuberculosis при лечении одного из опасных заболеваний человечества – туберкулеза [6]. Развитие перекрестной лекарственной устойчивости наряду с ростом природной устойчивости микобактерий (МБТ) к антибиотикам, распространение популяции бактерий в дормантном (спящем) состоянии, а также вич-ассоциированной разновидности туберкулеза создает глобальную проблему для терапии этого заболевания. На сегодняшний день общепризнано, что использование в медицинской химии комплексных соединений металлов создает предпосылки для решения многих проблем, связанных с созданием лекарственных препаратов. Например, такой подход (цис-платин, ауранофин, карбоплатин, нитропруссид, сульфадиазин серебра) уже показал свою эффективность в лечении рака, малярии, токсоплазмоза и других опасных заболеваний [7–15]. На роль высокоэффективных противотуберкулезных препаратов могут претендовать комплексы с эссенциальными металлами и фармацевтические композиции на их основе. Как известно, одним из факторов, от которых зависит выживаемость и реактивация дормантных микобактерий, является состояние их редокс-гомеостаза, зависящее от внутриклеточной концентрации ионов переходных металлов – Co2+, Ni2+, Mn2+, Fe3+, Zn2+, Cu2+ и др. Металлы в живых организмах входят в состав разнообразных ферментативных систем (пе-роксидазы, амилазы, дегидрогеназы) и выполняют важнейшие регуляторные функции (транспорт кислорода, окислительно-восстановительные) [16]. Это означает, что конструируемые координационные соединения представляют интерес как объекты изучения активности против мультирезистентных, чувствительных штаммов МБТ, а также дормантных и латентных микобактерий. К числу перспективных органических молекул относится 2-фуранкарбоновая кислота (пирослизевая, HFur) и ее производные, являющиеся основой ряда антибактериальных препаратов – фуразолидона, фурадонина, хинифурила и др. В частности, производные 5-нитро-2-фуранкарбоновой кислоты являются ингибиторами фермента изоцитрат-лиазы, чем, возможно, и объясняется механизм их противотуберкулезной активности [17]. Недавно S. Melnic и коллегами было показано, что гетерометаллические треугольные {Fe2Co}-комплексы c анионами 2-фуранкарбоновой кислоты проявляют активность in vitro против Mycobacterium tuberculosis H37Rv [18]. Ранее мы получили комплексы цинка c пиридином и 4-фенилпиридином, которые проявляют эффективность in vitro против непатогенного модельного для M. tuberculosis штамма M. smegmatis [19]. Настоящая работа продолжает поиск эффективных комплексов d-металлов на основе HFur и N-донорных лигандов. В этом сообщении приведены результаты по синтезу моноядерных фуроатных комплексов Cu2+, Zn2+ и Co2+ с 2,2'-бипиридином (Bpy), определению их строения и установлению биологической активности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез комплексов проводили с использованием коммерческих реагентов и растворителей без дополнительной очистки: цинк(II) ацетат дигидрат (98%, Acros), хлорид цинка (98% Alfa Aesar), медь(II) ацетат моногидрат (95%, Acros), 2-фуранкарбоновая кислота (Acros), ацетонитрил (“ос. ч.”, Химмед), 2,2'-бипиридин (Alfa Aesar). Безводный триметилацетат кобальта(II) получали из пивалиновой кислоты (HPiv, Acros) и ацетата кобальта(II) тетрагидрата (98%, Acros).
ИК-спектры соединений регистрировали на ИК-спектрофотометре с Фурье преобразованием Perkin-Elmer Spectrum 65 методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 400–4000 см–1.
Элементный анализ выполняли на автоматическом С,H,N-анализаторе Carlo Erba EA 1108.
Биологическую активность определяли в тест-системе M. smegmatis mc2 155 методом бумажных дисков. Фиксировали величину зоны подавления роста штамма, засеянного газоном на агаризованной среде, вокруг бумажных дисков, содержащих вещество в различных концентрациях. Бактерии, смытые с чашек Петри со средой Триптон-соевый агар М-290 (Himedia), выращивали в течение ночи в жидкой среде Lemco-TW (Lab Lemco’ Powder 5 g L–1 (Oxoid), Peptone special 5 g L–1 (Oxoid), NaCl 5 g L–1, Tween-80) при 37°С до среднелогарифмической фазы роста при оптической плотности OD600 = 1.5 и смешивали с расплавленной агаризованной средой М-290 в соотношении 1 : 9 : 10 (культура : Lemco-TW : М-290). Культуру инкубировали в течение 24 ч при 37°С. Минимальной ингибирующей концентрацией (MИК) считали концентрацию вещества, при которой зона подавления роста минимальна.
Синтез [Cu(Fur)2(Bpy)(H2O)] (I). Навески Сu(OAc)2 · H2O (0.182 г, 1 ммоль) и HFur (0.224 г, 2 ммоль) растворяли в 40 мл MeCN. К полученной суспензии добавляли Bpy (0.156 мг, 1 ммоль) и выдерживали реакционную смесь при 70°С в течение 3 ч. Полученный синий раствор отфильтровывали и концентрировали до объема 20 мл. Через сутки образовывались призматические кристаллы синего цвета, которые отделяли от маточного раствора декантацией, промывали MeCN и сушили на воздухе. Выход I 0.37 г (80%).
ИК (ν, см–1): 3360 у.сл, 3134 сл, 3120 сл, 3079 сл, 3060 сл, 3023 о.сл, 1695 у.сл, 1601 ср, 1568 о.с, 1495 ср, 1481 с, 1474 о.с, 1447 сл, 1385 о.с, 1370 о.с, 1356 о.с, 1322 о.сл, 1286 сл, 1258 сл, 1257 сл, 1225 ср, 1172 ср, 1187 о.с, 1137 ср, 1126 сл, 1075 ср, 106 ср, 1032 о.сл, 1019 о.с, 1007 о.с, 928 с, 896 о.сл, 883 с, 853 сл, 812 ср, 782 с, 766 о.с, 731 ср, 663 сл, 650 сл, 598 у.ср, 547 у.ср, 468 с.
Синтез [Zn(Fur)2(Bpy)(H2O)] (II). Навески Zn(OAc)2 · 2H2O (0.219 г, 1 ммоль) и HFur (0.224 г, 2 ммоль) растворяли в 40 мл MeCN. К полученной суспензии добавляли Bpy (0.156 мг, 1 ммоль) и выдерживали реакционную смесь при 70°С в течение 3 ч. Полученный бесцветный раствор отфильтровывали и концентрировали до объема 20 мл. Через сутки образовывались прозрачные игольчатые кристаллы, которые отделяли от маточного раствора декантацией, промывали MeCN и высушивали на воздухе. Выход II 0.32 г (70%).
ИК (ν, см–1): 3156 сл, 3114 сл, 3077 сл, 3058 сл, 3023 о.сл, 1634 сл, 1596 о.с, 1547 о.с, 1474 о.с, 1444 ср, 1418 о.с, 1399 о.с, 1318 ср, 1256 сл, 1229 ср, 1178 с, 1159 сл, 1072 ср, 1056 сл, 1026 ср, 1010 с, 930 ср, 904 сл, 884 ср, 861 сл, 789 с, 771 о.с, 734 у.с, 651 ср, 634 ср, 615 с, 599 с, 546 сл.
Синтез [Zn(Fur)2(Bpy)] (III). Навески безводного ZnCl2 (0.136 г, 1 ммоль), натриевую соль HFur (0.268 г, 2 ммоль) и Bpy (0.156 г, 1 ммоль) растворяли в 40 мл MeCN. Образовавшуюся суспензию перемешивали 24 ч при комнатной температуре. Далее реакционную смесь отфильтровывали и концентрировали до объема 10 мл при нагревании (70°C). Полученный раствор выдерживали при комнатной температуре. Образовавшиеся бесцветные игольчатые кристаллы отделяли от маточного раствора декантацией, промывали MeCN и высушивали на воздухе. Выход III 0.33 г (74%).
ИК (ν, см–1): 3105 сл, 3073 сл, 1596 с, 1575 ср, 1550 ср, 1473 с, 1443 с, 1420 с, 1400 ср, 1361 ср, 1318 ср, 1252 сл, 1229 сл, 1192 ср, 1177 ср, 1157 ср, 1138 ср, 1100 сл, 1071 сл, 1057 ср, 1026 ср, 1010 с, 976 сл, 930 ср, 904 сл, 884 сл, 884 сл, 818 с, 792 с, 769 оч.с, 732 с, 657 ср, 650 ср, 635 ср, 615 ср, 599 ср, 479 ср, 439 сл, 432 сл, 414 с.
Синтез [Co(Fur)2(Bpy)] (IV). В стеклянную ампулу помещали навески триметилацетата (пивалата) кобальта (0.261 г, 1.0 ммоль), HFur (0.224 г, 2.0 ммоль), Bpy (0.156 г, 1.0 ммоль) и конденсировали ацетонитрил (40 мл). Ампулу вакуумировали, запаивали и грели на масляной бане при температуре 120°C в течение 2 ч. Образующийся продукт кристаллизуется из раствора на стенках ампулы в виде фиолетовых кристаллов в форме параллелепипедов. Выход IV 0.43 г (98%).
ИК (ν, см–1): 3112 сл, 1588 ср, 1539 ср, 1473 с, 1445 ср, 1422 о.с, 1367 с, 1316 ср, 1230 сл, 1194 ср, 1177 сл, 1158 сл, 1070 сл, 1056 сл, 1025 сл, 1009 с, 930 ср, 903 ср, 884 сл, 857 сл, 816 с, 791 с, 777 о. с, 769 о.с, 735 с, 651 сл, 635 сл, 615 ср, 599 ср, 531 сл, 480 с, 450 сл, 415 ср.
РСА комплексов I–IV проведен на дифрактометре Bruker APEX2 CCD (графитовый монохроматор, ω-сканирование) с использованием CuKα-излучения (для I, II, IV) и MoKα-излучения (для III). Структуры расшифрованы с использованием программы ShelXT [20] и уточнены МНК в анизотропном полноматричном приближении по $F_{{hkl}}^{{\text{2}}}$ по программе Olex2 [21]. Атомы водорода молекул воды в комплексах I и II локализованы из разностных Фурье-синтезов электронной плотности, тогда как положения остальных атомов водорода рассчитаны геометрически. Все атомы водорода затем уточнены в изотропном приближении по модели наездника. Кристаллографические данные и параметры уточнения комплексов представлены в табл. 1, основные длины связей – в табл. 2.
Таблица 1.
Кристаллографические данные и параметры уточнения комплексов I–IV
| Параметр | Значение | |||
|---|---|---|---|---|
| I | II | III | IV | |
| М | 459.90 | 461.72 | 443.739 | 437.26 |
| T, K | 120 | 120 | 120 | 120 |
| Сингония | Моноклинная | Моноклинная | Моноклинная | Моноклинная |
| Пр. гр. | P21/c | P21/c | P21/n | P21/n |
| Z | 4 | 4 | 4 | 4 |
| a, Å | 6.935(3) | 6.7989(5) | 7.1783(2) | 7.2429(6) |
| b, Å | 16.746(7) | 16.9370(14) | 15.9764(3) | 16.1854(12) |
| c, Å | 16.422(7) | 16.2927(12) | 15.9478(3) | 16.0247(12) |
| β, град | 97.448(10) | 96.063(2) | 97.015(1) | 96.535(3) |
| V, Å3 | 1891.1(14) | 1865.7(2) | 1815.26(7) | 1866.4(3) |
| ρ(выч.), г см–3 | 1.6152 | 1.644 | 1.624 | 1.556 |
| μ, см–1 | 12.03 | 13.65 | 22.63 | 9.10 |
| F(000) | 942 | 944 | 901 | 892 |
| 2θmax, град | 60 | 50.5 | 135 | 60 |
| Число измеренных отражений | 10 605 | 142 89 | 24 797 | 18 002 |
| Число независимых отражений (Rint) | 5527 (0.696) | 4489 (0.0692) | 3199 (0.0905) | 4121 (0.1218) |
| Число отражений с I > 2σ(I) | 4231 | 3286 | 2798 | 2119 |
| Число уточняемых параметров | 272 | 271 | 262 | 262 |
| R1, wR2 (I > 2σ(I)) | 0.0526, 0.1030 | 0.0423, 0.0833 | 0.0362, 0.0799 | 0.0740, 0.1285 |
| R1, wR2 (все данные) | 0.0817, 0.1126 | 0.0670, 0.0946 | 0.0433, 0.0842 | 0.1599, 0.1567 |
| GOOF | 1.0497 | 1.011 | 1.0573 | 1.064 |
| Δρmin/Δρmax, e Å–3 | –0.869/0.792 | –0.575/0.387 | –0.471/0.320 | –0.439/0.340 |
Таблица 2.
Основные длины связей (Å) и углы (град) для I–IV
| Связь | I | II | III | IV |
|---|---|---|---|---|
| d, Å | ||||
| M−O(Fur) | 1.973(3), 1.984(3) | 2.0275(19), 2.0467(19) |
1.9875(18), 2.1035(18), 2.2063(17) |
2.020(4), 2.098(4), 2.198(4), 2.316(3) |
| M−O(H2O) | 2.222(3) | 2.0245(19) | ||
| M−N | 2.016(3), 2.025(2) | 2.096(2), 2.156(2) | 2.0790(19), 2.092(2) | 2.075(4), 2.080(4) |
| OMO | 91.01(10)–97.18(10) | 92.62(8)–101.77(8) | 61.35(7), 92.65(7), 111.08(7), 142.64(7) | 60.42(15), 61.50(14), 96.28(14), 99.76(15), 146.75(15) |
| Угол | ω, град | |||
| NMO | 91.52(11)–98.83(10), 162.94(11), 167.40(11) | 89.35(8)–105.06(8), 151.92(8), 163.06(8) | 96.51(7)–109.18(7), 157.93(7) | 94.77(15)–108.20(15), 159.26(16), 163.10(15) |
| NMN | 80.22(12) | 76.61(9) | 79.04(7) | 78.74(16) |
Структурные данные комплексов депонированы в Кембриджском банке структурных данных (CCDC № 1993168 (I), 1993169 (II), 1993170 (III), 1993171 (IV); http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Cтратегия данного исследования определялась тем, что рациональный дизайн биоактивных координационных соединений невозможен без понимания факторов, формирующих характер их взаимодействия с клеткой патогена. Для получения корреляционной зависимости строение–свойства–биологическая активность в качестве вариативного признака была взята природа комплексообразователя. В работе исследован ряд из биологически важных ионов меди(II), цинка(II) и кобальта(II). Комплексы [М(Fur)2(Bpy)(H2O)] (М = Cu (I), Zn (II)) были получены в реакциях ацетатов Сu(OAc)2 · H2O или Zn(OAc)2 · 2H2O и HFur (в соотношении M : Fur = 1 : 2) с последующим добавлением Bpy. На стадии смешения соли металла и HFur в MeCN образовывалась суспензия, которая при добавлении Bpy и выдерживании реакционной смеси при 70°С давала истинный раствор. Дополнительно показано, что одновременное использование ZnCl2 c NaFur (вместо Zn(OAc)2 2H2O) приводит к формированию безводного комплекса [Zn(Fur)2(Bpy)] (III). Комплекс [Co(Fur)2(Bpy)] (IV) был выделен в аналогичной реакции при использовании триметилацетатной соли. Все полученные соединения выделены в виде монокристаллов, что позволило определить их строение.
Комплексы I и II по данным РСА изоструктурны и кристаллизуются в пространственной группе P21/c (табл. 1, рис. 1). (Ранее [22–24] были получены изоструктурные аналоги обсуждаемых комплексов, различающиеся длинами связей M–N, M–O, а также углами OMO, NMO и NMN.) В обоих случаях катион металла координирует два монодентатно-связанных аниона 2-фуранкарбоновой кислоты, хелатную молекулу Bpy и молекулу воды (табл. 2), которые образуют вокруг него координационное окружение (MO3N2), имеющее форму искаженной квадратной пирамиды (τCu = = 0.07, τZn = 0.19) [25]. Атомы водородов молекулы воды участвуют в образовании внутримолекулярной водородной связи (O…O 2.715(4) и 2.653(3) Å, угол OHO 153(1)° и 146(1)° в I и II соответственно) с атомом кислорода одного из анионов. Аналогичная межмолекулярная водородная связь (O…O 2.749(4) и 2.701(3) Å, угол OHO 152(1)° и 176(1)° в I и II соответственно) приводит к формированию в кристаллах комплексов бесконечных водородно-связанных цепочек (рис. 2), дополнительно стабилизированных стекинг-взаимодействиями бипиридиновых лигандов с расстоянием между центрами ароматических колец, лежащим в интервале 3.666(4)–3.931(4) Å, и углом между плоскостями 1.78(12)°–3.70(9)°.
Рис. 1.
Молекулярное строение комплексов I и II. Здесь и далее атомы приведены в виде эллипсоидов тепловых колебаний (p = 50%). Атомы водорода (за исключением принадлежащих молекулам воды) не показаны для ясности.
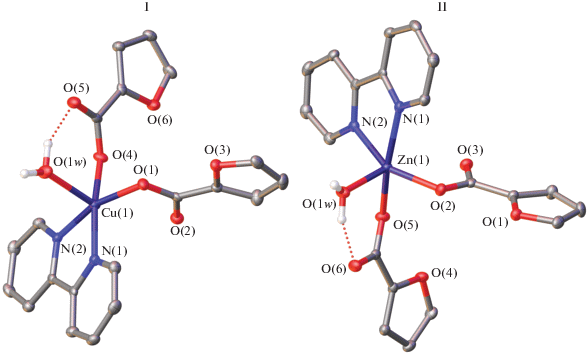
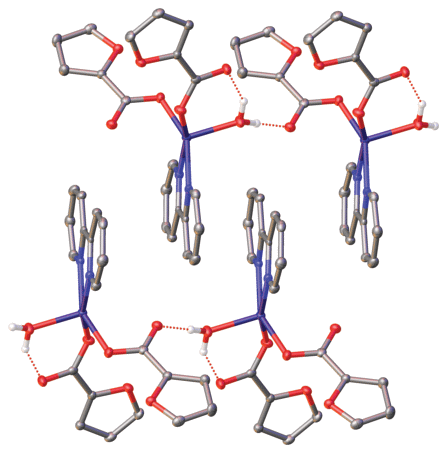
Рис. 2.
Фрагмент упаковки комплексов в кристаллах I и II, иллюстрирующий образование водородно-связанных цепей (водородные связи показаны пунктиром).
В комплексе III (рис. 3а) координационное окружение иона цинка (ZnO3N2) образовано одной хелатной молекулой Bpy и двумя монодентатно- и хелатно-связанными анионами кислоты (табл. 2) и соответствует искаженной квадратной пирамиде (τZn = 0.25) [25]. Отсутствие в данном комплексе молекулы воды приводит к тому, что образование бесконечных цепочек в кристалле (рис. 3в) происходит исключительно за счет стекинг-взаимодействия между бипиридиновыми лигандами соседних молекул комплекса с расстоянием между центрами ароматических колец 3.5937(14) Å и углом между их плоскостями 3.86(8)°.
Рис. 3.
Молекулярное строение комплексов III (а) и IV (б) и фрагменты их упаковок в кристалле, иллюстрирующие образование бесконечных цепочек за счет стекинг-взаимодействий (в, г соответственно).
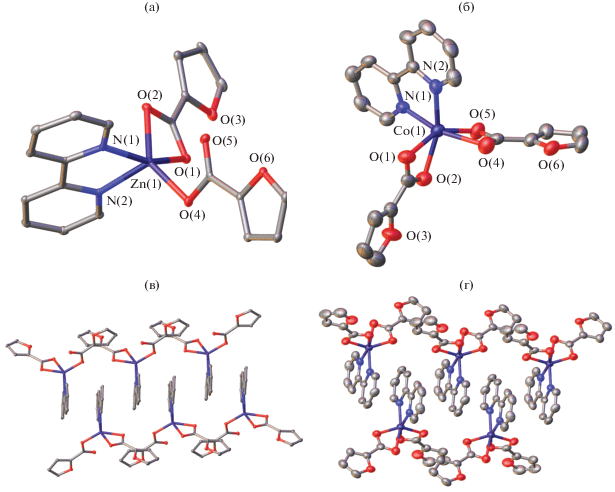
В отличие от трех предыдущих комплексов ион металла в IV (рис. 3б) имеет псевдооктаэдрическое координационное окружение (CoO4N2), в котором в качестве бидентатных лигандов выступает как молекула Bpy, так и оба аниона 2-фуранкарбоновой кислоты (табл. 2). При этом основным структурным мотивом в кристалле остаются бесконечные цепочки (рис. 3г), образованные молекулами комплекса посредством стекинг-взаимодействия между бипиридиновыми лигандами с расстоянием между центрами ароматических колец 3.907(3) Å и углом между плоскостями 3.43(18)°).
Антибактериальная активность соединений I, III и IV определена в отношении непатогенного штамма M. smegmatis. Известно, что устойчивость микобактерий к химиотерапевтическим агентам связана с низкой проницаемостью микобактериальной клеточной стенки, с ее необычной структурой. M. smegmatis являются быстрорастущими непатогенными бактериями и поэтому используются в качестве модельного организма для медленнорастущих бактерий M. tuberculosis, а также для первичного скрининга противотуберкулезных препаратов [26]. Тест-система M. smegmatis проявляет более высокую степень устойчивости к антибиотикам и противотуберкулезным агентам, чем M. tuberculosis, поэтому критерием отбора является концентрация вещества <100 нмоль/диск в отличие от M. tuberculosis [27]. Метод испытания включает количественную оценку диаметра зоны подавления роста культуры M. smegmatis, выращенной газоном на агаризованной среде, вокруг бумажных дисков, пропитанных испытуемыми соединениями. Вещества наносили на диски в разных концентрациях. Наблюдали увеличение диаметра halo (зона ингибирования роста) с увеличением количества вещества, нанесенного на диск. Концентрация вещества, при которой наблюдается минимальная видимая зона подавления роста, считается MИК (мкг/диск). Результаты антибактериальной активности в тестовой системе M. smegmatis mc2 155 и ее изменение с течением времени для соединений I, III и IV приведены в табл. 3. Как видно из данных табл. 3, соединения I и III проявляют биологическую активность ~2 раза выше, чем у изониазида и чуть ниже, чем у рифампицина. Несмотря на то что индивидуальный Bpy проявляет небольшую биологическую активность, в составе комплексов I и III она заметно возрастает (аналогичный эффект наблюдался в [19]). Кроме того, зона ингибирования у индивидуального Bpy, образовавшаяся в течение первых 24 ч роста культуры, через 5 сут зарастает полностью (что свидетельствует о слабом бактериостатическом действии Bpy), тогда как активность I в отношении бактерий не меняется и через 5 сут. Для комплекса III, так же как и для свободного Bpy, жизнедеятельность бактерий восстанавливается полностью через 5 сут.
Таблица 3.
Результаты антибактериальной активности в отношении Mycolicibacterium smegmatis
| Соединение | MИК, мкг/диск | Зона ингибирования роста M.smegmatis mc2 155, мм | |
|---|---|---|---|
| 24 ч | 24 ч | 120 ч* | |
| I | 46 | 7.0 | 7.0 |
| III | 44 | 6.5 | 0 |
| IV | 175 | 6.5 | 6.5 |
| HFur | 112 | 6.5 | |
| INH | 100 | 9.0 | 6.5 |
| RMP | 10 | 7.0 | 7.0 |
| Bpy | 78 | 7.5 | |
Таким образом, ионы меди(II), цинка(II) и кобальта(II) с анионами 2-фуранкарбоновой кислоты и Bpy формируют моноядерные изоструктурные комплексы. В стабилизации структур участвуют водородные связи (I и II), а также стекинг-взаимодействия между бипиридиновыми лигандами всех комплексов. Очевидно, что природа комплексообразователя определяет биологическую активность комплексов. Соединения I и III проявляют одинаковую биологическую активность in vitro в отношении M. smegmatis. Однако комплекс I проявляет высокую активность, не меняющуюся с течением времени и поэтому может оказаться перспективным для исследования на вирулентном штамме M. tuberculosis.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Louie A.Y., Meade T. // J. Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 6663.
Rojas S., Quartapelle-Procopio E., Carmona F. J. et al. // J. Mater. Chem. B. 2014. V. 2. P. 2473.
Thompson K.H., Orvig C.J. // Inorg. Biochem. 2006. V. 100. P. 1925.
Bello-Vieda N., Pastrana H., Garavito M. et al. // Molecules. 2018. V. 23. P. 361.
Goodwin L. // Am. J. Trop. Med. Hyg. 1995. V. 89. P. 339.
Global Tuberculosis Report 2018. Geneva: World Health Organization, 2018.
Mjos K.D., Orvig C. // Chem. Rev. 2014. V. 114. P. 4540.
Rosenberg B., VanCamp L., Krigas T. // Nature. 1965. V. 205. P. 698.
Rosenberg B., VanCamp L., Trosko J.E., Mansour V.H. // Nature. 1969. V. 222. P. 385.
Alderden R.A., Hall M.D., Hambley T.W.J. // J. Chem. Educ. 2006. V. 83. P. 728.
Berners-Pric S.J., Ronconi L., Sadler P.J. // Prog. Nucl. Magn. Reson. Spectrosc. 2006. V. 49. P. 65.
Cleare M.J., Hoeschele J.D. // Bioinorg. Chem. 1973. V. 2. P. 187.
Cleare M.J., Hoeschele J.D. // Platinum Met. Rev. 1973. V. 17. P. 2.
Gibaud S., Jaouen G., Jaouen G. // Med. Organometall. Chem. 2010. P. 1.
Patra M., Gasser G., Metzler-Nolte N. // Dalton Trans. 2012. V. 41. P. 6350.
Овчинников Ю.А. Биоорганическая химия. 1987. 516 с.
Krátk M, Vinová J. // Curr. Med. Chem. 2012. V. 19. P. 6126.
Melnic S., Prodius D., Stoeckli-Evans H. et al. // Eur. J. Med. Chem. 2010. V. 45. P. 1465.
Луценко И.А., Баравиков Д.Е., Кискин М.А. и др. // Коорд. химия. 2020. Т. 46. № 6. С. 366 (Lutsenko I.A., Baravikov D.E., Kiskin M.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 6. P. 411). https://doi.org/10.1134/S1070328420060056
Sheldrick G.M. // Acta Crystallpgr. A. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Ap-pl. Cryst. 2009. V. 42. P. 339.
Zheng X., Zhou Y., Zhang H. et al. // Synth. React. Inorg. Metal-Orgn. Nano-Metal Chem. 2007. V. 37. P. 235.
Zheng X., Shen X., Wan X. et al. // J. Coord. Chem. 2007. V. 60. P. 1317.
Ai Ch., Xiang J., Li M. et al. // Acta Crystallogr. E. 2007. V. 63. P. m565.
Addison A.W., Rao T.N. // Dalton Trans. 1984. P. 1349.
Ramon-García S., Ng C., Anderson H. et al. // Antimicrob. Agents. Chemother. 2011. V. 8. P. 3861.
Bekker O.B., Sokolov D.N., Luzina O.A. et al. // Med. Chem. Res. 2015. V. 24. P. 2926.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


