Координационная химия, 2020, T. 46, № 2, стр. 112-116
Гетеролептические биядерные иодоацетатные комплексы меди(II) с 3-бромпиридином и 4-этилпиридином: кристаллические структуры и особенности контактов галоген···галоген
С. А. Адонин 1, 2, 3, 4, *, А. С. Новиков 5, В. П. Федин 1, 4
1 Институт неорганической химии им. А.В. Николаева СО РАН
Новосибирск, Россия
2 Тюменский индустриальный университет, Тобольский индустриальный институт (филиал)
Тобольск, Россия
3 Южно-Уральский государственный университет
Челябинск, Россия
4 Новосибирский национальный исследовательский государственный университет
Новосибирск, Россия
5 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: adonin@niic.nsc.ru
Поступила в редакцию 09.08.2019
После доработки 21.08.2019
Принята к публикации 28.08.2019
Аннотация
Реакциями [Cu2(IOAc)4(H2O)2] c 3-бромпиридином и 4-этилпиридином в ацетоне получены гетеролигандные комплексы [Cu2(IOAc)4(3-BrPy)2] (I) и [Cu2(IOAc)4(4-EtPy)2] (II), строение которых определено методом РСА (CIF files CCDC № 1945900 (I), 1945901 (II)). В кристаллической структуре I наблюдаются специфические нековалентные взаимодействия I···I и Br···I, ведущие к образованию супрамолекулярных полимеров. Энергии данных контактов определены с помощью квантовохимических методов.
На протяжении последних лет галогенная связь (ГС) – особый вид нековалентных взаимодействий с участием атомов галогенов – привлекает все большее внимание исследователей [1–7]. С точки зрения супрамолекулярной координационной химии интересной задачей является поиск новых “строительных блоков”, способных к образованию ГС. В качестве кандидатов на эту роль рассматриваются, в частности, нейтральные комплексы типа [MIIL2X2] (X = Cl, Br, I; L = галогенсодержащий N-донорный лиганд) [8–11], полигалогениды [12, 13], перфторированные арены [14, 15] и т.д. Несмотря на немалое число описанных на данный момент комплексов с анионами галогенсодержащих карбоновых кислот [16–18] и интенсивное изучение карбоксилатных комплексов в целом [19–26], они нечасто рассматриваются как фрагменты супрамолекулярных систем, основанных на ГС. С точки зрения электронного строения и одоацетат-анион представляет особый интерес в контексте ГС. Вместе с тем структурная химия иодоацетатных комплексов изучена крайне слабо. На сегодняшний день описано строение лишь четырех соединений на основе Cu(II) [27–30] и по одному для Fe [31], Sb [32] и Pb [33].
Ранее мы показали, что [Cu2(IOAc)4(H2O)2] может быть использован в качестве прекурсора для синтеза гетеролептических комплексов путем замещения H2O на N-донорные лиганды. В зависимости от природы последних система ГС в твердом теле таких соединений может значительно изменяться [30].
В продолжение настоящей работы, мы получили комплексы [Cu2(IOAc)4(3-BrPy)2] (I) и [Cu2(IOAc)4(4-EtPy)2] (II), строение которых изучено методом РСА. В случае I в кристаллической структуре наблюдается образование системы контактов Br···I и I···I, энергии которых оценены с помощью квантовохимических расчетов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез проводили на воздухе. Комплекс [Cu2(IOAc)4(H2O)2] получили согласно литературной методике [29]; остальные исходные реагенты – из коммерческих источников. Ацетон подвергали очистке согласно стандартной процедуре.
Синтез[Cu2(IOAc)4(3-BrPy)2] (I). Навеску [Cu2(IOAc)4(H2O)2] (50 мг, 0.055 ммоль) растворяли в 15 мл кипящего ацетона и добавляли раствор 11 мкл (0.11 ммоль) 3-бромпиридина в 1 мл ацетона. Смесь медленно охлаждали до комнатной температуры. Охлаждение и постепенное упаривание растворителя (до ~1/2 изначального объема) приводит к образованию голубых кристаллов I, пригодных для РСА.
Синтез [Cu2(IOAc)4(4-EtPy)2] (II) проводили аналогично процедуре для I, используя 13 мкл (0.11 ммоль) 4-этилпиридина. Образуются голубые кристаллы II, пригодные для РСА.
РCA I и II получены при 130 K на автоматическом дифрактометре Agilent Xcalibur, оснащенном двухкоординатным детектором Atlas S2 (графитовый монохроматор, λ(MoKα) = 0.71073 Å, ω-сканирование). Интегрирование, учет поглощения, определение параметров элементарной ячейки проведены с использованием пакета программ CrysAlisPro. Кристаллические структуры расшифрованы с использованием программы SHELXT и уточнены полноматричным МНК в анизотропном (за исключением атомов водорода) приближении по программе SHELXL [34]. Позиции атомов водорода органических лигандов рассчитаны геометрически и уточнены по модели “наездника”. Кристаллографические данные и детали дифракционных экспериментов приведены в табл. 1.
Таблица 1.
Кристаллографические данные и параметры уточнения cтруктур I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| M | 1182.83 | 1081.13 |
| Сингония | Триклинная | Тетрагональная |
| Пр. гр. | P1 | P41212 |
| a, Å | 8.6878(4) | 14.2890(4) |
| b, Å | 9.1042(5) | 14.2890(4) |
| c, Å | 10.8343(5) | 15.1342(4) |
| α, град | 113.997(4) | 90 |
| β, град | 100.592(4) | 90 |
| γ, град | 103.429(4) | 90 |
| V, Å3 | 723.17 | 3090.03(19) |
| Z | 1 | 4 |
| ρ(выч.), г/см3 | 2.716 | 2.324 |
| μ, mm−1 | 8.55 | 5.42 |
| F(000) | 542 | 2024 |
| Размер кристалла, мм | 0.28 × 0.22 × 0.21 | 0.31 × 0.29 × 0.18 |
| Область сканирования по θ, град | 3.4–28.9 | 3.4–29.1 |
| Диапазон индексов hkl | −11 ≤ h ≤ 10, −12 ≤ k ≤ 11, −13 ≤ l ≤ 13 | −19 ≤ h ≤ 14, −13 ≤ k ≤ 17, −20 ≤ l ≤ 14 h = −19 → 14, k = −13 → 17, l = −20 → 14, h = −19 → 14, k = −13 → 17, l = −20 → 14 |
| Число измеренных/независимых отражений | 5443/3120 | 8491/3512 |
| Rint | 0.030 | 0.040 |
| Отражений с I > 2σ(I) | 2629 | 3056 |
| GOОF | 1.02 | 1.10 |
| R-факторы (I > 2σ(I)) | R1 = 0.0366, wR2 = 0.0746 | R1 = 0.0518, wR2 = 0.1338 |
| R-факторы (по всем отражениям) | R1 = 0.0451, wR2 = 0.0796 | R1 = 0.0618, wR2 = 0.1417 |
| Остаточная электронная плотность (max/min), e/Å3 | 1.36/−1.27 | 1.75/−1.27 |
Полные таблицы межатомных расстояний и валентных углов, координаты атомов и параметры атомных смещений структур депонированы в Кембриджском банке структурных данных (CCDC № 1945900 (I), 1945901 (II); https:// www.ccdc.cam.ac.uk/structures).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Как отмечалось ранее [30], работа, описывающая синтез и строение [Cu2(IOAc)4(H2O)2] [29], долгое время оставалась незамеченной, хотя это соединение может рассматриваться как удобный прекурсор для получения гетеролигандных комплексов. Помимо 3-BrPy и 4-EtPy, мы провели реакции с рядом замещенных пиридинов (Py, 4-MePy и т.д.). Было установлено, что, по-видимому, во всех случаях изначально образуются комплексы типа [Cu2(IOAc)4L2], однако в некоторых случаях они нестабильны в маточном растворе: в течение 2–3 сут наблюдается изменение окраски раствора и осадка на коричневую, при этом не удается выделить кристаллические продукты.
Строение I и II типично для биядерных карбоксилатов меди(II). Расстояния Cu···Cu составляют 2.643 и 2.709 Å соответственно (сравн. с 2.663 и 2.634 в [Cu2(IOAc)4(3.5-ClPy)2] и [Cu2(IOAc)4- (H2O)2] [29, 30]); длины связей Cu–O варьируют в диапазонах 1.962–1.974 и 1.942–2.007 Å. Длины связей Cu–N составляют 2.156 и 2.109–2.112 Å. В структуре II наблюдается разупорядочение этильных заместителей в обоих 4-EtPy лигандах.
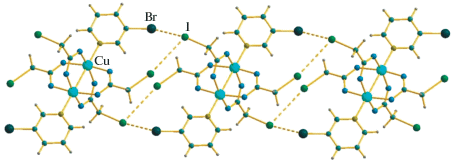
Анализ возможных контактов галоген···галоген в структурах I и II демонстрирует, что в случае II расстояния I···I (кратчайшее 4.212 Å) значительно превышают сумму ван-дер-ваальсовых радиусов по Бонди (3.96 Å [35, 36]), что позволяет предположить отсутствие нековалентных взаимодействий. Напротив, в структуре I расстояния Br···I и I···I короче, чем сумма соответствующих ван-дер-ваальсовых радиусов. Первые из них составляют 3.787 Å (сравн. с 3.81 Å [36]), что позволяет предположить наличие контактов, в образовании которых принимают участие фрагменты 3-BrPy и два из четырех иодоацетатных лигандов каждого из “строительных блоков” [Cu2(IOAc)4 (3-BrPy)2]. Во взаимодействия I···I (3.921 Å) вовлечены все четыре иодоацетатных лиганда. В совокупности обе системы контактов ведут к образованию одномерных супрамолекулярных цепочек (рис. 1). Величины углов CIBr, CBrI и CII (156.57°, 125.15° и 98.92°) позволяют отнести контакты к типам I и II соответственно [37], т.е. классифицировать часть из них как галогенные связи.
Рис. 2.
Диаграмма контурных линий распределения лапласиана электронной плотности ∇2ρ(r), связевые пути и поверхности нулевого потока, соответствующие нековалентным взаимодействиям I···Br и I···I в кристалле I. Критические точки связи (3, –1) – белые круги, критические точки ядер (3, –3) – серые круги.
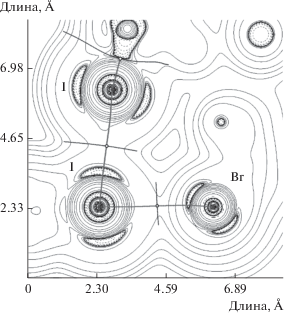
Для оценки энергий вышеупомянутых контактов мы выполнили квантово-химические расчеты в рамках теории функционала плотности (M06/DZP-DKH) [38–40] с помощью программного пакета Gaussian-16 и топологический анализ распределения электронной плотности по методу QTAIM (квантовая теория атомов в молекулах, предложенная Р. Бейдером) [41] с помощью программы Multiwfn (версия 3.6) [42]. Данный подход широко применяется для изучения нековалентных взаимодействий различных видов [4, 43–47]. Результаты представлены в табл. 2, диаграмма контурных линий распределения лапласиана электронной плотности ∇2ρ(r), связевые пути и поверхности нулевого потока, соответствующие нековалентным взаимодействиям I···Br и I···I в кристалле I представлены на pис. 2. Значения электронной плотности, лапласиана электронной плотности, суммарной плотности энергии, плотности потенциальной энергии и лагранжиана кинетической энергии в критических точках связей (3, –1), соответствующих нековалентным взаимодействиям I···Br и I···I в кристалле I, вполне типичны для такого рода супрамолекулярных контактов с участием атомов галогенов. Оценочные значения энергии нековалентных взаимодействий I···Br и I···I в I варьируют в диапазонах 1.3–2.1 и 1.3–2.5 ккал/моль соответственно, в зависимости от способа оценки [48–50]. Соотношение плотности потенциальной энергии и лагранжиана кинетической энергии в критических точках связей (3, –1), соответствующих нековалентным взаимодействиям I···Br и I···I в I, свидетельствует об отсутствии существенной доли ковалентной компоненты в данных супрамолекулярных контактах.
Таблица 2.
Значения электронной плотности (ρ(r)), лапласиана электронной плотности (∇2ρ(r)), суммарной плотности энергии (Hb), плотности потенциальной энергии (V(r)) и лагранжиана кинетической энергии (G(r)) (атомные единицы) в критических точках связей (3, –1), соответствующих нековалентным взаимодействиям I···Br и I···I в кристалле I, длины данных контактов (l, Å) и их энергии (E, ккал/моль), оцененные с помощью различных предложенных в литературе корреляций
| Супрамолекулярный контакт | ρ(r) | ∇2ρ(r) | Hb | V(r) | G(r) | Eа | Eб | Eв | Eг | lд |
|---|---|---|---|---|---|---|---|---|---|---|
| I···Br | 0.007 | 0.022 | 0.001 | –0.004 | 0.005 | 1.3 | 1.3 | 1.7 | 2.1 | 3.787 |
| I···I | 0.007 | 0.027 | 0.001 | –0.004 | 0.006 | 1.3 | 1.6 | 1.7 | 2.5 | 3.921 |
а E = –V(r)/2 (корреляция разработана для оценки энергии водородных связей) [48]. б E = 0.429G(r) (корреляция разработана для оценки энергии водородных связей) [49]. в E = 0.68(−V(r)) (корреляция разработана специально для оценки энергии нековалентных. взаимодействий с участием атомов иода) [50]. г E = 0.67G(r) (корреляция разработана специально для оценки энергии нековалентных взаимодействий с участием атомов иода) [50]. д Наименьшие ван-дер-ваальсовы радиусы для атомов брома и иода – 1.83 и 1.98 Å соответственно [35].
Авторы заявляют об отсутствии конфликта интересов
Список литературы
Mullaney B.R., Thompson A.L., Beer P.D. // Angew. Chem. Int. Ed. 2014. V. 53. P. 11458.
Bertani R., Sgarbossa P., Venzo A. et al. // Coord. Chem. Rev. 2010. V. 254. P. 677.
Cavallo G., Metrangolo P., Milani R. et al. // Chem. Rev. 2016. V. 116. P. 2478.
Ivanov D.M., Novikov A.S., Ananyev I.V. et al. // Chem. Commun. 2016. V. 52. P. 5565.
Bulatova M., Melekhova A.A., Novikov A.S. et al. // Z. Kristfllogr. Cryst. Mater. 2018. V. 233. P. 371.
Torubaev Y.V., Skabitskiy I.V., Rusina P. et al. // Crys-tEngComm. 2018. V. 20. P. 2258.
Matveychuk Y.V., Ilkaeva M.V., Vershinina E.A. et al. // J. Mol. Struct. 2016. V. 1119. P. 227.
Awwadi F.F., Turnbull M.M., Alwahsh M.I., Haddad S.F. // New J. Chem. 2018. V. 42. P. 10642.
Krasinski C.A., Solomon B.L., Awwadi F.F. et al. // J. Coord. Chem. 2017. V. 70. P. 914.
Awwadi F.F., Taher D., Haddad S.F., Turnbull M.M. // Cryst. Growth Des. 2014. V. 14. P. 1961.
Awwadi F.F., Taher D., Maabreh A. et al. // Struct. Chem. 2013. V. 24. P. 401.
Torubaev Y.V., Skabitskiy I.V., Pavlova A.V., Pasynskii A.A. // New J. Chem. 2017. V. 41. P. 3606.
Adonin S.A., Gorokh I.D., Abramov P.A. et al. // Dalton Trans. 2016. V. 45. P. 3691.
Sivchik V.V., Solomatina A.I., Chen Y.-T. et al. // Angew. Chem. Int. Ed. 2015. V. 54. P. 14057.
Brown J.J., Brock A.J., Pfrunder M.C. et al. // Aust. J. Chem. 2017. V. 70. P. 594.
Rustoy E.M., Agotegaray M., Piro O.E., Castellano E.E. // J. Coord. Chem. 2012. V. 65. P. 2341.
Huang S.-L., Zhang W.-H., Ling Y. et al. // Chem. Asian J. 2015. V. 10. P. 2117.
Yang S., Long L., Wu Z. et al. // Transition Met. Chem. 2002. V. 27. P. 546.
Sidorov A.A., Kiskin M.A., Aleksandrov G.G. et al. // Russ. J. Coord. Chem. 2016. V. 42. P. 621. https://doi.org/10.1134/S1070328416100031
Gol’dberg A.E., Nikolaevskii S.A., Kiskin M.A. et al. // Russ. J. Coord. Chem. 2015. V. 41. P. 777. https://doi.org/10.1134/S1070328415120015
Goldberg A.E., Kiskin M.A., Nikolaevskii S.A. et al. // Russ. J. Coord. Chem. 2015. V. 41. P. 182. https://doi.org/10.1134/S1070328415030021
Nikolaevskii S.A., Evstifeev I.S., Kiskin M.A. et al. // Polyhedron. 2018. V. 152. P. 61.
Kiraev S.R., Nikolaevskii S.A., Kiskin M.A. et al. // Inorg. Chim. Acta. 2018. V. 477. P. 15.
Gogoleva N.V., Shmelev M.A., Evstifeev I.S. et al. // Russ. Chem. Bull. 2016. V. 65. P. 181.
Nikolaevskii S.A., Kiskin M.A., Starikov A.G. et al. // Russ. J. Coord. Chem. 2019. V. 45. P. 273. https://doi.org/10.1134/S1070328419040067
Nikolaevskii S.A., Kiskin M.A., Starikova A.A. et al. // Russ. Chem. Bull. 2016. V. 65. P. 2812.
Zhang Z.-G., Dong X.-D., Li Y.-P. et al. // Acta Crystallogr. E. 2006. V. 62. P. m2326.
Zhao R., Sun J., Lu J., Li J. // Acta Crystallogr. E. 2009. V. 65. P. m241.
Drew M.G, Clerac R., De S. Datta D. // Indian J. Chem. A. 2007. V. 46. P. 760.
Adonin S.A., Novikov A.S., Sokolov M.N., Fedin V.P. // Inorg. Chem. Commun. 2019. V. 105. P. 221.
Nakamoto T., Wang Q., Miyazaki Y., Sorai M. // Polyhedron. 2002. V. 21. P. 1299.
Sharutin V.V., Sharutina O.K. // Russ. Chem. Bull. 2017. V. 66. P. 707.
Adonin S.A., Novikov A.S., Sokolov M.N. // Eur. J. Inorg. Chem. 2019. V. 39−40. P. 4221. https://doi.org/10.1002/ejic.201900349
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Bondi A. // J. Phys. Chem. 1966. V. 70. P. 3006.
Mantina M., Chamberlin A.C., Valero R. et al. // J. Phys. Chem. A. 2009. V. 113. P. 5806.
Varadwaj P., Varadwaj A., Marques H. et al. // Inorganics. 2019. V. 7. P. 40.
Zhao Y., Truhlar D.G. // Theor. Chem. Acc. 2008. V. 120. P. 215.
Canal Neto A., Jorge F.E. // Chem. Phys. Lett. 2013. V. 582. P. 158.
Barros C.L., de Oliveira P.J.P., Jorge.E. et al. // Mol. Phys. 2010. V. 108. P. 1965.
Bader R.F.W. // Chem. Rev. 1991. V. 91. P. 893.
Lu T., Chen F. // J. Comput. Chem. 2012. V. 33. P. 580.
Katkova S.A., Mikherdov A.S., Kinzhalov M.A. et al. // Chem. Eur. J. 2019. V. 25. P. 8590.
Kinzhalov M.A., Baykov S.V., Novikov A.S. et al. // Z. Kristfllogr. Cryst. Mater. 2019. V. 234. P. 155.
Ding X., Tuikka M.J., Hirva P. et al. // CrystEngComm. 2016. V. 18. P. 1987.
Mikherdov A.S., Novikov A.S., Kinzhalov M.A. et al. // Inorg. Chem. 2018. V. 57. P. 3420.
Kinzhalov M.A., Kashina M.V., Mikherdov A.S. et al. // Angew. Chem. Int. Ed. 2018. V. 57. P. 12785.
Espinosa E., Molins E., Lecomte C. // Chem. Phys. Lett. 1998. V. 285. P. 170.
Vener M.V., Egorova A.N., Churakov A.V., Tsirelson V.G. // J. Comput. Chem. 2012. V. 33. P. 2303.
Bartashevich E.V., Tsirelson V.G. // Russ. Chem. Rev. 2014. V. 83. P. 1181.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия