Координационная химия, 2020, T. 46, № 2, стр. 73-80
Синтез, структурное и масс-спектрометрическое исследование комплексов [Ni2(μ-OH2)(μ-O2CCH(CH3)2)2L2–4((CH3)2CHCO2)2]
Д. О. Блинов 1, *, А. А. Никифоров 1, 2, В. В. Гуржий 3, А. Е. Минкович 4, М. Ю. Максимов 5, Н. С. Панина 1, А. Н. Беляев 1, А. В. Еремин 2, **
1 Санкт-Петербургский государственный технологический институт (технический университет)
Санкт-Петербург, Россия
2 Институт высокомолекулярных соединений РАН
Санкт-Петербург, Россия
3 Институт наук о Земле Санкт-Петербургского государственного университета
Санкт-Петербург, Россия
4 НИИ гигиены, профпатологии и экологии человека Федерального медико-биологического агентства
Санкт-Петербург, Россия
5 Санкт-Петербургский политехнический университет Петра Великого
Санкт-Петербург, Россия
* E-mail: daniil.blinou@gmail.com
** E-mail: ha9room@gmail.com
Поступила в редакцию 11.07.2019
После доработки 11.08.2019
Принята к публикации 26.08.2019
Аннотация
Синтезированы три новых биядерных аквамостиковых 2-метилпропионатных комплекса никеля(II) [Ni2(μ-OH2)(μ-O2CCH(CH3)2)2L2–4((CH3)2CHCO2)2] (L = N,N,N',N'-тетраметилэтилендиамин (I), пиридин (II), 2,2'-дипиридил (III)). Комплексы охарактеризованы методами элементного и термического анализов, масс-спектрометрии, ИК- и электронной спектроскопии, РСА (CIF files CCDC № 1840763 (I), 1913469 (II), 1913471 (III)). На основе анализа масс-спектров полученных координационных соединений сделано предположение о формах их существования в растворе ацетонитрила.
Комплексы переходных металлов, содержащие несколько координационных металлоцентров, привлекают внимание благодаря специфичным каталитическим [1–3], магнитным [4–7], спектральным [8, 9] свойствам, возможного применения в фармакологии [10, 11]. Одна из наиболее исследованных систем – биядерные комплексы с мостиковыми карбоксилатными лигандами. Обширный ряд биядерных комплексов никеля(II), имеющих в структуре аква-, гидроксо- или фенолятмостиковые лиганды [12–14], представляет интерес из-за их схожести с активным центром фермента уреазы [15–18]. К настоящему времени в Кембриджском банке структурных данных (версия 5.40 от февраля 2019 года [19]) зарегистрированы несколько десятков соединений никеля(II), имеющих остов [Ni2(µ-OH2)(µ-O2CR)2L2]2+ (L = = бидентатный аминатный лиганд) [20–31]. При рассмотрении подобных соединений как катализаторов гомогенных процессов важным моментом является изучение особенностей их поведения в растворах. Однако в литературе в настоящее время этот вопрос недостаточно представлен.
В настоящей работе исследовано влияние природы N-донорных лигандов в биядерных комплексах никеля(II) состава [Ni2(μ-OH2)(μ-O2CCH(CH3)2)2L2–4((CH3)2CHCO2)2] (L = = N,N,N',N'-тетраметилэтилендиамин (Тmeda для I), пиридин (Рy для II), 2,2'-дипиридил (Вipy для III) на их структуру, характер термораспада и особенности фрагментации комплексов в растворах ацетонитрила.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все использованные соединения и растворители получали из коммерческих источников и использовали без дополнительной очистки. Синтетический хельерит NiCO3 ∙ 5.5H2O получали по методике [32].
ИК-спектры поглощения регистрировали в диапазоне 400–4000 см–1 на приборе Shimadzu IRTracer-100, оборудованном приставкой НПВО Specac Quest. ЭСП регистрировали на приборе СФ-56 с использованием кварцевых кювет (l = 1 см). C, H, N-элементный анализ выполняли с использованием LECO CHNS(O)-932.
Масс-спектрометрический анализ (ESI-MS) растворов комплексов проводили на приборе TSQ Quantum Access Max (Thermo Fisher Scientific). Растворы образцов (0.1 мг/мл) вводили непосредственно в электроспрей со скоростью потока 10 мкл/мин. Напряжение на распылителе и на капилляре составляло ±5 кВ и ±5 В соответственно, давление газа-носителя (сухой азот) 34.5 кПа, температура испарителя и капилляра 70 и 200°С соответственно. Спектры регистрировали в диапазоне наиболее интенсивных сигналов – 100–1000 Да.
Термораспад комплексов I–III исследовали методом термогравиметрического (ТГ) анализа на анализаторе Shimadzu DTG-60. Эксперименты проводили с постоянной скоростью нагревания 10 град/мин в атмосфере сухого азота. Нагрев изучаемых образцов проводили в открытых алюминиевых тиглях, масса отдельных навесок не превышала 10 мг.
Синтез μ-аква-k2O:O-ди-μ-2-метилпропионато-k4O:O'-бис[(2-метилпропионато-kO)(N,N,N',N'-тетраметилэтилендиамин-k2N,N')никеля(II)] [Ni2(μ-OH2)- (μ-O2CCH(CH3)2)2(Тmeda)2((CH3)2CHCO2)2] (I). К суспензии NiCO3 ∙ 5.5H2O (0.6534 г, 3 ммоль) в 40 мл смеси ацетонитрил–вода (100 : 1) добавляли 2-метилпропионовую кислоту (0.56 мл, 6 ммоль), после чего к реакционной смеси приливали раствор Тmeda (0.45 мл, 3 ммоль) в 10 мл ацетонитрила. При медленном упаривании на воздухе из маточного раствора выпадали зеленые кристаллы, пригодные для РСА. Выход I ~90%.
ИК-спектр (ν, см–1): 3019 сл, 2960 сл, 2866 сл, 2838 сл, 2801 сл, 2360 ср, 2000 сл 1618 с, 1616 с, 1522 сл, 1461 с, 1414 с, 1369 ср, 1284 ср, 1194 сл, 1166 сл, 1126 сл, 1090 сл, 1065 сл, 1026 сл, 958 сл, 911 сл, 827 сл, 802 сл, 775 сл, 640 сл, 618 сл, 492 сл.
Синтез μ-аква-k2O:O-ди-μ-2-метилпропионато-k4O:O'-бис[(2-метилпропионато-kO)бис(пиридин-kN)никеля(II)] дигидрата [Ni2(μ-OH2)(μ-O2CCH(CH3)2)2(Рy)4((CH3)2CHCO2)2] ∙ 2H2O (II). К суспензии NiCO3 ∙ 5.5H2O (0.8711 г, 4 ммоль) в 50 мл смеси ацетонитрил–вода (100 : 1) добавляли 2‑метилпропионовую кислоту (0.75 мл, 8 ммоль), после чего к реакционной смеси приливали раствор Рy (0.64 мл, 8 ммоль) в 10 мл ацетонитрила. При медленном упаривании на воздухе из маточного раствора выпадали голубые кристаллы, пригодные для РСА. Выход II ~85%.
ИК-спектр (ν, см–1): 3436 сл, 3075 сл, 2964 сл, 2924 сл, 2866 сл, 2325 сл, 2102 сл, 2051 о.сл, 1613 с, 1601 с, 1572 ср, 1533 ср, 1485 ср, 1471 ср, 1444 ср, 1415 с, 1365 ср, 1310 сл, 1286 ср, 1217 ср, 1169 сл, 1146 сл, 1111 сл, 1091 ср, 1074 ср, 1070 сл, 1038 ср, 1011 сл, 919 сл, 831 ср, 759 ср, 699 с, 651 ср, 629 ср, 566 ср, 433 ср.
Синтез μ-аква-k2O:O-ди-μ-2-метилпропионато-k4O:O')-бис[(2-метилпропионато-kO)(2,2'-бипиридин-k2N,N')никеля(II)] [Ni2(μ-OH2)(μ-O2CCH(CH3)2)2 (Вipy)2((CH3)2CHCO2)2] (III). К суспензии NiCO3 ∙ ∙ 5.5H2O (1.3068 г, 6 ммоль) в 40 мл смеси ацетонитрил–вода (100 : 1) добавляли 2‑метилпропионовую кислоту (1.12 мл, 12 ммоль), после чего к реакционной смеси приливали раствор Вipy (0.9364 г, 6 ммоль) в 10 мл ацетонитрила. При медленном упаривании на воздухе из маточного раствора выпадали синие кристаллы, пригодные для РСА. Выход III ~80%.
ИК-спектр (ν, см–1): 3114 сл, 3037 сл, 2961 сл, 2921 сл, 2866 сл, 2066 сл, 1979 сл, 1899 сл, 1612 с, 1605 с, 1569 ср, 1531 сл, 1495 сл, 1478 ср, 1469 ср, 1442 ср, 1414 с, 1366 ср, 1357 ср, 1322 ср, 1308 сл, 1285 ср, 1250 сл, 1168 сл, 1151 ср, 1113 сл, 1088 ср, 1058 ср, 1026 ср, 1018 сл, 919 сл, 829 ср, 763 с, 736 с, 652 ср, 632 ср, 553 ср, 448 сл, 417 ср.
РСА выполнен на дифрактометрe Agilent Technologies (Oxford Diffraction) “Xcalibur”, оснащенном детектором Eos CCD (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) при температуре 100(2) К для I и на дифрактометрe Rigaku Oxford Diffraction “XtaLAB Supernova”, оснащенном детектором HyPix-3000 (CuKα-излучение, λ = 1.54184 Å, зеркальный монохроматор) при температуре 100(2) К для II, III. Структуры соединений решены прямыми методами и уточнены с использованием программ SHELX [33], интегрированных в комплексе OLEX2 [34]. Конечные модели включают координаты и анизотропные тепловые параметры для всех неводородных атомов. Позиции атомов водорода органических фрагментов молекулы рассчитаны по алгоритму, заложенному в программе SHELX. Позиции атомов водорода органических молекул рассчитаны по алгоритмам, заложенным в программном комплексе SHELX, где Uизо(H) установлено как 1.5Uэкв(C) и C–H 0.96 Å для групп CH3, Uизо(H) установлено как 1.2Uэкв(C) и C–H 0.97 Å для групп CH2, Uизо(H) установлено как 1.2Uэкв(C) и C–H 0.93 Å для групп CH циклических фрагментов, Uизо(H) установлено как 1.2Uэкв(C) и C–H 0.98 Å для третичных групп CH. Позиции атомов водорода молекул H2O локализованы из разностного Фурье-синтеза и фиксированы в процессе уточнения с 1.5Uэкв(O). Отметим, что монодентатные 2-метилпропионатные лиганды в структуре комплекса II разупорядочены на две кристаллографически неэквивалентные позиции с общей заселенностью 1.0. Кристаллографические данные, параметры эксперимента и уточнения структур комплексов I–III приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур комплексов I–III
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III | |
| Эмпирическая формула | C28H62N4Ni2O9 | C36H54N4Ni2O11 | C36H46N4Ni2O9 |
| M | 716.23 | 836.25 | 796.19 |
| Сингония | Моноклинная | Триклинная | Триклинная |
| Пр. гр. | P21/n | P1 | P1 |
| a, Å | 10.1209(10) | 9.34060(10) | 10.4484(5) |
| b, Å | 16.3044(18) | 20.83840(10) | 13.0505(7) |
| c, Å | 21.8566(19) | 21.9543(2) | 15.0916(7) |
| α, град | 90 | 76.5040(10) | 77.525(4) |
| β, град | 90.658(2) | 82.1540(10) | 84.004(4) |
| γ, град | 90 | 89.3610(10) | 72.791(5) |
| V, Å3 | 3606.4(6) | 4115.40(6) | 1917.49(18) |
| Z; ρ(выч.), г/см3 | 4; 1.319 | 2; 1.350 | 2; 1.379 |
| F(000) | 1544 | 1768 | 836 |
| μ, мм–1 | 1.095 | 1.636 | 1.691 |
| Интервалы индексов | –13 ≤ h ≤ 12, –21 ≤ k ≤ 21, –27 ≤ l ≤ 28 |
–11 ≤ h ≤ 10, –25 ≤ k ≤ 25, –26 ≤ l ≤ 26 |
–9 ≤ h ≤ 12, –15 ≤ k ≤ 15, –18 ≤ l ≤ 18 |
| 2θmax, град | 54.996 | 143.776 | 139.99 |
| Число измеренных/независимых рефлексов | 8272/6559 | 16 099/14310 | 5862/7257 |
| Rint | 0.0237 | 0.0388 | 0.0501 |
| Число параметров | 412 | 1015 | 471 |
| GOOF | 1.031 | 1.033 | 1.043 |
| R1, wR2 (I > 2σ(I)) | 0.0310, 0.0651 | 0.0662, 0.1718 | 0.0708, 0.1793 |
| R1, wR2 (все данные) | 0.0462, 0.0728 | 0.0716, 0.1759 | 0.0867, 0.1931 |
| Δρmax/Δρmin, е Å–3 | 0.784/–0.432 | 1.059/–0.917 | 1.509/–0.639 |
Кристаллографические данные комплексов I–III депонированы в Кембриджском банке структурных данных (CCDC № 1840763 (I), 1913469 (II), 1913471 (III); www.ccdc.cam.ac.uk/structures/).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В настоящей работе в качестве исходного соединения использовали синтетический хельерит NiCO3 ∙ 5.5H2O, применение которого позволило быстро и с высоким выходом синтезировать три новых 2-метилпропионатных комплекса [Ni2(μ-OH2)(μ-O2CCH(CH3)2)2L2–4((CH3)2CHCO2)2] (L = = Тmeda (I), Рy (II), Bipy (III)).
Молекулярные структуры комплексов I–III подобны и имеют биядерный остов, в котором два атома никеля связаны между собой мостиковой молекулой воды и двумя бидентатно-мостиковыми карбоксилатными лигандами (рис. 1). Координационное окружение каждого иона никеля дополняется монодентатно координированным 2-метилпропионатным лигандом и одним бидентатно координированным N-донорным лигандом (Тmeda для I и Вipy для III) или двумя монодентатными (Рy для II). Структура комплексов I–III стабилизирована внутримолекулярными водородными связями (ВС) между мостиковой молекулой воды и монодентатно координированными карбоксилатными лигандами. Длины соответствующих ВС приведены в табл. 2.
Рис. 1.
Молекулярная структура I. Показаны внутримолекулярные водородные связи. Тепловые эллипсоиды с вероятностью 50%.
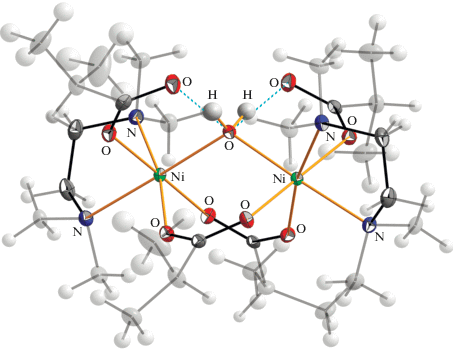
Таблица 2.
Основные усредненные длины связей и валентные углы в комплексах I–III
| Параметр | Комплекс | ||
|---|---|---|---|
| I | II | III | |
| OW∙∙∙Oкарбокс | 2.547 | 2.563 | 2.539 |
| Ni∙∙∙Ni | 3.480 | 3.557 | 3.503 |
| Ni–O(w) | 2.071 | 2.086 | 2.084 |
| Ni–N | 2.175 | 2.112 | 2.087 |
| Ni–Oμ‑карбокс | 2.033 | 2.042 | 2.043 |
| Ni–Oкарбокс | 2.082 | 2.062 | 2.091 |
| NiO(w)Ni | 114.35 | 116.99 | 114.42 |
| NNiN | 84.13 | 89.07 | 78.70 |
| w = H2O, карбокс. = O2CCH(CH3)2. | |||
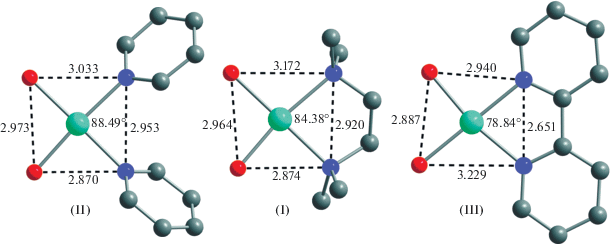
В случае комплексов I и III, содержащих хелатирующие бидентатные лиганды Тmeda и Вipy, наблюдается трапецеидальное искажение экваториальной плоскости координационного полиэдра, представленное на рис. 2. Для количественной характеристики искажения координационных полиэдров было использовано представление о так называемой “мере симметрии” (“continuous symmetry measures”) S(Oh) [35–37], которая описывает отклонение от формы идеального октаэдра: чем больше ее значение, тем более заметны отклонения. Расчет значений S(Oh) проводился по данным РСА с использованием алгоритма [38]. Для комплексов I, II и III значения S(Oh) составили 0.2044, 0.0744 и 0.6117 соответственно, что свидетельствует о том, что самые значительные отклонения наблюдаются для комплекса III, минимальные – для комплекса II. Это может быть связано с большей структурной жесткостью лиганда Вipy в комплексе по сравнению с Тmeda. В случае лиганда Рy нельзя исключать, что его монодентатная координация, допускающая большую гибкость металлоостова, приводит к наименьшему искажению координационных полиэдров.
Рис. 2.
Экваториальные плоскости координационных полиэдров комплексов I–III. Карбоксилатные лиганды и атомы водорода не указаны.
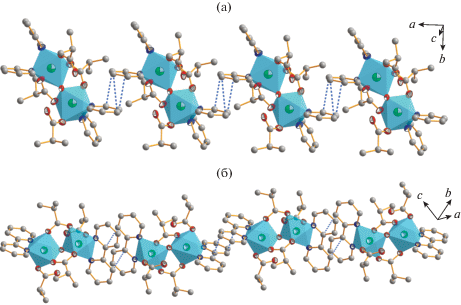
В кристаллической структуре комплексов II и III (рис. 3) наблюдаются π–π-стэкинг-взаимодействия ароматических лигандов (Рy и Вipy), приводящие к образованию 1D полимерных цепей со средними межплоскостными расстояниями 3.282 и 3.363 Å соответственно. Кристаллическая структура комплекса II, помимо π–π-взаимодействий, содержит систему ВС между монодентатно координированными карбоксилатными лигандами и сольватными молекулами воды.
Рис. 3.
Фрагмент кристаллической структуры комплексов II (а) и III (б) сo стэкинг-взаимодействиями. Показаны координационные полиэдры NiN2O4.
В ИК-спектре комплекса II слабый и широкий пик при 3436 см–1 свидетельствует о наличии кристаллизационной воды (νas(O–H) и νs(O–H)). Полосы поглощения в области 3100–2800 см–1 соответствуют колебаниям ν(C–H) метиленовых и метильных групп Tmeda (для I) и радикалов карбоксилатных лигандов (I–III). Интенсивные полосы поглощения νas(COO–) (1618 и 1616 для I, 1613 и 1601 для II, 1612 и 1605 см–1 для III), а также полосы νs(COO–) (1461 и 1414 для I, 1444 и 1415 для II, 1442 и 1414 см−1 для III) принадлежат мостиковым и монодентатным карбоксилатным лигандам соответственно [39].
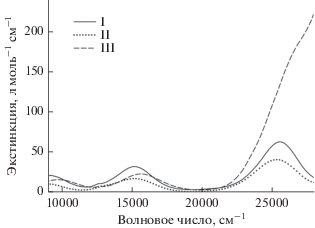
В комплексах I–III атомы никеля находятся в искаженном октаэдрическом окружении NiN2O4. Для подобных октаэдрических и псевдооктаэдрических d8-систем в видимой области проявляются три разрешенных по спину перехода 3A2g → 3T2g, 3A2g → 3T1g и 3A2g → 3T1g(P) [40, 41] при 7000–13 000, 11 000–20 000 и 19 000–27 000 см–1 соответственно. Для I–III данные переходы наблюдаются при ~9500, ~15 500 и ~26 000 см–1 соответственно (рис. 4, табл. 3). В случае комплекса III резкое усиление экстинкции перехода 3A2g → 3T1g(P) можно объяснить внутрилигандным переносом заряда в развитой ароматической системе Вipy-лигандa. Плечо при ~13 000 см–1 (рис. 4) можно объяснить низкоинтенсивным запрещенным по спину переходом 3A2g → 1Eg [40], наблюдаемом для комплексов I–III при 12 630 (11), 12 900 (9) и 12 750 (7) см–1 (л см–1 моль–1) соответственно.
Таблица 3.
Отнесение разрешенных электронных переходов в комплексах I–III
| Переход | ν, см–1 (ε, л см–1моль–1) | ||
|---|---|---|---|
| I | II | III | |
| 3A2g → 3T2g(F) | 9200 (22) | 9200 (10) | 10 020 (15) |
| 3A2g → 3T1g(F) | 15 190 (32) | 15 170 (17) | 15 700 (23) |
| 3A2g → 3T1g(P) | 25 530 (63) | 25 300 (41) | ~26 600 (180) |
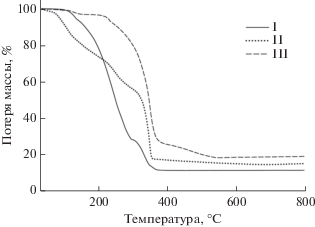
Исследование термического поведения I–III показало, что термодеструкция комплексов с моно- (II) и бидентатными (I и III) N-донорными лигандами протекает различными путями. Разложение комплекса II начинается с удаления внешнесферной кристаллизационной воды, заканчивающегося при 85°С (Δmтеор = 4.31, Δmэксп = 4.87%). Затем происходит совместное последовательное элиминирование мостиковой молекулы воды и двух молекул пиридина (Δmтеор = = 21.07, Δmэксп = 21.52%), возможно, сопровождающееся образованием соединений с остовом типа “китайского фонарика”, как было показано в [21, 42]. Далее наблюдаются две последовательные ступени разложения при 210–310 и 310–360°С с образованием оксида никеля(II) (Δmтеор = 56.75, Δmэксп = 58.33%) (рис. 5).
На кривой ТГ комплекса I наблюдается потеря 2.5% массы в интервале 100–120°С, что соответствует потере мостиковой молекулы воды. В интервале 140–300°С наблюдается резкая потеря массы в 65.3%. Суммарная убыль массы составляет 88.2% при содержании никеля в комплексе (в пересчете на оксид) 20.9%, что свидетельствует о параллельной процессам термодеструкции сублимации комплекса.
Разложение комплекса III начинается с удаления мостиковой молекулы воды в интервале 100–130°С. Дальнейшее нагревание приводит к резкой потере массы образца (Δmэксп = 65.27%) в интервале 230–370°С. В диапазоне 370–540°С наблюдаются две стадии разложения комплекса, соответствующие окончательному разрушению координационных полиэдров с образованием NiO (Δmтеор = 81.2, Δmэксп = 80.5%).
Для получения информации о возможных формах существования комплексов в растворах ацетонитрила было проведено их масс-спектрометрическое исследование. В спектрах ESI-MS ацетонитрильного раствора комплекса I как в положительном, так и в отрицательном диапазонах детектирования наблюдаются низкоинтенсивные пики, соответствующие молекулярными ионам: [M+H]+ (m/z = 714.2, 1%); [M–H]–, (m/z = 713.2, 1%). Наибольшую интенсивность имеет ион, соответствующий моноядерной частице [Ni(Тmeda)- ((CH3)2CHCOO)]+ (m/z = 261.1, 100%). С меньшей интенсивностью наблюдаются два пика с m/z = = 567.2 (17%) и 609.2 (12%). Второй пик можно отнести к иону [Ni2(O2CCH(CH3)2)3(Тmeda)2]+.
В случае комплекса II в масс-спектрах наблюдается значительно большее количество пиков с высокими интенсивностями, соответствующих “тяжелым” ионам. Пики с m/z = 799.2 (20%) и 781.8 (38%) были отнесены к молекулярному иону [M+H]+ и его дегидратированной форме [M–H2O+H]+. Помимо этого, наблюдаются два высокоинтенсивных пика, отнесенных к [Ni2(O2CCH(CH3)2)4(Рy)3+H]+ (m/z = 702.2, 100%) и [Ni2(O2CCH(CH3)2)4(Рy)3+MeCN+H]+ (m/z = 743.2, 75%). Как и в случае комплекса I, в растворе II детектируются моноядерные частицы [Ni(O2CCH(CH3)2)2(Рy)2+H]+ (m/z = 391.0, 36%). Одной из причин отсутствия молекулы воды в структуре большинства ионов может быть процесс дегидратации комплексов на инжекционном прогреваемом капилляре (transferline) масс-спектрометра.
Таким образом, получены три новых биядерных 2-метилпропионатных комплекса с терминальными N-донорными лигандами [Ni2(μ-OH2)- (μ-O2CCH(CH3)2)2L2–4((CH3)2CHCO2)2] (L = = Тmeda, Рy, Вipy). На основе данных РСА рассчитаны наблюдаемые отклонения полученных соединений от формы идеального октаэдра. Структурно более жесткие хелатирующие бидентатные лиганды Вipy и Тmeda вызывают наибольшие трапецеидальные искажения экваториальной плоскости кординационных полиэдров (I < III), тогда как монодентатно координированный Рy допускает большую гибкость металлоостова II, приводящую к его наименьшему искажению. В кристаллической структуре комплексов с ароматическими лигандами Рy и Вipy наблюдаются π–π-стэкинг-взаимодействия, приводящие к формированию 1D-полимерных цепей.
Термодеструкция комплекса I сопровождается возгонкой соединения. В случае комплексов II и III конечным продуктом разложения является NiO. При этом в интервале 120–200°С комплекс II теряет лиганды Рy и изомеризуется с образованием структур типа “китайский фонарик”.
По данным спектров ESI-MS комплекса I в ацетонитрильных растворах доминирует процесс частичного элиминирования карбоксилатных лигандов с образованием ионов [Ni2(O2CCH(CH3)2)3-(Тmeda)2]+ и их последующая фрагментация с образованием моноядерных частиц [Ni(Тmeda)- ((CH3)2CHCOO)]+. Во всех идентифицированных ионах в координационном окружении никеля сохраняется один лиганд Тmeda. В случае комплекса II основной процесс – элиминирование одного лиганда Рy с образованием биядерных комплексных катионов [Ni2(O2CCH(CH3)2)4(Рy)3+H]+ и [Ni2(O2CCH(CH3)2)4(Рy)3+MeCN+H]+, претерпевающих последующую фрагментацию в меньшей степени, чем комплекс I. Отсутствие мостиковой молекулы воды в структуре большинства ионов в растворах обоих комплексов может быть объяснено ее потерей в условиях электроспрея.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Long J.-M., Gao H.-Y., Liu F.-Sh. et al. // Inorg. Chim. Acta. 2009. V. 362. № 9. P. 3035.
Wang J.-W., Liu W.-J., Zhong D.-Ch., Lu T.-B. // Coord. Chem. Rev. 2019. V. 378. P. 237.
Фишер А.И., Панина Н.С., Беляев А.Н. // Коорд. химия. 2016. Т. 42. № 10. С. 596 (Fischer A.I., Panina N.S., Belyaev A.N. // Russ. J. Coord. Chem. 2016. V. 42. № 10. P. 635).https://doi.org/10.1134/S1070328416100018
Zorina-Tikhonova E.N., Gogoleva N.V., Sidorov A.A. // Polyhedron. 2017. V. 130. P. 67.
Malkov A.E., Fomina I.G., Sidorov A.A. et al. // J. Mol. Struct. 2003. V. 656. № 1–3. P. 207.
Novotortsev V.M., Rakutin Yu. V., Nefedov S.E., Eremenko I.L. // Russ. Chem. Bull. Int. Ed. 2000. V. 49. № 3. P. 438.
Nikolaevskii S.A., Kiskin M.A., Starikova A.A. et al. // Russ. Chem. Bull. Int. Ed. 2016. V. 65. № 12. P. 2812.
Das M., Harms K., Ghosh B.N. et al. // Polyhedron. 2015. V. 87. P. 286.
Matelková K., Boča R., Dlháň Ľ. et al. // Polyhedron. 2015. V. 95. P. 45.
Bottari B., Maccari R., Monforte F. et al. // Bioorg. Med. Chem. 2001. V. 9. № 8. P. 2203.
Bharty M.K., Paswan S., Dani R.K. et al. // J. Mol. Struct. 2017. V. 1130. P. 181.
Rispens M.T., Gelling O.J., de Vries A.H.M. et al. // Tetrahedron. 1996. V. 52. № 10. P. 3521.
Dey S.K., Salah El Fallah M., Ribas J. et al. // Inorg. Chim. Acta 2004. V. 357. № 5. P. 1517.
Chang C.-H., Tsai C.-Y., Lin W.-J. et al. // Polymer. 2018. V. 141. P. 1.
Sumner J.B. // J. Biol. Chem. 1926. V. 69. P. 435.
Blakeley R.L., Treston A., Andrews R.K., Zerner B. // J. Am. Chem. Soc. 1982. V. 104. № 2. P. 612.
Blakeley R.L., Zerner B. // J. Mol. Catal. 1984. V. 23. № 2–3. P. 263.
Lippard S.J. // Science. 1995. V. 268. № 5213. P. 996.
Groom C.R., Bruno I.J., Lightfoot M.P., Ward S.C. // Acta Crystallogr. B. 2016. V. 72. P. 171.
Eremenko I.L., Golubnichaya M.A., Nefedov S.E. et al. // Russ. Chem. Bull. Int. Ed. 1998. V. 47. № 4. P. 704.
Eremenko I.L., Nefedov S.E., Sidorov A.A. et al. // Inorg. Chem. 1999. V. 38. № 17. P. 3764.
Fomina I.G., Sidorov A.A., Aleksandrov G.G. et al. // Russ. Chem. Bull. Int. Ed. 2004. V. 53. № 1. P. 114.
Денисова Т.О., Александров Г.Г., Фиалковский О.П., Нефедов С.Е. // Журн. неорган. химии. 2003. Т. 48. № 9. С. 1476.
Михайлова Т.Б., Фомина И.Г., Сидоров А.А. и др. // Журн. неорган. химии. 2003. Т. 48. № 10. С. 1648.
Margossian T., Larmier K., Kim. S.M. et al. // J. Am. Chem. Soc. 2017. V. 139. № 20. P. 6919.
Karmakar A., Deka K., Sarma R.J., Baruah J.B. // Inorg. Chem. Commun. 2006. V. 9. № 8. P. 836.
Karmakar A., Sarma R.J., Baruah J.B. // Eur. J. Inorg. Chem. 2006. V. 2006. № 22. P. 4673.
Song W.-D., Yan J.-B., Hao X.-M. // Acta Crystallogr. E. 2008. V. 64. P. m919.
Singh S., Saini D., Mehta S.K., Choquesillo-Lasarte D. // J. Coord. Chem. 2011. V. 64. № 9. P. 1544.
Qadir A.M. // Asian J. Chem. 2013. V. 25. № 15. P. 8829.
Walsh J.P.S., Sproules S., Chilton N.F. et al. // Inorg. Chem. 2014. V. 53. № 16. P. 8464.
Bette S., Rincke C., Dinnebier R.E., Voigt W. // Z. Anorg. Allg. Chem. 2016. V. 642. № 9–10. P. 652.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339.
Alvarez S., Avnir D., Llunell M., Pinsky M. // New J. Chem. 2002. V. 26. P. 996.
Alvarez S. // Chem. Rev. 2015. V. 115. № 24. P. 13447.
Павлов А.А., Никовский И.А., Полежаев А.В. и др. // Коорд. химия. 2019. Т. 45. № 6. С. 341 (Pavlov A.A., Nikovskii I.A., Polezhaev A.V. et al. // Russ. J. Coord. Chem. 2019. V. 45. P. 402). https://doi.org/10.1134/S1070328419060046
The Continuous Symmetry Group. http://www.csm.huji.ac.il/new/.
Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds. Pt B: Applications in Coordination, Organometallic, and Bioinorganic Chemistry. N.Y.: Wiley, 2009.
Lever A.B.P. Inorganic Electronic Spectroscopy. Amsterdam: Elsevier, 1984.
Meredith P.L., Palmer R.A. // Inorg. Chem. 1971. V. 10. № 5. P. 1049.
Lee D., Hung P.-L., Spingler B., Lippard S.J. // Inorg. Chem. 2002. V. 41. № 3. P. 521.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия