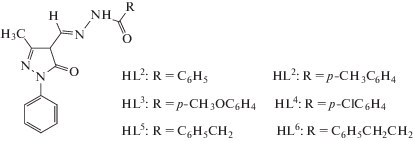Координационная химия, 2020, T. 46, № 4, стр. 232-240
Фотолюминесценция Координационных соединений цинка с ацилгидразонами 3-метил-1-фенил-4-формилпиразол-5-она
А. Н. Гусев 1, *, Е. В. Брага 1, М. А. Крюкова 2, Н. В. Любомирский 1, Е. А. Замниус 1, В. Ф. Шульгин 1
1 Крымский федеральный университет им. В.И. Вернадского
Симферополь, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: galex0330@rambler.ru
Поступила в редакцию 20.10.2019
После доработки 12.11.2019
Принята к публикации 15.11.2019
Аннотация
С целью поиска новых люминофоров, демонстрирующих эффективную фотолюминесценцию в видимой области, синтезированы новые координационные соединения цинка на основе ацилгидразонов 3-метил-1-фенил-4-формипиразол-5-она состава [Zn(L)(CH3COO)Solv] (Solv = H2O (I), Py (II)). Комплексы I и II охарактеризованы методами элементного и термогравиметрического анализа, масс-, ИК-, УФ-спектроскопии. Строение двух комплексов [Zn(L5)(CH3COO)H2O] и [ZnL4(CH3COO)Py] установлено по данным РСА (CCDC № 1958400 и 1958401 соответственно). Комплексы I и II демонстрируют люминесценцию в видимой области с максимумом 414–536 нм и квантовым выходом 9.5–64% в зависимости от природы ацильного фрагмента.
Координационные соединения цинка, проявляющие люминесцентные свойства, в последние десятилетия привлекают все большее внимание исследователей как альтернатива более дорогостоящих люминофоров на базе комплексов платиновых металлов [1] и лантанидов [2]. Полностью заполненная d-оболочка катиона цинка приводит к реализации только внутрилигандных π–π*-переходов при реализации люминесценции [3, 4]. Поэтому основным фактором, позволяющим управлять фотофизическими характеристиками цинковых комплексов, является оптимальный дизайн соответствующих органических лигандов. Наибольшее распространение получили комплексы с лигандами, содержащими донорные атомы кислорода и азота и сопряженные ароматические фрагменты [5–7]. Такие соединения демонстрируют не только высокие показатели яркости, но и являются перспективными источниками синего излучения, необходимого для создания полноцветных электролюминесцентных устройств. Тем не менее в литературе описано всего несколько типов органических производных, координационные соединения которых демонстрируют перспективные для практического использования оптические свойства. Лучшие показатели были получены для азометиновых производных салицилового альдегида, а также его гетероциклических аналогов [8–11]. Однако использование ацилгидразонов в качестве органической матрицы в литературе представлено единичными примерами. При этом даже имеющиеся данные показывают высокую эффективность флуоресценции и термическую устойчивость [12–14]. Следует также отметить, что основное внимание в литературе уделено гидразонам на основе салицилового альдегида и его аналогов, в связи с чем перспективным является поиск альтернативных органических лигандов, способных эффективно связывать катионы цинка и демонстрировать фотолюминесценцию в видимой области [15].
В настоящем сообщении приведены результаты исследования строения и фотолюминесцентных свойств координационных соединений цинка с гидразонами 3-метил-1-фенил-4-формилпиразол-5-она и некоторых карбоновых кислот.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных соединений использовали дигидрат ацетата цинка квалификации (“ч. д. а.”). 3‑Метил-1-фенил-4-формилпиразол-5-он получали по модифицированной методике [16]. Гидразоны HL1–HL6 получали по ранее описанным методикам [17]. Растворители, используемые в работе (этанол, ацетонитрил и пиридин) предварительно очищались путем перегонки.
Синтез координационных соединений I–VI. 3‑Ме-тил-1-фенил-4-формилпиразол-5-он (2 ммоль) растворяли при перемешивании и нагревании (50–60°С) в 25 мл 96%-ного этанола. К полученному раствору добавляли 2 ммоль соответствующего гидразида. При дальнейшем перемешивании и нагревании в течение 1–2 ч образовывался осадок, к которому добавляли еще 10 мл этанола и 2 ммоль Zn(OAс)2 · 2H2O. Реакционную смесь перемешивали при нагревании с обратным холодильником в течение 4 ч. Образовавшийся осадок оставляли на ночь под маточным раствором, затем отфильтровывали, промывали этанолом и высушивали на воздухе. Получили комплексы I–VI.
Комплекс [Zn(L1)(CH3COO)H2O] (I) гидратацетато-N'-(5-окси-3-метил-1-фенил-пиразол-4-ил)метилен]бензогидразидоцинк: кристаллы светло-желтого цвета, выход 72%. ИК-спектр (ν, см–1): 1596 (Амид-I), 1554 (COO–), 1530 (C=N), 1354 (COO–), 1339 (Cпир–O).
Комплекс [Zn(L2)(CH3COO)H2O] (II) гидрат-ацетато-N'-(5-окси-3-метил-1-фенил-пиразол-4-ил)метилен]-4-метилбензогидразидоцинк: кристаллы светло-желтого цвета, выход 59%. ИК‑спектр (ν, см–1): 1596 (Амид-I), 1559 (COO–), 1528 (C=N), 1358 (COO–), 1340 (Cпир–O).
Комплекс [Zn(L3)(CH3COO)H2O] (III) гидрат-ацетато-N'-(5-окси-3-метил-1-фенил-пиразол-4-ил)метилен]-4-метоксибензогидразидоцинк: кристаллы светло-желтого цвета, выход 86%. ИК-спектр (ν, см–1): 1601 (Амид-I), 1558 (COO–), 1528 (C=N), 1348 (COO–), 1343 (Cпир–O).
Комплекс [Zn(L4)(CH3COO)H2O] (IV) гидрат-ацетато-N'-(5-окси-3-метил-1-фенил-пиразол-4-ил)-метилен]-4-хлорбензогидразидоцинк, кристаллы светло-желтого цвета, выход 78%. ИК-спектр (ν, см–1): 1595 (Амид-I), 1566 (COO–), 1526 (C=N), 1362 (COO–), 1343 (Cпир–O).
Комплекс [Zn(L5)(CH3COO)H2O] (V) гидрат-ацетато-N'-(5-окси-3-метил-1-фенил-пиразол-4-ил)метилен]-2-фенилэтаногидразидоцинк, кристаллы кремового цвета, выход 63%. ИК-спектр (ν, см–1): 1606 (Амид-I), 1562 (COO–), 1530 (C=N), 1353 (COO–), 1346 (Cпир–O).
Комплекс [Zn(L6)(CH3COO)H2O] (VI) гидратацетато-N'-(5-окси-3-метил-1-фенил-пиразол-4-ил)метилен]-3-фенилпропаногидразидоцинк, кристаллы кремового цвета, выход 78%. ИК-спектр (ν, см–1): 1607 (Амид-I), 1560 (COO–), 1529 (C=N), 1361 (COO–), 1346 (Cпир–O).
Синтез координационных соединений VII–XII. 3-Метил-1-фенил-4-формилпиразол-5-он (2 ммоль) растворяли при перемешивании и нагревании (50–60°C) в 25 мл 96%-ного этанола. К полученному раствору добавляли 2 ммоль соответствующего гидразида. При дальнейшем перемешивании при нагревании в течение 1–2 ч образовывался осадок, к которому, добавляли еще 10 мл этанола и 2 ммоль Zn(OAс)2 · 2H2O и 5 мл пиридина. Реакционную смесь перемешивали при нагревании с обратным холодильником в течение 4 ч. Образовавшийся осадок оставляли на ночь под маточным раствором, затем отфильтровывали, промывали этанолом и высушивали на воздухе. Получили комплексы VII–XII.
Комплекс [Zn(L1)(CH3COO)Py] (VII) пиридин-aцетато-N'-(5-окси-3-метил-1-фенил-пиразол-4-ил)метилен]бензогидразидоцинк, кристаллы кремового цвета, выход 85%. ИК-спектр (ν, см–1): 1595 (Амид-I), 1546 (COO–), 1530 (C=N), 1341 (COO–), 1339 (Cпир–O).
Комплекс [Zn(L2)(CH3COO)Py] (VIII) пиридинaцетато-N'-(5-окси-3-метил-1-фенил-пиразол-4-ил)метилен]-4-метилбензогидразидоцинк, кристаллы светло-желтого цвета, выход 81%. ИК-спектр (ν, см–1): 1596 (Амид-I), 1557 (COO–), 1527 (C=N), 1356 (COO–), 1343 (Cпир–O).
Комплекс [Zn(L3)(CH3COO)Py] (IX) пиридин-ацетато-N'-(5-окси-3-метил-1-фенил-пиразол-4-ил)метилен]-4-метоксибензогидразидоцинк, кристаллы светло-желтого цвета, выход 90%. ИК-спектр (ν, см–1): 1598 (Амид-I), 1566 (COO–), 1530 (C=N), 1357 (COO–), 1341 (Cпир–O).
Комплекс [Zn(L4)(CH3COO)Py] (X) пиридинaцетато-N'-(5-окси-3-метил-1-фенил-пиразол-4-ил)ме-тилен]-4-хлорбензогидразидоцинк, кристаллы светло-желтого цвета, выход 83%. ИК-спектр (ν, см–1): 1601 (Амид-I), 1564 (COO–), 1528 (C=N), 1358 (COO–), 1341 (Cпир–O).
Комплекс [Zn(L5)(CH3COO)Py] (XI) пиридин-ацетато-N'-(5-окси-3-метил-1-фенил-пиразол-4-ил)метилен]-2-фенилэтаногидразидоцинк, кристаллы кремового цвета, выход 70%. ИК-спектр (ν, см–1): 1604 (Амид-I), 1559 (COO–), 1530 (C=N), 1358 (COO–), 1342 (Cпир–O).
Комплекс [Zn(L6)(CH3COO)Py] (XII) пиридин-ацетато-N'-(5-окси-3-метил-1-фенил-пиразол-4-ил)метилен]-3-фенилпропаногидразидоцинк, кристаллы кремового цвета, выход 72%. ИК-спектр (ν, см–1): 1606 (Амид-I), 1565 (COO–), 1530 (C=N), 1351 (COO–), 1344 (Cпир–O).
ИК-спектры записывали в диапазоне 4000–400 см–1 на ИК-Фурье спектрометре Spectrum Two PerkinElmer Inc. методом однократного НПВО. Спектры диффузного отражения (СДО) регистрировали на спектрофотометре Cintra 4040. Термогравиметрические (ТГ) исследования проводили на приборе STA-8000 в атмосфере кислорода.
Масс-спектры регистрировали на приборе Finnagan TSQ 700. Образцы растворяли в метаноле. Ионы определяли путем сканирования в диапазоне m/z 50–1500.
Спектры фотолюминесценции (ФЛ) для твердых образцов и растворов в ацетонитриле регистрировали на приборе FluoroMax-4 (Horiba Scientific) с ксеноновой лампой (150 Вт) при комнатной температуре. Квантовый выход люминесценции определяли абсолютным методом с помощью интеграционной сферы Quanta-φ.
РСА выполнен на оборудовании Центра коллективного пользования Санкт-Петербургского государственного университета. Монокристаллы, пригодные для РСА получены путем перекристаллизации соответствующих координационных соединений из этанола. Экспериментальные наборы отражений для комплексов V и XI получены стандартным методом [8] на дифрактометре SuperNova, оборудованном HyPix-3000 детектором и источником монохроматического излучения (CuKα, λ = 1.54184 Å).
Структуры расшифрованы прямым методом и уточнены в полноматричном анизотропном приближении для всех неводородных атомов. Позиции атомов водорода рассчитаны геометрически и уточнены в модели “наездника”. Расчеты проведены с использованием комплекса программ SHELX-2014 [17]. Кристаллографические параметры и детали РСА представлены в табл. 1.
Таблица 1.
Основные кристаллографические данные и характеристики рентгеноструктурного эксперимента для комплексов V, X
| Параметр | Значение | |
|---|---|---|
| V | X | |
| Сингония | Триклинная | Ромбическая |
| Пр. гр. | P1 | Pbca |
| Параметры ячейки: | ||
| a, Å | 9.9078(3) | 22.4975(3) |
| b, Å | 10.4391(3) | 7.78610(10) |
| c, Å | 12.1412(3) | 27.3870(4) |
| V, Å3 | 1069.96(6) | 4797.32(11) |
| Z | 2 | 8 |
| ρ(выч.), г/см3 | 1.477 | 1.543 |
| μ, см–1 | 1.945 | 2.814 |
| F(000) | 492 | 2288 |
| Область θ, град | 3.835–69.998 | 3.2060–71.9770 |
| Интервалы индексов | –12 ≤ h ≤ 12, –12 ≤ k ≤ 11, –14 ≤ l ≤ 14 |
–27 ≤ h ≤ 27, –8 ≤ k ≤ 9, –33 ≤ l ≤ 32 |
| Общее число отражений | 9489 | 25 065 |
| Независимых отражений | 4853 | 4691 |
| Число отражений с I ≥ 2σ(I) | 4314 | 4179 |
| Число уточняемых параметров | 283 | 327 |
| R1 по I ≥ 2σ(I) | 0.0323 | 0.0342 |
| wR2 (по всем данным) | 0.0741 | 0.0865 |
| Δρmin/Δρmax, е Å–3 | –0.52/0.310 | –0.37/0.438 |
Полный набор рентгеноструктурных данных для соединений V и XI депонирован в Кембриджском банке структурных данных (CCDC № 1958400, 1958401 соответственно; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Гидразоны НL1–НL6 – удобные матрицы для получения устойчивых координационных соединений. Наличие нескольких “кислых” атомов водорода и возможность существования нескольких таутомерных форм у исследуемых лигандов предполагает возможность получения нескольких типов комплексов в зависимости от степени депротонирования гидразонов. Проведенные в настоящей работе исследования показывают, что взаимодействие НL1–НL6 с ацетатом цинка приводит к образованию комплексов с однократно депротонированной формой лигандов, даже в присутствии избытка пиридина. Состав соединений установлен по данным элементного анализа и ESI-масс-спектроскопии. Данные элементного анализа указывают на соотношение металл–лиганд 1 : 1 в составе комплексов. Моноядерное строение комплексов в растворах подтверждено данными масс-спектроскопии. В масс-спектрах соединений наблюдается наиболее интенсивные пики, отвечающие ожидаемым молярным массам частиц ZnL+ и ZnLH2O+, а также ZnLPy+. Остальные сигналы в масс-спектрах характеризуются низкой интенсивностью (<15%) и отвечают продуктам частичной фрагментации комплексов под действием источника ионизации и диссоциации комплексов.
Термическая устойчивость и сольватный состав комплексов охарактеризован методом ТГ. По данным последней термическое поведение комплексов обеих серий однотипно. Так, для комплексов II–VI нагревание до 100–180°С приводит к дегидратации комплексов, сопровождающейся эндотермическим эффектом ~55–65 кДж/моль, указывающее на координацию молекулы воды. В комплексе I дегидратация протекает в два этапа при 60–100 и 150–190°С. Дальнейшее нагревание приводит к удалению ацетат-аниона и в результате к разложению комплекса и его выгоранию. Десольватация комплексов VII–XII протекает в один этап в интервале 160–280°С. Потеря массы отвечает удалению молекулы пиридина и ацетат-аниона. Дальнейшее нагревание приводит к полной деструкции комплексов.
Способ координации ацилгидразонов установлен по данным ИК-спектроскопии. Наиболее показательным является исчезновение в ИК-спектрах комплексов I–XII полосы валентных колебаний карбонильной группы C=O пиразольного фрагмента [18]. Вместо нее появляется интенсивная полоса в области 1339–1346 см–1, относящаяся к валентным колебаниям группы С–О– и указывающая на депротонирование пиразольного фрагмента и переход его в енольную форму. Полоса Амид-I (1619–1632 см–1) батохромно смещена на 28–34 см–1 по сравнению со спектрами свободных лигандов. Кроме того, в ИК-спектрах комплексов наблюдаются характерные полосы с максимумами при 1566–1541 и 1361–1354 см–1, относящиеся к симметричным и ассиметричным валентным колебаниям карбоксильной группы координированного ацетат-аниона.
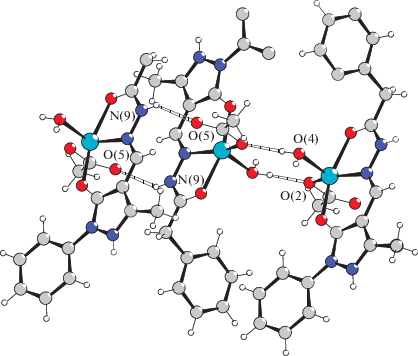
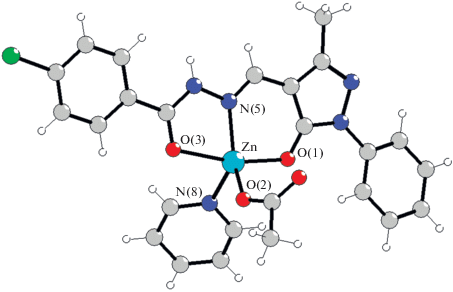
Строение координационных соединений V и X установлено с помощью РСА. Комплекс [Zn(L5)- (CH3COO)H2O] (V) кристаллизуется в триклинной сингонии с пр. гр. $P\bar {1}.$ По данным РСА, соединение V имеет молекулярное строение (рис. 1). Координационная сфера катиона цинка образована одним атомом азота N(6) и атомами кислорода пиразольного фрагмента лиганда О(1) и карбоксильной группы гидразона О(3), а также атомами кислорода координированного ацетат-аниона О(2) и воды О(4). Координационный полиэдр имеет геометрию искаженной тетрагональной пирамиды (параметр Аддисона 0.19). Основание пирамиды образованo атомами O(1), O(2), O(3) и N(6), атом цинка приподнят над основанием пирамиды на 0.318 Å. Ацетат-анион координирован монодентатно, ацилгидразон – в анионной форме за счет депротонирования пиразольного фрагмента. Хелатофорный гидразоновый фрагмент практически плоский, максимальное отклонение от среднеквадратичной плоскости не превышает 0.051 Å. Фенильное кольцо бензильного радикала повернуто относительно хелатного фрагмента на угол 76.72°. Система водородных связей играет ключевую роль в формировании кристаллической решетки. Молекулы комплекса V объединятся в 3D-ансамбль, состоящий из последовательно соединенных центросимметричных димеров за счет связей O(2)···H(4)BO(w4), N(8)···H(4А)O(w4) и N(9)Н(9)···O(5) соответственно (рис. 2). Кроме того, кристаллическая решетка дополнительно стабилизирована системой стекинг-взаимодействий между пиразольными кольцами соседних молекул.
Рис. 1.
Строение молекулы и нумерация атомов комплекса V. Основные длины связей: Zn(1)–O(1) 2.0393(19), Zn(1)–O(2) 1.9798(19), Zn(1)–O(3) 2.1687(19), Zn(1)–O4 2.0220(19), Zn(1)–N6 2.048(2) Å.
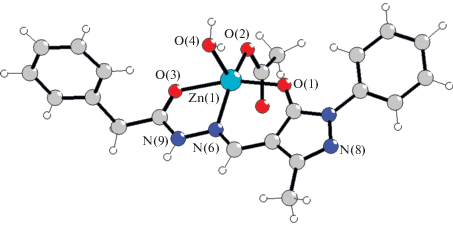
Соединение X кристаллизуется в ромбической сингонии с пр. гр. Pbca и также имеет молекулярное строение (рис. 3). Координационная сфера катиона цинка образована двумя атомами кислорода и атомом азота депротонированного гидразона, атомом кислорода ацетат-аниона и атомом азота координированной молекулы пиридина. Координация молекулы пиридина приводит к изменению геометрии координационного полиэдра до искаженной тригональной бипирамиды (параметр Аддисона 0.57). Длины связей координационного полиэдра [Zn(L4)(CH3COO)Py] (X) близки к аналогичным параметрам в комплексе V. Соседние молекулы комплекса объединены в центросимметричные димеры за счет образования водородных связей N(7)H(7)···O(4).
Рис. 3.
Строение молекулы и нумерация атомов комплекса X. Основные длины связей: Zn–O(1) 2.0534(14), Zn–O(2) 1.9477(15), Zn–O(3) 2.2250(14), Zn–N(5) 2.0387(16), Zn–N(8) 2.0787(16) Å.
В твердом состоянии комплексы I–XII обнаруживают интенсивное поглощение УФ-излучения с максимумом при длине волны ~350–370 нм. Максимум поглощения для комплексов V, VI, а также XI и XII смещен в коротковолновую область по сравнению с комплексами на основе ароматических кислот. Поглощение обусловлено электронными π–π*-переходами в сопряженной системе лиганда, образованной пиразольным циклом и гидразонным фрагментом.
Как указывалось ранее, координационные соединения d10-металлов с азометиновыми производными салицилового альдегида являются перспективными люминесцентными материалами. Координационные соединения на основе 3-метил-1-фенил-4-ацилпиразол-5-онов в последние годы приобретают все большее значение как более эффективные фото- и электролюминфоры [10, 11, 18–21], что требует расширения числа объектов подобного типа. Качественная проверка люминесцентных свойств синтезированных координационных соединений показала, что комплексы I–XII проявляют интенсивную флуоресценцию в синем, сине-зеленом или зеленом диапазонах в зависимости от состава и природы лиганда в твердом состоянии и слабую в растворе (табл. 2).
Таблица 2.
Параметры спектров люминесценции твердых образцов комплексов I–XII
| Соединение | λвозб, нм | λэм, нм | QY, % | CIE | τсредн, нс |
|---|---|---|---|---|---|
| I | 405 | 485 | 19.5 | х = 0.197 y = 0.319 |
9.11 |
| II | 385 | 517 | 15.4 | х = 0.296 y = 0.568 |
8.74 |
| III | 400 | 475 | 21.9 | х = 0.185 y = 0.306 |
11.31 |
| IV | 420 | 495 | 64.2 | х = 0.186 y = 0.331 |
12.10 |
| V | 370 | 425 | 32.9 | х = 0.157 y = 0.102 |
9.17 |
| VI | 371 | 414 | 23.0 | х = 0.157 y = 0.105 |
9.54 |
| VII | 395 | 483 | 30.3 | х = 0.162 y = 0.219 |
11.9 |
| VIII | 395 | 536 | 30.0 | х = 0.388 y = 0.544 |
15.43 |
| IX | 395 | 468 | 33.0 | х = 0.159 y = 0.198 |
20.3 |
| X | 420 | 486 | 36.7 | х = 0.190 y = 0.346 |
17.28 |
| XI | 373 | 457 | 27.9 | х = 0.153 y = 0.136 |
16.17 |
| XII | 390 | 438 | 9.5 | х = 0.175 y = 0.199 |
18.83 |
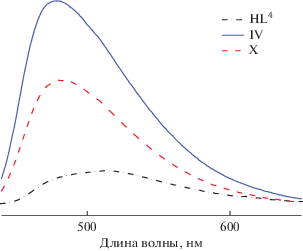
Исходные гидразоны в твердом состоянии проявляют слабую фотолюминесценцию с максимумами при 502 (HL1), 520 (HL2), 502 (HL3), 508 (HL4), 435 (HL5) и 437 нм (HL6) соответственно. При переходе к координационным соединениям интенсивность люминесценции возрастает, причем максимум излучения смещается в синюю область (рис. 4), что связано с переходом лиганда в иную таутомерную форму при координации.
Рис. 4.
Спектр люминесценции твердых образцов лиганда HL4 и комплексов IV и X на его основе при комнатной температуре (λвозб = 380 нм).
При возбуждении координационных соединений светом с длиной волны 370–420 нм твердые комплексы I–VI демонстрируют интенсивную фотолюминесценцию с максимумами при 485, 515, 475, 493, 425, 414 нм соответственно (рис. 5). Широкая полоса излучения в спектрах ФЛ исследуемых соединений, очевидно, обусловлена переносом энергии между высшей занятой и низшей вакантной молекулярными орбиталями. Известно, что депротонирование органических лигандов при образовании комплексов с d10-металлами значительно уменьшает энергетический зазор между граничными орбиталями и приводит к батохромному сдвигу максимума излучения в спектрах фотолюминесценции. Полученные данные свидетельствуют о нарушении этой закономерности. По сравнению со спектрами свободных лигандов полосы люминесценции соответствующих комплексов гипсохромно смещены на 5–27 нм. Очевидно, это связано с изменением таутомерной формы гидразонов при переходе в координационные соединения [9].
Рис. 5.
Нормализованные спектры люминесценции твердых образцов комплексов I–VI при комнатной температуре (λвозб = 380 нм).
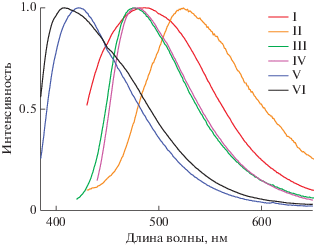
Максимум излучения для комплексов на основе производных ароматических кислот смещен в красную область по сравнению с алифатическими аналогами V и VI. Для комплексов I–IV максимум закономерно батохромно смещается в ряду CH3O < H < Cl < CH3, что согласуется с усилением электрон-донорной способности заместителя. Введение метиленовых звеньев между хелатирующим узлом и фенильным кольцом гидразидного фрагмента лиганда приводит к смещению максимума люминесценции в синюю область спектра
Замена молекул воды на пиридин при переходе к комплексам VII–XII принципиально не изменяет вид спектра люминесценции. Положение максимума или практически не изменяется (VII, IX, X) или батохромно смещается (VIII, XI, XII) по сравнению c гидратированными аналогами.
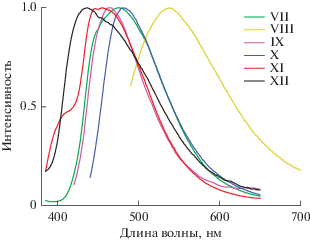
Растворы комплексов I–VI в ацетонитриле практически не излучают, в то время как пиридиновые комплексы VII–XII демонстрируют слабую фотолюминесценцию в видимой области с максимумами 491, 588, 470, 552, 461, 465 нм соответственно (рис. 6). Максимумы спектров в растворе претерпевают батохромный сдвиг по сравнению со спектрами твердых образцов. Скорее всего, это связано с разрушением водородных связей, которые реализуются в кристаллических решетках и способствуют делокализации электронной плотности и сближению энергий граничных орбиталей.
Рис. 6.
Нормализованные спектры люминесценции твердых образцов комплексов VII–XII при комнатной температуре (λвозб = 380 нм).
Квантовый выход люминесценции твердых образцов составляет 9.5–64%. Эффективность фотолюминесценции гидратных комплексов в целом ниже эффективности фотолюминесценции пиридинивых аналогов в случае производных ароматических кислот, в то время как для фенилалкильных производных наблюдается обратная зависимость. Низкая эффектность излучения для растворов в ацетонитриле (квантовый выход менее 1%), скорее всего, связана с тушащим действием OH и NH осцилляторов, действие которых в кристалле нивелируется прочными водородными связями.
Время жизни возбужденного состояния было измерено для твердых образцов с помощью анализа кривых затухания интенсивности излучения при мониторинге максимума излучения. Во всех случаях кривые затухания хорошо аппроксимируются двуэкспоненциальными функциями следующего вида:
(1)
$I = {{A}_{1}}\exp \left( {{{{{\tau }_{1}}} \mathord{\left/ {\vphantom {{{{\tau }_{1}}} t}} \right. \kern-0em} t}} \right) + {{A}_{2}}\exp \left( {{{{{\tau }_{2}}} \mathord{\left/ {\vphantom {{{{\tau }_{2}}} t}} \right. \kern-0em} t}} \right),$Усредненное время жизни τAv рассчитывали как
(2)
${{\tau }_{{A{v}}}} = {{({{A}_{1}}{{\tau }_{1}} + {{A}_{2}}{{\tau }_{2}})} \mathord{\left/ {\vphantom {{({{A}_{1}}{{\tau }_{1}} + {{A}_{2}}{{\tau }_{2}})} {({{A}_{1}} + {{A}_{2}})}}} \right. \kern-0em} {({{A}_{1}} + {{A}_{2}})}}.$Общим трендом для исследуемых комплексов является меньшее время жизни для комплексов I–VI (8.74–12.1 нс) по сравнению с пиридильными аналогами (11.9–20.3 нс), что указывает на дезактивирующую роль координированных молекул воды.
Таким образом, на примерах двух серий комплексов цинка с ацилгидразонами 3-метил-1-фенил-4-формилпиразол-5-оном проанализировано влияние природы заместителей и сольватного состава на фотолюминесцентные характеристики. Для более глубокого понимания взаимосвязи строения и оптических свойств необходимо расширение числа объектов такого типа с подтвержденной структурой, а также проведение теоретического моделирования возбужденного состояния молекул. Тем не менее проведенные исследования показывают очевидную перспективность практического использования синтезированных координационных соединений как люминесцентных материалов, генерирующих синее и зеленое свечение.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Ch Y., Chou P.-T. // Chem. Soc. Rev. 2010. V. 39. P. 638.
Eliseeva S.V., Bunzl J.-C.G. // Chem. Soc. Rev. 2010. V. 39. P. 189.
Xu Y., Meng J., Meng L. et al. // Chem. Eur. J. 2010. V. 16. P. 12898.
Yu X.-Y., Ye L., Zhang X. et al. // Dalton Trans. 2010. V. 39. P. 10617.
Dumur F., Conta E., Wantz G., Gigmes D. // Eur. J. I-norg. Chem. 2014. P. 4186.
Dong Y.-W., Fan R.-Q., Chen W. et al. // RSC Adv. 2016. V. 6. P. 110422.
Li S.M., Zheng X.J., Yuan D.Q. et al. // Inorg. Chem. 2012. V. 51. P. 1201.
Dumur F., Beouch L., Tehfe M.-A. et al. // Thin Solid Films. 2014. V. 564. P. 351.
Kotova O.V., Eliseeva S.V., Averjushkin A.S. et al. // Russ. Chem. Bull. Int. Ed. 2008. V. 57. P. 1881.
Gusev A.N., Kiskin M.A., Braga E.V. et al. // J. Phys. Chem. C. 2019. V. 123. P. 11850.
Burlov A.S., Vlasenko V.G., Dmitriev A.V. et al. // Synthetic Metals. 2015. V. 203. P. 156.
Xu G.-C., Zhang L., Zhang Y.-H. et al. // CrystEngComm, 2013. V. 15. P. 2873.
Wang L., Qin W., Tang X. et al. // J. Phys. Chem. A. 2011. V. 115. P. 1609.
Borbone F., Caruso U., Causà M. et al. // Eur. J. Inorg. Chem. 2014. P. 2695.
Marchetti F., Pettinari C., Di Nicola C. et al. // Coord. Chem. Rev. 2019. V. 401. P. 213069.
Квитко И.Я., Порай-Кошиц Б.А. // Журн. орган. химии. 1969. Т. 5. № 9. С. 1685.
Mohamed S.K., Mague J.T., Akkurt M. et al. // IUCrData. 2017. V. 2. x171666.
Sheldrick G.M. SADABS. Program for Scanning and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 1997.
Gusev A., Shul’gin V., Braga E. et al. // J. Lumin. 2018. V. 202. P. 370.
Gusev A.N., Shul’gin V.F., Braga E.V. et al. // Polyhedron. 2018. V. 155. P. 202.
Burlov A.S., Koshchienko Y.V., Makarova N.I. et al. // Synth. Met. 2016. V. 220. P. 543.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия