Координационная химия, 2020, T. 46, № 4, стр. 249-256
Синтез, кристаллическое строение и термические свойства протонных металлсодержащих ионных жидкостей, галогенметаллатов диэтаноламмония: (HOCH2CH2)2NH2FeCl4, ((HOCH2CH2)2NH2)2CoCl4
М. А. Захаров 1, *, Ю. В. Филатова 1, М. А. Быков 1, Н. В. Авраменко 1, Л. А. Асланов 1
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: max@struct.chem.msu.ru
Поступила в редакцию 15.10.2019
После доработки 05.11.2019
Принята к публикации 15.11.2019
Аннотация
Синтезированы протонные металлсодержащие ионные жидкости с катионом диэтаноламмония (HO–CH2–CH2)2${\text{NH}}_{{\text{2}}}^{ + }$ (DEAH+) и анионами ${\text{FeCl}}_{{\text{4}}}^{-},$ ${\text{CoCl}}_{{\text{4}}}^{{{\text{2}}-}}$ (DEAHFeCl4 (I), (DEAH)2CoCl4 (II)). Методом РСА определено их кристаллическое строение (CIF files CCDC № 1957208 (I) и 1957189 (II)). Соединение I имеет слоистое строение. Слой состоит из катионов DEAH+ с разупорядоченной системой водородных связей и присоединенных анионов ${\text{FeCl}}_{{\text{4}}}^{-}.$ Структура II представляет собой трехмерный каркас, состоящий из катионов DEAH+ и анионов ${\text{CoCl}}_{{\text{4}}}^{{{\text{2}}-}},$ соединенных водородными связями. Термический анализ показал, что температуры плавления I (45°С) и II (55°С) ниже 100°С, энтальпия плавления I выше, чем энтальпия плавления II, а температура разложения II (210°С) выше, чем у I (128°C).
По многим прогнозам глобальное потребление энергии значительно возрастет к середине XXI столетия, и эта возросшая потребность будет частично удовлетворена за счет использования возобновляемых источников энергии. Из-за прерывистого характера действия солнечных панелей должны быть разработаны совместимые крупномасштабные устройства накопления энергии для ее потребления в ночное время. Нужны электрические аккумуляторы большой емкости с высокой плотностью энергии, сделанные из дешевых материалов [1].
Проточные аккумуляторы, основанные на неводных системах, потенциально предлагают более широкие электрохимические окна, более высокую эффективность цикла зарядки, пониженную температурную чувствительность, увеличенный срок службы, а в некоторых случаях даже благоприятные прогнозы стоимости. Перспективны аккумуляторы с ионными жидкостями (ИЖ), поскольку ИЖ практически не испаряются, что отвечает требованиям противопожарной безопасности.
ИЖ интенсивно исследуются последние три десятка лет благодаря разнообразию и специфике их свойств как растворителей [2, 3], катализаторов [2, 4], молекулярных магнитов [5–7], электролитов для аккумуляторов [8, 9] и многого другого. Отдельный класс ИЖ представляют собой соли жидкие при комнатной температуре (комнатно-температурные ИЖ (room temperature ionic liquids)). Как известно, знание структуры помогает выявить зависимость свойств от строения и состава, но исследование структуры жидкостей сопряжено с известными трудностями [10]. Исследование структур веществ методом РСА дает неоспоримые преимущества, но, к сожалению, в случае с ИЖ, часто стеклующихся, а не кристаллизующихся, этот метод бывает неприменим. Исследованные в данной работе методом РСА соли кристаллизуются при температурах ниже 100°С, а поэтому относятся к ИЖ.
Применение в разных областях нашли протонные ИЖ [3, 11, 12]. Протонные ИЖ получаются по стехиометрической реакции между кислотой Бренстеда и основания Бренстеда и содержат диссоциирующий протон в катионе (в отличие от традиционных ИЖ, являющихся апротонными) [3]. Новым направлением в исследованиях ИЖ с недавних пор стали металлсодержащие ИЖ (ионные жидкости с координированным катионом металла) [13]. Протонные металлсодержащие ИЖ (ПМИЖ) представлены в [14].
Недавно была предложена новая группа ионных жидкостей (MetIL) [15–19] с ионами переходного металла в качестве координационных центров и аминоспиртами в качестве лигандов. Есть много интересных результатов, связанных с синтезом, структурой и свойствами MetIL с общей формулой MA2 ∙ 6L, где M = Fe(III), Cu(II), Mn(II), Zn(II), A = ${\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{SO}}_{{\text{3}}}^{-}$ = OTf– (трифлат-анион), ${\text{N}}\left( {{\text{S}}{{{\text{O}}}_{{\text{2}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}}} \right)_{{\text{2}}}^{-}$ = NTf2 (бис-(трифторметилсульфонил)имид), CH3(CH2)CH(C2H5)COO– = EHN (2-этилгексаноат-ион), L = DEA (диэтаноламин) или EA (этаноламин). Все полученные MetIL считаются отдельными координационными соединениями, а не растворами солей переходных металлов или их комплексов в избытке лиганда [15–19]. Они имеют два преимущества: низкая цена и высокая концентрация металлов, которую невозможно получить в растворах солей [20, 21].
В [22] сообщается о RTIL, которые имеют катионы Ag$\left( {{{{\text{H}}}_{{\text{2}}}}{\text{N--R}}} \right)_{{\text{2}}}^{ + }$ или ${\text{Zn}}\left( {{{{\text{H}}}_{{\text{2}}}}{\text{N--R}}} \right)_{{\text{4}}}^{{{\text{2}} + }}$ (R = алкильная группа). Существует также ряд ИЖ, содержащих ферроценил-функционализированные катионы [23]. Синтез, строение и свойства Fe((HOCH2CH2)2NH)6(CF3SO3)3 представлены в [24].
Недавно был опубликован ряд статей о RTIL, содержащих анионы на основе переходных металлов. Примеры включают соединения, в состав которых входят катионы имидазолия с тетраэдрическими галогеноферратами и катионы фосфония с различными кобальтатами, а также RTIL, состоящие из алкиламмония, фосфония или имидазолия и кластеров полиоксотунгстата [25, 26]. Возможность использования EmimFeCl4 в аккумуляторах описана в [27]. Другие области применения ИЖ с анионом ${\text{FeCl}}_{{\text{4}}}^{-}$ описаны в [13, 28–32].
В настоящей работе мы представляем синтез, кристаллическое строение и термические свойства двух протонных металлсодержащих ионных жидкостей с катионом диэтаноламмония (HO–CH2–CH2)2${\text{NH}}_{{\text{2}}}^{ + }$ и анионами ${\text{FeCl}}_{{\text{4}}}^{-}$ или ${\text{CoCl}}_{{\text{4}}}^{{{\text{2}}--}}.$
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали FeCl3 · 6H2O (“ч. д. а”), CoCl2 · 6H2O (“ч. д. а”), НCl (“х. ч.”), H2SO4 (“х. ч.”), (HOCH2CH2)2NH (99%, Acros), Fe (стружка, “х. ч.”), P4O10 (“ч.”).
Синтез хлорида железа(III). Безводный хлорид железа получали в результате реакции железной стружки с осушенным хлором. В колбу Вюрца, содержащую 12.5 г (79 ммоль) KMnO4 с помощью капельной воронки небольшими порциями добавляли 79 мл концентрированной HCl (2.511 моль). Реакционную смесь слегка подогревали. Выделившийся хлор пропускали сначала через промывалку с концентрированной H2SO4, а затем над стружкой Fe (5 г, 89.3 ммоль), помещенной в сухую кварцевую трубку. Трубку во время реакции нагревали промышленным феном (Т ≈ 470°C). Получили блестящие черно-коричневые гигроскопичные кристаллы, которые запаяли в стеклянные ампулы. Выход FeCl3 89%.
Синтез протонной ионной жидкости хлорида диэтаноламмония (DEAHCl). Хлорид диэтаноламмония синтезировали по методике [33]:
(1)
$\begin{gathered} {{\left( {{\text{HOC}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{2}}} \right)}_{2}}{\text{NH}} + {\text{HCl}} = \\ = {{\left( {{\text{HOC}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{2}}} \right)}_{2}}{\text{N}}{{{\text{H}}}_{{\text{2}}}}{\text{Cl}}. \\ \end{gathered} $В круглодонную колбу с обратным холодильником, помещенную в баню со льдом и содержащую 37.103 г (353.4 моль) диэтаноламина в 50 мл дихлорметана, при перемешивании по каплям добавляли соляную кислоту (ρ = 1.1111 г/см3, ω = = 22.54 мас. %) с 5%-ным избытком от стехиометрического количества (54.1 мл, 371 ммоль). Полученный раствор перемешивали на магнитной мешалке в течение 2 ч. Затем из реакционной смеси отгоняли растворитель на роторном испарителе до постоянной массы. В результате получили прозрачную вязкую жидкость. Выход 96%.
Синтез тетрахлороферрата(III) диэтаноламмония (I) выполняли двумя способами согласно реакциям
(3)
$\begin{gathered} {\text{DEAHCl}} + {\text{FeC}}{{{\text{l}}}_{3}} \cdot 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {\text{DEAHFeC}}{{{\text{l}}}_{4}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $В обоих случаях синтезы проводили аналогично с той лишь разницей, что в случае гексагидрата массу соли FeCl3 брали с учетом кристаллизационной воды, а синтез с безводным свежеприготовленным хлоридом железа(III) проводили в сухом боксе в атмосфере аргона.
В стеклянный бюкс с крышкой помещали 6.013 г (37 ммоль) FeCl3 или 10.009 г (37 ммоль) FeCl3 · 6H2O и 5.236 г (37 ммоль) хлорида диэтанол-аммония. Затем смесь при нагревании до 70°С перемешивали в течение 3 ч на магнитной мешалке до полной гомогенизации. Полученное темно-бурое вязкое вещество помещали в эксикатор с P4O10. Через 1 нед. в обоих случаях образовались коричневые кристаллы I.
Синтез тетрахлорокобальтата(II) диэтаноламмония (II) выполняли двумя способами, используя шестиводный хлорид кобальта(II) или безводный хлорид кобальта согласно реакциям
(4)
$2{\text{DEAHCl}} + {\text{CoC}}{{{\text{l}}}_{2}} = {{\left( {{\text{DEAH}}} \right)}_{2}}{\text{CoC}}{{{\text{l}}}_{4}},$(5)
$\begin{gathered} 2{\text{DEAHCl}} + {\text{CoC}}{{{\text{l}}}_{2}} \cdot 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {{\left( {{\text{DEAH}}} \right)}_{{\text{2}}}}{\text{CoC}}{{{\text{l}}}_{4}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Синтезы в обоих случаях проводили аналогично, но в случае гексагидарата массу соли CoCl2 брали с учетом кристаллизационной воды, синтез с безводным хлоридом кобальта(II) проводили в сухом боксе в атмосфере аргона.
В стеклянный бюкс с крышкой помещали 0.507 г (3.9 ммоль) CoCl2 или 0.928 г (3.9 моль) CoCl2 · 6H2O и 1.104 г (7.8 моль) хлорида диэтаноламмония. Затем смесь при нагревании до 50°С перемешивали в течение 1 ч на магнитной мешалке до полной гомогенизации. Полученную темно-сине-фиолетовую жидкость помещали в эксикатор с P4O10. Через 1 нед. в обоих случаях образовались темно-синие кристаллы II.
Образцы полученных металлсодержащих ИЖ исследовали методом дифференциальной сканирующей калориметрии (ДСК) на приборе Netzsch DSC-204 F1. Измерительную систему калибровали согласно стандарту ISO 11357-1 по параметрам фазовых переходов стандартных веществ (C6H12, Hg, бензойная кислота, Ga, KNO3, In, Sn, Bi, CsCl, чистота 99.99%). Систематическая ошибка температурной калибровки (определена по In) составляет 0.1°C.
Образцы тестировали в стандартных алюминиевых ячейках (V = 56 мм3, d = 6 мм), завальцованных крышкой с отверстием (отношение площади дна ячейки к площади отверстия составляло ~40) в потоке (40 мл/мин) азота (“ос. ч.”) при скорости нагревания 5 K/мин. Экспериментальные данные обрабатывали с помощью пакета анализа NETZSCH Proteus Analysis согласно стандарту ISO/CD 11358.
Синхронный термогравиметрический и масс-спектрометрический анализ продуктов термического разложения выполняли для образцов I и II. Анализ проводили на приборе Netzsch STA-409 PC/PG с квадрупольным масс-спектрометром QMS 403C Aëolos (скорость потока аргона 30 мл/мин в интервале 40–600°С и скорость нагрева 5 К/мин).
РСА I и II проведен с использованием монокристального рентгеновского дифрактометра Stadi Vari Pilatus 100K. Кристаллические структуры расшифрованы прямыми методами (программа SHELX-97 [34]) и уточнены полноматричным методом наименьших квадратов. Все атомы, кроме атомов водорода, уточнены анизотропно (программа SHELXL в пакете программ SHELX-97 [34]). Атомы водорода метиленовых групп заданы геометрически и не уточнены. Положения атомов водорода OH и NH2+ групп найдены из разностных синтезов Фурье и уточнены в изотропном приближении, при этом атомы водорода гидроксильных групп уточнены с фиксированным расстоянием O–H, равным 0.86 Å (команда DFIX). В структуре I около атомов кислорода О(1) и О(2) (гидроксильных групп) найдено по два пика электронной плотности, заданных как атомы водорода с заселенностью 0.5, которые уточнены, как указано выше. Для обработки данных использована программа WinGX [35]. Рисунки структур подготовлены с использованием программы Diamond 3.0 [36]. Кристаллографические данные и детали съемки приведены в табл. 1.
Таблица 1.
Кристаллографические данные и условия съемки образцов I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Брутто-формула | C4H8NO2Cl4Fe | C8H16N2O4Cl4Co |
| М | 303.8 | 413 |
| Излучение; λ, Å | CuKα (1.54186) | MoKα ( 0.71073) |
| Сингония | Моноклинная | Моноклинная |
| Пр. гр. | P21/с | С2/с |
| a, Å | 7.781(1) | 11.4866(9) |
| b, Å | 12.764(1) | 9.2475(6) |
| c, Å | 11.947(1) | 17.164(1) |
| β, град | 90.77(1) | 108.273(6) |
| V, Å3 | 1186.4(2) | 1731.3(2) |
| Z | 4 | 4 |
| ρ(выч.), г/см3 | 1.701 | 1.585 |
| Температура, К | 293(2) | 293(2) |
| μ, мм–1 | 18.242 | 1.617 |
| F(000) | 612 | 852 |
| Область θ, град | 5.07–66.40 | 2.499–31.092 |
| Общее число рефлексов | 7154 | 12 523 |
| Число независимых рефлексов (Rint) | 2011 (0.0849) | 2748 (0.1141) |
| Число рефлексов с I >2σ(I) | 1036 | 2052 |
| Число уточняемых параметров | 125 | 104 |
| GOOF по F 2 | 0.785 | 1.018 |
| R1 по I > 2σ(I) | 0.0382 | 0.0437 |
| wR2 (по всем данным) | 0.0652 | 0.1335 |
| Остаточная электронная плотность (min/max), e Å–3 | –0.21/0.24 | –0.71/1.42 |
Кристаллические структуры депонированы в Кембриджском банке структурных данных (CCDC № 1957208 (I) и 1957189 (II); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif). Параметры кристаллических структур I и II также можно получить у авторов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
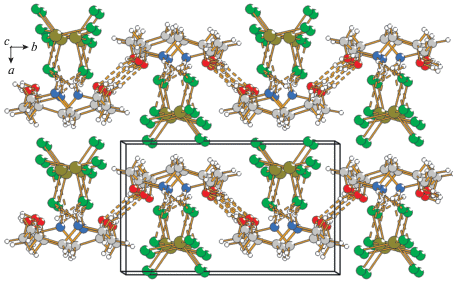
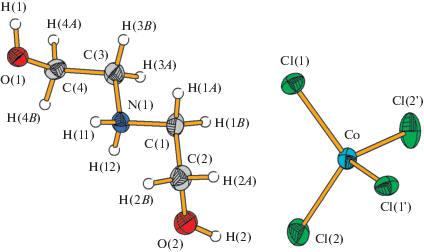
Независимая часть элементарной ячейки в структуре I состоит из катиона DEAH+ и аниона ${\text{FeCl}}_{{\text{4}}}^{-}.$ Атом железа окружен хлорид-ионами по вершинам искаженного тетраэдра (рис. 1) с расстояниями Fe(1)–Cl(l) 2.1663(15), Fe(1)–Cl(2) 2.2096(14), Fe(1)–Cl(3) 2.1710(14) и Fe(1)–Cl(4) 2.1902(15) Å, наиболее далеко от атома железа располагаются атомы хлора, образующие водородные связи (BC) с атомами азота диэтаноламмония (N(1)···Cl(2) 3.468(5), N(1)···Cl(2') 3.517(5) и N(1)···Cl(4) 3.338(5) Å). Атомы водорода гидроксильных групп были уточнены в двух равнозаселенных (по 0.5) положениях, так как, с одной стороны, у атомов O(2) и O(1) имеется по два коротких расстояния (2.758(6) и 2.719(5) Å), подходящих для BC, с другой – на разностном синтезе Фурье локализуются пики электронной плотности, подходящие для атомов водорода. Катионы образуют тетрамеры посредством BC между атомами O(2) и О(1) разных молекул диэтаноламмония, причем предполагаемое разупорядочение атомов водорода по двум позициям можно объяснить равновероятным образованием BC либо через атомы H(2) и H(4) (BC показаны штрихом на рис. 2), либо через атомы H(1) и H(3) (BC показаны пунктиром на рис. 2).
Рис. 1.
Фрагмент структуры I. Тепловые эллипсоиды с вероятностью 50%. Атомы водорода H(1), H(2), H(3) и H(4) имеют заселенность 0.5.
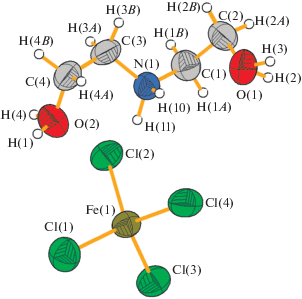
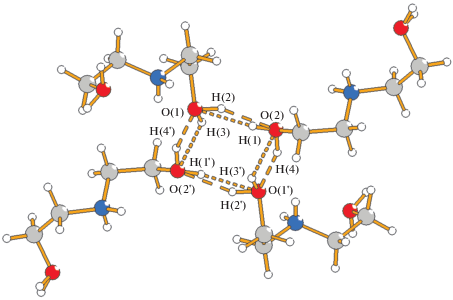
Рис. 2.
Тетрамеры из катионов DEAH+ в структуре I. Анионы не показаны. Штрихом показан один вариант системы водородных связей, пунктиром – другой равновероятный вариант.
Тетрамеры образуют гофрированные слои, перпендикулярные оси а. Анионы дополняют слои из катионов посредством ионных взаимодействий и BC (N(1)···Cl(2) 3.468(5), N(1)···Cl(2') 3.517(5) и N(1)···Cl(4) 3.338(5) Å). Между слоями действуют силы Ван-дер-Ваальса (рис. 3).
Независимая часть элементарной ячейки структуры II состоит одного катиона DEAH+ и половины аниона ${\text{CoCl}}_{{\text{4}}}^{{{\text{2}}--}}$ (атом кобальта лежит на поворотной оси 2) (рис. 4). Атом кобальта имеет координационное окружение из атомов хлора по вершинам искаженного тетраэдра (рис. 4). Расстояния Co–Cl в тетраэдре СоCl4 равны Co‒Cl(1) 2.2842(7) Å и Co–Cl (2) 2.2723(7) Å. Анионы образуют слои, перпендикулярные оси с. Катионы между собой соединяются BC между атомами азота аминогрупп и атомами кислорода гидроксильных групп (N(1)···O(1) 2.799(3), N(1)···O(2) 2.808(4) Å). При этом образуются цепочки из катионов, вытянутых вдоль направления [110] (рис. 5). Соседние катионные цепочки связаны между собой при помощи осей симметрии 2 и 21 и объединяются анионами через BC между атомами кислорода гидроксильной группы и атомами хлора (O(2)···Cl(2) 3.079(3), O(1)···Cl(1) 3.129(2) Å) в трехмерный каркас (рис. 6).
Рис. 5.
Цепочки из катионов DEAH+ в структуре II. Анионы и метиленовые атомы водорода не показаны для ясности.
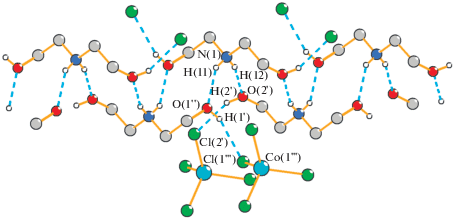
Рис. 6.
Структура II. Штриховыми линиями показаны водородные связи. Атомы водорода метиленовых групп не показаны для ясности.
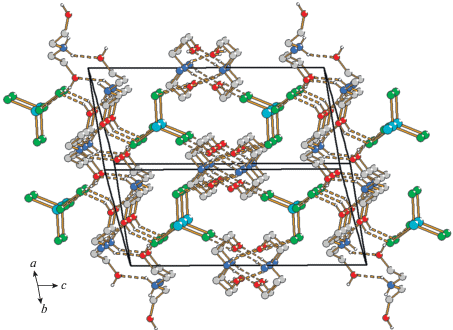
Результаты ДСК всех полученных металлсодержащих ИЖ представлены в табл. 2. Разница в температурах плавления I и II, возможно, зависит от различий кристаллических структур и составов ИЖ: кристаллическая структура I слоистая с взаимодействием между слоями посредством сил Ван-дер-Ваальса, а структура II представляет собой трехмерный каркас, образованный кулоновскими взаимодействиями между катионами и анионами и ВС O–H···O и N–H···Cl. По нашим данным, при замене атома водорода в ОН-группе диэтаноламмония на углеводородный радикал (например, метил) ионные жидкости имеют только процессы стеклования и размягчения, а плавление и кристаллизация отсутствуют.
Таблица 2.
Результаты ДСК металлсодержащих ионных жидкостей
| Образец | Тпл, °С | ΔHпл, кДж/моль |
|---|---|---|
| DEAHFeCl4 (реакция 2) | 45.5 | 87.010 |
| DEAHFeCl4 (реакця3) | 45.4 | 98.308 |
| (DEAH)2CoCl4 (реакция 4) | 52.5 | 28.877 |
| (DEAH)2CoCl4 (реакция 5) | 58.2 | 34.872 |
Согласно данным термического анализа (ДСК–ТГ), температура разложения ИЖ I составила 128°С, а II – 210°С, последняя ИЖ более перспективна для использования, так как имеет более высокую температуру разложения.
В заключение можно отметить следующее: 1) впервые синтезированы две протонные металлсодержащие ИЖ; 2) определены кристаллические структуры полученных ИЖ, DEAHFeCl4 (I) имеет слоистое строение, внутри слоя находится слой из катионов DEAH+ с разупорядоченной системой водородных связей и присоединенных анионов ${\text{FeCl}}_{{\text{4}}}^{-},$ структура (DEAH)2CoCl4 (II) представляет собой трехмерный каркас, состоящий из цепочек катионов DEAH+, соединенных анионами посредством водородных связей; 3) температуры плавления I (45°С) и II (55°С) ниже 100°С, энтальпия плавления I выше, чем энтальпия плавления II; температура разложения II (210°С) выше, чем у I (128°C).
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Staiger C.L., Pratt III H.D., Leonard J.C. et al. // Proc. EESAT (16–19 Oct. 2011). San Diego (California), 2011. P. 91.
Vekariya R.L. // J. Mol. Liq. 2017. V. 227. P. 44.
Greaves T.L., Drummond C.J. // Chem. Rev. 2015. V. 115. P. 11379.
Dai C., Zhang J., Huang C., Lei Z. // Chem. Rev. 2017. V. 117. P. 6929.
Yoshida Y., Tanaka H., Saito G. et al. // Inorg. Chem. 2009. V. 48. P. 9989.
Yoshida Y., Saito G. // J. Mater. Chem. 2006. V. 16. P. 1254.
Hayashi S., Hamaguchi H.-O. // Chem. Lett. 2004. V. 33. P. 1590.
Hapiot P., Lagrost C. // Chem. Rev. 2008. V. 108. P. 2238.
Watanabe M., Thomas M.L., Zhang S. et al. // Chem. Rev. 2017. V. 117. P. 7190.
Hayes R., Warr G.G., Atkin R. // Chem. Rev. 2015. V. 115. P. 6357.
Hu J., Ma J., Zhu Q, et al. // Angew. Chem. Int. Ed. 2015. V. 54. P. 5399.
Hunt P.A., Ashworth C.R., Matthews R.P. // Chem. Soc. Rev. 2015. V. 44. P. 1257.
Zazybin A., Rafikova Kh., Yu V. et al. // Russ. Chem. Rev. 2017. V. 86. P. 1254.
Dengler J.E., Dorodian A., Bernhard R. // J. Organomet. Chem. 2011. V. 696. P. 3831.
Anderson T.M., Ingersoll D., Rose A.J. et al. // Dalton Trans. 2010. V. 39. P. 8609.
Pratt III H.D., Rose A.J., Staiger C.L., et al. // Dalton Trans. 2011. V. 40. P. 11396.
Pratt III H.D., Leonard J.C., Steele L.A.M. et al. // Inorg. Chim. Acta. 2013. V. 396. P. 78.
Pratt III H.D., Ingersoll D., Hudak N.S. et al. // J. Electroanal. Chem. 2013. V. 704. P. 153.
Zakharov M.A., Fetisov G.V., Veligzhanin A.A. et al. // Dalton Trans. 2015. V. 44. P. 18576.
Schaltin S., Brooks N.R., Binnemans K., Fransaer J. // J. Electrochem. Soc. 2011. V. 158. P. D21.
Brooks N. R., Schaltin S., van Hecke K. et al. // Chem. Eur. J. 2011. V. 17. P. 5054.
Huang J.-F., Luo H., Dai S. // J. Electrochem. Soc. 2006. V. 153. P. J9.
Balasubramanian R., Wang W., Murray R.W. // J. Am. Chem. Soc. 2006. V. 128. P. 9994.
Anderson T. M., Ingersoll D., Rose A.J. et al. // Dalton Trans. 2010. V. 39. P. 8609.
Yoshida Y., Tanaka H., Saito G. et al. // Inorg. Chem. 2009. V. 48. P. 9989.
Ortiz-Acosta D., Purdy G.M., Scott B. et al. // ECS Trans. 2009. V. 16. P. 171.
Katayama Y., Konishiike I., Miura T., Kishi T. // J. Power Sources. 2002. V. 109. P. 327.
Wang J., Yao H., Nie Y. et al. // J. Mol. Liq. 2012. V. 169. P. 152.
Sun X., Zhao S., Zhang M. // Petrol. Sci. 2005. V. 2. P. 77.
Small L.J., Pratt III H.D., Staiger C.L., Anderson T.M. // Adv. Sustain. Syst. 2017. V. 1. № 1700066.
Estager J., Holbrey J.D., Swadźba-Kwaśny M. // Chem. Soc. Rev. 2014. V. 43. P. 847.
Wang L.-J., Lin C.-H. // Mini-Rev. Org. Chem. 2012. V. 9. P. 223.
Petrović Z. D., Hadjipavlou-Litina D., Pontiki E. et al. // Bioorg. Chem. 2009. V. 37. P. 162.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Farrugia L.J. // J. Appl. Cryst. 1999. V. 32. P. 837.
Diamond. Crystal and Molecular Structure Visualization. Bonn: Crystal Impact, 2014.
Дополнительные материалы
- скачать Zakharov.docx
- Приложение
Инструменты
Координационная химия