Координационная химия, 2020, T. 46, № 5, стр. 304-315
Первые полиядерные соединения палладия [(C5H12NO)(PdCl3)]n и [(C10H16NO)2(Pd2Cl6)] с высокой противоопухолевой и радиопротекторной активностью
И. А. Ефименко 1, *, М. В. Филимонова 2, А. В. Чураков 1, Н. А. Иванова 1, О. С. Ерофеева 1, А. С. Самсонова 2, Т. С. Подосинникова 2, А. С. Филимонов 2
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Медицинский радиологический научный центр им. А.Ф. Цыба – филиал Национального медицинского исследовательского центрa радиологии Минздрава России
Обнинск, Россия
* E-mail: ines@igic.ras.ru
Поступила в редакцию 16.07.2019
После доработки 14.10.2019
Принята к публикации 21.10.2019
Аннотация
Впервые синтезированы полимерные комплексы палладия [(C5H12NO)(PdCl3)]n (I) и [(C10H16NO)2-(Pd2Cl6)] (II) и методом РСА определено их строение. Комплексы I и II характеризуются умеренной токсичностью (3-й класс токсичности) и высокой противоопухолевой и радиопротекторной активностью. При воздействии I и II на карциному легких Льюис (КЛЛ) наблюдались статистически значимые противоопухолевые и антиметастатические эффекты, превосходящие действие цисплатина: при использовании I и II торможение роста КЛЛ достигало 60.0%, а в случае цисплатина – 48.0%. Подавление активности метастазирования КЛЛ в случае использования I составляло 75%, для II – 91.0% по сравнению с 69.0% в случае цисплатина. Установлено, что II проявляет выраженное радиопротекторное действие. При однократном облучении животных в дозе 8.2 Гр их выживаемость составляла 58.0% против 4.5% в контроле. При фракционном облучении животных в возрастающих дозах 2.5, 3 и 3.5 Гр их выживаемость равна 75.0% против 33.0% в контроле.
В настоящее время в клинической практике широко применяются противоопухолевые препараты на основе комплексов платины (цисплатин, карбоплатин и оксалиплатин). Однако сохраняется большой круг злокачественных новообразований не чувствительных к этим препаратам, а также при повторных курсах химиотерапии нередко развивается резистентность опухоли к ним. Кроме того, указанные выше противоопухолевые препараты на основе платины обладают высокой токсичностью, которая нередко не позволяет в необходимом объеме проводить лечение вследствие угнетения иммунной системы, кроветворной функции костного мозга, нарушения жизнедеятельности сердечнососудистой и нервной систем, печени, почек и других систем организма [1–9].
В связи с этим поиск новых препаратов на основе платиновых металлов является актуальной задачей, так как позволит в случае удачи предложить для лечения онкологических больных более эффективные и менее токсичные соединения, а также решить проблему резистентности.
Из большого числа исследованных соединений палладия выявлен новый класс соединений – моноядерные катионно-анионные комплексы палладия [AmH]n[PdCl4], где Am – представители разных групп азотсодержащих лигандов (амины, амиды, имидазолы, триазолы и др.) [10–12]. Наиболее перспективными соединениями этого класса оказались комплексы палладия [C5H12NO]2[PdCl4] и [C10H16NO]2[PdCl4], содержащие в качестве катиона протонированные молекулы метилморфолина и 1-фенил-2-метиламино-1-пропанола.
В наших публикациях [13–15] и патентах [16–19] представлены результаты исследований противоопухолевой активности на ряде штаммов опухолей. Показана возможность создания соединений палладия, существующие отличия в механизме действия которых обеспечивают этим соединениям преимущества по эффективности и безопасности по сравнению с цисплатином [20–23]. Следует отметить, что указанные выше комплексы обладают и высокой радиопротекторной активностью, результаты исследования которой изложены в приведенных публикациях.
Уменьшение токсичности и повышение противоопухолевой активности описанных ранее представителей разработанного нами нового класса катионно-анионных соединений палладия с высокой противоопухолевой активностью (AmHn)m[PdCl4] может быть достигнуто в результате: 1) замещения хлорид-ионов на карбоксилатные и 2) повышением в комплексе содержания действующего начала (палладия). Для решения первой задачи были изучены условия образования комплексов (AmH)2[Pd(RCOO)4], где Am – морфолин (C4H9NO), R–CH2Cl, CHCl2, CCl3 и CF3. Выбор галогензамещенных карбоновых кислот, рКа которых лежит в интервале 2.87–0.0, основан на результатах изучения возможности замещения хлорида на ацетат. Единственным продуктом реакции ацетата палладия с морфолином оказался аминатный комплекс транс-(C4H9NO)2Pd(CH3COO)2 [24], обладающий низкой противоопухолевой активностью. Вместе с тем в литературе описан биядерный аминатный комплекс с мостиковым ацетатным фрагментом и лигандом 2-фенилпиридином, проявляющий низкую токсичность и более высокую противоопухолевую активность по сравнению с цисплатином [25]. Наше исследование показало, что катионно-анионные комплексы с протонированной молекулой морфолина (C4H10NO)2[Pd(RCOO)4] образуются только в случае, если R = CCl3 и CF3; для R = CH2Cl, CHCl2 образуются биядерные комплексы [(C4H9NO)2Pd2(μ-RCOO)2(RCOO)2] с координированной молекулой морфолина [26].
Цель нашего исследования – повышение противоопухолевой активности моноядерных соединений палладия за счет увеличения действующего начала в них (палладия), т.е. синтеза полиядерных соединений.
В настоящей публикации описаны методы синтеза полиядерных комплексов [(C5H12NO)(PdCl3)]n (I) и [(C10H16NO)2(Pd2Cl6)] (II), содержание палладия в которых более чем на 10% превышает его содержание в моноядерных аналогах. Результаты исследования I и II показали не только высокую противоопухолевую, в том числе и антиметастатическую активность, но и высокую радиопротекторную активность, что открывает возможность осуществления лечения онкобольных комбинированием методов лечения при использовании одного препарата. Полученные комплексы I и II и их свойства ранее в литературе не описаны.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза I и II в качестве исходных соединений использовали PdCl2, квалификации “ч.” (Реахим), 4-метилмофолин C5H11NO и l-1-фенил-2-метиламино-1-пропанол C10H15NO (Fluka), бензонитрил, (С6H5CN)2PdCl2 (Aldrich), ацетон, хлористый метилен, соляная кислота, ледяная уксусная кислоты (Химмед), цисплатин (EBEWE Pharma Ges.m.b.HHfg.KG., Австрия), изотонический раствор хлорида натрия (ООО Гротекс и ОАО Дальхимфарма).
Синтез [(C5H12NO)(PdCl3)]n (I) в водной среде. В круглодонную колбу помещали 0.89 г (8.8 ммоль) метилморфолина в смеси 20 мл воды и 0.90 мл концентрированной HCl. Затем при перемешивании добавляли 1.56 г (8.8 ммоль) дихлорида палладия, предварительно растертого до порошкообразного состояния, и 25 мл воды. Содержимое колбы перемешивали при 40°С на магнитной мешалке в течение 5 ч до полного растворения дихлорида палладия. Раствор коричневого цвета профильтровывали и выпаривали на водяной бане при 35°C до минимального объема. Образовавшийся при охлаждении осадок отфильтровывали и высушивали в вакууме при 93 Па до постоянной массы. Выход 2.43 г (88% от введенного палладия).
| Найдено, %: | C 19.07; | H 4.34; | N 3.94; | Cl 33.97; | Pd 33.66. |
| Для C5H12NOCl3Pd | |||||
| вычислено, %: | C 19.07; | H 3.84; | N 4.44; | Cl 33.77; | Pd 33.79. |
Синтез [(C5H12NO)(PdCl3)]n (I) в неводной среде. В коническую колбу с обратным холодильником помещали 0.45 г (3.32 ммоля) гидрохлорида метилморфолиния и 0.59 г (3.32 ммоля) хлорида палладия, предварительно растертых до порошкообразного состояния, и приливали 30 мл хлористого метилена. Смесь перемешивали при 30°С в течение 15 ч. Образовавшийся осадок розовато-бежевого цвета отфильтровывали, промывали хлористым метиленом и высушивали на воздухе при комнатной температуре до постоянной массы. При перекристаллизации из водного раствора получали монокристаллы вишневого цвета, пригодные для РСА. Выход продукта 0.96 г (91% в расчете на введенный в реакцию палладий).
| Найдено, %: | C 18.97; | H 4.47; | N 4.14; | С1 33.52; | Pd 33.65. |
| Для C5H12NOCl3Pd | |||||
| вычислено, %: | C 19.07; | H 3.84; | N 4.44; | C1 33.77, | Pd 33.79. |
Синтез [C10H16NO]2[Pd2Cl6] (II) в неводной среде. В круглодонную колбу помещали 0.25 г (1.24 ммоль) солянокислого 1-фенил-2-аминопропанола, 10 мл ацетона и 2 мл ледяной уксусной кислоты. К этой смеси приливали раствор 0.47 г (1.25 ммоль) (C6H5CN)2PdCl2 в 30 мл ацетона. Реакционную смесь перемешивали с помощью магнитной мешалки при комнатной температуре до полного растворения твердой фазы (4 ч), затем на роторном испарителе упаривали до объема 10 мл. Переносили раствор в фарфоровую чашку, добавляли 2 мл уксусной кислоты и упаривали на водяной бане при 45°С до формирования обильного осадка коричневого цвета. После охлаждения смеси осадок отфильтровывали через стеклянный фильтр, сушили в вакууме при 93 Па до постоянной массы. Выход продукта 0.34 г (93% от введенного палладия). Монокристалл светло-коричневого цвета вырастили из маточного раствора после отделения осадка.
| Найдено, %: | C 32.23; | H 4.35; | N 4.02; | Cl 28.31; | Pd 28.43. |
| Для C20H32N2O2Cl6Pd2 | |||||
| вычислено, %: | C 31.69; | H 4.26; | N 3.70; | Cl 28.06; | Pd 28.08. |
Элементный анализ проводили на анализаторе фирмы Carlo Erba Instruments CHNSOEA 1108. Содержание палладия в образцах определяли весовым методом.
РСА I и II получены на автоматическом дифрактометре Bruker SMART APEX II (для I) и Bruker SMART 1K (для II) (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) в режиме ω-сканирования. Учет поглощения введен по измерениям интенсивностей эквивалентных отражений [27]. Структуры расшифрованы прямым методом и уточнены полноматричным анизотропным МНК по F 2 для всех неводородных атомов (SHELXTL) [28]. В структуре I все водородные атомы найдены из разностного ряда и их позиционные параметры уточнены. Для кристалла II все атомы водорода помещены в рассчитанные положения и уточнены по схеме “наездника”. Кристаллографические данные и детали дифракционных экспериментов комплексов I и II приведены в табл. 1, параметры водородных связей – в табл. 2.
Таблица 1.
Кристаллографические данные и параметры уточнения структур I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| М | 314.91 | 757.98 |
| Цвет, габитус | Красный, пластинки | Оранжевый, пластинки |
| Размер кристалла, мм | 0.16 × 0.10 × 0.01 | 0.28 × 0.10 × 0.02 |
| Сингония | Ромбическая | Ромбическая |
| Пр. гр. | Pbca | P212121 |
| Параметры ячейки: | ||
| a, Å | 12.9174(8) | 9.0897(8) |
| b, Å | 7.4348(5) | 9.1997(8) |
| c, Å | 19.8878(13) | 33.717(3) |
| V, Å3 | 1910.0(2) | 2819.5(4) |
| Z | 8 | 4 |
| ρcalcd, г cм–3 | 2.190 | 1.786 |
| µ, мм–1 | 2.727 | 1.864 |
| F(000) | 1232 | 1504 |
| Температура, K | 150 | 120 |
| Интеравал по θ, град | 2.58–26.00 | 2.27–27.00 |
| Собрано отражений | 12 051 | 17 330 |
| Независимых отражений (Rint) | 1876 (0.0409) | 6152 (0.0535) |
| Параметров уточнения | 136 | 293 |
| Отражений с I > 2σ(I) | 1536 | 5279 |
| GOOF | 1.010 | 1.089 |
| R-факторы (I > 2σ(I)) | 0.0211, 0.0450 | 0.0509, 0.1033 |
| R-факторы (по всему массиву данных) | R1 = 0.0293, wR2 = 0.0484 | R1 = 0.0637, wR2 = 0.1076 |
| Параметр абс. cтруктуры | 0.01(5) | |
| Остаточная электронная плотность (max/min), e/Å3 | 0.426/–0.384 | 1.361/–1.071 |
Таблица 2.
Геометрические параметры водородных связей в структуре II
| D–H…A | Расстояние, Å | Угол DHA, град | ||
|---|---|---|---|---|
| D–H | A…H | D…A | ||
| O(1A)–H(1C)…Cl(2) | 0.85 | 2.39 | 3.244(6) | 179.9 |
| O(2)–H(2)…Cl(2) | 0.85 | 2.30 | 3.153(6) | 179.9 |
| N(1)–H(1B)…Cl(1) | 0.92 | 2.33 | 3.204(7) | 159.6 |
| N(1B)–H(1AB)…Cl(6) | 0.92 | 2.56 | 3.314(7) | 139.9 |
| N(2A)–H(2AA)…Cl(5) | 0.92 | 2.65 | 3.214(7) | 119.9 |
| N(2A)–H(2BA)…Cl(6) | 0.92 | 2.36 | 3.219(7) | 154.5 |
Структурные данные для соединений I и II депонированы в Кембриджском банке структурных данных (КБСД № 1817357 (I), 1817358 (II); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
Изучение токсичности соединений I и II. Острую токсичность определяли при однократном внутривенном введении аутбредным мышам (самкам) растворов комплексов в диапазоне доз. Перед введением комплексы растворяли в 0.9% изотоническом растворе натрия хлорида до концентрации препарата 0.4%. Введение осуществляли в хвостовую вену мыши внутривенно медленно в течение 15–20 с. В качестве тест-системы были использованы здоровые половозрелые аутбредные нелинейные мыши (самки) массой 18–20 г. В каждую экспериментальную группу включали по шесть особей. Общее количество животных на каждый комплекс составило 36 особей. За два часа до эксперимента животных лишали корма, но не воды. Срок наблюдения за животными составил 14 сут. В период эксперимента регистрировали гибель животных и клинические признаки интоксикации.
Изучение противоопухолевой активности соединений I и II. Оценку противоопухолевой активности проводили на перевиваемой мышиной карциноме легких Льюис (КЛЛ). Штамм КЛЛ получали из банка опухолевых материалов ФГБУ РОНЦ им. Н.Н. Блохина и поддерживали на самцах мышей C57BL6j. Трансплантацию КЛЛ самцам мышей F1 (CBA × C57BL6j) проводили подкожным введением 1.9 × 106 опухолевых клеток в 0.1 мл суспензии на основе среды 199 (Панэко, РФ) в область латеральной поверхности правого бедра, на которой предварительно депилировали шерстный покров. Животных включали в опыт на 7-е сут после перевивки КЛЛ, когда опухолевый узел сформировался и достигал измеряемого размера практически у всех мышей. Методом рандомизации животных распределили на четыре группы – контрольную и три подопытных, по 15 мышей в каждой. Животные контрольной группы в дальнейшем не получали никаких воздействий. Животным первой подопытной группы на 7, 8, 11, 12 и 13 сут роста КЛЛ проводили в/в введение в боковую вену хвоста препарата сравнения цисплатин в дозе 1.2 мг/кг в виде 0.012% раствора – 0.1 мл на 10 г массы тела. Животным второй и третьей подопытных групп в эти же сроки проводили в/в введение в боковую вену хвоста, соответственно, I и II в дозе 22.0 мг/кг в виде 0.22% раствора – 0.1 мл на 10 г массы тела. Все инъекционные растворы изготавливали ex tempore на основе изотонического раствора натрия хлорида и вводили внутривенно медленно.
Переносимость изучаемых препаратов оценивали путем ежедневного осмотра и наблюдения за животными, включая реакцию животных на инъекции, неврологический статус по характеру спонтанной двигательной активности, общей возбудимости, реакции на тактильные и звуковые раздражители, пищевую активность животных и динамику роста их массы тела.
Влияние препаратов на опухолевый процесс изучали по динамике роста и активности метастазирования КЛЛ. Для этого каждые 3–4 сут у всех животных измеряли калипероммаксимальный (L) и минимальный (W) диаметр опухолевых узлов, и оценивали их объем в приближении $V = \left( {L{{W}^{2}}} \right)\left( {{\pi \mathord{\left/ {\vphantom {\pi 6}} \right. \kern-0em} 6}} \right),$ которое надежно коррелирует с данными МРТ [29].
Противоопухолевый эффект оценивали путем статистического сравнения объема опухолевых узлов в контрольной и подопытных группах на различных сроках наблюдения и по индексу торможения роста (ТРО): ${\text{ТРО}}$ = ${{\left( {{{V}_{{\text{K}}}} - {{V}_{{\text{O}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{V}_{{\text{K}}}} - {{V}_{{\text{O}}}}} \right)} {{{V}_{{\text{K}}}} \times 100\% ;}}} \right. \kern-0em} {{{V}_{{\text{K}}}} \times 100\% ;}}$ где ${{V}_{{\text{K}}}}$ и ${{V}_{{\text{O}}}}$ – средние объемы узлов в контрольной и опытной группе [30]. На 21-е сут роста карциномы животных выводили из опыта путем цервикальной дислокации под эфирным наркозом, выделяли легкие, фиксировали их 24 ч в жидкости Буэна и далее под микроскопом CX21 (Olympus Corp., Япония) проводили подсчет числа крупных и мелких легочных метастазов. Антиметастатический эффект оценивали путем статистического сравнения числа метастазов в группах и по индексу ингибирования метастазирования (ИИМ): ${\text{ИИМ}}$ = ${{\left( {{{f}_{{\text{K}}}}{{M}_{{\text{K}}}} - {{f}_{{\text{O}}}}{{M}_{{\text{O}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{f}_{{\text{K}}}}{{M}_{{\text{K}}}} - {{f}_{{\text{O}}}}{{M}_{{\text{O}}}}} \right)} {{{f}_{{\text{K}}}}{{M}_{{\text{K}}}}}}} \right. \kern-0em} {{{f}_{{\text{K}}}}{{M}_{{\text{K}}}}}}$ × $100\% ;$ где fK и fO – доля животных с метастазами в контрольной и опытной группе, MK и MO – среднeе число метастазов в контрольной и опытной группе [30].
Статистическую оценку значимости межгрупповых различий регистрируемых показателей проводили путем рангового дисперсионного анализа Краскела–Уоллиса с последующим применением критерия Данна. Различия полагали достоверными на 0.05 уровне значимости. Расчеты выполнены с помощью программного пакета Statistica 7.0 (StatSoft Inc., США).
Изучение радиопротекторной активности соединений I и II. Радиозащитные свойства I и II изучали на инбредных мышах самцах линии C57B1 массой тела 18–24 г при внутривенном введении в дозах, составляющих 1/8 и 1/2 величины ЛД16 за 15–20 мин до однократного облучения и через 15–20 мин после облучения каждой фракцией при трехкратном ежедневном облучении.
Облучение осуществляли γ-лучами 137Cs (мощность 1.88–1.75 рад/с) на установке ИГУР. Однократное облучение животных производили в дозе 8.2 Гр, при которой ранее было обнаружено защитное действие соединений на основе палладия и производных ароматических аминов [16, 17]. Шкала возрастающих доз облучения при трехкратном ежедневном фракционном воздействии включала дозы 2.5, 3.0 и 3.5 Гр.
Животным опытных групп внутривенно в хвостовую вену вводили 0.35%-ный раствор комплексов в изотоническом растворе хлорида натрия в дозах от 1/8 и 1/2 величины ЛД16 (у I ЛД16 = 71.0 мг/кг, у II ЛД16 = 77.0 мг/кг). Животным соответствующих групп контроля облучения вводили внутривенно физиологический раствор в объеме 0.3 мл на мышь. Животные группы биологического контроля не подвергались воздействию облучения, исследуемых комплексов и растворителя. Каждая экспериментальная группа животных включала от 12 до 24 особей, в том числе группа контроля облучения и группа биологического контроля. Наблюдение за животными проводили в течение 30 сут. Следили за состоянием и поведением животных, отмечали количество павших и сроки их гибели. Выживаемость животных определяли в процентах на 30-е сут наблюдения.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
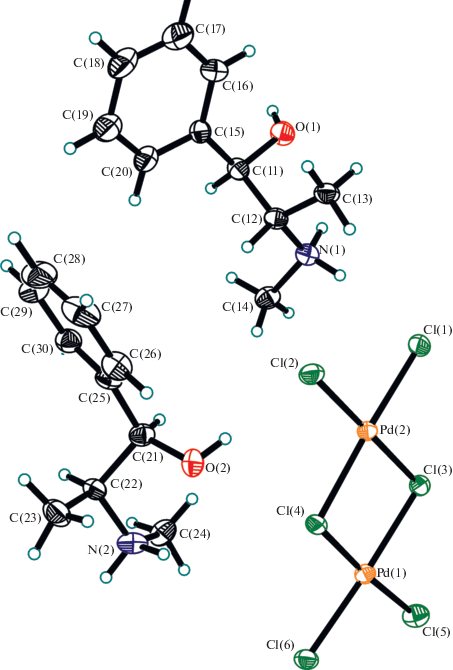
Задача по повышению содержания палладия в новых комплексах была решена при разработке методов синтеза I и II. Полученные соединения представляют собой комплексы с полиядерными анионами. По данным РСА, комплекс I содержит полимерный цепочечный анион ${{\left[ {{\text{PdCl}}_{{\text{3}}}^{--}} \right]}_{n}},$ комплекс II – биядерный анион [Pd2Cl6]2–. В качестве противоионов в I используются протонированные молекулы N-метилморфолина, в II – 1-фенил-2-метиламино-1-пропанола.
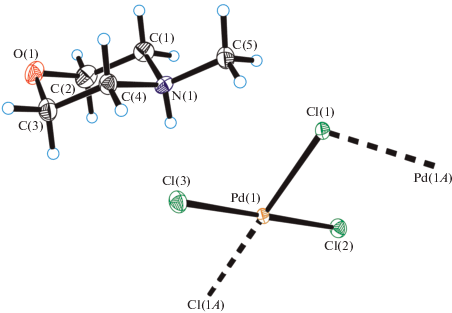
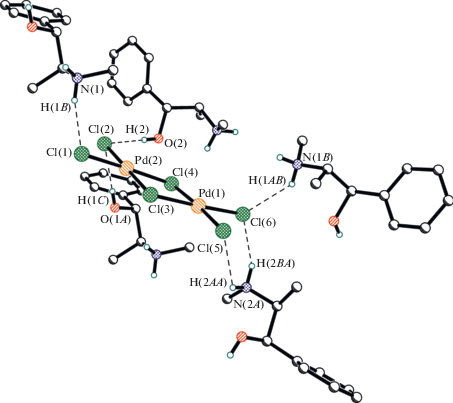
В структуре II практически плоский анион (в пределах 0.145(2) Å) находится в общем положении (рис. 1). Оба атома палладия имеют слегка искаженное квадратное окружение с цис-углами ClPdCl, лежащими в пределах 85.70(6)°–94.33(7)°. Как следует ожидать, концевые расстояния Pd–Cl (2.273(2)–2.297(2) Å) заметно меньше мостиковых (2.311(2)–2.339(2) Å). Это находится в согласии с данными КБСД (май 2019 г., версия 5.40 [31]), в котором для 42 изолированных анионов [Pd2Cl6]2– эти расстояния в среднем составляют 2.277 и 2.338 Å соответственно.
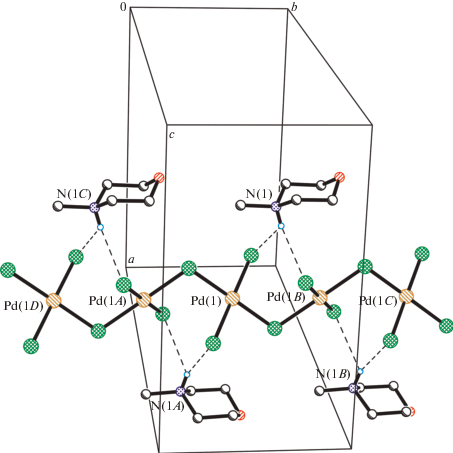
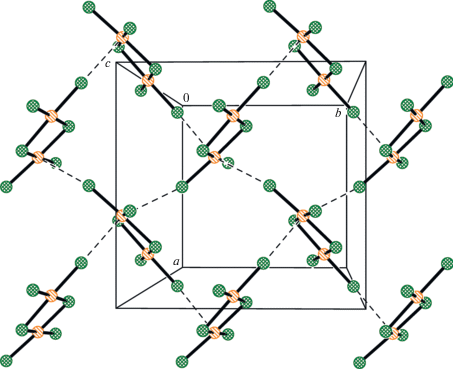
В структуре I обнаружены полимерные цепочечные анионы ${{\left[ {{\text{PdCl}}_{{\text{3}}}^{--}} \right]}_{n}}$ (рис. 2, 3 ). Фрагменты [PdCl3]– находятся в общем положении, а соседние элементы цепи порождаются кристаллографическими осями 21, проходящими вдоль направления а. Атом палладия имеет почти идеальное квадратное окружение с цис-углами ClPdCl, лежащими в пределах 89.44(2)°–90.28(2)°. Интересно отметить, что в отличие от предыдущего случая, концевые и мостиковые расстояния Pd–Cl в этом анионе практически одинаковы: 2.2975(6), 2.3045(6) и 2.3082(6), 2.3137(7) Å соответственно. Кроме того, в отличие от мостикового димерного аниона [Pd2Cl6]2– в структуре II, где углы PdClPd при мостиковых атомах хлора близки к 90° (93.37(7)° и 94.33(7)°), в анионе [PdCl3–]n данный угол равен 107.08(3)°. К настоящему времени в КБ-СД имеются сведения только об одной структуре, содержащей аналогичный цепочечный анион – диметиламмонийной соли [Me2NH2][PdCl3]n (III) [28, 31–33]. Однако в III атом палладия расположен на кристаллографическом центре инверсии, а угол при мостиковом атоме хлора значительно меньше (101.2°). Мостиковые и концевые расстояния Pd–Cl в кристалле III, как и в II, весьма близки (~2.31 Å).
В соединении I катион метилморфолиния принимает конформацию ванны, а метильная группа занимает экваториальное положение. В структуре II присутствуют два кристаллографически независимых хиральных катиона с близкими геометрическими параметрами. Интересно, что они оба имеют гош-конформацию относительно связи Ph(HO)C–C(Me)NH2Me с торсионными углами Ph–C–C–N близкими к 180° (176.1(6)° и 172.8(6)°). Аналогично, в обоих катионах связи Me–C–N–Me принимают транс-конформацию с торсионными углами 158.5(7)° и 171.7(7)° соответственно.
В кристалле I катионы N-метилморфолиния связаны слабой бифуркатной водородной связью N–H…Cl с концевыми атомами хлора полимерного аниона (N…Cl 3.353(2), 3.401(2) Å) (рис. 3).
В структуре II димерные анионы [Pd2Cl6]2– связаны между собой в слои, перпендикулярные кристаллографической оси а за счет слабых, направленных почти перпендикулярно плоскостям анионов, взаимодействий Pd(1)…Cl(1) (3.229 Å) и Pd(1)…Cl(6) (3.751 Å). Межслоевые пространства заняты катионами, связанными с анионами за счет слабых водородных связей типа OH…Cl и NH…Cl, образованных только за счет всех четырех концевых атомов хлора (табл. 2, рис. 4, 5).
Изучение токсичности и биологической активности I и II с полиядерными анионами показало, что они существенно отличаются по этим параметрам от их аналогов с моноядерным анионом [PdCl4]2–.
Исследование острой токсичности I и II при их внутривенном введении показало, что эти соединения принадлежат к соединениям 3-го класса токсичности и опасности, что позволяет считать их умеренно токсичными соединениями [34]. Параметры острой токсичности ЛД16, ЛД50 и ЛД84 составили 71.0, 95.0 и 119.0 мг/кг для I и 77.0, 100.0 и 124.0 мг/кг для II.
Первичный анализ динамики роста КЛЛ в различных группах животных показал, что цисплатин и изучаемые комплексы вызывали торможение роста опухоли (табл. 3). Однако наиболее выраженный, статистически достоверный противоопухолевый эффект наблюдался у животных-опухоленосителей, получавших I (табл. 4). Показатели роста КЛЛ по каждому животному были нормированы на величину объема КЛЛ у этого животного на 7-е сут после перевивки.
Таблица 3.
Динамика роста карциномы легких Льюис в экспериментальных группах
| Группа | Средний объем опухоли, мм3 (M ± S.D.) | ||||
|---|---|---|---|---|---|
| 7 сут | 10 сут | 13 сут | 17 сут | 21 сут | |
| Контроль | 34.9 ± 21.0 (n = 15)* |
76.2 ± 48.9 (n = 15) |
195.4 ± 130.7 (n = 15) |
504.7 ± 348.5 (n = 15) |
731.7 ± 531.3 (n = 15) |
| Цисплатин | 31.6 ± 21.1 (n = 15) |
76.1 ± 73.7 (n = 15) |
163.3 ± 168.1 (n = 15) |
420.5 ± 450.7 (n = 15) |
518.2 ± 564.0 (n = 15) |
| I | 28.3 ± 12.8 (n = 15) |
44.5 ± 27.1 (n = 13) |
87.6 ± 89.9** (n = 13) |
248.1 ± 320.2** (n = 13) |
352.9 ±459.4** (n = 13) |
| II | 51.9 ± 41.4 (n = 15) |
88.4 ± 78.6 (n = 14) |
184.6 ± 164.1 (n = 14) |
407.9 ± 307.8 (n = 11) |
586.9 ± 458.2 (n = 11) |
Таблица 4.
Динамика относительного роста карциномы легких Льюис в экспериментальных группах
| Группа | Средний относительный объем опухоли, отн. ед. (M ± S.D.) | ||||
|---|---|---|---|---|---|
| 7 сут | 10 сут | 13 сут | 17 сут | 21 сут | |
| Контроль | 1.0 (n = 15)* |
2.2 ± 1.1 (n = 15) |
6.5 ± 4.4 (n = 15) |
19.6 ± 17.0 (n = 15) |
27.8 ± 23.0 (n = 15) |
| Цисплатин | 1.0 (n = 15) |
2.1 ± 1.5 (n = 15) |
4.7 ± 5.5 (n = 15) |
11.9 ± 13.8 (n = 15) |
14.4 ± 14.7** (n = 15) |
| I | 1.0 (n = 15) |
1.6 ± 0.7 (n = 13) |
2.9 ± 2.1** (n = 13) |
7.7 ± 8.2** (n = 13) |
10.9 ± 12.1** (n = 13) |
| II | 1.0 (n = 15) |
1.5 ± 0.7 (n = 14) |
3.5 ± 2.2 (n = 14) |
7.8 ± 6.6** (n = 11) |
11.2 ± 10.4 (n = 11) |
В табл. 3 показано статистически достоверное противоопухолевое действие I и II. Существенное торможение роста КЛЛ при воздействии цисплатина развивалось только к концу курса препарата (ТРО = 28.0%) и в последующем возрастало до конца наблюдения (ТРО = 48.0%). Торможение КЛЛ при воздействии изучаемых комплексов развивалось более стремительно, чем в случае использования цисплатина: после первых двух инъекций оно было существенным (ТРО = 23–32%), к концу курса возрастало до 42–55%, и в дальнейшем достигало 60.0% (I и II). При этом важно отметить, что в данном опыте выраженный противоопухолевый эффект I и II в отношении КЛЛ стабильно сохранялся по окончанию их курса (11-е сут) не менее 10 сут, является существенным признаком при оценке противоопухолевого действия.
Таким образом, по действующим формальным критериям отбора перспективных противоопухолевых средств (ТРО > 50%; длительность эффекта по окончанию воздействия – не менее 1 нед. [30]) I и II следует рассматривать как перспективные к дальнейшей разработке в качестве новых противоопухолевых средств.
Активность метастазирования КЛЛ, как и ее рост, в данном опыте отличалась атипично высокой вариабельностью. Анализ показателей метастазирования карциномы показал, что выраженность антиметастатического действия изучаемых комплексов, в целом коррелировала с их противоопухолевым действием (табл. 5). Цисплатин отчетливо подавлял процессы метастазирования (ИММ = 69.0%), тем не менее его эффект в данном опыте оставался в пределах статистической тенденции (p = 0.08–0.17). Существенно более выраженное, статистически достоверное антиметастатическое действие оказывал комплекс II (ИММ = 91.0%). Комплекс II не только ингибировал процессы метастазирования КЛЛ, но и достоверно подавлял рост легочных метастазов – число крупных метастазов снижалось более чем в 4 раза. Комплекс I по выраженности антиметастатического действия также превосходил таковую у цисплатина.
Таблица 5.
Показатели метастазирования КЛЛ в экспериментальных группах
| Группа | Среднее число метастазов на 21-е сут (M ± S.D.) | ИИМ, % | ||
|---|---|---|---|---|
| крупные | малые | общее | ||
| Контроль | 17.1 ± 20.2 (n = 15)* |
28.9 ± 30.2 (n = 15) |
45.9 ± 49.0 (n = 15) |
|
| Цисплатин | 5.1 ± 7.0 (n = 15) |
13.5 ± 21.5 (n = 15) |
18.7 ± 27.4 (n = 15) |
68.7 |
| I | 4.4 ± 7.2 (n = 11) |
12.4 ± 15.2 (n = 11) |
16.8 ± 23.6 (n = 11) |
74.4 |
| II | 3.7 ± 6.8** (n = 13) |
8.5 ± 13.7** (n = 13) |
12.2 ± 20.1** (n = 13) |
90.6 |
Таким образом, согласно действующим критериям по первичному отбору потенциальных антиметастатических средств (ИИМ > 70% [30]) I и II следует рассматривать как перспективные соединения для дальнейшей разработки в качестве противоопухолевых средств с выраженными антиметастатическими свойствами.
Результаты эксперимента свидетельствуют о том, что карцинома легких Льюис, перевиваемая опухоль мышей, относящаяся к списку обязательных к использованию при доклиническом исследовании противоопухолевых средств, является чувствительной опухолью к действию I и II [30].
Результаты исследования радиопротекторной активности I и II свидетельствуют о наличии у них радиозащитных свойств, которые более выражены у II в дозе 10.0 мг/кг (1/8ЛД16) при однократном и фракционном (трехкратном) облучении. Так, при однократном облучении профилактическое введение II в дозе 10.0 мг/кг (1/8ЛД16) существенно облегчало течение лучевого поражения и обеспечило достоверное увеличение выживаемости животных до 58.0% по сравнению с контролем облучения – 4.5% (р < 0.05). При введении II в дозе 39.0 мг/кг (1/2ЛД16) перед однократным облучением также был зарегистрирован высокий процент выживаемости животных – 33.0%. Комплекс I в этом опыте также проявил радиозащитный эффект – при дозе 1/8ЛД16 выживаемость составила 21.0%, при дозе 1/2ЛД16 – 12.5%, что свидетельствует о дополнительном токсическом воздействии I в дозе 1/2ЛД16. При анализе смертности в группах животных контроля облучения и группах животных, получавших I и II в дозах 1/8ЛД16 и 1/2ЛД16, не выявлено каких-либо отличий: средняя продолжительность жизни павших животных в указанных группах, находилась в диапазоне от 13.0 ± 1.6 до 15.0 ± 0.8 сут. Как известно, именно на 10–20-е сут после облучения происходит резкое угнетение гемопоэза и развитие острой лучевой болезни (табл. 6) [35].
Таблица 6.
Результаты изучения радиозащитных свойств I и II при однократном облучении
| Группа | Доза исследуемого соединения | Доза исследуемого соединения, мг/кг | Количество животных в группе | Выживаемость | Средняя продолжительность жизни павших, сут | |
|---|---|---|---|---|---|---|
| абс. | % | |||||
| I | 1/8ЛД16 | 9 | 24 | 5 | 21 | 13.0 ± 1.6 |
| I | 1/2ЛД16 | 36 | 24 | 3 | 12.5 | 12.8 ± 0.9 |
| II | 1/8ЛД16 | 10 | 24 | 14 | 58* | 14.2 ± 1.5 |
| II | 1/2ЛД16 | 39 | 24 | 8 | 33 | 15.7 ± 1.1 |
| Контроль облучения | Физ. р-р | 22 | 1 | 4.5 | 15.0 ± 0.8 | |
| Биологический контроль | 12 | 12 | 100 | |||
В опыте с фракционным трехкратным облучением в возрастающих дозах 2.5, 3.0, 3.5 Гр наиболее эффективным также проявил себя II, который в дозе 1/8ЛД16 (10.0 мг/кг) обеспечил 75.0% выживаемости животных по сравнению с контролем облучения 33.3% и обеспечил максимальную защиту животным в самый пик развития острой лучевой болезни (10–20 сут после облучения), продлив им жизнь до 21.3 ± 5.5 сут, что на 8 сут дольше, чем в группе контроля облучения – 13.6 ± 2.4 сут. Эффективность I при фракционном облучении составила при дозе 1/8ЛД16 (9.0 мг/кг) – 42.0% выживаемости (табл. 7).
Таблица 7.
Результаты изучения радиозащитных свойств I и II при фракционном трехкратном облучении
| Группа | Доза исследуемого соединения | Доза исследуемого соединения, мг/кг | Количество животных в группе | Выживаемость | Средняя продолжительность жизни павших, сут | |
|---|---|---|---|---|---|---|
| абс. | % | |||||
| I | 1/8ЛД16 | 9 | 12 | 5 | 42 | 14.1 ± 1.9 |
| I | 1/2ЛД16 | 36 | 12 | 3 | 25 | 12.9 ± 2.6 |
| II | 1/8ЛД16 | 10 | 12 | 9 | 75* | 21.3 ± 5.5 |
| II | 1/2ЛД16 | 39 | 12 | 6 | 50 | 18.7 ± 3.9 |
| Контроль облучения | Физический раствор | 12 | 4 | 33.3 | 13.6 ± 2.4 | |
| Биологический контроль | 12 | 10 | 100 | |||
Таким образом, в работе описаны методы синтеза и свойства первых катионно-анионных комплексов палладия с полимерным $[{\text{PdC}}{{{\text{l}}}_{{\text{3}}}}]_{n}^{ - }$ и биядерным [Pd2Cl6]2– анионами, характеризующиеся высокой противоопухолевой и радиопротекторной активностью, что позволяет рассматривать эти соединения как основу эффективных средств для использования в онкологии и радиологии. Полученные результаты зафиксированы в патенте [36].
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Lippert B. Cisplatin: Chemistry and Biochemistry of Leading Anticancer Drag. Weinheim: Wiley–VCH, 1995.
Fulford A. // Plat. Met. Rev. 1966. V. 40. № 4. P. 161.
Giachetti S., Perpoint B., Zidani R. et al. // J. Clin. Oncol. 2000. V. 18. P. 136.
Weiss R.V., Poster D.S. // Cancer Treat. Rev. 1982. V. 9. P. 37.
Groth S., Nielsen H., Sorensen J. et al. // Cancer Chemother. Pharmacol. 1986. V. 17. P. 191.
Petrov V.I., Fisenko V.P., Arzamatsev E.V. et al. Guide on Experimental (Pre-Clinical) Study of New Substances for Pharmacology. Remedium, 2000. P. 398.
Brienza S., Vignoud J., Itznaki M. et al. // Proc. Am. Soc. Clin. Oncol. 1995. V. 14. P. 209.
Dress M., Dengler W.M., Hendrics H.R. et al. // Eur. J. Cancer. A. 1995. V. 31. P. 356.
Levi F., Perpoint B., Garuit C. et al. // Eur. J. Cancer. A. 1993. V. 29. P. 1608.
Ефименко И.А. // Коорд. химия. 1998. Т. 24. № 4. С. 282.
Захарова (Ефименко) И.А. // Исследования по неорганической химии и химической технологии. М.: Наука, 1988. С. 171.
Efimenko I.A., Shishilov O.N. // Russ. J. Inorg. Chem. 2012. V. 57. № 14. P. 1695. https://doi.org/10.1134/S0036023612140021
Ефименко И.А., Чураков А.В., Иванова Н.А. и др. // Журн. неорган. химии. 2017. Т. 62. № 11. С. 1476 (Efimenko I.A., Churakov A.V., Ivanova N.A. et al. // Russ. J. Inorg. Chem. 2017. V. 62. P. 1469).https://doi.org/10.1134/S0036023617110043
Efimenko I.A., Shishilov O.N., Ivanova N.A. et al. // Precious Met. 2012. V. 33. S1. P. 240.
Захарова И.А., Жаворонков Н.М., Курбанов Т.Х. и др. // А.с. СССР № 1412229 от 22.03.1988.
Ефименко И.А., Курбакова А.П., Грап С.Р. и др. Пат. РФ № 2022968. // Б.И. 1994. № 21.
Ефименко И.А., Локшин Б.В., Иванова Н.А. Пат. РФ № 2089186 // Б.И. 1997. № 25.
Ефименко И.А., Иванова Н.А. Евраз. пат. № 010431 // Б.И. 2008. № 4.
Кузнецов Н.Т., Ефименко И.А., Иванова Н.А. и др. Пат. РФ № 2613305 // Б.И. 2017. № 8.
Тихомиров А.Г., Иванова Н.А., Ерофеева О.С. и др. // Коорд. химия. 2003. Т. 29. № 7. С. 525 (Tikhomirov A.G., Ivanova N.A., Erofeeva O.S. et al. // Russ. J. Coord. Chem. 2003. V. 29. № 7. P. 489).https://doi.org/10.1023/A:1024731014000
Акатьева М.Е., Ерофеева О.С., Добрынина Н.А. // Коорд. химия. 2004. Т. 30. № 8. С. 621 (Akat’eva M.E., Erofeeva O.S., Dobrynina N.A. et al. // Russ. J. Coord. Chem. 2004. V. 30. № 8. P. 584).https://doi.org/10.1023/B:RUCO.0000037439.30356.e0
Горбачева Л.Б., Тихомиров А.Г., Дедерер Л.Ю. // Хим.-фарм. журн. 2008. Т. 42. № 2. С. 3.
Грехова А.К., Горбачева Л.Б., Иванова Н.А. // Биомед. хим. 2013. Т. 59. № 1. С. 107.
Шишилов О.Н., Стромнова Т.А., Чураков А.В. и др. // Журн. неорган. химии. 2006. Т. 51. № 4. С. 626 (Shishilov O.N., Stromnova T.A., Churakov A.V. et al. // Russ. J. Inorg. Chem. 2006. V. 51. P. 574).https://doi.org/10.1134/S0036023606040127
Qi-Pin Qin, Bi-Qun Zou, Ming-Xiong Tan et al. // Inorg. Chem. Commun. 2018. V. 96. P. 106.
Ефименко И.А., Чураков А.В., Ерофеева О.С. // Коорд. химия. 2019. Т. 45. № 9. С. 515 (Efimenko I.A., Churakov A.V., Erofeeva O.S. et al. // Russ. J. Coord. Chem. 2019. V. 45. № 9. P. 615).https://doi.org/10.1134/S1070328419090033
Sheldrick G.M. SADABS. Program for Scaling and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 1997.
Sheldrick G.M. // Acta. Crystallogr. A. 2008. V. 64. № 1. P. 112.
Kawano K., Hattori Y., Iwakura H. et al. // Exp. Ther. Med. 2012. V. 4. № 1. P. 61.
Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: ГрифиК, 2012. 944 с.
Groom C.R., Allen F.H. // Angew. Chem. Int. Ed. 2014. V. 53. P. 662.
Raper E.S., Kubiak M., Glowiak T. // Acta Crystallogr. C. 1997. V. 53. P. 1201.
Vranec P., Potocnak I., Repovsky P. // Acta Crystallogr. C. 2012. V. 68. P. M370.
Березовская И.В. // Токсикологический вестник. 2010. № 5. С. 1041.
Радиационная медицина. Т. 1 / Под ред. Ильина Л.А. М., 2004.
Барчуков В.Г., Ефименко И.А., Ерофеева О.С. и др. Пат. РФ № 2699809 // Б.И. 2019. № 26.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия