Координационная химия, 2020, T. 46, № 5, стр. 259-263
Комплексные соединения железа(II) с 2,2'-бипиридиламином и кластерными анионами бора [BnHn]2– (n = 10, 12)
С. Е. Короленко 1, *, В. В. Авдеева 1, Е. А. Малинина 1, А. С. Кубасов 1, О. Н. Белоусова 1, Н. Т. Кузнецов 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: korolencko0110@yandex.ru
Поступила в редакцию 31.10.2019
После доработки 10.12.2019
Принята к публикации 16.12.2019
Аннотация
В работе изучены реакции комплексообразования железа(II) с 2,2'-бипиридиламином (BPA) в присутствии кластерных анионов бора [BnHn]2– (n = 10, 12) в водных растворах. Синтезированы смешанолигандные комплексы [Fe(BPA)2(H2O)2][BnHn] (n = 10 (I), n = 12 (II)) с кластерными анионами бора во внешней сфере. Показано, что соотношение реагентов не влияет на состав и строение полученных соединений. Соединения I и II идентифицированы по данным элементного анализа и ИК-спектроскопии. Методом РСА установлено строение комплекса [Fe(BPA)2(H2O)2][B10H10] ∙ 3H2O (I ∙ 3H2O) (СIF file CCDC № 1962445).
Кластерные анионы бора могут образовывать внутрисферные комплексы (в присутствии Cu(I), Ag(I), Pb(II)), а также стабилизировать катионные комплексы металлов (Fe(II), Co(II), Ni(II)), образуя внешнюю сферу [1–10]. В данных работах систематизирована реакционная способность клозо-бороводородных анионов в реакциях комплексообразования переходных металлов в присутствии нейтральных органических лигандов, а также обсуждаются условия протекания реакций, сопровождающих или превалирующих над реакциями комплексообразования. Следует учитывать, что в отсутствие конкурентноспособных органических лигандов молекулы растворителей могут выступать в качестве лигандов и достраивать координационную сферу атома металла.
Железо образует соединения в нескольких устойчивых степенях окисления, что обуславливает интерес к реакциям его комплексообразования. При изучении реакций комплексообразования следует учитывать возможность его окисления под действием кислорода воздуха. В свою очередь, клозо-декаборатный анион способен выступать в качестве восстановителя, снижая степень окисления металлов вплоть до нулевой [1].
В литературе описано ограниченное число комплексов железа(II) с кластерными анионами бора; в этих соединениях кластерные анионы бора образуют внешнюю сферу. При взаимодействии карбонатов или гидроксидов металлов M(II) с (H3O)2[B12H12] образуются смешанокатионные клозо-додекабораты [M(H2O)6](H3O)2[B12H12]2 ∙ 6H2O (M = Mn, Fe, Co, Ni, Cu, Zn, Cd), структуры которых изучены методом РСА [11]. Полученные соединения изоструктурны и построены из катионных аквакомплексов металлов [M(H2O)6]2+. При этом структура стабилизируется за счет образования специфических взаимодействий В–Н⋅⋅⋅Н–О между ВН-группами кластерного аниона и молекулами воды аквакатиона. Изучены комплексы железа(II) с циклопентадиенильным лигандом (Cp) и кластерными анионами бора во внешней сфере (FeCp(Me3NCH2-Cp))2[B10H10] [12], (FeCp(Me2CH-Cp))2[B12H12] [12], (FeCp(Me2NHCH2-Cp))2[B12H12] [13]. трис-Хелатные комплексы железа(II) с азагетероциклическими лигандами L (L = бипиридил (Bipy), фенантролин (Phen)) [14] образуются при взаимодействии солей Fe(II) с лигандами L в присутствии клозо-бороводородных анионов [BnHn]2– (n = 10, 12). Из реакционной системы, содержащей соли Fe(III) с лигандами L и клозо-декаборатный анион, помимо комплексов железа(II) [FeL3][В10H10], на поверхности раствора образуется смешанолигандный комплекс железа(II) с мостиковой CO3-группой [Fe2(µ-CO3)(Phen)4]- [B10H10] ∙ 2.5DMF [15]. Данный биядерный комплекс образуется в ходе окислительно-восстановительной реакции благодаря участию клозо-декаборатного аниона [B10H10]2–; при этом изменяется координационная сфера металла. Координационная сфера железа(II) дополняется карбонат-ионами, источником которых является CO2 воздуха, что и обусловливает образование кристаллов комплекса на поверхности.
В настоящей работе в продолжение исследования взаимодействия переходных металлов M(II) с кластерными анионами бора [BnHn]2– (n = 10, 12) в присутствии N-содержащих органических лигандов изучена реакция комплексообразования железа(II) с 2,2'-бипиридиламином (BPA) в присутствии анионов [B10H10]2– и [B12H12]2– и определено влияние условий протекания реакций на состав полученных соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Декагидро-клозо-декаборат триэтиламмония (Et3NH)2[B10H10] синтезировали из декаборана-14 через стадию образования 1,6-бис(триэтиламин)декаборана согласно методике [16]. Додекагидро-клозо-додекаборат триэтиламмония (Et3NH)2[B12H12] получали в результате пиролиза раствора декаборана в триэтиламинборане по методике [17]. Клозо-додекаборат цезия получали кипячением (Et3NH)2[B12H12] в водном растворе гидроксида цезия до полного удаления триэтиламина. Клозо-додекаборат тетрабутиламмония (Bu4N)2[B12H12] синтезировали по обменной реакции между Cs2[B12H12] и соответствующими галогенидами.
Синтез [Fe(BPA)2(H2O)2][An] ([An] = [B10H10]2– (I), [B12H12]2– (II)). К раствору FeCl2 (1.2 ммоль) в H2O (15 мл) приливали растворы, содержащие (Et3NH)2[B10H10] (1.2 ммоль) или (Bu4N)2[B12H12] (1.2 ммоль) и BPA (3.6 ммоль) в том же растворителе (10 мл). В ходе реакции наблюдали изменение окраски реакционного раствора на оранжевый. В течение 24 ч наблюдали образование окрашенных кристаллов I ∙ 3H2O и II, которые отфильтровывали и высушивали на воздухе. Выход 70–75%.
| Найдено, %: | C 43.08; | H 5.37; | N 15.02; | B 19.2. |
| Для C20H32B10N6O2Fe (I) | ||||
| вычислено, %: | C 43.48; | H 5.84; | N 15.21; | B 19.6. |
| Найдено, %: | C 41.59; | H 5.85; | N 14.51; | B 22.3. |
| Для C20H34B12N6O2Fe (II) | ||||
| вычислено, %: | C 41.70; | H 5.95; | N 14.59; | B 22.5. |
ИК-спектр I (NaCl; ν, см–1): 2437, 2446 ν(BH); 1010 δ(BBH); 3250, 3166 ν(NH); 3571, 3472 ν(OH); 1600–700 ν(BPA).
ИК-спектр II (NaCl; ν, см–1): 2473 ν(BH); 1007 δ(BBH); 3247, 3168 ν(NH); 3573, 3475 ν(OH); 1600–700 ν(BPA).
Элементный анализ на углерод, водород и азот осуществляли на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (CarloErba) (перед проведением анализа образцы высушивали до постоянной массы). Анализ на бор выполняли методом ICPMS на атомно-эмиссионном спектрометре с индуктивно связанной плазмой iCAP 6300 Duo.
ИК-спектры исходных соединений и продуктов реакций записывали на ИК-фурье-спектрометре ИНФРАЛЮМ ФТ-02 (НПФ АП Люмекс) в области 4000–600 см–1 с разрешением 1 см–1. Исследовали суспензии высушенных твердых образцов в вазелиновом (Aldrich) масле. Для записи спектров использовали пластинки NaCl.
Наборы дифракционных отражений для кристаллa I ∙ 3H2O получены в Центре коллективного пользования ИОНХ РАН на автоматическом дифрактометре Bruker APEX 2 CCD (λMoKα, графитовый монохроматор, ω–φ сканирование). Поглощение учтено полуэмпирическим методом по эквивалентным отражениям. В структуре I ∙ 3H2O неводородные атомы уточнены в анизотропном приближении. Все атомы Н локализованы в разностных синтезах и уточнены в изотропном приближении: атомы Н(C) – по модели наездника с Uизо = 1.2Uэкв(С), остальные – независимо.
При сборе и обработке массивов отражений использовали программы APEX2, SAINT и SAD-ABS [18]. Структуры расшифрованы с помощью программ SHELXS-2008 [19]. Уточнение структур проведено по программам SHELXL, версии 2013 и 2014 [19]. Основные кристаллографические данные, параметры эксперимента и характеристики уточнения структур приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структуры I ∙ 3H2O
| Параметр | Значение |
|---|---|
| Брутто-формула | C20H38B10N6O5Fe |
| M | 606.51 |
| T, K | 120 |
| Пр. гр.; Z | P21/n; 4 |
| a, Å | 10.7795(3) |
| b, Å | 21.2357(6) |
| c, Å | 12.9615(4) |
| β, град | 95.7480(10) |
| V, Å3 | 2952.10(15) |
| ρ(выч.), г/см3 | 1.365 |
| µMo, мм–1 | 0.554 |
| F(000) | 1264.0 |
| Размер кристалла, мм | 0.34 × 0.3 × 0.2 |
| Интервал углов 2θ, град | 4.254–64.3 |
| Число отражений измеренных/независимых (N) | 30 479/9576 |
| Rint | 0.0364 |
| R1, wR2 по No | 0.0410, 0.1033 |
| R1, wR2 по N | 0.0594, 0.1120 |
| GOOF | 1.025 |
| Δρmax/Δρmin, e Å–3 | 0.51/–0.47 |
Координаты атомов и другие параметры структуры I ∙ 3H2O депонированы в Кембриджском банке структурных данных (ССDC № 1962445); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
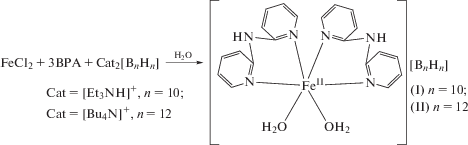
В настоящей работе исследована реакция комплексообразования железа(II) с 2,2'-бипиридиламином в присутствии клозо-боратных анионов [B10H10]2– и [B12H12]2–. Установлено, что при трехкратном избытке BPA образуются комплексы [Fe(BPA)2(H2O)2][An] ([An] = [B10H10]2– (I), [B12H12]2– (II)). Реакции протекают согласно схеме 1:
Схема 1 .
Примечательно, что в отличие от случая с L = = Bipy, Phen [13] независимо от соотношения металл : лиганд проведение реакции комплексообразования в присутствии BPA не приводит к образованию трис-хелатных комплексов [FeL3][An]. Это свидетельствует о том, что катионный комплекс [Fe(BPA)2(H2O)2]2+ проявляет большую устойчивость по сравнению с комплексом [Fe(BPA)3]2+ в водном растворе.
Согласно данным ИК-спектроскопии, в полученных комплексных соединениях кластерные анионы бора находятся во внешней сфере. В ИК-спектрах I и II присутствуют полосы, отвечающие валентным колебаниям связей B–H кластерных анионов бора и О–Н молекул воды, а также полный набор колебаний координированного гетероциклического лиганда в области 1600–700 см–1. Полосы, соответствующие валентным колебаниям связи N–H координированного 2,2'-бипиридиламина в комплексах I и II, наблюдаются в области 3250–3166 см–1.
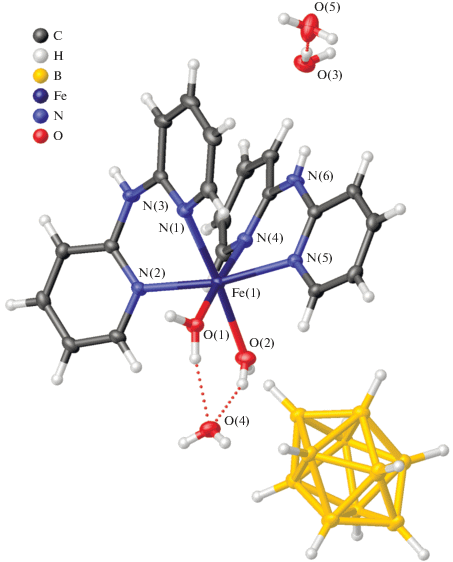
Согласно данным РСА, в структуре I ∙ 3H2O (рис. 1) молекулы лиганда BPA замыкают шестичленные хелатные циклы, образуя асимметричную ванну таким образом, что атом Fe и атом N мостиковой NH-группы отклоняются от плоскости остальных атомов цикла в одну сторону на 0.969 и 0.196, 0.997 и 0.231 Å соответственно. Катионный комплекс [Fe(BPA)2(H2O)2]2+ имеет цис-строение. Пиридиновые циклы одной молекулы BPA образуют между собой двугранный угол 29.3°, другой – 19.9°.
Все пять молекул воды образуют цепочку водородных связей, формируя единые ассоциаты О(1) → О(4) → О(3) → О(5) и О(2) → О(4) → О(3) → → О(5) (табл. 2). Благодаря образованию сетки водородных связей, комплексные катионы [Fe(BPA)2(H2O)2]2+ связаны двумя молекулами воды в 1D-полимерные нити в направлении оси b: Fe → О(1) → О(4) → О(3) → N'(6) и Fe → О(2) → → О(4) → О(3) → N'(6). Все атомы Н молекул воды, а также атом H(3N) молекулы ВPA, не занятые в Н-связях, участвуют во взаимодействиях с атомами Н боргидридного аниона (Н⋅⋅⋅Н 2.09(4)–2.41(5) Å). Комплекс изоструктурен ранее описанному соединению [Ni(BPA)2(H2O)2][B10H10] · · 3H2O [20].
Таблица 2.
Геометрические параметры водородных связей в структуре I ⋅ 3H2O*
| D–H⋅⋅⋅A | Расстояние, Å | Угол DHA, град | |
|---|---|---|---|
| H⋅⋅⋅A | D⋅⋅⋅A | ||
| O(1)–H(1A)⋅⋅⋅O(4) | 1.92(2) | 2.721(2) | 160(2) |
| O(2)–H(2A)⋅⋅⋅O(4) | 2.02(3) | 2.749(2) | 155(3) |
| O(3)–H(3C)⋅⋅⋅O(5) | 1.73(2) | 2.698(2) | 175(2) |
| O(4)–H(4B)⋅⋅⋅O(3) | 2.10(3) | 2.849(2) | 169(3) |
| N(6)–H(6)⋅⋅⋅O(3)#1 | 2.23(2) | 2.969(2) | 160.4(2) |
Следует отметить, что при проведении реакции с солями Fe(III) для лигандов Bipy и Phen была отмечена возможность образования биядерных комплексов Fe(II) с мостиковой карбонатной группой [14]. Установлено, что проведение реакции комплексообразования в присутствии BPA и кластерных анионов бора при использовании солей Fe(III) приводит к восстановлению Fe(III) до Fe(II) с образованием вышеописанных комплексов I, II; образование аналогичных биядерных комплексов железа(II) не наблюдается.
Таким образом, в настоящей работе изучено взаимодействие железа(II) с кластерными анионами бора [B10H10]2– и [B12H12]2– в присутствии азагетероциклического лиганда BPA. Показано, что при проведении реакции комплексообразования в водном растворе природа азагетероциклического лиганда оказывает существенное влияние на формирование комплексных соединений. Установлено, что образование комплексов [Fe(BPA)2(H2O)2][An] ([An] = [B10H10]2– (I), [B12H12]2– (II)) происходит независимо от соотношения реагентов. Проведение реакции комплексообразования с использованием солей Fe(III) приводит к восстановлению Fe(III) до Fe(II) и образованию вышеописанных комплексов.
Авторы сообщают, что у них нет конфликта интересов.
Список литературы
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2017. V. 62. № 13. P. 1673. https://doi.org/10.1134/S0036023617130022
Avdeeva V.V., Malinina E.A., Sivaev I.B. et al. // Crystals. 2016. V. 6. № 5. P. 60. https://doi.org/10.3390/cryst6050060
Avdeeva V.V., Malinina E.A., Goeva L.V., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2148. https://doi.org/10.1134/S0036023610140032
Авдеева В.В., Малинина Е.А., Кузнецов Н.Т. // Журн. неорган. химии. 2020. Т. 65. № 3. С. 334 (Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2020. V. 65. № 3. P. 335. https://doi.org10.1134/S003602362003002X
Авдеева В.В., Малинина Е.А., Жижин К.Ю., Кузнецов Н.Т. // Журн. неорган. химии. 2020. Т. 65. № 4. С. 495 (Avdeeva V.V., Malinina E.A., Zhizhin K.Yu., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2020. V. 65. № 4. P. 514). https://doi.org10.1134/S0036023620040026.
Авдеева В.В., Вологжанина А.В., Малинина Е.А. и др. // Коорд. химия. 2019. Т. 45. №. 4. С. 242 (Avdeeva V.V., Vologzhanina A.V., Malinina E.A. et al. // Russ. J. Coo-rd. Chem. 2019. V. 45. № 4. P. 301).https://doi.org/10.1134/S1070328419040018
Zhizhin K.Yu., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2089. https://doi.org/10.1134/S0036023610140019
Sivaev I.B., Prikaznov A.V., Naoufal D. // Coll. Czech. Chem. Commun. 2010. V. 75. № 11. P. 1149. https://doi.org/10.1135/cccc2010054
Sivaev I.B., Bregadze V.I., Sjöberg S. // Collect. Czech. Chem. Commun. 2002. V. 67. P. 679. https://doi.org/10.1135/cccc20020679
Жданов А.П., Войнова В.В., Клюкин И.Н. и др. // Коорд. химия. 2019. Т. 45. № 8. С. 476 (Zhdanov A.P., Voinova V.V., Klyukin I.N. еt al. // Russ. J. Coord. Chem. 2019. V. 45. № 8. P. 563).https://doi.org/10.1134/S1070328419080098
Nguyen Duc Van. Thesis. Stuttgart: Institut fűr Anorganische Chemie der Universitat, 2009.
Zhang Y., Cai Z., Chen Z. et al. // Chin. J. Struct. Chem. 1982. V. 1. P. 46.
Zhang Y., Chen Z., Cai Z., et al. // Chin. J. Struct. Chem. 1982. V. 2. P. 201.
Avdeeva V.V., Vologzhanina A.V., Goeva L.V. et al. // Z. Anorg. Allg. Chem. 2014. V. 640. № 11. P. 2149.
Авдеева В.В., Вологжанина А.В., Гоева Л.В. и др. // Докл. РАН. 2015. Т. 461. № 6. С. 664 (Avdeeva V.V., Vologzhanina A.V., Goeva L.V. et al. // Dokl. Chem. 2015. V. 461. P. 96).https://doi.org/10.1134/S0012500815040035
Miller H.C., Miller N.E., Muetterties E.L. // J. Am. Chem. Soc. 1963. № 11. P. 338.
Greenwood N.N., Morris J.H. // Proc. Chem. Soc. 1963. № 11. P. 338.
APEX2 (V. 2009, 5-1), SAINT (V7.60A), SADABS (2008/1). Madison (WI, USA): Bruker AXS Inc., 2008–2009.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. № 1. P. 112.
Авдеева В.В., Полякова И.Н., Гоева Л.В. и др. // Журн. неорган. химии. 2016. Т. 61. №. 3. С. 318 (Avdeeva V.V., Polyakova I.N., Goeva L.V. еt al. // Russ. J. Inorg. Chem. 2016. V. 61. № 3. P. 302).https://doi.org/10.1134/S0036023616030037
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия