Координационная химия, 2020, T. 46, № 6, стр. 349-356
Новые смешанолигандные формиаттриазолдикарбоксилаты европия и гадолиния: синтез, структура и люминесцентные свойства
Ю. А. Белоусов 1, 2, *, В. Е. Гончаренко 1, А. М. Лунев 1, А. В. Сидорук 1, С. И. Беззубов 3, И. В. Тайдаков 2
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Физический институт им. П.Н. Лебедева РАН
Москва, Россия
3 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: belousov@inorg.chem.msu.ru
Поступила в редакцию 26.11.2019
После доработки 09.12.2019
Принята к публикации 24.12.2019
Аннотация
В результате сольвотермального синтеза в смеси вода–ДМФ (1 : 1) из смеси 1,2,3-триазол-4,5-дикарбоновой кислоты (H3TDA), NaOH и Ln(NO3)3 (Ln = Eu, Gd) получены комплексы {(NMe2H2)- [Ln(TDA)(HCOO)] ∙ 0.5H2O)}. Для комплекса европия методом РСА установлена кристаллическая структура (CIF file CCDC № 1939689) и показано, что соединение представляет собой ионный металлоорганический каркасный координационный полимер, где полости в анионной структуре [Eu(TDA)(HCOO)]– частично заняты катионами диметиламмония и молекулами воды. При изучении спектров люминесценции производного гадолиния определена энергия триплетного уровня лиганда H3TDA (~25 300 см–1), значение которой позволяет эффективно сенсибилизировать люминесценцию ионов РЗЭ, в частности Eu3+. Изучены кинетика затухания и спектры эмиссии и возбуждения смешанометаллических производных {(NMe2H2)[Gd1 – xEux(TDA)(HCOO)] ∙ 0.5H2O)} и показано, что разбавление европия гадолинием приводит к существенному снижению концентрационного тушения люминесценции европия и возрастанию наблюдаемых времен жизни возбужденного состояния Eu3+.
Уникальные люминесцентные свойства ионов РЗЭ, прежде всего европия, тербия, самария и диспрозия, могут быть использованы в создании OLED-устройств [1–4], сенсорных материалов [5–8], защите банкнот и ценных бумаг [9], а также для биовизуализации [10–13]. Интерес к комплексам РЗЭ со структурой металлоорганические каркасные полимеры (МОКП) связан с возможностью создания уникальных материалов, в которых сорбция молекул-“гостей” пористой структурой приводит к появлению люминесцентного сенсорного отклика [5, 14–18].
Для получения хорошо люминесцирующих МОКП на основе ионов РЗЭ требуется соблюдение некоторых правил, а именно минимизации числа ОН-, CH- и NH-связей в молекулах комплекса, способствующих эффективному тушению люминесценции ионов РЗЭ [19, 20]. Надо подавлять и другие механизмы тушения ионов РЗЭ, например концентрационное тушение, для чего применяют разбавление ионов излучающих РЗЭ тяжелым парамагнитным ионом Gd3+ [21]. Кроме того, лиганд должен обладать высокой энергией триплетного уровня (~20 000 см–1 в случае комплексов европия [22]), необходимой для сенсибилизации ионов РЗЭ. Указанным требованиям отвечают некоторые азолполикарбоновые кислоты, например 1,2,3-триазол-4,5-дикарбоновая кислота (H3TDA) [5, 23], представляющая собой весьма удобный “строительный блок” для получения МОКП. Этому способствует возможность образования им моно-, двух- и трехзарядных анионов, а также экзополидентатность, благодаря которой одна молекула лиганда может координировать сразу два [24], три [25] или четыре [26] иона металла. Депротонированный ион TDA3– вовсе не содержит CH-, NH- и OH-группы, вызвающие мультифононное тушение люминесценции.
К настоящему времени описано много кристаллических структур 1,2,3-триазол-4,5-дикарбоксилатов d-металлов, в частности кобальта [27], меди [28], цинка [26], кадмия [23, 24, 28]. По комплексам H3TDA и структурно близкого ей лиганда – бензимидазолдикарбоновой кислоты – имеется обзорная работа [29].
Комплексы H3TDA с лантанидами представлены в литературе недостаточно. В частности, описаны 3d-МОКП [23, 30] структуры [Ln(TDA)(H2O)3] ∙ ∙ H2O и 1d-полимеры [30, 31]. Было показано, что производные тербия и европия проявляют интенсивную ионную люминесценцию при облучении УФ-светом и вызванную переходами внутри f‑оболочек РЗЭ. Смешанометаллический комплекс [Tb0.9Eu0.1(TDA)] мы предложили в качестве чувствительного сенсора для определения следов H2O в тяжелой воде D2O, а также в апротонных органических растворителях – диоксане и ацетонитриле [5].
Для создания новых комплексов H3TDA с РЗЭ мы провели сольвотермальный синтез МОКП в смеси водa–ДМФ и обнаружили образование новых соединений {(NMe2H2)[Ln(TDA)(HCOO)] ∙ · 0.5H2O} (Ln = Eu (I), Gd (II). Формиат-анион и катион диметиламмония образуются, очевидно, при гидролизе ДМФ.
В настоящей работе изучена кристаллическая структура соответствующего производного европия, а также изучены люминесцентные свойства комплексов европия, гадолиния и смешанных гадолиний-европиевых производных.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованные в работе коммерчески доступные реагенты и растворители: 1,2,3-бензотриазол (“ч.”, Реахим), нитраты европия и гадолиния, полученные растворением соответствующих оксидов (99.999%, Ланхит) в концентрированной азотной кислоте (“х. ч.”, ХРС).
Синтез H3TDA проводили по описанной методике [32]. Продукт реакции очищали двухкратной перекристаллизацией из горячей воды, причем для обесцвечивания раствор кипятили с активированным углем 15 мин и фильтровали. Выход 40%.
ИК-спектр (ν, см–1): 3542 с, 2900–2400 ср, 1720 ср, 1585 ср, 1534 сл, 1395 сл, 1295 ср, 995 с. ЯМР 13C (ДМСО-d6; δ, м.д.): 161.5, 137.8.
Синтез комплексов I, II и {(NMe2H2)[Eu1 – xGdx-(TDA)(HCOO)] ∙ 0.5H2O} (x = 0.1–0.9). В тефлоновый контейнер (10 мл) помещали 3.00 мл ДМФ, добавляли 78.5 мг (0.5 ммоль) H3TDA, 500 мкл 2 М раствора NaOH и 2.5 мл 0.2 М раствора Eu(NO3)3 (I), Gd(NO3)3 (II) или смеси этих растворов в соответствующем требуемом объемном соотношении для смешанометаллических комплексов. Контейнер закрывали, помещали в стальной автоклав, нагревали до 160°С (50°С/ч), выдерживали при 160°С 48 ч. Затем контейнер охлаждали (2°С/ч) до комнатной температуры. Образовавшийся белый осадок отфильтровывали под вакуумом через бумажный фильтр (синяя лента), промывали водой (5 × 10 мл), этанолом (2 × 10 мл) и сушили в вакуумированном эксикаторе над P4O10 48 ч.
Диметиламмония [(1H-1,2,3-триазол-4,5-дикарбоксилато(3-))(μ-формиато) европиат(III)] ∙ ∙ 0.5 гидрат (I): ИК-спектр (ν, см–1): 3600–2800 с, 2730 о.сл, 2539 о.сл, 2436 о.сл, 1571 о.с, 1422 ср, 1369 ср, 1272 ср, 1157 о.с, 1027 о.сл, 1014 о.сл, 859 с, 821 о.с, 798 ср, 783 ср, 712 сл, 530 с, 435 с. Выход 85%.
Диметиламмония [(1H-1,2,3-триазол-4,5-дикарбоксилато(3-))(μ-формиато) гадолинат(III)] ∙ ∙ 0.5 гидрат (II): ИК-спектр (ν, см–1): 3600–2800 с, 2779 о.сл, 2543 о.сл, 443 о.сл, 1574 о.с., 1425 ср, 1370 ср, 1276 ср, 1159 о.с, 1028 о.сл, 1015 сл, 860 с, 822 о.с, 798 c, 785 с, 713 сл, 533 с, 438 с. Выход 88%.
Элементный анализ проводили с использованием микроанализатора Fision Instruments 1108.
ИК-спектры регистрировали на спектрометре FTIR Spectrum One Perkin-Elmer в таблетках KBr в области 400–4000 см–1 с разрешением 0.5 см–1. Спектры фотолюминесценции и времена жизни возбужденных состояний Eu3+ порошкообразных образцов измеряли с помощью спектрофлуориметра Varian Cary Eclipse. Все спектры люминесценции и возбуждения измеряли с поправкой на инструментальные функции. Измерения проводили в кварцевых кюветах диаметром 5 мм при комнатной температуре. Погрешность измерения времен жизни составила 1%.
Термический анализ проводили на приборе NETZSCHSTA 409 PC/PG в атмосфере воздуха, при скорости нагрева 10°С/мин. Порошковые дифрактограммы регистрировали с использованием дифрактометра BrukerD8 Advance (CuKα, λ = 1.5418 Å).
EDX-анализ проводили с использованием электронного микроскопа Leo Supra 50VP, снабженного детектором Oxford Instruments Xmax (напряжение 15 кВ, энергетическое разрешение 129 эВ для линии MnKα (5898.8 эВ)). Статистический анализ данных EDX для определения соотношения Eu : Gd в комплексах проводили с использованием пакета ImageJ.
РСА. Монокристалл комплекса I отобран среди продуктов сольвотермального синтеза. Сбор экспериментальных данныx проведен на автоматическом четырехкружном дифрактометре Xcalibur Sapphire 3 при температуре 120 K (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) в режиме κ-сканирования. Учет поглощения введен по измерениям интенсивностей эквивалентных отражений [33].
Структура расшифрована прямым методом и уточнена полноматричным анизотропным МНК по F 2 для всех неводородных атомов [34]. Кристалл комплекса I – рацемический двойник с соотношением компонент 0.84/0.16. Кроме того, кристаллическая структура псевдосимметричная из-за расположения тяжелых атомов европия, приблизительно (на 87% согласно checkCif) отвечающего более высокосимметричной группе Pnma. Атомы водорода помещены в рассчитанные позиции и уточнены с использованием модели “наездника”. Кристаллографические данные, детали эксперимента и уточнения структур приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структуры I
| Формула | [(CH3)2NH2]+[Eu(C4N3O4)(HCO2]– ∙ 0.5H2O |
|---|---|
| M | 406.15 |
| Размер кристалла, мм | 0.10 × 0.12 × 0.34 |
| Сингония | Ромбическая |
| Пр. гр. | Pna21 |
| a, Å | 12.7834(4) |
| b, Å | 10.0323(3) |
| c, Å | 8.8998(4) |
| V, Å3 | 1141.37(7) |
| Z | 4 |
| ρ(выч.), г/см3 | 2.364 |
| µ, мм–1 | 5.529 |
| F(000) | 780 |
| Область θ, град | 2.08–30.00 |
| Интервалы индексов | –17 ≤ h ≤ 17, –14 ≤ k ≤ 14, –12 ≤ l ≤ 12 |
| Всего отражений | 22 062 |
| Независимых отражений | 3315 (Rint = 0.0486, Rsigma = 0.0303) |
| Полнота сбора данных по θ, % | 100 |
| Число переменных/ограничений | 197/7 |
| Добротность по F 2 | 1.151 |
| R1 по I > 2σ(I) | 0.0281 |
| wR2 (все данные) | 0.0568 |
| Δρmаx/Δρmin, e/Å3 | 1.36/–1.51 |
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (CCDC № 1939689; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac. uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
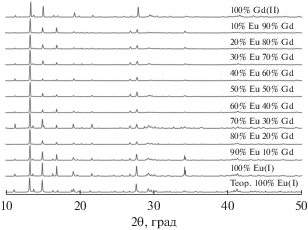
Ранее синтез МОКП на основе триазолдикарбоновой кислоты и катионов РЗЭ проводили только в воде [23, 30, 31]. Замена растворителя на смесь воды и ДМФ позволила получить новые соединения I и II. РФА I, II, теоретический РФА, рассчитанный по данным кристаллической структуры и РФА серии смешанометаллических комплексов приведен на рис. 1. Все соединения изоструктурны, и их рентгенограммы хорошо соотносятся с рассчитанной для структуры I. Незначительную разницу в относительных интенсивностях отдельных рефлексов можно объяснить текстурой образца и наличием переменного количества молекул воды в полостях каркаса.
Рис. 1.
Экспериментальные рентгенограммы комплекса II, смешанометаллической сериии, комплекса I и рассчитанная, по данным РСА, теоретическая рентгенограмма для I (см. сверху вниз).
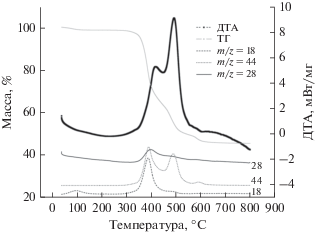
Комплекс I исследован методом ДТА с масс-спектрометрическим детектированием летучих продуктов (рис. 2). В интервале 50–150°С происходит потеря воды (потеря 0.5 молекул воды на одну формульную единицу I составляет: расч. 2.21%, эксп. 1.81%). Комплекс устойчив к дальнейшему нагреванию, и только при температуре выше 330°С начинается его разложение с последующим окислением до Eu2O3, CO2, H2O и N2 (потеря массы: расч. 56.5%, эксп. 55.5%).
Рис. 2.
Кривые потери массы (ТГ), ДТА, а также сигналы с масс-спектрометрического детектора продуктов термического разложения для комплекса I.
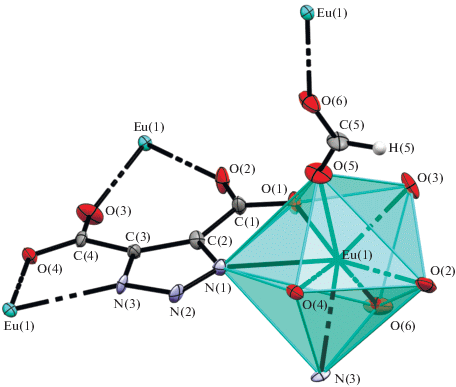
Кристаллическая решетка комплекса I построена как трехмерный каркасный координационный полимер, образованный анионным каркасом [Eu(TDA)(HCOO)]– (рис. 3) и содержащий катионы ${\text{NM}}{{{\text{e}}}_{2}}{\text{H}}_{2}^{ + }$ и молекулы воды в полостях.
Рис. 3.
Кристаллическая структура I. Вид вдоль кристаллографической оси a. Атомы водорода не показаны.

Катионы европия находятся в низкосимметричном координационном окружении (рис. 4). Полиэдр можно описать как искаженную двухшапочную тригональную призму с основаниями N(1), O(1), O(5); N(3), O(2), O(6) и вершинами O(4), O(3). Некоторые параметры кристаллической структуры I суммированы в табл. 2.
Таблица 2.
Некоторые межатомные расстояния и валентные углы в структуре I
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| Eu–O(1) | 2.440(7) | O(3)EuN(3) | 142.9(2) |
| Eu–O(2) | 2.36(1) | O(5)EuO(6) | 150.8(3) |
| Eu–O(3) | 2.374(4) | O(1)EuO(2) | 147.8(3) |
| Eu–O(4) | 2.432(5) | O(4)EuO(6) | 137.7(2) |
| Eu–O(5)(HCOO) | 2.31(1) | O(5)EuN(1) | 86.3(3) |
| Eu–O(6)(HCOO) | 2.333(9) | O(3)EuN(3) | 142.9(2) |
| Eu–O(средн.) | 2.375(1) | O(2)EuN(1) | 148.3(3) |
| Eu–N(1) | 2.572(6) | O(4)EuO(5) | 71.3(3) |
| Eu–N(3) | 2.554(6) | N(1)EuO(1) | 63.8(2) |
| Eu–Eu(min) | 6.8173(4) | N(1)EuO(6) | 104.4(2) |
| Eu–Eu (связанные через μ2HCOO–) | 6.839(1) | O(1)EuN(3) | 121.4(2) |
| Eu–N(4)$({\text{NM}}{{{\text{e}}}_{2}}{\text{H}}_{2}^{ + })$ | 4.20(1) | N(3)EuO(2) | 80.5(3) |
| N4–O(1) | 2.76(2) | O(2)EuO(5) | 92.1(3) |
| N4–O(3) | 3.03(1) | O(4)EuN(1) | 72.7(2) |
| N4–O(7)(H2O) | 2.32(3) | N(3)EuN(1) | 78.7(2) |
Средняя длина связей Eu–О(TDA) (2.4026 Å) заметно превышает среднее расстояние О(НСОО)–Eu (2.3235 Å), что свидетельствует о более прочном характере последней. Расстояния Eu–N (средн. 2.5615 Å) больше любого расстояния Eu–O в силу большей электроотрицательности кислорода.
Все анионы TDA3– эквивалентны, и каждый координирует катион европия двумя донорными атомами: либо двумя атомами кислорода (О(3) и О(2)), либо атомом кислорода и атомом азота (O(1), N(1) и O(4), N(3)). Формиат-анионы также выступают в роли мостиковых лигандов, связывая два катиона европия.
Благодаря использованию лиганда H3TDA, строение которого предопределяет каркасный полимерный характер образуемых им комплексных соединений, в структуре содержится система каналов, максимальный размер которых ~7 × 7 Å. Вид вдоль оси a на полимерную структуру МОКП показан на рис. 2.
Катионы диметиламмония в структуре разупорядочены, и смещение атомов азота между двумя позициями составляет 1.255 Å. Разупорядочение можно связать с тем, что размер полостей в каркасе существенно превышает размеры катиона диметиламмония.
Соединение I при УФ-облучении с разными длинами волн (254, 312, 365 и 405 нм) демонстрирует красно-оранжевую люминесценцию, характерную для комплексов европия. При облучении коротковолновым УФ-светом (254 нм) комплекса II наблюдается неяркая сине-зеленая люминесценция лиганда.
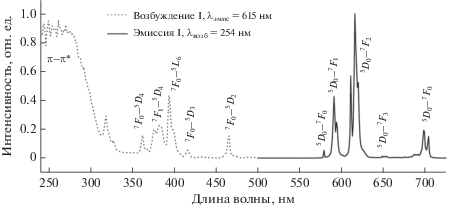
Для определения энергии триплетного уровня лиганда H3TDA был зарегистрирован спектр фосфоресценции комплекса гадолиния II (рис. 5). Для определения положения максимумов спектр представляли в виде суммы трех гауссовых компонент при помощи пакета OriginPro 8.
Рис. 5.
Спектр фосфоресценции II при комнатной температуре (λвозб = 254 нм) и его разложение на гауссианы.
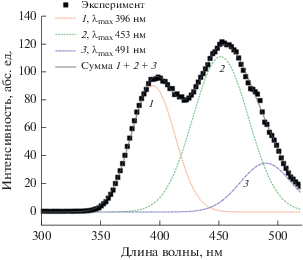
В спектре присутствуют три полосы, положения с максимумами: 396 (25 300), 453 (22 100) и 491 нм (20 400 см–1). Эти полосы следует отнести к фосфоресценции лиганда. Для этих полос удалось определить наблюдаемые времена жизни возбужденных состояний (τнабл), составляющие 111, 126 и 120 мкс (для длин волн 396, 453 и 491 нм соответственно). Энергия первого перехода в 25300 см–1 соответствует значению триплетного уровня лиганда. Энергетический зазор между триплетным уровнем лиганда и резонансным уровнем Eu3+ очень большой и составляет ~8000 см–1, что, согласно правилу Латва [22], должно препятствовать эффективной передачи энергии электронного возбуждения. Несмотря на это комплекс I люминесцирует при УФ-облучении, причем в спектре люминесценции присутствуют исключительно полосы эмиссии европия. Последнее можно объяснить невозможностью эффективного колебательного тушения в исследуемой системе.
Спектры эмиссии и возбуждения комплекса I приведены на рис. 6. В спектре возбуждения присутствует как широкая полоса с максимумом при 254 нм, так и ряд узких полос, наиболее интенсивная из которых имеет максимум при 394 нм, относящихся к f–f-переходам иона европия. Отнесение отдельных переходов спектральным линиям европия проведено на основе литературных данных [35] и показано на рис. 6.
В спектре фотолюминесценции комплекса I отсутствует широкая полоса, найденная для комплекса II и связанная с собственной люминесценцией лиганда. Это свидетельствует о полноте передачи энергии возбуждения с триплетного уровня лиганда на резонансный уровень европия 5D0, т.е. о сенсибилизации люминесценции европия по принципу “эффекта антенны”. Время жизни возбужденного состояния иона Eu3+, определенное по кинетике затухания перехода 5D0–7F2, составило 645 мкс. Это существенно выше, чем в гидрате {[Eu(TDA)(H2O)3](H2O)} [5], где τнабл составило 292 мкс. Возрастание τнабл следует связать с подавлением колебательного ОН-тушения при удалении молекул воды.
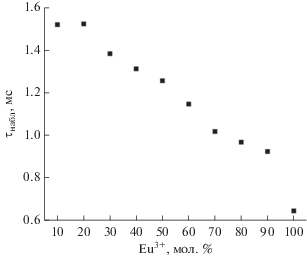
Тем не менее общая интенсивность люминесценции I невелика в сравнении с другими комплексами. Это может быть связано с наличием различных путей безызлучательной релаксации, в частности концентрационного тушения. Для проверки этого предположения была синтезирована серия смешанометаллических комплексов {(NMe2H2)[Eu1 – xGdx(TDA)(HCOO)] ∙ 0.5H2O)} (x = 0.1–0.9) в тех же условиях, в которых получали в чистом виде соединения I и II. Изоструктурность соединений индивидуальным I и II подтверждены методом РФА порошка, соответствие состава заложенному при синтезе подтверждено методом EDX. Зарегистрированные спектры люминесценции для образцов данной серии полностью совпадают со спектрами люминесценции I даже при содержании Gd3+ в 90%. Для данных соединений также изучены τнабл, существенно возрастающие при уменьшении содержания Eu3+ (см. рис. 7). Максимальный эффект достигается при мольной доле европия в 20%, после чего начинается спад интенсивности. Это подтверждает наличие в комплексе I канала безызлучательной релаксации энергии электронного возбуждения иона Eu3+, связанной с концентрационным тушением.
Рис. 7.
Зависимость наблюдаемого времени жизни в комплексах {(NMe2H2)[Eu1 – xGdx(TDA)(HCOO)] ∙ · 0.5H2O} от мольной доли Eu3+.
Таким образом, замена воды на смесь вода–ДМФ при сольвотермальном синтезе триазолдикарбоксилатов РЗЭ приводит к образованию разнолигандных комплексов, содержащих помимо триазолдикабоксилат-аниона формиат-анион и катион диметиламмония, образующиеся при гидролизе ДМФ. Полученные соединения не содержат воды или ДМФ в ближней координационной сфере РЗЭ, что обуславливает люминесценцию комплекса европия, не претерпевающую колебательного тушения. Для дополнительного повышения времен жизни возбужденного состояния успешно себя показал метод разбавления европия гадолинием, что приводит к снижению концентрационного тушения и повышению наблюдаемого времени жизни возбужденного состояния европия почти в 2.5 раза.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Korshunov V.M., Ambrozevich S.A., Taydakov I.V. et al. // Dyes Pigments. 2019. V. 163. P. 291.
Taydakov I.V., Akkuzina A.A., Avetiso R.I. et al. // Lumin. 2016. V. 77. P. 31.
Girotto E., Pereira A., Arantes C. et al. // Lumin. 2019. V. 208. P. 57.
Panyushkin V.T., Kapustina A.A., Nikolayev A.A. et al. // J. Appl. Spectr. 2019. V. 85. P. 1133.
Gontcharenko V.E., Lunev A.M., Taydakov et al. // IEEE Sens. J. 2019. V. 19. P. 7365.
Turel M., Čajlaković M., Austin E. et al. // Sens. Actuat. B. 2008. V. 131. P. 247.
Almeida N.A., Rodrigue J., Silva P. et al. // Sens. Actuat. B. 2016. V. 234. P. 137.
Sørensen T.J., Kenwrigh A.M., Faulkner S. // Chem. Sci. 2015. V. 6. P. 2054.
Suyver J.F., Meijerink A. // Chem. Weekblad. 2002. V. 98. P. 12.
Yang Y., Wang P., Lu L. et al. // Anal. Chem. 2018. V. 90. P. 7946.
DaCosta M.V., Doughan S., Han Y., Krull U.J. // Anal. Chim. Acta. 2014. V. 832. P. 1.
Eliseeva S.V., Bünzli J.C.G. // Chem. Soc. Rev. 2010. V. 39. P. 189.
Заиров Р.Р., Шамсутдинова Н.А., Фаттахова А.Н. и др. // Изв. АН. Сер. хим. 2016. Т. 5. С. 1325.
Luo F., Batten S.R. // Dalton Trans. 2010. V. 39. P. 4485.
Liu H., Wang H., Chu T. et al. // J. Mat. Chem. C. 2014. V. 2. P. 8683.
Hao J.N., Yan B. // Chem. Commun. 2015. V. 51. P. 7737.
Hao J.N., Yan B. // J. Mat. Chem. C. 2014. V. 2. P. 6758.
Ji G., Liu J., Gao X. et al. // J. Mat. Chem. A. 2017. V. 5. P. 10200.
Clarkson I., Dickins R., de Sousa A. // Perkin Trans. 1999. V. 2. P. 93.
Hemmilä I., Mukkala V.M., Takalo H. // J. Fluorescence. 1995. V. 5. P. 159.
Tobita S., Arakawa M., Tanaka I. // J. Phys. Chem. 1985. V. 89. P. 5649.
Latva M., Takal H., Mukkala V.M. et al. // J. Lumin. 1997. V. 75. P. 149.
Chen C.J., Gao J.Y., Zhao X. et al. // Z. Anorg. Allgem. Chem. 2012. V. 638. P. 2324.
Lin L., Lin Y.J, Jin G.X. // Appl. Organomet. Chem. 2019. V. 33. P. e4759.
Zhou X.H., Chen Q. // Cryst. Rep. 2017. V. 62. P. 238.
Yuan G., Shao K.Z., Du D.Y. et al. // Solid State Sci. 2011. V. 13. P. 1083.
Li L., Zou J.Y., Gu Z. et al. // Inorg. Chem. Commun. 2016. V. 65. P. 59.
Zhao T., Jing X., Wang J. et al. // Crystal Growth Des. 2012. V. 12. P. 5456.
Zhang S., Shi W., Cheng P. // Coord. Chem. Rev. 2017. V. 352. P. 108.
Zhang X., Xu N., Zhang S.Y. et al. // RSC Advances. V. 4. P. 40643.
Chen C., Zhang S.Y., Song H.B. et al. // Inorg. Chim. Acta. 2009. V. 362. P. 2749.
Plaut G.W.E. // J. Am. Chem. Soc. V. 76. P. 5801.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Sheldrick G.M. SADABS. Program for Scaling and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 1997.
Binnemans K. // Coord. Chem. Rev. 2015. V. 295. P. 15.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия