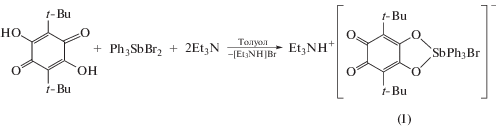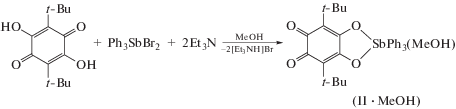Координационная химия, 2020, T. 46, № 6, стр. 340-348
Катехолаты трифенилсурьмы(V) на основе 3,6-ди-трет-бутил-2,5-дигидрокси-1,4-бензохинона
Л. С. Охлопкова 1, А. И. Поддельский 1, *, И. В. Смолянинов 2, Г. К. Фукин 1
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
2 Южный научный центр РАН
Ростов-на-Дону, Россия
* E-mail: aip@iomc.ras.ru
Поступила в редакцию 05.11.2019
После доработки 10.12.2019
Принята к публикации 16.12.2019
Аннотация
2,5-Дигидрокси-3,6-ди-трет-бутил-п-бензохинон (QtBuDiol) взаимодействует с Ph3SbBr2 в толуоле в присутствии триэтиламина с образованием ионного комплексного соединения [Et3NH]+-[(Dionet-BuDiolate)SbPh3Br]– (I). Данная реакция в среде метанола приводит к полному вытеснению бромид ионов из координационной сферы сурьмы с образованием соответствующего 1,2-диолата трифенилсурьмы(V) (Dionet-BuDiolate)SbPh3 ∙ MeOH (II ∙ MeOH). Молекулярное строение комплексов установлено методом РСА (CIF files CCDC № 1960681 (I ∙ толуол) и 1960682 (II ∙ 2MeOH)). В обоих комплексах наблюдается хиноидный тип распределения связей в шестичленном углеродном цикле и двойные связи C=O в фрагментах Ph3SbO2C6(t-Bu)2O2. Формально комплексы можно рассматривать как производные 3,6-ди-трет-бутил-о-бензохинона с металлоорганическим фрагментом Ph3SbO2 в положениях 4 и 5 хинонового кольца. Электрохимическое восстановление II ∙ MeOH в дихлорметане происходит при Е1/2 = –1.52 В, что сильно смещено в катодную область по сравнению с данными для 3,6-ди-трет-бутил-о-бензохинона (Е1/2 = –0.51 В). Подобное смещение потенциала свидетельствует о значительном уменьшении электроноакцепторных свойств о-хиноидного фрагмента, что обусловлено влиянием электронодонорного катехолатного металлоцикла.
Интерес к координационным соединениям, способным потенциально выступать строительными блоками при дизайне гетерометаллических комплексных соединений, в том числе координационных полимеров, в последнее десятилетие возрос в несколько раз. Это связано с тем, что, с одной стороны, в природе ферменты, активные фрагменты которых содержат несколько металлов, часто ответственны за химические трансформации, требующие переноса одного или нескольких электронов, и участвуют в таких важных процессах, как окисление, восстановление, гидролиз и др. Например, окисление воды с помощью Фотосистемы II [1] (Photosystem II), восстановление O2 цитохромоксидазой [2] или фиксация N2 [3], диспропорционирование супероксид-анион-радикала в кислород (супероксид-дисмутаза), разложение пероксида водорода (каталаза) под влиянием ферментов антиоксидантной защиты [4], гидролиз сложных эфиров фосфорной кислоты фосфатазами [5] и др. С другой стороны, гетерометаллические координационные соединения активно применяются в разных областях: от катализа до медицины [6–10]. Хорошие возможности для получения моно-, би- и полиядерных гомо- и гетерометаллических комплексов предоставляют 2,5-дигидрокси-1,4-бензохиноны и их 3,6-дизамещенные производные [11–16]. Однако необходимо отметить, что в литературе практически нет примеров комплексов переходных металлов на основе 3,6-ди-трет-бутил-2,5-дигидрокси-1,4-бензохинона [17, 18] и полностью отсутствует информация о производных металлов главных групп на основе данного лиганда.
В настоящей работе мы представляем моноядерные комплексы трифенилсурьмы(V) на основе 2,5-дигидрокси-3,6-ди-трет-бутил-1,4-бензохинона (Qt-BuDiol). Катехолатные комплексы триарилсурьмы(V) – класс соединений с редокс-активными лигандами, интересный по нескольким причинам: триарилсурьма(III) образует с о-хинонами достаточно устойчивые хелатные металлоциклы, что позволяет исследовать химические и электрохимические превращения редокс-активных лигандов без участия редокс-инертного металлоорганического фрагмента; присутствие тяжелого атома сурьмы в комплексе с редокс-активным лигандом в некоторых случаях позволяет моделировать химическое поведение комплекса переходного металла; для катехолатных комплексов сурьмы(V) продемонстрировано много различных структурных типов, определяемых как строением заместителей при центральном атоме сурьмы, так и строением непосредственно редокс-активного лиганда [19]. Данные о гетерометаллических комплексах сурьмы, в которых металлические центры связаны между собой редокс-активным мостиковым лигандом, и о моноядерных катехолатах сурьмы, способных выступать прекурсорами для таких гетерометаллических производных, весьма немногочисленны [20–24].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез, выделение и исследование свойств комплексов проводили в вакуумированных ампулах в отсутствие кислорода. Органические растворители, используемые в работе, очищали по стандартным методикам [25].
Синтез триэтиламмония (3,6-ди-трет-бутил-циклогекса-1,5-диен-4,5-дион-1,2-диолат)трифенилбромоантимоната(V) [Et3NH]+[(Dionet-BuDiolate)-SbPh3Br]– (I). Раствор 100 мг (0.2 ммоль) дибромидатрифенилсурьмы в 20 мл толуола приливали при постоянном перемешивании к раствору 50.8 мг (0.2 ммоль) Qt-BuDiol в 30 мл толуола в присутствии 0.028 мл (0.2 ммоль) Et3N. Практически сразу цвет раствора сменился на фиолетовый. Быстрое концентрирование раствора позволило получить фиолетовый мелкокристаллический порошок комплекса I. Выход I 138 мг (91%).
ИК-спектр (ваз. масло; ν, см–1): 1613 с, 1530 с, 1430 с, 1394 с, 1362 с, 1303 с, 1231 cр, 1212 с, 1205 с, 1185 ср, 1159 ср, 1068 с, 1036 сл, 1022 ср, 999 ср, 979 ср, 903 с, 840 ср, 810 сл, 792 сл, 780 сл, 733 с, 692 с, 655 с, 603 с, 557 сл, 535 сл, 509 сл, 467 с, 454 с. ЯМР 1H (CDCl3; δ, м.д.): 1.26–1.35 (м., 27 Н: 18 Н, CH3, t‑Bu + 9 Н, CH3, Et3N), 4.11 (септ., 6 Н, CH2, Et3N), 7.15–7.35 (м., 15Н, 3Ph), 7.74 (c., NH).
После медленного концентрирования и длительного выдерживания данного раствора при 0°С в течение 3 сут выделили фиолетовые кристаллы комплекса I ∙ толуол, пригодные для РСА.
Синтез (3,6-ди-трет-бутил-циклогекса-1,5-диен-4,5-дион-1,2-диолато)-метанолтрифенилсурьмы(V) (DionetBuDiolate)SbPh3 ∙ 2MeOH (II ∙ 2MeOH). Малиновые кристаллы комплекса II ∙ 2MeOH получали из 100 мг (0.2 ммоль) дибромидатрифенилсурьмы и 50.8 мг (0.2 ммоль) QtBuDiol в 30 мл метанола в присутствии триэтиламина (0.2 ммоль). Кристаллы II ∙ · 2MeOH выпадали непосредственно из реакционной смеси после полного смешения реагентов при комнатной температуре. Выход II ∙ 2MeOH 111 мг (83%).
ИК-спектр (ваз. масло; ν, см–1): 1654 сл, 1625 с, 1550 с, 1391 с, 1351 с, 1288 с, 1232 ср, 1213 ср, 1187 ср, 1159 ср, 1072 ср, 1065 ср, 1055 ср, 1034 с, 1013 с, 997 ср, 981 ср, 933 сл, 903 с, 825 сл, 743 ср, 733 с, 694 с, 655 ср, 621 с, 577 ср, 541 сл, 501 сл. ЯМР 1H (CDCl3; δ, м.д.): 1.32 (с., 18 Н, CH3, t-Bu), 7.13–7.20 (м., 9Н, o,p-H, Ph), 7.29–7.37 (м., 6 Н, m-H, Ph). ЯМР 13C{1H} (СDCl3; δ, м.д.): 30.46, 34.24, 118.69, 125.24, 128.12, 128.98, 129.19, 134.24, 137.82.
Спектры ЯМР 1H, 13C{1H} регистрировали на спектрометре Bruker AVANCE DPX-200, растворитель CDCl3. ИК-спектры регистрировали на Фурье-ИК спектрометре ФСМ 1201 в вазелиновом масле. Элементный анализ проводили на C,H,N-анализаторе Euro EA 3000, а также методом пиролитического разложения в токе кислорода. Квантово-химические расчеты выполняли с использованием программного пакета Gaussian09 [26] с применением метода расчета: B3LYP/def2tzvp. Измерение потенциалов окисления проводили методом циклической вольтамперометрии (ЦВА) в трехэлектродной ячейке с помощью потенциостата IPC-pro в среде аргона. Рабочий электрод – стационарный стеклоуглеродный электрод с диаметром 2 мм, вспомогательный электрод – платиновая пластина (S = 18 мм2). Электрод сравнения Ag/AgCl/KCl(нас.) с водонепроницаемой диафрагмой. Скорость развертки потенциала 0.2 В/с.
РСА I ∙ толуол и II ∙ 2MeOH проведен при 100 К на дифрактометрах Bruker Smart Apex (I ∙ толуол) и Xcalibur (II ∙ 2MeOH) (графитовый монохроматор, MoKα-излучение, λ = 0.71073 Å). Экспериментальные наборы интенсивностей интегрированы с помощью программы SAINT [27] и CrysAlisPro 1.171.38.46 [28]. Программы SADABS [29] и SCALE3 ABSPACK [30] использованы для введения поправок на поглощение. Структуры расшифрованы прямым методом и уточнены полноматричным МНК по F 2 с использованием программного пакета SHELXTL [31]. Все неводородные атомы уточнены в анизотропном приближении. Атомы водорода помещены в геометрически рассчитанные положения и уточнены изотропно в модели “наездника”. Кристаллографические данные для соединений I ∙ толуол и II ∙ 2MeOH приведены в табл. 1, основные длины связей – в табл. 2.
Таблица 1.
Кристаллографические данные и параметры эксперимента и характеристики уточнения структур I · толуол и II · 2MeOH
| Параметр | Значение | |
|---|---|---|
| I · С6Н5СН3 | II · 2MeOH | |
| Брутто-формула | C45H57NO4BrSb | C34H41O6Sb |
| М | 877.57 | 667.42 |
| Т, К | 100(2) | 100(2) |
| Сингония | Моноклинная | Моноклинная |
| Пр. гр. | P21/n | С2/c |
| a, Å | 9.8072(16) | 27.9065(5) |
| b, Å | 18.541(3) | 9.59000(10) |
| c, Å | 23.146(4) | 23.7840(4) |
| β, град V, Å |
99.487(7) 4151.1(12) |
96.167(2) 6328.32(17) |
| Z | 4 | 8 |
| ρ(выч.), г см–3 | 1.404 | 1.401 |
| µ, мм–1 | 1.669 | 0.914 |
| F(000) | 1808 | 2752 |
| Область измерений по θ, град | 1.415–28.999 | 3.060–27.994 |
| Число собранных отражений | 32 140 | 53 375 |
| Число независимых отражений | 11 024 | 7637 |
| Rint | 0.0701 | 0.0213 |
| GOOF поF 2 | 1.021 | 1.069 |
| R1/wR2 (I > 2σ(I )) | 0.0570/0.1058 | 0.0193/0.0431 |
| R1/wR2 (по всем параметрам) | 0.0997/0.1194 | 0.0218/0.0439 |
| Δρmax/Δρmin, e Å–3, | 1.129/–1.291 | 0.412/–0.461 |
Таблица 2.
Основные длины связей в молекулах I и II ∙ · MeOH в кристаллах I · толуол и II ∙ 2MeOH соответственно
| Связь | I | II ∙ MeOH |
|---|---|---|
| d, Å | ||
| Sb(1)–O(1) | 2.088(3) | 2.059(1) |
| Sb(1)–O(2) | 2.096(3) | 2.053(1) |
| Sb(1)–C(15) | 2.142(4) | 2.128(1) |
| Sb(1)–C(21) | 2.142(4) | 2.130(1) |
| Sb(1)–C(27) | 2.151(4) | 2.135(1) |
| C(1)–O(1) | 1.305(4) | 1.318(2) |
| C(2)–O(2) | 1.301(4) | 1.311(2) |
| C(4)–O(3) | 1.226(4) | 1.233(2) |
| C(5)–O(4) | 1.241(4) | 1.229(2) |
| C(1)–C(2) | 1.516(5) | 1.525(2) |
| C(1)–C(6) | 1.381(5) | 1.369(2) |
| C(2)–C(3) | 1.370(5) | 1.366(2) |
| C(3)–C(4) | 1.446(5) | 1.438(2) |
| C(4)–C(5) | 1.565(6) | 1.550(2) |
| C(5)–C(6) | 1.435(5) | 1.451(2) |
| Sb(1)–Br(1) | 2.6960(6) | |
| Sb(1)–O(1S) | 2.314(1) | |
Структурные данные кристаллов I ∙ толуол и II ∙ 2MeOH депонированы в Кембриджском банке структурных данных (CCDC № 1960681 и 1960682 соответственно; deposit@ ccdc.cam.ac.uk; www: http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Один из удобных синтетических подходов к получению катехолатных комплексов триорганилсурьмы(V) – окислительное присоединение различных о-хинонов к триарил- и триалкилстибинам [32–38]. Данная реакция в большинстве случаев протекает без осложнений и ведет к получению целевого продукта с хорошим выходом, близком к количественному. В отличие от о-хинонов, 2,5-дигидрокси-3,6-ди-трет-бутил-п-бензохинон не взаимодействует с трифенилсурьмой в среде слабополярного растворителя (например, толуола). Однако данный п-бензохинон реагирует с Ph3SbBr2 в растворе толуола в присутствии триэтиламина практически со скоростью смешения реагентов (схема 1 ) с получением ионного комплекса I.
Схема 1 .
В ходе реакции происходит изменение окраски реакционной смеси от желтой до фиолетовой. После отделения бромида триэтиламмония и быстрого концентрирования растворителя был выделен мелкокристаллический порошок комплекса I малинового цвета с выходом, близким к количественному. Медленное концентрирование раствора и выдерживание при 0°С в течение 3 сут позволило получить кристаллы I ∙ толуол, пригодные для РСА. Комплекс I содержит комплексный анион с атомом брома на центральном атоме сурьмы и катион триэтиламмония.
Интересно отметить, что замена толуола на метанол в качестве растворителя позволяет легко получить комплекс II ∙ MeOH (схема 2 ), не содержащий закомплексованной аммонийной соли.
Схема 2 .
ИК-спектр полученного диолата II ∙ MeOH в области частот 1200–1700 см–1 содержит интенсивные полосы поглощения при 1625 и 1550 см–1, а также 1288 см–1. Первые две полосы отвечают валентным колебаниям карбонильных групп, третья полоса характерна для одинарных связей С–О диолатного лиганда. Также наблюдаются валентные колебания связей Sb–C(Ph) в области 450–500 см–1 и скелетные колебания фрагмента SbPh3 в области 620–730 см–1. Формально комплекс II можно рассматривать как 3,6-ди-трет-бутил-о-бензохинон с фрагментом Ph3SbO2 в положениях 4 и 5 хинонового кольца.
Для кристаллов I ∙ толуол и II ∙ 2MeOH выполнен РСА. Соответствующие молекулярные структуры приведены на рис. 1.
Рис. 1.
Молекулярное строение комплексов в кристаллах I ∙ толуол (а) и II ∙ 2MeOH (б) (тепловые эллипсоиды 50%-ной вероятности). Атомы водорода за исключением NH-группы, метильные группы трет-бутильных заместителей не показаны.
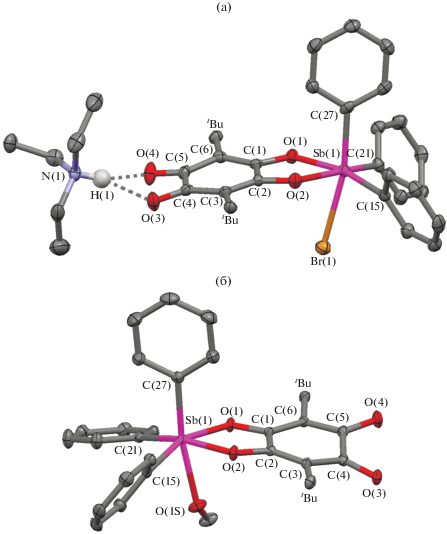
Строение координационных узлов в обоих комплексах сходно. Атомы сурьмы имеют искаженное октаэдрическое окружение, образованное атомами O(1), O(2), C(15), C(21), C(27) и атомом брома Br(1) в I или атомом O(1S) координированной молекулы метанола в II ∙ MeOH. Отклонение металла от экваториальной плоскости, образованной атомами катехолатного лиганда О(1) и О(2) и атомами углерода двух фенильных групп, составляет в случае I 0.16(1) Å, а для II ∙ MeOH 0.29(1) Å. Пятичленный металлоцикл SbOOCC неплоский, угол перегиба по линии О(1)…О(2) по отношению к плоскости катехолатного лиганда составляет 8.5(2)° для I и 4.1(1)° для II ∙ MeOH. Интересно, что в случае комплекса II ∙ MeOH трет-бутильные группы находятся в заторможенной конформации, а карбонильные кислороды разупорядочены, чего не наблюдается в ионном производном.
Связи С(1)–О(1), C(2)–O(2) (1.305(4), 1.301(4) Å в I; 1.318(2), 1.311(2) Å в II ∙ MeOH) лежат в диапазоне одинарных связей C–O в различных катехолатных комплексах сурьмы(V) [39–49], в то время как связи С(4)–О(3) и C(5)–O(4) (1.226(4), 1.241(4) Å в I; 1.233(2), 1.229(2) Å в II ∙ MeOH) лежат в интервале двойных связей С=O [50]. При этом в комплексе I наблюдается некоторое удлинение связи C(5)–O(4) относительно C(4)–O(3), вероятно, связанное с тем, что в комплексе I триэтиламмониевый катион расположен таким образом, что атом водорода H(1) лежит между связями C=O диолатного лиганда в комплексном анионе и направлен к ним, при этом расстояние H(1)…O(4) на 0.03 Å короче, чем H(1)…O(3): 1.892(5) и 2.322(5) Å соответственно. Известно четыре подобные структуры среди комплексов переходных металлов, но на основе 3,6-ди-хлор(бром)-2,5-ди-трет-бутил-п-бензохинона, а именно моноядерный монолигандный комплекс родия [Et3NH]+[(DioneClDiolate)Rh(CO)2]– [51], моноядерные трис-лигандные комплексы хрома(III), железа(III) общего вида [Et3NH$]_{3}^{ + }$[(DioneClDiolate)3M]3– (M = Fe, Cr) [52] и смешанолигандный хромомарганцевый комплекс полимерного строения [53]. В моноядерных комплексах триалкиламмониевый катион связан с карбонильными группами редокс-активного лиганда (NH…O 1.987–2.388 Å).
В шестичленных циклах C(1–6) в обоих комплексах наблюдается хиноидный тип распределения связей, при этом связи C(2)–C(3) и C(1)–C(6) укорочены (на 0.07–0.19 Å) по сравнению с остальными связями в циклах C(1–6). Однако в случае комплекса I карбонильные группы лежат практически в одной плоскости (торсионный угол O(3)–C(4)–C(5)–O(4) равен 2.14°) вследствие взаимодействия с триэтиламмониевым катионом, а в II ∙ MeOH торсионный угол O(3)–C(4)–C(5)–O(4) составляет 22.09°, что соответствует подобным искажениям в структуре различных о-хинонов [54]. В литературе описано много комплексов переходных металлов на основе незамещенного 2,5-дигидрокси-п-бензохинона, 3,6-дихлор- или 3,6-динитро-2,5-дигидрокси-п-бензохинона. Среди них описано несколько моноядерных моно-, бис- и трис-лигандных производных, содержащих в данном редокс-активном диолатном лиганде в положениях 4 и 5 свободные карбонильные группы, однако в данном случае хиноновый фрагмент искажен менее выражено, обычно торсионный угол O=C–C=O не превышает 6° [55–59].
В кристаллической ячейке II ∙ 2MeOH молекулы II ∙ MeOH расположены таким образом, что образуют димеры за счет межмолекулярных водородных связей с координированной и сольватированной молекулами метанола (рис. 2). Соответствующие расстояния составляют O(1S)–H(1S)…O(2S) 1.78(1), O(2S)–H(2S)…O(3) 2.09(1), O(2S)–H(2S)…O(4) 2.50(1) Å; углы (1S)H(1S)O(2S) 171.9(1)°, O(2S)H(2S)O(3) 147.5(1)°, O(2S)H(2S)O(4) 143.4(1)°.
Рис. 2.
Строение димера в кристаллах II ∙ 2MeOH (трет-бутильные группы и атомы водорода кроме атомов водорода гидроксильных групп молекул метанола не показаны).
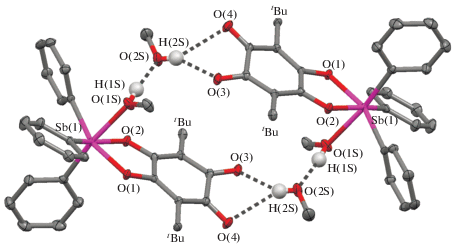
Рис. 3.
ЦВА-восстановление комплекса II ∙ MeOH в диапазоне развертки потенциала от 0 до –1800 мВ (CH2Cl2, СУ-электрод, 0.15 М Bu4NClO4, с = 0.002 моль/л, V = 0.2 В/с относительно Ag/AgCl/KCl(нас.)).
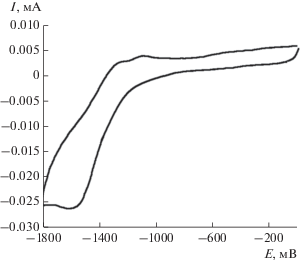
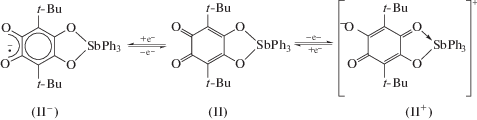
Электрохимическое поведение комплекса II ∙ ∙ MeOH было исследовано с помощью ЦВА. В отличие от большинства катехолатных комплексов триарилсурьмы(V), изученных этим же методом [60–68], для комплекса II ∙ MeOH наблюдается один одноэлектронный необратимый пик окисления при высоком анодном потенциале 1.44 В, отвечающий образованию нестабильного интермедиата [II ∙ MeOH]+ (схема 3 ). В катодной области фиксируется квазиобратимый одноэлектронный пик восстановления (Е1/2 = –1.52 В, рис. 3), приводящий к генерированию анион-радикальной формы лиганда в [II ∙ MeOH]– (схема 3 ). Значение потенциала этого редокс-перехода значительно смещено в катодную область по сравнению с данными для 3,6-ди-трет-бутил-о-бензохинона (Е1/2 = = –0.51 В), полученными в аналогичных условиях. Подобное смещение потенциала свидетельствует о значительном уменьшении электроноакцепторных свойств о-хиноидного фрагмента, что обусловлено влиянием электронодонорного катехолатного металлоцикла.
Схема 3 .
Для сравнения электрохимическое восстановление п-бензохинона Qt-BuDiol в растворе дихлорметана протекает в две стадии, причем первая волна слабообратима ($E_{{{\text{пк}}}}^{1}$ = –0.26 В), что связано с протекающей последующей химической стадией – протонированием генерируемого анион-радикала соседней молекулой хинона, а вторая волна восстановления ($E_{{{\text{пк}}}}^{2}$ = –1.04 В (Е1/2 = –0.95 В)) квазиобратима (Ia/Ic = 0.8), что обусловлено обратимым характером – восстановлением образующегося радикала. Окисление данного п-бензохинона протекает необратимо при +1.80 В.
Электронное строение соединения II также исследовано квантовохимическими расчетами методом DFT, согласно которым граничные орбитали, отвечающие за окислительно-восстановительное поведение комплекса, расположены на редокс-активном лиганде (ВЗМО –5.7 эВ, НСМО 2.33 эВ). Полученное значение энергетической щели (НСМО–ВЗМО = 3.37 эВ) хорошо согласуется с результатами ЦВА. К настоящему времени ни одна попытка получить биядерный комплекс трифенилсурьмы(V) из II или II ∙ MeOH по обменной реакции или реакцией присоединения, к сожалению, не увенчались успехом. Это, очевидно, связано с понижением потенциала восстановления о-хинонового фрагмента в II ∙ MeOH вследствие введения трифенилсурьмы через атомы кислорода в положения 4 и 5 в формально 3,6-ди-трет-бутил-о-бензохинон по сравнению с исходным лигандом и изученными ранее о-хинонами.
Таким образом, исследовано взаимодействие 2,5-дигидрокси-3,6-ди-трет-бутил-п-бензохинона с Ph3SbBr2 в присутствии триэтиламина в растворе толуола и метанола. Показано, что в толуоле происходит образование ионного комплексного соединения [Et3NH]+[(Dionet-BuDiolate)SbPh3Br]–, которое фактически является продуктом замещения в координационной сфере сурьмы только одного атома галогена, при этом триэтиламин полностью депротонирует редокс-активный лиганд с образованием катиона триэтиламмония и аниона (1,2-диолат)трифенилбромоантимоната(V). В метаноле происходит полное вытеснение бромид ионов из координационной сферы сурьмы с образованием соответствующего замещенного 1,2-диолата трифенилсурьмы(V) (Dionet-BuDiolate)SbPh3 ∙ ∙ MeOH. Согласно данным РСА, в обоих комплексах наблюдается хиноидный тип искажения шестичленного углеродного цикла, и формируются двойные связи C=O в фрагментах Ph3SbO2C6(t‑Bu)2O2. Формально комплексы можно рассматривать как производные 3,6-ди-трет-бутил-о-бензохинона с металлоорганическим фрагментом Ph3SbO2 в положениях 4 и 5 хинонового кольца. Электрохимическое восстановление замещенного 1,2-диолата трифенилсурьмы(V) в дихлорметане происходит при большом отрицательном потенциале (Е1/2 = –1.52 В), что свидетельствует о значительном уменьшении электроноакцепторных свойств о-хиноидного фрагмента вследствие электронодонорного влияния катехолатного металлоцикла.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Loll B., Kern J., Saenger W. et al. // Nature. 2005. V. 438. P. 1040.
Tsukihara T., Aoyama H., Yamashita E. et al. // Science. 1995. V. 269. P. 1069.
Peters J.W., Szilagyi R.K. // Curr. Opin. Chem. Biol. 2006. V. 10. P. 101.
Corpas F.J., Fernández-Ocaña A., Carreras A. et al. // Plant Cell Physiol. 2006. V. 47. P. 984.
Schenk G., Ge Y., Carrington L. et al. // Arch. Biochem. Biophys. 1999. V. 370. P. 183.
Adams R.D., Cotton F.A. Catalysis by Di- and Polynuclear Metal Cluster Complexes. Wiley-VCH, 1998. P. 283.
Buchwalter P., Rosé J., Braunstein P. // Chem. Rev. 2015. V. 115. P. 28.
Mata J.A., Hahn F.E., Peris E. // Chem. Sci. 2014. V. 5. P. 1723.
Yalymov A.I., Bilyachenko A.N., Levitsky M.M. et al. // Catalysts. 2017. V. 7. P. 1.
Kalck P. // Top. Organomet. Chem. 2016. V. 59. P. 1.
Molcanov K., Juric M., Kojic-Prodic B. // Dalton Trans. 2013. V. 42. P. 15756.
Atzori M., Artizzu F., Marchio L. et al. // Dalton Trans. 2015. V. 44. P. 15786.
Simonson A.N., Kareis C.M., Ovanesyan N.S. et al. // Polyhedron. 2018. V. 139. P. 215.
Kawata S., Kumagai H., Adachi K., Kitagawa S. // Dalton Trans. 2000. P. 2409.
Bruijnincx C.A., Viciano-Chumillas M., Lutz M. et al. // Chem. Eur. J. 2008. V. 14. P. 5567.
Benmansour S., Gomez-Claramunt P., Valles-Garcia C. et al. // Cryst. Growth Des. 2016. V. 16. P. 518.
Kil Sik Min, Di Pasquale A.G., Rheingold A.L. et al. // J. Am. Chem. Soc. 2009. V. 131. P. 6229.
Kil Sik Min, Di Pasquale A.G., Rheingold A.L. et al. // Inorg. Chem. 2007. V. 46. P. 1048.
Poddel’sky A.I. // Nova Science Publishers / Ed. Razeghi M. New York. 2012. Ch. 12. P. 267.
Cherkasov V.K., Grunova E.V., Poddel’sky A.I. et al. // J. Organomet. Chem. 2005. V. 690. P. 273.
Poddel’sky A.I., Somov N.V., Druzhkov N.O. et al. // J. Organomet. Chem. 2011. V. 696. № 2. P. 517.
Куропатов В.А., Клементьева С.В., Поддельский А.И. и др. // Изв. АН. Сер. хим. 2010. № 9. С. 1652 (Kuropatov V.A., Klementieva S.V., Poddel’sky A.I. et al. // Russ. Chem. Bull. Int. Ed. 2010. V. 59. № 9. P. 1698).
Черкасов В.К., Грунова Е.В., Абакумов Г.А. // Изв. АН. Сер. хим. 2005. Т. 9. С. 2004.
Baryshnikova S.V., Bellan E.V., Poddel’sky A.I. et al. // Eur. J. Inorg. Chem. 2016. V. 33. P. 5230.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. С. 437.
Frisch M.J. Gaussian 09 (revision E.01). Wallingford (CT, USA): Gaussian, Inc., 2013.
SAINT. Data Reduction and Correction Program. Version 8.27B. Madison (WI, USA): Bruker AXS Inc., 2014.
CrysAlis Pro. Rigaku Oxford Diffraction, 2015.
Sheldrick G.M. SADABS-2012/1. Bruker/Siemens A-rea Detector Absorption Correction Program. Madison (WI, USA): Bruker AXS Inc., 2012.
SCALE3 ABSPACK: Empirical Absorption Correction. CrysAlis Pro-Software Package. Agilent Technologies, 2012.
Sheldrick G.M. SHELXTL. Version6.14. Structure Determination Software Suite. Madison (WI, USA): Bruker AXS, 2003.
Cherkasov V.K., Abakumov G.A., Grunova E.V. et al. // Chem. Eur. J. 2006. V. 12. № 14. P. 3916.
Поддельский А.И., Смолянинов И.В., Курский Ю.А. и др. // Изв. АН. Сер. хим. 2009. № 3. С. 520 (Poddel’sky A.I., Smolyaninov I.V., Kurskii Yu.A. et al. // Russ. Chem. Bull. Int. Ed. 2009. V. 58. № 3. P. 532).
Poddel’sky A.I., Vavilina N.N., Somov N.V. et al. // J. Organomet. Chem. 2009. V. 694. № 21. P. 3462.
Поддельский А.И., Смолянинов И.В. // Журн. общ. химии. 2010. Т. 80. № 3. С. 538 (Poddel’sky A.I., Smolyaninov I.V. // Russ. J. Gen. Chem. 2010. V. 80. № 3. P. 538).
Poddel’sky A.I., Smolyaninov I.V., Berberova N.T. et al. // J. Organomet. Chem. 2015. V. 789–790. P. 8.
Poddel’sky A.I., Arsenyev M.V., Astaf’eva T.V. et al. // J. Organomet. Chem. 2017. V. 835. P. 17.
Поддельский А.И., Охлопкова Л.С., Мещерякова И.Н. и др. // Коорд. химия. 2019. Т. 45. № 2. С. 120 (Poddel’skii A.I., Okhlopkova L.S., Meshcheryakova I.N. et al. // Russ. J. Coord. Chem. 2019. V. 45. P. 133).https://doi.org/10.1134/S1070328419010093
Hall M., Sowerby D.B. // J. Am. Chem. Soc. 1980. V. 102. № 2. P. 628.
Holmes R.R., Day R.O., Chandrasekhar V., Holmes J.M. // Inorg. Chem.1987. V. 26. P. 157.
Dodonov V.A., Fedorov A.Yu., Fukin G.K. et al. // Main Group Chem. 1999. V. 3. № 1. P. 15.
Poddel’sky A.I., Smolyaninov I.V., Fukin G.K. et al. // J. Organomet. Chem. 2018. V. 867. P. 238.
Poddel’sky A.I., Astaf’eva T.V., Smolyaninov I.V. et al. // J. Organomet. Chem. 2018. V. 873. P. 57.
Arsenyev M.V., Astaf’eva T.V., Baranov E.V. et al. // Mendeleev Commun. 2018. V. 28. P. 76.
Poddel’sky A.I., Druzhkov N.O., Fukin G.K. et al. // Polyhedron. 2017. V. 124. P. 41.
Poddel’sky A.I., Smolyaninov I.V., Fukin G.K. et al. // J. Organomet. Chem. 2016. V. 824. P. 1.
Поддельский А.И., Илякина Е.В., Смолянинов И.В. и др. // Изв. АН. Сер. хим. 2014. № 4. С. 923 (Poddel’skii A.I., Ilyakina E.V., Smolyaninov I.V. et al. // Russ. Chem. Bull., Int. Ed. 2014. V. 63. № 4. P. 923).
Poddel’sky A.I., Baranov E.V., Fukin G.K. et al. // J. Organomet. Chem. 2013. V. 733. P. 44.
Poddel’sky A.I., Somov N.V., Druzhkov N.O. et al. // J. Organomet. Chem. 2011. V. 696. № 2. P. 517.
Lide D.R. CRC Handbook of Chemistry and Physics. CRC Press: Boca-Raton (FL, USA), 2005. P. 513.
Elduque A., Garces Y., Lahoz F.J. et al. // Inorg. Chem. Commun. 1999. V. 2. P. 414.
Atzori M., Artizzu F., Sessini E. et al. // Dalton Trans. 2014. V. 43. P. 7006.
Palacios-Corella M., Fernandez-Espejo A., Bazaga-Garcia M. et al. // Inorg. Chem. 2017. V. 56. P. 13865.
Fukin G.K., Cherkasov A.V., Shurygina M.P. et al. // Struct. Chem. 2010. V. 21. № 3. P. 607.
Folgado J.V., Ibanez R., Coronado E. et al. // Inorg. Chem. 1988. V. 27. P. 19.
Spengler R., Lange J., Zimmermann H. et al. // Acta Crystallogr. B. 1995. V. 51. P. 174.
Nagayoshi K., Kabir Md.K., Tobita H. et al. // J. Am. Chem. Soc. 2003. V. 125. P. 221.
Ishikawa R., Horii Y., Nakanishi R. et al. // Eur. J. Inorg. Chem. 2016. P. 3233.
Dubraja L., Molcanov K., Zilic D. et al. // New J. Chem. 2017. V. 41. P. 6785.
Poddel’sky A.I., Smolyaninov I.V., Somov N.V. et al. // J. Organomet. Chem. 2010. V. 695. № 4. P. 530.
Poddel’sky A.I., Smolyaninov I.V., Kurskii Yu.A. et al. // J. Organomet. Chem. 2010. V. 695. № 8. P. 1215.
Смолянинов И.В., Поддельский А.И., Берберова Н.Т. и др. // Коорд. химия. 2010. Т. 36. № 9. С. 650 (Smolyaninov I.V., Poddel’skiy A.I., Berberova N.T. et al. // Russ. J. Coord. Chem. 2010. V. 36. № 9. P. 644).https://doi.org/10.1134/S1070328410090022
Поддельский А.И., Смолянинов И.В., Вавилина Н.Н. и др. // Коорд. химия. 2012. Т. 38. № 4. С. 296 (Poddel’sky A.I., Smolyaninov I.V., Vavilina N.N. et al. // Russ. J. Coord. Chem. 2012.V. 38. № 4. P. 284).https://doi.org/10.1134/S1070328412040094
Поддельский А.И., Арсеньев М.В., Охлопкова Л.С. и др. // Коорд. химия. 2017. Т. 43. № 12. С. 744 (Poddel’sky A.I., Arsen’ev M.V., Okhlopkova L.S. et al. // Russ. J. Coord. Chem. 2017. V. 43. № 12. P. 843).https://doi.org/10.1134/S1070328417120089
Smolyaninov I.V., Antonova N.A., Poddel’sky A.I. et al. // Appl. Organomet. Chem. 2012. V. 26. № 6. P. 277.
Смолянинова С.А., Поддельский А.И., Смолянинов И.В., Берберова Н.Т. // Коорд. химия. 2014. V. 40. № 5. С. 274 (Smolyaninova S.A., Poddel’sky A.I., Smolyaninov I.V., Berberova N.T. // Russ. J. Coord. Chem. 2014. V. 40. № 5. P. 273).https://doi.org/10.1134/S107032841405011X
Смолянинов И.В., Поддельский А.И., Смолянинова С.А., Мовчан Н.О. // Журн. общ. химии. 2014. V. 84. № 9. С. 1523. (Smolyaninov I.V., Poddel’skii A.I., SmolyaninovaS.A., Movchan N.O. // Russ. J. Gen. Chem. 2014.V. 84.№ 9. P. 1761).
Смолянинов И.В., Поддельский А.И., Смолянинова С.А., Берберова Н.Т. // Электрохимия. 2015. Т. 51. № 11. С. 1155 (Smolyaninov I.V., Poddel’skii A.I., Smolyaninova S.A., Berberova N.T. // Russ. J. Electrochem. 2015. V. 51. № 11. P. 1021).
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия