Координационная химия, 2020, T. 46, № 7, стр. 437-448
Влияние заместителей в ароматическом фрагменте бензоатного аниона на строение и состав образующихся {Cd-Ln}-комплексов
М. А. Шмелев 1, *, Н. В. Гоголева 1, Ф. М. Долгушин 2, К. А. Лысенко 2, 3, М. А. Кискин 1, Е. А. Вараксина 2, 4, И. В. Тайдаков 2, 4, 5, А. А. Сидоров 1, И. Л. Еременко 1, 2
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова
Москва, Россия
3 МГУ им. М.В. Ломоносова
Москва, Россия
4 Физический институт им. П.Н. Лебедева РАН
Москва, Россия
5 Московский физико-технический институт
(национальный исследовательский университет)
Долгопрудный, Россия
* E-mail: shmelevma@yandex.ru
Поступила в редакцию 10.12.2019
После доработки 11.02.2020
Принята к публикации 17.02.2020
Аннотация
Взаимодействием Cd(NO3)2 ∙ 4H2O и Eu(NO3)3 ∙ 6H2O с калиевыми солями производных бензойной кислоты и 2,2'-дипиридилом (Bipy) в этаноле при одинаковых условиях синтеза получены гомо- и гетерометаллические комплексы: [Eu2Cd2(BA)8(NO3)2(Bipy)2] (I, BA = анион бензойной кислоты), [Ln2Cd2(4-TBA)10(Bipy)2] (Ln = Eu (II), Tb (III); 4-TBA = анион 4-(трифторметил)бензойной кислоты), [Cd(4-CBA)2(H2O)(Bipy)] (IV, 4-CBA = анион 4-цианобензойной кислоты), [Cd(PFBA)2(H2O)(Bipy)]n (V, PFBA = анион пентафторбензойной кислоты), [Cd2(4-APFBA)4(Bipy)2] ∙ 4H2O (VI, 4-ATFBA = анион 4-амино-2,3,5,6-тетрафторбензойной кислоты). Строение новых комплексов I, II, IV и VI определено методом РСА (CCDC № 1970348, 1970350, 1970347, 1970351 соответственно), изоструктурность II и III подтверждена данными РФА. Показано, что строение и состав серии выделенных соединений I–VI определяется природой заместителей в бензоат-анионе. Для соединений II и III изучены фотолюминесцентные свойства.
Синтез гетерометаллических карбоксилатных комплексов, в которых сочетаются атомы 3d-металлов или кадмия с атомами редкоземельных элементов связан с решением ряда актуальных научных и практических задач. Гетерометаллические соединения заданного состава, в том числе стехиометрического, могут быть использованы в качестве прекурсоров для получения различных однородных по составу дисперсных оксидных материалов [1].
Комплексы с атомами лантанидов исследуются в качестве перспективных магнитных и люминесцентных материалов [2, 3]. Полиядерные металлоостовы, формирующиеся в составе молекулярных гетерометаллических соединений, можно использовать в качестве готовых вторичных блоков для каркасных металл-органических полимеров [4, 5]. Доступность широкого круга монокарбоновых кислот позволяет получать гетерометаллические комплексы, строение которых определяется природой анионов, в том числе заместителя при карбоксилатной группе, N-донорным лигандом и ионным радиусом ионов металлов [6–8]. Расширение круга {Cd-Ln}-комплексов, подбор условий синтеза, анализ строения, структуроопределяющих факторов и физико-химических свойств являются неотъемлемыми задачами неорганической химии. Мы использовали однотипные методики синтеза, заключающиеся в действии на нитраты кадмия(II) и лантанидов(III), калиевой солью производных бензойной кислоты и 2,2'-дипиридилом (Bipy) в растворе этанола. В представленной системе варьируется только один параметр – природа заместителей в бензоатном анионе, что, помимо возможности реализации указанных выше задач, позволяет сравнить продукты реакции и определить возможные детали синтеза целевых комплексов.
В настоящем исследовании мы ограничились бензойной (H(BA)), 4-трифторметилбензойной (H(4-TBA)), 4-цианобензойной (H(4-CBA)), 4-амино-2,3,5,6-тетрафоторбензойной (H(4-ATFBA)) и пентафторбензойной (H(PFBA)) кислотами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом новых комплексов, выполняли на воздухе с использованием этанола (“х. ч.”). Для получения новых соединений использовали следующие реагенты: Cd(NO3)2 · 4H2O (99+%, Acrosorganics), Eu(NO3)3 · · 6H2O (99.99%, Ланхит), Tb(NO3)3 · 6H2O (99.99%, Ланхит), КОН (“ч. д. а.”), H(BA) (≥99.5%, ACS reagent), H(4-TBA) (98%, Acrosorganics), H(4-CBA) (99%, Acrosorganics), H(PFBA) (99%, P&MInvest), H(4-ATFBA) (98%, P&MInvest), Bipy (99%, AlfaAesar).
ИК-спектры соединений регистрировали на ИК-спектрофотометре с Фурье-преобразованием Spectrum 65 (PerkinElmer) методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 4000–400 см–1. Спектры люминесценции измеряли с помощью спектрофлуориметра Fluorolog FL3-22 (Horiba-Jobin-Yvon), оснащенного ксеноновой лампой мощностью 450 Вт и стандартным фотоумножителем PMT R-928. Для измерения кинетических зависимостей затухания люминесценции использовали ксеноновую лампу-вспышку. Все спектры были скорректированы с учетом аппаратной функции прибора. Элементный анализ выполняли на CHNS-анализаторе EuroЕА 3000 (EuroVector). Рентгенофазовый анализ проведен на дифрактометре Bruker D8 Advance (CuKα, λ = 1.54060 Å, Ni-фильтр, LYNXEYE детектор, геометрия на отражение).
Синтез [Eu2Cd2(BA)8(NO3)2(Bipy)2] (I). К раствору Cd(NO3)2 · 4H2O (0.100 г, 0.324 ммоль) в 10 мл этанола добавляли раствор KBA (0.090 г, 0.649 ммоль) в 10 мл этанола, полученный при взаимодействии KOH (0.036 г, 0.649 ммоль) и H(BA) (0.063 г, 0.649 ммоль). Реакционную смесь перемешивали в течение 15 мин при 70°С и отфильтровывали от образовавшегося белого осадка KNO3. К фильтрату добавляли суспензию, полученную при взаимодействии Eu(NO3)3 · 6H2O (0.049 г, 0.108 ммоль) и KBA (0.045 г, 0.325 ммоль, полученного взаимодействием KOH (0.018 г, 0.325 ммоль) и H(BA) (0.039 г, 0.325 ммоль) в 10 мл EtOH. Реакционную массу перемешивали 15 мин при 70°С, отфильтровывали белый осадок KNO3, добавляли навеску Вipy (0.051 г, 0.324 ммоль) и смесь перемешивали при 70°С до растворения белого осадка. Бесцветный раствор выдерживали при комнатной температуре и медленном испарении. Образовавшиеся через 5 сут бесцветные кристаллы, пригодные для РСА, отделяли декантацией, промывали холодным этанолом (T ≈ 5°C) и сушили на воздухе. Выход соединения I 0.078 г (27.4%) в расчете на Cd(NO3)2 · 4H2O.
ИК-спектр (НПВО; ν, см–1): 3389 cр, 2973 сл, 1594 ср, 1545 ср, 1491 с, 1475 ср, 1439 с, 1392 с, 1317 ср, 1291 с, 1176 c, 1156 cp, 1071 с, 1040 c, 1019 cp, 942 ср, 879 ср, 848 ср, 814 ср, 765 ср, 716 с, 688 ср, 676 ср, 650 ср, 628 сл, 551 cл, 427 cр, 415 с.
Синтез [Eu2Cd2(4-TBA)10(Bipy)2] (II) проводили по методу, аналогичному для I, с использованием H(4-TBA) вместо H(BA) с навесками, указанными в табл. 1. Образовавшиеся через 48 ч бесцветные кристаллы, пригодные для РСА, отделяли декантацией, промывали холодным этанолом (T ≈ 5°C) и сушили на воздухе. Выход соединения II 0.235 г (61.3%) в расчете на Cd(NO3)2 · 4H2O.
| Найдено, %: | С 44.22; | Н 2.32; | N 2.21. |
| Для C100H56N4O20F30Cd2Eu2 | |||
| вычислено, %: | C 43.92; | H 2.05; | N 2.05. |
Таблица 1.
Навески реагентов (г) при получении комплексов I–VI при соотношении Cd : Ln : O2CR : Bipy = 3 : : 1 : 5 : 3
| Комплекс | HO2CR | Cd(O2CR)2 | Ln(O2CR)3 | Bipy | ||||
|---|---|---|---|---|---|---|---|---|
| Cd(NO3)2 · 4H2O | HO2CR | KOH | Ln(NO3)2 · xH2O | HO2CR | KOH | |||
| I | H(BA) | 0.01 | 0.063 | 0.036 | 0.049 | 0.040 | 0.018 | 0.051 |
| II | H(4-TBA) | 0.01 | 0.107 | 0.036 | 0.049 | 0.053 | 0.018 | 0.051 |
| III | H (4-TBA) | 0.01 | 0.107 | 0.036 | 0.050 | 0.036 | 0.018 | 0.051 |
| IV | H(4-CBA) | 0.01 | 0.076 | 0.036 | 0.049 | 0.038 | 0.018 | 0.051 |
| V | H(PFBA) | 0.01 | 0.109 | 0.036 | 0.049 | 0.055 | 0.018 | 0.051 |
| VI | H(4-ATFBA) | 0.01 | 0.123 | 0.036 | 0.049 | 0.062 | 0.018 | 0.051 |
ИК-спектр (НПВО; ν, см–1): 2988 ср, 1630 ср, 1596 ср, 1536 с, 1513 ср, 1475 ср, 1362 оч. с, 1316 оч. с, 1156 ср, 1128 с, 1100 с, 1062 с, 1015 ср, 868 с, 790 с, 783 с, 769 ср, 757 ср, 735 сл, 710 с, 651 ср, 629 сл, 595 сл, 539 сл, 434 ср, 419 ср.
Синтез [Tb2Cd2(4-TBA)10(Bipy)2] (III) проводили по методу, аналогичному для I, с использованием H(4-TBA) вместо H(BA) и нитрата Tb в качестве источника атомов лантанида с навесками, указанными в табл. 1. Образовавшийся через 24 ч белый поликристаллический осадок отделяли декантацией, промывали холодным этанолом (T ≈ 5°C) и сушили на воздухе. Выход соединения III 0.259 г (67.2%) в расчете на Cd(NO3)2 · 4H2O.
| Найдено, %: | С 44.10; | Н 2.17; | N 2.05. |
| Для C100H56N4O20F30Cd2Tb2 | |||
| вычислено, %: | C 43.81; | H 2.04; | N 2.04. |
ИК-спектр (НПВО; ν, см–1): 2991 сл, 1633 с, 1592 ср, 1535 с, 1517 ср, 1474 с, 1359 с, 1316 оч. с, 1154 ср, 1129 ср, 1098 сл, 1061 с, 1019 ср, 864 ср, 788 ср, 785 ср, 771 ср, 757 ср, 741 ср, 711 с, 652 ср, 627 ср, 594 ср, 541 ср, 431 ср, 422 ср.
Синтез [Cd(4-CBA)2(H2O)(Bipy)] (IV) проводили по методу, аналогичному для I, с использованием H(4-CBA) вместо H(BA) с навесками, указанными в табл. 1. Образовавшиеся через 3 сут бесцветные кристаллы, пригодные для РСА, отделяли декантацией, промывали холодным этанолом (T ≈ 5°C) и сушили на воздухе. Выход соединения IV 0.062 г (37.8% ) в расчете на Cd(NO3)2 · 4H2O.
ИК-спектр (v, см–1): 3079 сл, 2227 ср, 1702 ср, 1604 ср, 1585 с, 1539 с, 1490 сл, 1472 ср, 1439 с, 1407 с, 1378 с, 1299 ср, 1287 с, 1249 ср, 1168 ср, 1150 сл, 1131 сл, 1094 сл, 1060 сл, 1015 ср, 976 сл, 933 сл, 862 с, 815 ср, 768 с, 734 ср, 693 ср, 651 ср, 628 сл, 572 с, 542 с, 438 ср, 421 сл, 413 сл.
Синтез [Cd(PFBA)2(H2O)(Bipy)]n (V) проводили по методу, аналогичному для I, с использованием H(4-PFBA) вместо H(BA) с навесками, указанными в табл. 1. Полученный в результате реакции бесцветный раствор помещали в круглодонную колбу и выдерживали при 5°C 14 сут. Образовавшиеся бесцветные кристаллы, пригодные для РСА, отделяли декантацией, промывали холодным этанолом (T ≈ 5°C) и сушили на воздухе. Выход соединения V 0.112 г (57.3%) в расчете на Cd(NO3)2 · 4H2O.
ИК-спектр (v, см–1): 3188 c, 1653 ср, 1593 сл, 1519 сл, 1488 сл, 1477 сл, 1442 сл, 1397 сл, 1367 сл, 1318 ср, 1286 ср, 1181 c, 1161 cp, 1121 c, 1101 сл, 1062 c, 1043 c, 1018 cp, 989 сл, 932 сл, 828 сл, 763 сл, 734 сл, 698 сл, 649 сл, 627 сл, 582 cp, 479 cp, 458 c, 442 c, 425 c.
Синтез [Cd2(4-APFBA)4(Bipy)2] . 4H2O (VI) проводили по методу, аналогичному для I, с использованием H(4-APFBA) вместо H(BA) с навесками, указанными в табл. 1. Полученный в результате реакции бесцветный раствор выдерживали при комнатной температуре и медленном испарении 9 сут. Образовавшиеся бесцветные кристаллы, пригодные для РСА, отделяли декантацией, промывали холодным этанолом (T ≈ 5°C) и сушили на воздухе. Выход соединения VI 0.076 г (37.6%) в расчете на Cd(NO3)2 · 4H2O.
ИК-спектр (НПВО; ν, см–1): 3411 cр, 3188 сл, 1662 ср, 1567 с, 1526 ср, 1487 с, 1441 ср, 1374 с, 1248 сл, 1175 cр, 1126 cp, 1099 сл, 1061 ср, 1017 cл, 945 с, 806 ср, 759 с, 746 с, 735 с, 650 ср, 626 ср, 575 сл, 499 ср, 446 ср, 426 сл, 414 ср.
РСА монокристаллов соединений I, II, IV, VI выполнен на дифрактометре Bruker Apex II, оборудованном CCD-детектором (MoKα, λ = 0.71073 Å, графитовый монохроматор) [9]. Для всех соединений введена полуэмпирическая поправка на поглощение по программе SADABS [10]. Структуры расшифрованы прямыми методами и уточнены полноматричным МНК в анизотропном приближении для всех неводородных атомов. Атомы водорода при атомах углерода органических лигандов генерированы геометрически и уточнены в модели “наездника”. Расчеты проведены по комплексу программ SHELX [11]. Геометрия полиэдров металлов была определена с использованием программы SHAPE 2.1 [12, 13]. Кристаллографические параметры и детали уточнения структур I, II, IV и VI приведены в табл. 2.
Таблица 2.
Кристаллографические параметры и детали уточнения структур I, II, IV и VI
| Параметр | I | II | IV | VI |
|---|---|---|---|---|
| М | 2026.16 | 2732.20 | 578.84 | 1441.61 |
| Т, K | 120(2) | 120(2) | 150(2) | 296(2) |
| Сингония | Триклинная | Триклинная | Моноклинная | Моноклинная |
| Пр. гр. | Р1 | Р1 | P2/c | P21/n |
| a, Å | 11.3382(5) | 15.6579(13) | 21.9699(10) | 15.6831(6) |
| b, Å | 13.8155(6) | 15.6751(13) | 8.6161(5) | 12.2957(4) |
| c, Å | 14.0949(6) | 21.493(2) | 12.2475(6) | 15.8547(6) |
| α, град | 71.8130(10) | 76.123(2) | 90 | 90 |
| β, град | 70.7460(10) | 77.701(2) | 92.4040(10) | 91.8000(10) |
| γ, град | 81.1380(10) | 84.104(2) | 90 | 90 |
| V, Å3 | 1977.0(2) | 4996.3(7) | 2316.3(2) | 3055.8(2) |
| Z | 1 | 2 | 4 | 2 |
| ρ(выч.), г см3 | 1.702 | 1.816 | 1.660 | 1.567 |
| μ, мм–1 | 2.176 | 1.786 | 0.990 | 0.805 |
| θmax, град | 28.997 | 25.242 | 26.396 | 30.548 |
| Tmin/Tmax | 0.658/0.780 | 0.673/0.842 | 0.673/0.745 | 0.645/0.746 |
| Число измеренных рефлексов | 31 800 | 76 639 | 20 739 | 37 281 |
| Число независимых рефлексов | 10 529 | 24 056 | 4729 | 9332 |
| Rint | 0.0377 | 0.0756 | 0.0418 | 0.0487 |
| Число рефлексов с I > 2σ(I) | 8849 | 17 940 | 4348 | 7159 |
| Число уточняемых параметров | 999 | 9974 | 9875 | 9708 |
| GOOF | 1.024 | 1.042 | 1.076 | 1.034 |
| R1 (I > 2σ(I)) | 0.0305 | 0.0695 | 0.0232 | 0.0632 |
| wR2 (I > 2σ(I)) | 0.0753 | 0.1995 | 0.0544 | 0.1561 |
| Δρmin/Δρmax, е Å–3 | –1.348/2.194 | –1.972/4.070 | –0.393/0.408 | –1.198/0.977 |
Координаты атомов и другие параметры соединений I, II, IV и VI депонированы в Кембриджском банке структурных данных (CCDC № 1970348, 1970350, 1970347, 1970351 соответственно; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При взаимодействии Cd(NO3)2 ∙ 4H2O и Ln(NO3)3 ∙ 6H2O (Ln = Eu, Tb) с калиевой солью кислоты H(BA) или ее замещенных производных – кислот H(4-TBA), H(4-CBA), H(PFBA) или H(4-ATFBA) – в присутствии Bipy (соотношение 1 : 1 : 5 : 1) в этаноле; в зависимости от природы кислоты, кристаллизуются гетерометаллические комплексы I–VI (cхема 1).
Схема 1 .
Соединения I–III с анионами BA и 4-TBA представляют собой тетраядерные комплексы с линейным металлоостовом {Cd…Ln…Ln…Cd}, в которых способы связывания атомов металлов друг с другом отличаются.
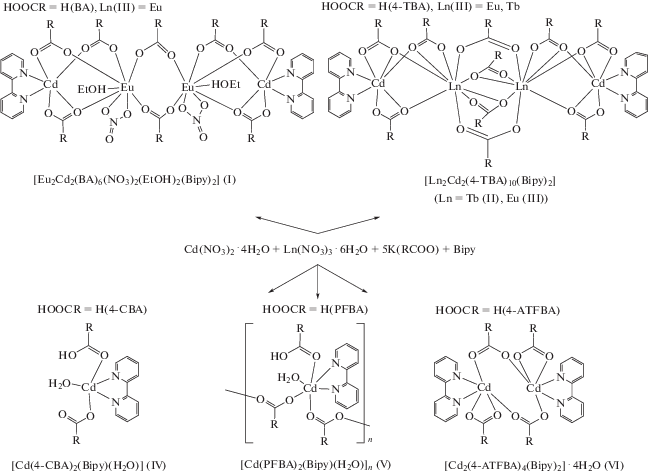
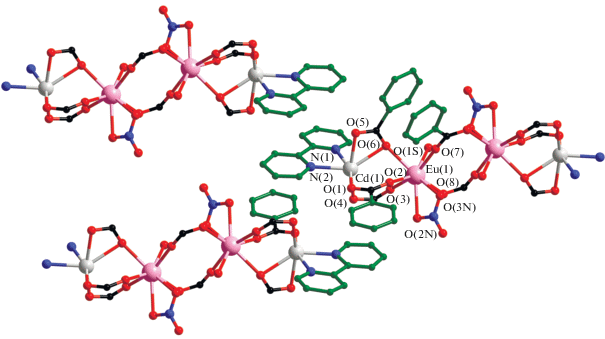
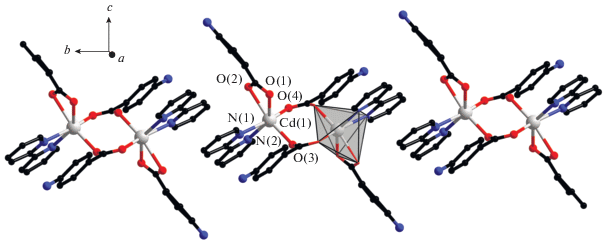
В центросимметричной молекуле комплекса I два центральных атома Eu(1) связаны между собой двумя мостиковыми карбоксилат-анионами (Eu–O 2.242(2)–2.346(2), Eu(1)…Eu(1A) 4.865(4) Å). Каждый атом европия в молекуле связан c атомом Cd(1) (угол Сd(1)Eu(1)Eu(1A) 156°) за счет координации одного хелатно-мостикового и двух мостиковых карбоксилат-анионов, замыкающих хелатный цикл на атоме Cd(1) (Eu–O 2.353(3)–2.433(2), Cd–O 2.208(3)–2.343(3), Cd(1)…Eu(1) 3.805(3) Å) (рис. 1). Каждый атом кадмия достраивает свое октаэдрическое окружение (CdO4N2) двумя атомами N хелатной молекулы Bipy (Cd–N 2.310(2), 2.331(3) Å). Атом Eu достраивает свое окружение (EuO8) до искаженной двухшапочной тригональной призмы за счет координации атомов кислорода молекулы этанола и хелатно связанного NO3-аниона (Eu–O 2.458(2)–2.540(3) Å). Источником ${\text{NO}}_{3}^{--}$ является исходная неорганическая соль.
Рис. 1.
Строение комплекса I (заместители при карбоксилатной группе, атомы водорода и сольватные молекулы не показаны).
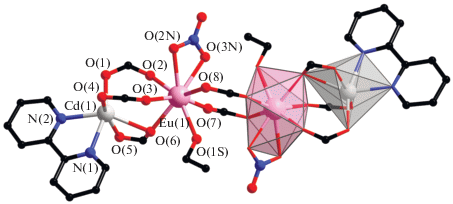
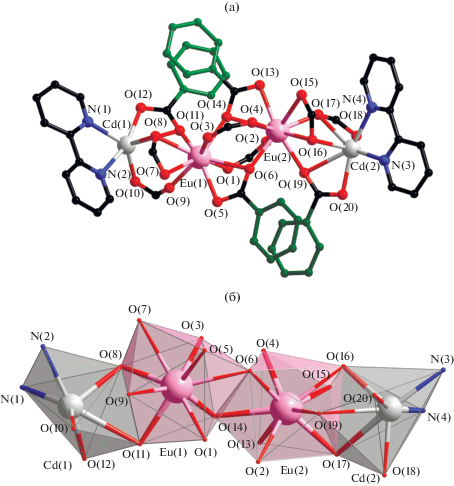
В комплексе II все атомы в составе молекулы структурно неэквивалентны. Геометрия координационного окружения обоих центральных атомов Eu (EuO9) соответствует одношапочной квадратной антипризме. Между собой атомы Eu(1) и Eu(2) связаны двумя мостиковыми и двумя хелатно-мостиковыми карбоксилат анионами (Eu–O 2.343(6)–2.584(5), Eu(1)…Eu(2) 3.964(7) Å (рис. 2а). В парах Ln–Cd атомы металлов связаны двумя хелатно-мостиковыми и одним мостиковым или тремя хелатно-мостиковыми карбоксилат-анионами (Eu–O 2.317(7)–2.620(6), Cd–O 2.228(6)–2.722(6), Cd…Eu 3.672(7), 3.749(7) Å). Атомы Cd достраивают свое окружение (CdO4/5N2) до искаженного тригонально-призматического (Cd(1)–N 2.290(7), 2.362(9) Å) и пентагонально-бипирамидального (Cd(2)–N 2.286(7), 2.387(9) Å) координацией двух атомов N молекулы Bipy (рис. 2б).
Рис. 2.
Строение молекулы комплекса II (а) (показаны заместители при карбоксилатной группе, участвующие в формировании внутримолекулярных π–π*-взаимодействий, атомы водорода и сольватные молекулы не показаны); координационные полиэдры ионов Cd и Eu комплекса II (б).
Комплекс III изоструктурен II, что было подтверждено данными РФА (рис. 3). Кристаллическая упаковка молекул также меняется в зависимости от природы анионов карбоновой кислоты. В кристалле комплекса I наблюдаются супрамолекулярные π–π-взаимодействия в результате близкой к параллельной ориентации пиридильных фрагментов лигандов соседних молекул (кратчайшее расстояние между плоскостями циклов лиганда (dплl–dпл), расстояние между центроидами С5N-фрагментов (dцентр– dцентр) и двугранный угол между ними (φ) равны 3.30, 3.72 Å, и 0.05° соответственно). Дипиридил также взаимодействует с ароматическим циклом BA соседней молекулы комплекса (расстояние между центроидами ароматических C5N- и С6-фрагментов и двугранный угол между ними равны 3.643 Å и 6.8° соответственно). Дополнительно π–π-взаимодействия наблюдаются между анионами BA двух соседних молекул I (расстояние между плоскостями, расстояние между центроидами С6-фрагментов и двугранный угол между ними равны 3.39, 3.40 Å; 3.843, 3.830 Å и 0.0°, 1.6°). Между OH-группой координированной молекулы EtOH и атомом O NO3-аниона происходит образование внутримолекулярной H-связи (O(1S)…O(3N) 2.745 Å) (рис. 4).
Рис. 3.
Сравнение дифрактограммы, полученной методом РФА для III (а) с расчетной (по данным РСА) для комплекса II (б).
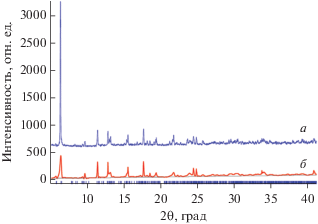
Рис. 4.
Фрагмент кристаллической упаковки комплекса I. Показаны заместители при карбоксилатной группе и молекулы Bipy, участвующие в π–π*-взаимодействиях (атомы водорода и сольватные молекулы не показаны).
Напротив, в случае комплекса II молекулы располагаются в кристалле изолированно, а внутримолекулярные π–π*-взаимодействия наблюдаются только между двумя парами 4-TBA-анионов (dпл–dпл = 3.53, dцентр–dцентр = 3.72 Å, φ = 4.61° и (dпл–dпл = 3.44, dцентр–dцентр = 3.83 Å, φ = 6.81°, рис. 2a).
Основное различие в строении комплексов заключается в характере связывания атомов Eu. Так, в I присутствуют две мостиковые карбоксилатные группы, тогда как в II имеются две мостиковые и две хелатно-мостиковые карбоксилатные группы. Координационные полиэдры атомов Eu в I имеют одну общую вершину, тогда как в II сочленены по ребру. Такое различие обусловлено составом комплексов. В I компактные NO3-анионы не обеспечивают достаточного экранирования атома металла, в результате его координационное окружение дополнено молекулой этанола. Тогда как в II координационное окружение атома Eu состоит из девяти атомов O только от карбоксилатных групп. При переходе от КЧ 8 к КЧ 9 наблюдается увеличение длины средней связи Ln–O (2.386 Å для I, 2.442 Å для II), что также характеризует факт роста стерических эффектов в ближайшем окружении ионов металлов.
В литературе сообщается только о нескольких примерах {Cd2Ln2}-комплексов с анионами ароматических монокарбоновых кислот, которые демонстрируют близкое к I и II строение ([Cd2Ln2(p-Tol)10(Рhen)2] (Ln = Nb, Pr, Sm), [Cd2Ho2(p-ClВnz)10(Рhen)2] [14] (Рhen = 1,10-фенантролин, H(p-Tol) = 4-метилбензойная кислота, H(p-ClВnz) = 4-хлорбензойная кислота)). Описан пример гетерометаллического {CdEu}-комплекса бензойной кислоты и Рhen состава [Cd2Eu(BA)7(Рhen)2], который, в отличие от комплекса I, формирует трехъядерный металлоостов [15]. Семейство {CdLn}-комплексов дополнено несколькими примерами биядерных, трехъядерных и пентаядерных соединений [14–18]. В случае Ln-3d-комплексов тетраядерные соединения схожего строения представлены более широко: Zn [15, 19, 20], Co [21–24], Ni [25, 26], Mn [27].
В случае использования солей H(4-CBA), H(PFBA) или H(4-ATFBA) в условиях, аналогичных для I–III, формирование гетерометаллических комплексов не наблюдалось. Единственными выделенными кристаллическими продуктами реакции были гомометаллические координационные соединения кадмия IV–VI. Однако, по-видимому, исключать принципиальную возможность образования гетерометаллических комплексов в растворе не следует, ввиду их вероятной нестабильности или высокой реакционной способности в существующих условиях проведения эксперимента.
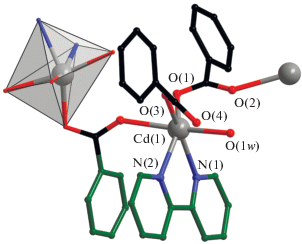
В структуре моноядерного комплекса IV (рис. 5а) атом кадмия достраивает свое окружение (CdO4N2) до тригонально-призматического координацией четырех атомов O двух хелатно и монодентатно связанных 4-CBA анионов (Cd–O 2.223(2)–2.459(2) Å), молекулы воды (Cd–O 2.307(2) Å) и двух атомов N молекулы Bipy (Cd–N 2.303(2)–2.311(3) Å).
Рис. 5.
Строение комплекса IV (заместители при карбоксилатной группе, атомы водорода и сольватные молекулы не показаны) (a); фрагмент кристаллической упаковки комплекса IV (показаны заместители при карбоксилатной группе и молекулы Bipy, участвующие в формировании π–π*-взаимодействий, атомы водорода и сольватные молекулы не показаны) (б).
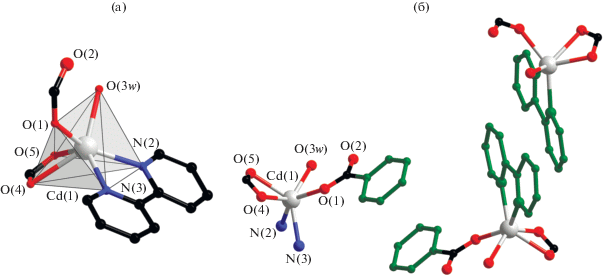
В упаковке комплекса IV (рис. 5б) наблюдается близкая к параллельной ориентация ароматических фрагментов N-донорных лигандов (dцентр– dцентр = = 3.57 Å и φ = 4.74°) и ароматических фрагментов 4-CBA-анионов соседних молекул комплекса (dпл–dпл = 3.45 Å, dцентр–dцентр = 3.67 Å, φ = 0.0°).
Комплекс V представляет собой известный полимер [28], в котором элементарное звено {Cd(H2O)(O2CR)2(Bipy)} имеет сходное строение с молекулярным комплексом IV, но хелатная карбоксилатная группа реализует также мостиковую функцию с образованием цепочки из атомов Cd (рис. 6). Следует отметить, что факт реализации полимерной структуры необычен, так как соединения состава [Cd(H2O)(O2CR)2(Bipy)] с анионами монокарбоновых ароматических кислот представлены исключительно моноядерными и биядерными молекулярными комплексами [29–34].
Рис. 6.
Фрагмент полимерной цепи комплекса V (показаны заместители при карбоксилатной группе и молекулы Bipy, участвующие в формировании π–π*-взаимодействий, атомы водорода и фтора, сольватные молекулы не показаны).
По мнению авторов статьи [28], стабилизация полимерной структуры происходит за счет π-стекинг-взаимодействий, межмолекулярных H-связей и слабых C–H…F–C взаимодействий. Однако недавно мы показали, что проведение реакции V в среде MeCN–EtOH и использование соотношения Cd : Ln = 3 : 1 позволяет избежать формирования гомометаллического полимера V и выделить {Cd2Ln}-комплекс состава [Cd2Eu(4-CBA)6(NO3)(Вipy)2] [17].
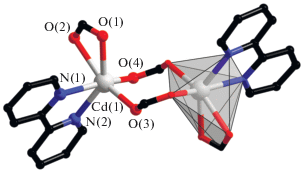
Использование калиевой соли H(4-ATFBA) в условиях, аналогичных получению I–V приводило к формированию гомометаллического комплекса VI. В его структуре атомы Cd формируют центросимметричный биядерный металлоостов за счет мостиковой координации двух 4-ATFBA-анионов (Cd–O 2.252(2)–2.276(3) Å; рис. 7). Каждый атом кадмия достраивает свое окружение (CdO4N2) до искаженного октаэдрического координацией двух атомов N молекулы Bipy (Cd–N 2.318(4), 2.367(4) Å) и двух атомов хелатно связанной карбоксилатной группы (Cd–O 2.321(3), 2.441(3) Å).
Рис. 7.
Строение комплекса VI (4-амино-2,3,5,6-тетрафторфенильные заместители, атомы водорода и сольватные молекулы не показаны).
В кристалле комплекса VI присутствуют межмолекулярные H-связи между аминогруппой и атомом кислорода двух 4-ATFBA-анионов соседних молекул комплекса (N(3)…O(1) 2.893 Å). Между ароматическими фрагментами Bipy соседних молекул комплекса наблюдаются π–π-взаимодействия (dпл–dпл = 3.44, dцентр–dцентра = 3.70 Å, φ = 0.29°) с образованием супрамолекулярной цепочки вдоль оси b (рис. 8).
Рис. 8.
Фрагмент кристаллической упаковки молекул комплекса VI (показаны заместители при карбоксилатной группе и молекулы Bipy, участвующие в формировании π–π*-взаимодействий, атомы водорода и фтора, и сольватные молекулы не показаны).
Фотофизические свойства комплексов II и III, содержащие ионы лантанидов, были изучены для твердых образцов при комнатной температуре. При возбуждении УФ-излучением образцы демонстрируют характерную для ионов европия(III) и тербия(III) соответственно, металл-центрированную люминесценцию. В спектре эмиссии комплекса II (рис. 9а) наблюдающиеся узкие полосы люминесценции с максимальной интенсивностью на длинах волн 580, 593, 617, 650 и 697 нм соответствуют переходам иона европия(III) 5D0 → 7FJ, где J = 0–4 соответственно. Серия слабых полос в диапазоне длин волн 520–560 нм относится к излучательным переходам с более высокого возбужденного состояния 5D1 иона Eu3+. Переход 5D0 → 7F0 в спектре люминесценции представлен единственной симметричной полосой, что свидетельствует об одинаковом координационном окружении обоих ионов европия(III) в молекуле. Это также подтверждается одноэкспоненциальным характером затухания люминесценции Eu3+ в исследуемом комплексе (τнабл = 1.8 мс).
Рис. 9.
Спектр эмиссии комплекса II (а) и III (б) при комнатной температуре и λэмис = 617, 545 нм соответственно. На вставке – фрагмент спектра с лиганд-центрированной люминесценцией.
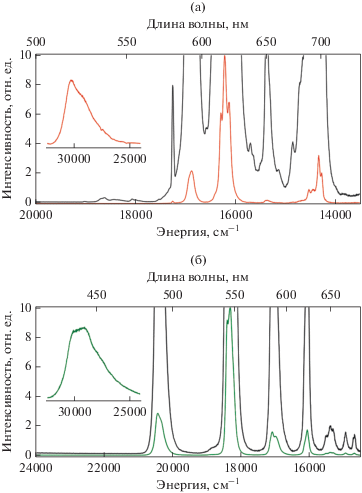
Отношение интегральных интенсивностей переходов 5D0 → 7F2 и 5D0 → 7F1 иона европия(III) часто служит мерой асимметрии окружения Eu3+, так как при наличии центра инверсии переход 5D0 → 7F2 строго запрещен. Следовательно, чем сильнее нарушение симметрии локального поля иона европия(III), тем интенсивнее переход 5D0 → 7F1. От--ношение I(5D0 → 7F2)/I(5D0 → 7F1) для комплекса II равно 5.54, что согласуется с отсутствием центра инверсии координационного окружения Eu3+.
Спектр эмиссии комплекса III (рис. 9б) содержит узкие полосы с максимумами интенсивности на длинах волн 490, 546, 585 и 622 нм, соответствующие переходам 5D4 → 7FJ, где J = 6–3 соответственно. Полосы переходов 5D4 → 7FJ(J = 2–0) с максимумами при 649, 668 и 680 нм соответственно, гораздо менее интенсивны.
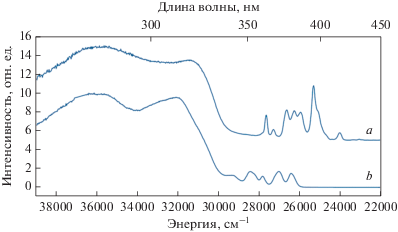
Спектры оптического возбуждения люминесценции комплексов II и III приведены на рис. 10. Широкие полосы, относящиеся к π → π*-переходам лигандов, свидетельствуют о сенсибилизации люминесценции ионов лантанидов ароматической составляющей комплекса, далее d-блоком. Узкие линии относятся к f–f-поглощению соответствующих ионов лантанидов. Как следует из представленных спектров, возбуждение ионов через лиганд в случае с исследуемыми комплексами более эффективно, чем прямое возбуждение Ln3+, наблюдается ярко выраженный “антенный эффект”.
Рис. 10.
Спектры возбуждения люминесценции комплексов II (a), III (б) при λвозб = 280 нм и комнатной температуре.
Комплексы II и III демонстрируют невысокий квантовый выход люминесценции (13 и 7% соответственно). Для выяснения причины низкой эффективности люминесценции комплекс II был подробнее исследован спектральными и кинетическими методами. Измерение затухания люминесценции показало большое время жизни 5D0-состояния комплекса II (~1.8 мс), что приближено к времени жизни этого состояния свободного иона европия(III). Внутренний квантовый выход был рассчитан по формуле $Q_{{{\text{Eu}}}}^{{{\text{Eu}}}}$ = $\frac{{{{{\tau }}_{{{\text{набл}}}}}}}{{{{{\tau }}_{{\text{R}}}}}},$ где τнабл – характерное время жизни 5D0-состояния, 1/τизл = = Aизл = AMДn3Iобщ/IMД – вероятность излучательного перехода Eu3+ в основное состояние, AMД – излучательная вероятность магнитного дипольного перехода 5D0 → 7F1, которую в первом приближении можно считать не зависящей от лигандного окружения и равной 14.65 с–1, n – коэффициент преломления, принимаемый нами равным 1.5, Iобщ/IMД – отношение общей интегральной интенсивности люминесценции иона к интегральной интенсивности перехода 5D0 → 7F1 [35]. Внутренний квантовый выход комплекса II равен 81%, что свидетельствует об эффективности процесса люминесценции иона европия(III) в данной матрице и отсутствии тушителей люминесценции в ближайшем окружении иона, например высокочастотных осцилляторов O–H и C–H [36]. Следовательно, низкий абсолютный квантовый выход люминесценции связан с неэффективным переносом энергии от d-блока к центральному иону. На низкую эффективность транспортировки энергии также указывают широкие полосы в диапазоне длин волн 310–440 нм в спектрах люминесценции комплексов II и III (вставки на рис. 9 и 10 соответственно), относящиеся к излучательным переходам d-блока в основное состояние. Интенсивность этих полос по отношению к интенсивности люминесценции иона лантанида составляет ~2% у комплекса II и ~5% у комплекса III. Часть возбуждающей энергии также теряется на безызлучательные переходы лигандов в основное состояние, происходящие без передачи энергии к эмиссионному центру.
Таким образом, на примере исследованной системы, мы изучили влияние природы заместителя при карбокислатной группе на состав и строение образующихся продуктов реакции. С анионами бензойной и 4-трифторметилбензойной были выделены гетерометаллические {Cd2Ln2}-комплексы, с анионами 4-цианобензойной, 4-амино-2,3,5,6-тетрафоторбензойной и пентафторбензойной кислот получены комплексы Cd. Для выделения {Cd2Eu}-комплекса с анионом пентафторбензойной кислоты, который был описан ранее, необходимы изменения условий синтеза, это указывает на возможность получения {Cd2Ln2}-комплексов и с другими анионами кислот. Комплексы II и III характеризуются металл-центрированной эмиссией, усиленной ароматическими органическими лигандами. Невысокие квантовые выходы люминесценции для II и III связаны с малоэффективным переносом энергии от лигандов-антенн к центральному иону.
Список литературы
Koroteev P.S., Dobrokhotova Zh. V., Novotortsev V. M. // Russ. J. Gen. Chem. 2018. V. 88. № 6. P. 1306. https://doi.org/10.1134/S1070363218060415
Simon J.A. Pope, Burton-Pye Benjamin P., Rory Berridge et al. // Dalton Trans. 2006. № 23. P. 2907.
Koroteev P.S., Dobrokhotova Z.V., Ilyukhin A.B. et al. // Polyhedron. 2015. V. 85. P. 941.
Dybtsev D.N., Sapianik A.A., Fedin V.P. // Mendeleev Commun. 2017. V. 27. № 4. P. 321.
Barsukova M.O., Samsonenko D.G., Sapianik A.A. et al. // Polyhedron. 2018. V. 144. P. 219.
Dobrokhotova Zh.V., Gogoleva N.V., Zorina-Tikhonova E.N. et al. // Eur. J. Inorg. Chem. 2015. № 19. P. 3116.
Гоголева Н.В., Зорина-Тихонова Е.Н., Кискин М.А. и др. // Изв АН. Сер. хим. 2014. № 12. С. 2741.
Gogoleva N.V., Zorina-Tikhonova E.N., Kiskin M.A. et al. // Eur. J. Inorg. Chem. 2017. № 3. P. 547.
SMART (control) and SAINT (integration). Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
Sheldrick G.M. SADABS. Madison (WI, USA): Bruker AXS Inc., 1997.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Alvarez S., Llunell M. // Dalton Trans. 2000. P. 3288.
Casanova D., Llunell M., Alemany P., Alvarez S. // Chem. Eur. J. 2005. V. 11. P. 1479.
Chi Yu-Xian, Niu Shu-Yun, Jin Jing et al. // Dalton trans. 2009. № 37. P. 7653.
Yu-Xian Chi, Yu-Qian Liu, Xiao-Shuang Hu et al. // Z. Anorg. Allg. Chem. 2016. V. 642. P. 73.
Шмелев М.А., Гоголева Н.В., Кискин М.А. и др. // Коорд. химия. 2020. Т. 46. № 1. С. 1 (Shmelev M.A., Gogoleva N.V., Kiskin M.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. №. 1. P. 3).https://doi.org/10.1134/S1070328420010078
Chi Yu-Xian, Niu Shu-Yun, Wang Zhao-Long, Jin Jing // Eur. J. Inorg. Chem. 2008. № 14. P. 2336.
Chi Yu-Xian, Niu Shu-Yun, Wang Zhao-Long et al. // Gaodeng Xuexiao Huaxue Xuebao (Chem. J. Chin. Univ.). 2008. V. 29. P. 1081.
Goldberg A.A., Kiskin M., Nikolaevskii S. et al. // Chem. Asian J. 2016. V. 11. P. 604.
Yin Mingcai, Sun Jutang // J. Coord. Chem. 2005. V. 58. P. 335.
Goldberg A.E., Nikolaevskii S.A., Kiskin M.A. et al. // Russ. J. Coord. Chem.2015. V. 41. P. 707. https://doi.org/10.1134/S1070328415120015
Zhu Yan, Luo Feng, Feng Xue-Feng et al. // Aust. J. Chem. 2013. V. 66. P. 75.
Zhao Fang-Hua, Li Hui, Che Yun-Xia et al. // Inorg. Chem. 2014. V. 53. P. 9785.
Chen Sihuai, Mereacre V., Zhao Zhiying et al. // New J. Chem. 2018. V. 42. P. 1284.
Li Yan, Shang Qiu, Zhang Yi-Quan et al. // Chem. Eur. J. 2018. V. 22. P. 18840.
Gogoleva N., Zorina-Tikhonova E., Sidorov A. et al. // J. Cluster Sci. 2015. V. 26. P. 137.
Tan Xin, Che Yun-Xia, Zheng Ji-Min // Inorg. Chem. Commun. 2013. V. 37. P. 17.
Kong Y.-J., Li P., Han L.-J. et al. // Acta Crystallogr. C. 2017. V. 73. P. 424.
Zhang Bi-Song, Zeng Xi-Rui, Fang Xiao-Niu, Huang Chun-Fang // Z. Kristallogr. New Cryst. Struct. 2005. V. 220. P. 141.
Zhu Long-Guan, Hu Mao-Lin // Acta Crystallogr. E. 2006. V. 62. P. M653.
Daia P.X., Yangb E.C., Zhaob X.J. // Russ. J. Coord. Chem. 2015. V. 41. P. 16.
Xiu-Rong Jiang, Yan Dong, Wu-Hua Chen, De-Cai Wen // Asian. J. Chem. 2012. V. 24. P. 2813.
Chun-Sen Liu, Jun-Jie Wang, Ze Chang, Li-Fen Yan // Z. Anorg. Allg. Chem. 2010. V. 636. P. 1115.
Deng Zhao-Peng, Gao Shan, Huo Li-Hua, Zhao Hui // Acta Crystallogr. E. 2007. V. 63. P. m2799.
Werts M.H.V., Jukesand R.T.F., Verhoeven J.W. // Phys. Chem. Chem. Phys. 2002. V. 4. P. 542.
Beeby A., Clarkson I.M., Dickins R.S. et al. // Perkin Trans. 1999. V. 2. P. 493.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия