Координационная химия, 2020, T. 46, № 8, стр. 465-476
Синтез и люминесцентные свойства комплексов лантаноидов с бензотиазолилфенолятными и -нафтолятными лигандами
Т. В. Балашова 1, *, С. К. Полякова 1, 2, А. А. Кукинов 1, 2, И. Д. Гришин 2, Р. В. Румянцев 1, Г. К. Фукин 1, В. А. Ильичев 1, М. Н. Бочкарев 1, 2
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
2 Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: petrovsk@iomc.ras.ru
Поступила в редакцию 15.01.2020
После доработки 12.03.2020
Принята к публикации 22.03.2020
Аннотация
Синтезированы комплексы Sm, Er, Yb содержащие, анионные (4,5,6,7-тетрафторбензотиазол-2-ил)-2-(3,4,5,6-тетрафтор)фенолятные (SONF), 3-(2-бензотиазол-2-ил)-2-нафтолятные (NpSON) и нейтральные 1,10-фенантролиновые и 2,2'-бипиридильные лиганды. Строение комплексов Yb(SONF)2(NpSON)(DME)1.5 (II) и ранее полученного Er(SONF)3(DME) (I) установлено методом РСА (CIF files CCDC № 1972769 и 1972770 соответственно). Все комплексы при возбуждении светом с λ 405 нм обнаружили люминесценцию лигандов и соответствующих ионов Ln3+. OLED-устройства на основе комплексов самария показали металл-центрированную эмиссию средней интенсивности при напряжении 19 В.
Среди потенциальных областей применения соединений редкоземельных металлов одной из основных является область люминесцентных материалов, что обусловлено уникальным свойством ионов Ln3+ генерировать узкополосную эмиссию f–f-переходов. При этом длина волны излучения может меняться от ближнего УФ- до ближнего ИК-диапазонов в зависимости от природы лантаноида. Скандий, иттрий и лантан, не имеющие f-электронов, а также лютеций с заполненной 4f-оболочкой не дают металл-центрированной эмиссии, однако их производные представляют значительный интерес как модельные соединения и потенциальные флуорофоры с лиганд-центрированной эмиссией. Кроме использования люминесцентных комплексов в биомедицине для диагностики заболеваний и визуализации внутренних органов и тканей в живых системах [1–4], большое внимание уделяется их применению в качестве эмиссионных слоев в органических светоизлучающих диодах (OLEDs) [5–7]. Хорошо известный и практически единственный способ повышения эффективности свечения ионов лантаноидов – выбор лигандов, способных сенсибилизировать свечение лантаноидного центра за счет антенного эффекта. В последние годы особенно большое внимание привлекают комплексы лантаноидов, излучающие в ближней ИК-области [8], что связано с их применением в оптических усилителях [9, 10], лазерных системах [11], приборах ночного видения, охранных устройствах и флуороиммунологических анализах [12]. Синтез ИК-излучающих люминофоров представляет некоторые трудности, поскольку энергетическая щель между основным и возбужденным состояниями иона Ln3+ в этом случае невелика, и, как следствие, колебания низкоэнергетических связей С–Н в лигандах эффективно тушат эмиссию металла. Ранее было показано, что замена CH-групп на CF-группы позволяет увеличить эффективность люминесценции вследствие уменьшения тушения [13, 14].
Другой способ повышения ИК-эффективности люминофоров – введение в комплекс нейтральных лигандов, обеспечивающих высокий коэффициент экстинкции. Одним из наиболее распространенных нейтральных лигандов для сенсибилизации люминесценции ионов лантаноидов является о‑фенантролин, обладающий высоким молярным коэффициентом экстинкции [15–18]. Кроме того, присутствие в молекуле фенантролина двух атомов азота обеспечивает образование стабильного хелатного цикла с ионом металла и экранирование его координационной сферы от тушащих люминесценцию молекул воды или растворителя.
Цель настоящей работы – синтез новых эффективных ИК-излучающих люминофоров, а именно гетеролигандных комплексов Er и Yb, и исследование их фото- и электролюминесцентных свойств. Для отработки метода синтеза были получены комплексы самария.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтезы проводили в условиях, исключающих контакт с кислородом и влагой воздуха, с использованием стандартной техники Шленка. Диметоксиэтан (ДМЕ) и тетрагидрофуран (THF) сушили бензофенонкетилом натрия по стандартной методике и отбирали в вакууме непосредственно перед использованием. Силиламидные комплексы Ln[N(SiMe3)2]3 получали по методике [19], лиганды (2-бензтиазол-2-ил)нафтол (HNpSON) и 2‑(3,4,5,6-тетрафтор-2-гидроксифенил)-4,5,6,7-тетрафторбензотиазол [H(SONF)] – по методикам [20, 21]. 2,2'-Бипиридин (Вipy) и 1,10-фенантролин (Phen) – коммерческие реактивы (Aldrich). Комплексы Er(SONF)3(DME) (I) и Yb(SONF)2Cp(DME) получали, как описано ранее [22, 23].
Синтез Yb(SONF)2(NpSON)(DME)1.5 (II). Раствор 3-(2-бензотиазол-2-ил)-2-нафтола (65 мг, 0.23 ммоль) в ДМЕ (5 мл) добавляли к раствору Yb(SONF)2Cp(DME) (250 мг, 0.23 ммоль) в ДМЕ (10 мл). Реакционную смесь перемешивали в течение 30 мин при комнатной температуре. При медленном удалении летучих продуктов реакции выпадали кристаллы желтого цвета, которые отделяли декантацией. Твердый продукт промывали холодным ДМE и высушивали в вакууме. Выход II 240 мг (77%).
| Найдено, %: | C 44.42; | H 1.90; | N 3.17; | S 7.26; | Yb 13.06. |
| Для C49H25N3O6F16S3Yb | |||||
| вычислено, %: | C 44.08; | H 1.71; | N, 3.09; | S, 7.11; | Yb, 12.93. |
ИК-спектр (KBr; ν, cм–1): 1652 ср, 1627 ср, 1589 с, 1347 с, 1315 сл, 1260 ср, 1186 ср, 1142 сл, 1128 сл, 1088 ср, 1051 ср, 991 с, 950 ср, 888 сл, 852 ср, 817 сл, 752 с, 722 ср, 625 сл, 466 сл.
Синтез Sm(SONF)3(Phen)(DME) (III). Раствор 2-(3,4,5,6-тетрафтор-2-гидроксифенил)-4,5,6,7-тетрафторбензотиазола (114 мг, 0.31 ммоль) и Phen (18.5 мг, 0.10 ммоль) в ДМЕ (10 мл) добавляли к раствору Sm[N(SiMe3)2]3 (65 мг, 0.10 ммоль) в ДМЕ (5 мл). Реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Раствор концентрировали до 2 мл. Светло-желтый осадок комплекса III осаждали гексаном, отделяли декантацией, промывали холодным гексаном и сушили в вакууме. Выход III 112 мг (71%).
| Найдено, %: | C 43.14; | H 1.18; | N 4.57; | S 6.28; | Sm 10.43. |
| Для C55H18N5O5F24S3Sm | |||||
| вычислено, %: | C 43.20; | H 1.15; | N 4.63; | S 6.32; | Sm 10.39. |
ИК-спектр (KBr; ν, cм–1): 1652 ср, 1632 ср, 1586 ср, 1498 с, 1422 ср, 1351 сл, 1286 сл, 1259 ср, 1227 сл, 1183 сл, 1147 сл, 1098 сл, 1056 сл, 1000 с, 881 сл, 866 сл, 844 ср, 817 ср, 773 сл, 754 ср, 656 сл, 639 сл, 627 сл, 525 сл, 495 сл, 461 сл. ЯМР 19F (376 МГц; THF-d8; 20°C; δ, м.д.): –140.8 м., –142.3 м., –149.8 м., –158.2 м., –161.7 м., –162.0 м., –162.2 м., –180.0 м. МАЛДИ МС: (М+) 1071.8 (Sm(SONF)2(Phen)+); (M–) 1633.8 $\left( {{\text{Sm}}\left( {{\text{SO}}{{{\text{N}}}^{{\text{F}}}}} \right)_{{\text{4}}}^{--}} \right).$
Синтез Sm(SONF)3(Bipy)(DME) (IV). Раствор 2‑(3,4,5,6-тетрафтор-2-гидроксифенил)-4,5,6,7-тетрафторбензотиазола (178 мг, 0.50 ммоль) и Вipy (25 мг, 0.16 ммоль) в ДМЕ (10 мл) добавляли к раствору Sm[N(SiMe3)2]3 (101 мг, 0.16 ммоль) в ДМЕ (5 мл). Реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Рас-твор концентрировали до 2 мл. Выпавший светло-желтый осадок комплекса IV отделяли декантацией, промывали холодным ДМE и высушивали в вакууме. Выход IV 170 мг (70%).
| Найдено, %: | C 42.23; | H 1.20; | N 4.65; | S 6.38; | Sm 10.61. |
| Для C53H18N5O5F24S3Sm | |||||
| вычислено, %: | C 42.18; | H 1.23; | N 4.59; | S 6.41; | Sm 10.68. |
ИК-спектр (KBr; ν, cм–1): 1654 ср, 1596 ср, 1500 с, 1439 с, 1412 сл, 1352 ср, 1291 сл, 1261 ср, 1181 ср, 1159 сл, 1139 сл, 1098 ср, 1047 сл, 998 с, 886 ср, 869 сл, 820 ср, 766 ср, 749 ср, 654 сл, 647 сл, 625 сл, 615 сл, 600 сл, 525 сл, 498 сл, 464 сл. ЯМР 19F (376 МГц; THF-d8, 20°C; δ, м.д.): –140.1 м., –140.3 м., –150.5 м., –155.6 м., –161.0 м., –161.6 м., –164.8 м., –178.5 м. МАЛДИ МС: (М+) 1047.7 (Sm(SONF)2(Вipy)+); (M–) 1633.8 $\left( {{\text{Sm}}\left( {{\text{SO}}{{{\text{N}}}^{{\text{F}}}}} \right)_{{\text{4}}}^{--}} \right).$
Синтез Er(SONF)3(Phen)(DME) (V) выполняли по методике, аналогичной для III, используя 2‑(3,4,5,6-тетрафтор-2-гидроксифенил)-4,5,6,7-тетрафторбензотиазол (163 мг, 0.44 ммоль), Phen (26 мг, 0.14 ммоль) и Er[N(SiMe3)2]3 (95 мг, 0.15 ммоль) в ДМЕ (15 мл). Выход V 177 мг (78%).
| Найдено, %: | C 42.67; | H 1.17; | N 4.52; | S 6.60; | Er 10.80. |
| Для C55H18N5O5F24S3Er | |||||
| вычислено, %: | C 42.64; | H 1.20; | N 4.59; | S 6.57; | Er 10.77. |
ИК-спектр комплекса V аналогичен спектру соединения III. МАЛДИ МС: (М+) 1087.9 (Er(SONF)2-(Phen)+); (M–) 1647.8 $\left( {{\text{Er}}\left( {{\text{SO}}{{{\text{N}}}^{{\text{F}}}}} \right)_{{\text{4}}}^{--}} \right).$
ИК-спектры записывали на Фурье-спектрометре ФСМ-1201 в диапазоне 4000–400 см–1 (суспензии в вазелиновом масле). С, Н, N, S-элементный анализ выполняли на анализаторе Elementar Vario ELcube Analyzer. Спектры поглощения снимали на спектрометре Perkin-Elmer 577, для снятия спектров эмиссии в диапазоне 200–800 нм использовали спектрометр Perkin-Elmer LS-55. Спектры и эффективность в ИК-диапазоне определяли на спектрометре NIR-512 (Ocean Optics), калиброванном по лампе LS-1 CAL (Ocean Optics). Спектры ЯМР 19F регистрировали при 376 МГц в THF-d8 на спектрометре Agilent DD2 400.
Масс-спектры регистрировали с использованием масс-спектрометра Bruker Microflex LT в линейном режиме. Подготовка образца: 2–5 мг твердого соединения распределяли по пластине из нержавеющей стали с помощью шпателя. На распределенное по пластине соединение наносили 2 мкл раствора DCTB (транс-2-[3-(4-трет-бутилфенил)-2-метил-2-пропенилиден]малонитрил) (20 мг/мл) в THF, затем образец высушивали на воздухе в течение 5–10 с и помещали в спектрометр. Регистрировали спектры положительных или отрицательных ионов в зависимости от анализируемого соединения.
Трехслойные OLED-устройства (органические светоизлучающие диоды) состава ITO/TPD (25 нм)/комплекс (45 нм)/BATH (15 нм)/Yb (ITO – окись индия-олова (анод), TPD – N,N'-бис-(3-метилфенил)-N,N'-дифенилбензидин (дырочно-транспортный слой), BATH – 4,7-дифенил-1,10-фенантролин (дырочно-блокирующий слой), Yb – катод) получали последовательным нанесением нанослоев органических материалов и верхнего иттербиевого контакта методом термического испарения–конденсации в вакууме (5 × 10−6 Торр) на стеклянную подложку, покрытую прозрачным проводящим оксидом индия-олова ITO (100 нм, поверхностное сопротивление 15 Ом/см2, Aldrich). Толщину слоев контролировали с помощью калиброванного кварцевого резонатора (“Quartz crystal monitor Q-pod”). Спектры электролюминесценции (ЭЛ) в видимом диапазоне, вольт-амперные и яркостные характеристики получали на некапсулированных образцах с использованием флуориметра USB-2000 (“Ocean Optics”) для видимого диапазона и NIR-512 (“Ocean Optics”) для ближнего ИК-диапазона, источника питания PPE 3323 (“GW Instek”) и цифрового мультиметра GDM 8246 (“GW Instek”).
РСА. Кристаллографические данные комплексов I и II получены на дифрактометре Bruker D8 Quest (графитовый монохроматор, МоKα-излучение, λ = 0.71073 Å). Экспериментальные наборы интенсивностей интегрированы с помощью программы SAINT [24]. Программа SADABS [25] использована для введения поправок на поглощение. Структуры расшифрованы методом “dual-space” с использованием программы SHELXT [26]. Неводородные атомы уточнены полноматричным МНК по $F_{{hkl}}^{{\text{2}}}$ в анизотропном приближении с помощью программного пакета SHELXTL [27]. Атомы водорода помещены в геометрически рассчитанные положения и уточнены в модели наездника. В кристалле на две молекулы комплекса I приходится одна некоординированная молекула ДМЕ. Кристалл комплекса I уточнен, как двухкомпонентный двойник с соотношением доменов ~0.92 : 0.08 (матрица двойникования [–1 0 0 0 –1 0 –0.583 –0.699 1]). На каждую молекулу комплекса I в кристалле приходится 2.5 молекулы толуола. Основные кристаллографические характеристики и параметры уточнения структур I и II приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические характеристики и параметры уточнения для комплексов I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Брутто-формула | C60.50H30ErF24N3O5S3 | C49H25F16N3O6S3Yb |
| М | 1598.31 | 1324.94 |
| Температура, K | 100(2) | 100(2) |
| Сингония | Триклинная | Триклинная |
| Пр. гр. | P1 | P1 |
| a, Å | 10.6172(7) | 13.6813(8) |
| b, Å | 12.9600(8) | 13.8163(8) |
| c, Å | 22.9917(14) | 25.6341(15) |
| α, град | 76.210(2) | 81.212(2) |
| β, град | 78.758(2) | 78.226(2) |
| γ, град | 72.119(2) | 82.168(3) |
| V, Å3 | 2898.5(3) | 4660.1(5) |
| Z | 2 | 4 |
| ρ(выч.), мг/м3 | 1.831 | 1.888 |
| μ, мм–1 | 1.688 | 2.262 |
| Размер кристалла, мм | 0.25 × 0.21 × 0.12 | 0.20 × 0.17 × 0.09 |
| F(000) | 1572 | 2600 |
| θ, град | 2.243–28.000 | 2.256–29.999 |
| Число отражений собранных/независимых | 28 946/13 641 | 63 520/27 132 |
| Rint | 0.0448 | 0.0585 |
| R1, wR2 (I > 2σ(I)) | 0.0681, 0.01464 | 0.0467, 0.0756 |
| R1, wR2 (по всем данным) | 0.0787, 0.01526 | 0.0729, 0.0802 |
| S | 1.075 | 1.029 |
| Остаточная электронная плотность (max/min), e/Å3 | 2.064/–2.760 | 2.062/–1.590 |
Таблица 2.
Основные длины связей и валентные углы в структурах I и II
| Связь | I (Ln = Er) | II (Ln = Yb) | |
|---|---|---|---|
| A | B | ||
| d, Å | |||
| Ln(1)–O(1) | 2.148(5) | 2.148(2) | 2.161(3) |
| Ln(1)–O(2) | 2.161(5) | 2.166(2) | 2.152(2) |
| Ln(1)–O(3) | 2.138(5) | 2.115(2) | 2.119(2) |
| Ln(1)–O(4) | 2.414(5) | 2.428(2) | 2.387(2) |
| Ln(1)–O(5) | 2.395(5) | 2.366(2) | 2.402(2) |
| Ln(1)–N(2) | 2.584(6) | 2.549(3) | 2.577(3) |
| Ln(1)–N(3) | 2.632(6) | 2.473(3) | 2.492(3) |
| Ln(1)…S(1) | 3.808 | 3.970 | 4.046 |
| Угол | ω, град | ||
| O(2)Yb(1)N(2) | 70.55(19) | 69.90(9) | 69.89(9) |
| O(3)Yb(1)N(3) | 69.2(2) | 72.33(9) | 72.38(9) |
| O(1)Yb(1)O(2) | 94.4(2) | 88.04(9) | 84.57(9) |
| O(1)Yb(1)O(3) | 111.3(2) | 118.33(9) | 119.49(10) |
| O(2)Yb(1)O(3) | 138.22(19) | 141.45(9) | 144.36(9) |
Структуры депонированы в Кембриджском банке структурных данных (CCDC № 1972769 (II), 1972770 (I); https://www.ccdc.cam.ac.uk/structures/).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
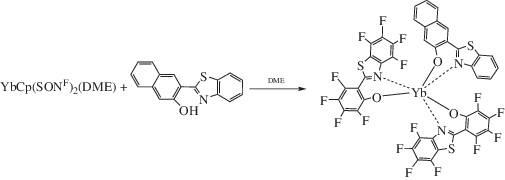
Для получения комплекса Yb(SONF)2(NpSON)- (DME)1.5 (II) использована реакция соединения YbCp(SONF)2, содержащего лабильную группу Cp-Yb, с (2-бензтиазол-2-ил)нафтолом в растворе ДМE (схема 1 ). Реакция легко протекает при комнатной температуре, в результате образуется продукт в виде желтых кристаллов с выходом 77%.
Схема 1 .
По данным РСА, в кристалле II находятся две независимые молекулы A и B комплекса с подобным молекулярным строением. Среднее отклонение неводородных атомов при наложении двух молекул составляет 0.270 Å. Поскольку основные геометрические характеристики обеих молекул близки (табл. 2), далее будет подробно рассмотрено строение только молекулы A. Атом иттербия в комплексе II связан с двумя SONF-лигандами, NpSON-лигандом и нейтральной молекулой ДМЕ (рис. 1б).
Рис. 1.
Молекулярная структура комплексов I (а) и II (б). Тепловые эллипсоиды приведены с 30%-ной вероятностью. Атомы водорода не показаны для ясности.
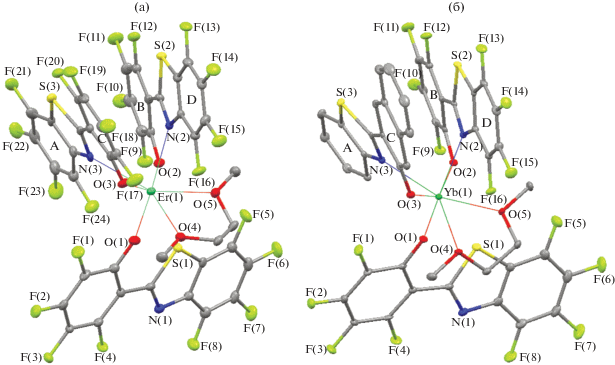
Нафтильный лиганд NpSON и один из SONF-лигандов имеют бидентатную координацию через атомы азота и кислорода. Второй SONF-лиганд связан с атомом иттербия монодентатно через атом кислорода. Бензотиазолильный фрагмент в этом лиганде направлен на атом металла атомом серы, однако расстояние Yb…S (3.970 Å) существенно превышает сумму ионного радиуса Yb3+ (R = 0.985 Å) [28] и ван-дер-ваальсова радиуса серы (R = 1.8 Å) [29]. Таким образом, координационное число атома иттербия в комплексе II равно семи.
Расстояния Yb–O и Yb–N в комплексе II варьируются в узком диапазоне (табл. 2), характерном для родственных комплексов иттербия [30–32]. Оба SONF-лиганда и NpSON-лиганд в комплексе II неплоские.
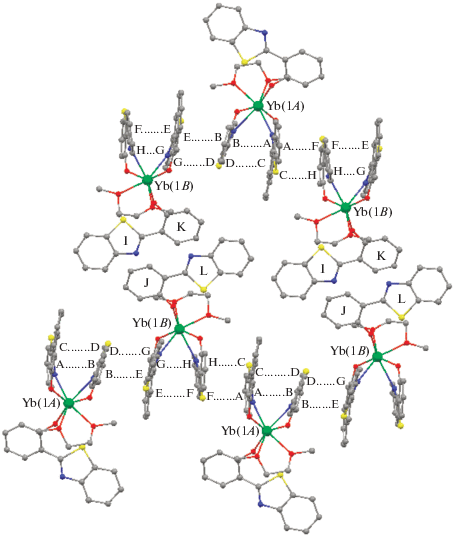
Геометрические характеристики молекул комплекса II свидетельствуют о существовании π…π-взаимодействия между лигандами NpSON и бидентатно координированным SONF. Двугранный угол между фенолятным фрагментом SONF-лиганда и бензотиазолильным фрагментом NpSON-лиганда составляет 20.98°, а двугранный угол между нафтолятным фрагментом NpSON-лиганда и бензотиазолильным фрагментом SONF-лиганда – 12.14°. Расстояния между центрами ароматических систем A…B и C…D составляют 3.694 и 3.469 Å соответственно (рис. 1). В кристалле молекулы A и B образуют цепочки за счет межмолекулярных π…π-взаимодействий (рис. 2).
Рис. 2.
Фрагмент кристаллической упаковки комплекса II. Обозначения ароматических систем в молекуле B: G, H, E и F соответствуют обозначениям A, B, C и D в молекуле А (рис. 1). Атомы фтора и водорода не приведены для ясности.
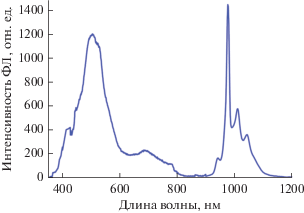
Исследование фотолюминесцентных свойств комплекса II показало, что при возбуждении диодным лазером с λ = 405 нм при 300 К, кроме лиганд-центрированной эмиссии, наблюдается интенсивная люминесценция ионов Yb3+ (985 нм, переход 2F5/2 → 2F7/2) (рис. 3).
Интересно отметить, что в комплексе эрбия Er(SONF)3(DME) (I), полученном ранее и выделенном из метанольного раствора, все три лиганда SONF связаны с атомом металла бидентатно [22]. В то же время, как установлено в настоящем исследовании, в кристаллах того же комплекса I, полученных из раствора в толуоле, два анионных лиганда координированы на атоме металла бидентатно, тогда как третий связан с ионом Er3+ только через атом кислорода. Атом серы бензотиазолильного фрагмента монодентатно координированого лиганда, так же как в комплексе II, направлен на атом металла. Расстояние Er…S (3.808 Å) в I несколько короче соответствующего Yb…S в II, однако существенно превышает сумму ионного радиуса Er3+ (R = 1.004 Å) [29] и ван-дер-ваальсова радиуса серы (R = 1.8 Å) [30]. Таким образом, атом эрбия в I имеет схожее координационное окружение с атомом Yb в II.
Расстояния Er–O и Er–N в комплексе I сопоставимы или незначительно превосходят расстояния Yb–O и Yb–N в комплексе II (табл. 2), что хорошо согласуется с незначительным различием в ионных радиусах эрбия и иттербия [28]. Так же, как в комплексе II, в комплексе I реализуются внутримолекулярные π…π-взаимодействия между бидентатно координированными лигандами, о чем свидетельствуют геометрические характеристики молекул. Двугранные углы между фенолятными и бензотиазолильными фрагментами SONF-лигандов составляют 19.73° и 25.18°. Расстояния между центрами ароматических систем A…B и C…D составляют 3.597 и 3.678 Å соответственно (рис. 1а). Кроме того, расположение молекул комплекса I в кристалле указывает на существование межмолекулярного π…π-взаимодействия: бидентатно координированные SONF-лиганды расположены таким образом, что плоскости ароматических колец A и C практически параллельны плоскостям некоординированных молекул толуола (двугранные углы между плоскостями A и E, С и F составляют 0.32°, 2.98°), а плоскости ароматических колец B и D незначительно развернуты относительно плоскостей молекул толуола (двугранные углы B и E, D и F составляют 21.04° и 21.62°). Расстояния между центрами ароматических систем A…E, С…F, B…E, D…F составляют 3.532, 3.416, 3.806 и 3.704 Å соответственно (рис. 4).
Рис. 4.
Фрагменты кристаллической упаковки комплекса I. Ароматические системы молекул толуола в кристалле отмечены на рисунке буквами E, F, H. Атомы фтора и водорода не приведены для ясности.
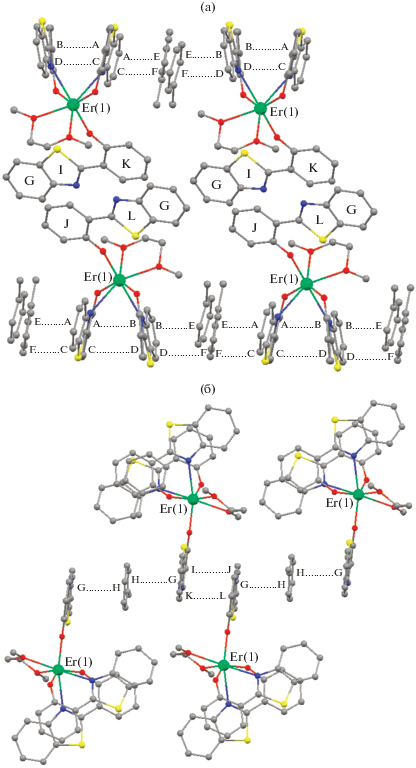
Монодентатно координированные SONF-лиганды практически параллельны друг другу и формируют димерные пары (рис. 4а). Вследствие межмолекулярных π…π-взаимодействий [33] молекулы соединения в кристалле формируют квазибесконечные цепочки (рис. 4б).
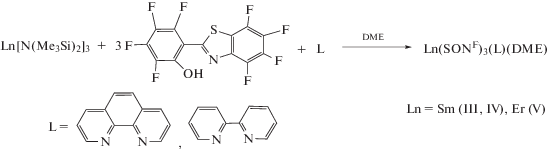
Известно, что введение в состав комплексов нейтральных вспомогательных лигандов, таких как Phen и Bipy позволяет повысить термостабильность соединений за счет насыщения координационной сферы иона лантаноида [34] и, как следствие, предотвращения внутримолекулярной координации F–Ln, имеющей место в гомолигандных комплексах [22]. Такой же прием был использован при получении полифторированных бензотиазолятных комплексов Sm и Er, предназначенных для приготовления OLED-устройств методом термического напыления в вакууме. Соединения III–V были получены по реакции Ln[N(SiMe3)2]3 с H(SONF) в среде ДМE в присутствии Phen или Bipy (схема 2 ).
Схема 2 .
Поскольку кристаллы комплексов III–V, пригодные для РСА, не были получены, их строение было предположено на основании данных элементного анализа, ИК-спектроскопии и времяпролетной МАЛДИ масс-спектрометрии. В масс-спектре комплекса V, зарегистрированного в режиме положительных ионов (рис. 5а) наблюдаются сигналы от катионов [(SONF)2Er(Phen)]+ (1087 Да), получаемые при отрыве одного лиганда от молекулы соединения. Следует отметить, что изотопное распределение для зарегистрированного сигнала полностью соответствует теоретически рассчитанному, что позволяет идентифицировать сигналы.
Рис. 5.
Масс-спектр V, записанный в положительном (а) и отрицательном (б) режимах с использованием DCTB в качестве матрицы.
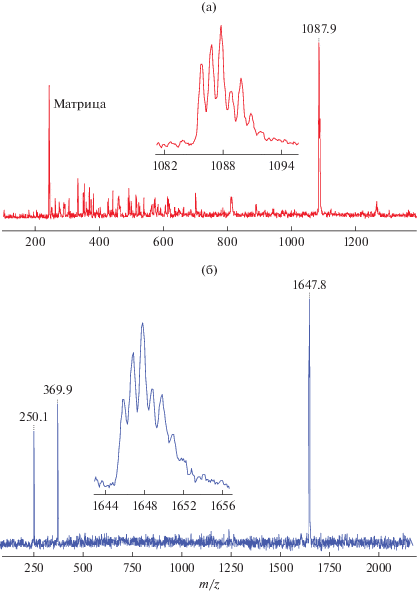
Масс-спектр, зарегистрированный в отрицательном режиме, содержит сигналы от матрицы, свободного заряженного SONF-лиганда и сигнал от анионов [(SONF)4Er]– (1630–1648 Да). Последние образуются при замене фенантролинового лиганда на анион SONF при лазерном воздействии на комплекс (рис. 5б). Образование подобных анионов характерно для комплексов редкоземельных элементов с бензотиазолилфенолятными лигандами [35, 36] и служит подтверждением предполагаемой структуры V.
Масс-спектры соединений самария III и IV, зарегистрированные в отрицательном и положительном режимах имеют схожую структуру и содержат сигналы от аналогичных ионов с изотопным распределением, отвечающим теоретически рассчитанному. Примечательно, что в масс-спектрах нет сигналов от ионов, содержащих два и более атомов металла, что подтверждает одноядерную структуру комплексов.
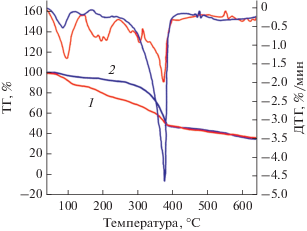
Термографический (ТГ) анализ комплексов эрбия показал, что введение молекулы Phen, как и в других фторированных комплексах лантаноидов, существенно повышает термостабильность соединения (рис. 6).
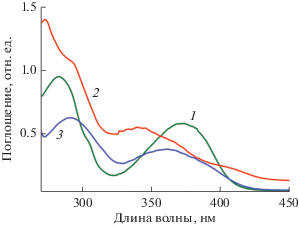
В спектрах поглощения растворов комплексов III и IV в THF при комнатной температуре (рис. 7) наблюдаются полосы при 273–290 нм, обусловленные π–π*-переходами (В-полоса), а также полосы в области 343–373 нм, обусловленные n–π*-переходами. Максимумы поглощения в комплексах III и IV смещены по сравнению с комплексом Sm(SONF)3 за счет межлигандного взаимодействия SONF-лигандов с Phen- и Bipy-лигандами, а также за счет изменения координационной сферы атома самария.
Рис. 7.
Спектры поглощения комплексов: Sm(SONF)3Bipy (1), (Sm(SONF)3Phen (2), Sm(SONF)3 (3) в растворе THF при комнатной температуре (10–5 моль/л).
Все полученные соединения при возбуждении УФ-светом обнаруживают фотолюминесценцию (ФЛ) лигандов в виде уширенной полосы c максимумом в области 480 нм (рис. 8а). Относительный квантовый выход близок к 100%. Спектр ФЛ в видимой области комплекса самария III, содержащего нейтральный Phen-лиганд, в отличие от комплекса IV с Bipy-лигандом, наряду с полосами лигандов содержит полосы металл-центрированной эмиссии, соответствующие переходам 4G5/2 → 6H5/2, 4G5/2 → 6H7/2, 4G5/2 → 6H9/2 в ионах Sm3+ (рис. 8а).
Рис. 8.
Спектр ФЛ комплексов III (1) и IV (2) в растворе THF при λвозб = 380 нм (а), спектр ЭЛ комплекса III (б).
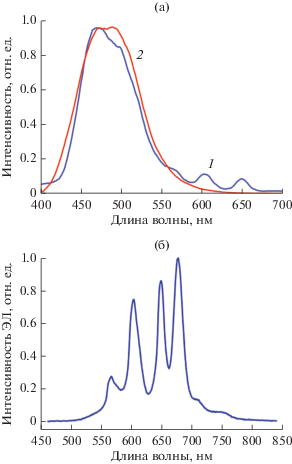
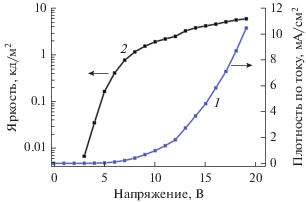
Достаточно высокая термостабильность комплексов с нейтральными Phen- и Вipy-лигандами позволила использовать их для приготовления OLED-устройств методом вакуумного напыления. ЭЛ-свойства полученных комплексов изучены на трехслойных модельных светодиодах состава ITO/TPD (25 нм)/комплекс (45 нм)/BATH (15 нм)/Yb. Рабочие характеристики диодов приведены в табл. 3. Вопреки ожиданиям, комплекс эрбия V не показал электролюминесценции. Спектр ЭЛ комплекса самария III содержит полосы эмиссии, характерные для иона Sm3+ (рис. 8б).
Таблица 3.
Рабочие характеристики органических светоизлучающих диодов
| Комплекс | Напряжение включения, В* | Максимальная яркость (при напряжении), кд/м2 | Эффективность по току, кд/А | Эффективность по мощности, лм/Вт |
|---|---|---|---|---|
| [Sm(SON)3]2** | 4.8 | 120(19) | 0.12 | 0.02 |
| Sm(SONF)3(Phen)(DME) | 5.8 | 17(19) | 0.17 | 0.003 |
* При яркости 1 кд/м2. ** Характеристики для комплекса [Sm(SON)3]2 приведены из [37].
Вольт-амперные характеристики (рис. 9) показывают, что комплекс III обладает более низкими зарядотранспортными свойствами, чем нефторированный аналог [37]. Как видно из данных табл. 3, OLED на основе комплекса III демонстрируют меньшую яркость и эффективность по мощности, тогда как эффективность по току несколько выше, чем для OLED на основе [Sm(SON)3]2. Такое поведение может обуславливаться изменением энергии фронтальных орбиталей ВЗМО и НСМО, приводящим к увеличению оптической щели комплекса, что было подтверждено проведенными ранее квантово-химическими расчетами [22]. Наиболее вероятно, что возросшее сопротивление препятствует увеличению яркости и эффективности электролюминесценции комплексов лантаноидов с перфотрированными лигандами, несмотря на то что фотолюминесцентные свойства этих соединений имеют лучшие характеристики.
Таким образом, cинтезированы гомо- и гетеролигандные комплексы Sm, Er и Yb, содержащие лиганды H(SONF), H(NpSON), Phen и Вipy и изучены их люминесцентные свойства. Комплекс иттербия обнаружил металл-центрированную эмиссию в ближнем ИК-диапазоне, обусловленную f–f-переходами, характерными для ионов Yb3+, что делает возможным его применение в биоимиджинге. Комплексы Sm обладают ФЛ в видимом диапазоне. Введение в состав этих соединений N-донорных лигандов привело к повышению их термостабильности, что позволило изготовить модельное OLED-устройство на основе комплекса самария, демонстрирующее металл-центрированную эмиссию средней интенсивности.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
New E.J., Parker D., Smith D.G., Walton J.W. // Curr. Opin. Chem. Biol. 2010. V. 14. P. 238.
Егорова А.В., Скрипинец Ю.В., Александрова Д.И., Антонович В.П. // Методы и объекты хим. анализа. 2010. Т. 5. С. 180.
Hovinen J., Guy P.M. // Biocojugate Chem. 2009. V. 20. P. 404.
Hagan A.K., Zuchner T. // Anal. Bioanal. Chem. 2011. V. 400. P. 2847.
Binnemans K. // Chem. Rev. 2009. V. 109. P. 4283.
Eliseeva S.V., Bünzli J.-C. // Chem. Soc. Rev. 2010. V. 39. P. 189.
Бочкарев М.Н., Витухновский А.Г., Каткова М.А. Органические светоизлучающие диоды (OLED). Нижний Новгород: ДЕКОМ, 2011. 364 с.
Blasse G., Grabmaier B.C. Luminescent Materials. Berlin (Germany): Springer, 1994.
Sun R.G., Wang Y.Z., Zheng Q.B. et al. // J. Appl. Phys. 2000. V. 87. P. 7589.
Kuriki K., Koike Y., Okamoto Y. // Chem. Rev. 2002. V. 102. P. 2347.
Hasegawa Y., Ohkubo T., Sogabe K. et al. // Angew. Chem. Int. Ed. 2000. V. 39. P. 357.
Zhang J., Badger P.D., Geib S.J., Petoud S. // Angew. Chem. Int. Ed. 2005. V. 44. P. 2508.
Zheng Y.X., Lin J., Liang Y.J. et al. // J. Mater. Chem. 2001. V. 11. P. 2615.
Hasegawa Y., Kimura Y., Murakoshi K. et al. // J. Phys. Chem. 1996. V. 100. P. 10201.
Tsaryuk V., Turowska-Tyrk I., Legendziewicz J. et al. // J. Alloys Compd. 2002. V. 341. P. 323.
Bünzli J.-C.G., Piguet C. // Chem. Soc. Rev. 2005. V. 34. P. 1048.
Zhong G., Kim K., Jin J.-I. // Synth. Met. 2002. V. 129. P. 193.
Armaroli N., De Cola L., Balzani V. et al. // Faraday Trans. 1992. P. 553.
Bradley D.C., Ghotra J.S., Hart F.A. // Dalton Trans. 1973. V. 10. P. 1021.
Burin M.E., Kuzyaev D.M., Lopatin M.A. et al. // Synth. Met. 2013. V. 164. P. 55.
Li Z., Dellali A., Malik J. et al. // Inorg. Chem. 2013. V. 52. P. 1379.
Balashova T.V., Burin M.E., Ilichev V.A. et al. // Molecules. 2019. V. 24. P. 2376.
Балашова Т.В., Баранов Е.В., Фукин Г.К. и др. // Коорд. химия. 2019. Т. 45. № 10. С. 617 (Balashova T.V., Baranov E.V., Fukin G.K. et al. // Russ. J. Coord. Chem. 2019 V. 45. P. 712). https://doi.org/10.1134/S107032841909001X
SAINT. Version 8.38A. Data Reduction and Correction Program. Madison (WI, USA): Bruker AXS Inc., 2012.
Krause L., Herbst-Irmer R., Sheldrick G. M., Stalke D. // J. Appl. Cryst. 2015. V. 48. P. 3.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Shannon R.D. // Acta Crystallogr. A. 1976. V. 32. P. 751.
Batsanov S.S. // Inorganic Materials. 2001. V. 37. P. 871.
Aspinall H.C., Bacsa J., Beckingham O.D. et al. // Dalton Trans. 2014. V. 43. P. 1434.
Balashova T.V., Pushkarev A.P., Rumyantcev R.V. et al. // J. Organomet. Chem. 2015. V. 777. P. 42.
Balashova T.V., Ilichev V.A., Grishin I.D. et al. // Inorg. Chim. Acta. 2018. V. 483. P. 379.
Janiak C. // Dalton Trans. 2000. № 21. P. 3885.
Pushkarev A.P., Ilichev V.A., Maleev A.A. et al. // J. Mater. Chem. C. 2014. V. 2. № 8. P. 1532.
Balashova T.V., Ilichev V.A., Grishin I.D. et al. // Inorg. Chim. Acta. 2018. V. 483. P. 379.
Балашова Т.В., Пушкарев А.П., Ильичев В.А. и др. // Изв. АН. Сер. хим. 2016. Т. 65. № 7. С. 1739 (Balashova T.V., Pushkarev A.P., Il’ichev V.A. et al. // Russ. Chem. Bull. 2016. V. 65. № 7. P. 1739).
Balashova T.V, Pushkarev A.P., Il’ichev V.A. et al. // Polyhedron. 2013. V. 50. P. 112.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия