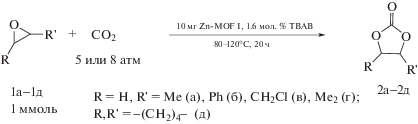Координационная химия, 2020, T. 46, № 8, стр. 477-484
Линейные координационные полимеры на основе бис(1-бензотриазолил)метана и нитратов цинка и меди
Ю. А. Белоусов 1, 2, *, В. Е. Гончаренко 1, Г. Н. Бондаренко 1, О. Г. Ганина 1, С. И. Беззубов 3, И. В. Тайдаков 2
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Физический институт им. П.Н. Лебедева РАН
Москва, Россия
3 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: belousov@inorg.chem.msu.ru
Поступила в редакцию 24.12.2019
После доработки 25.02.2020
Принята к публикации 02.03.2020
Аннотация
Взаимодействием растворов нитратов цинка и меди(II) с лигандом бис-1,1'-1,2,3-бензотриазолилметаном (Bbtm) в ацетонитриле получены комплексные соединения {[(Zn(Bbtm)(H2O)4](NO3)2}n (I) и [Cu(Вbtm)(NO3)2]n (II), кристаллические структуры которых установлены методом РСА (CIF files ССDС № 1963126 (I), 1963127 (II)). Комплекс I представляет линейный кординационный полимер (1D МОКП), в котором октаэдрическая координация центрального атома обеспечена четырьмя молекулами воды и двумя атомами азота двух молекул Bbtm, находящихся в транс-положении. В структуре II координационная сфера меди включает два атома азота лигандов Вbtm и четыре кислорода от двух нитрат-анионов, один из которых, так же как и лиганд Вbtm, мостиковый. Это позволяет описать структуру II, как 3D-МОКП. Для ранее не описанного соединения I зарегистрированы спектры люминесценции, максимум эмиссии наблюдается при 363 нм. Соединение I также протестировано в качестве катализатора реакции циклоприсоединения СО2 к эпоксидам. Показано, что полученный МОКП эффективно катализирует эти реакции как для монозамещенных, так и для дизамещенных эпоксидов.
Металл-органические каркасные координационные полимеры (МОКП) применяются в хранении и разделении газов и жидкостей, в сенсорике и в катализе [1, 2]. Катионы цинка и меди входят в состав большого количества МОКП, причем такие материалы часто используют в качестве катализаторов [3, 4]. Обладая средней жесткостью по Пирсону, катионы двухзарядных цинка и меди могут координироваться как кислород-, так и азот-донорными лигандами.
В настоящее время описаны различные комплексы цинка с 1,2,3-бензотриазолом [5–8]. Эти соединения представляют собой координационные полимеры различной размерности, а каждое бензотриазольное кольцо по атомам N1 и N3 координирует атом цинка. Комплексы лигандов на основе 1,2,3-бензотриазола с цинком и кадмием способны к лиганд-центрированной флуоресценции [5, 6, 8, 9], причем возбуждение обычно происходит в области 250–290 нм, а эмиссия имеет место при 350–400 нм.
Лиганд бис(1H-бензо[1,2,3]триазол-1-ил)-метан был впервые получен в [10] по реакции 1,2,3-бензотриазола с формальдегидом в присутствии диметиламина в ледяной уксусной кислоте. Более удобный метод синтеза – взаимодействие 1,2,3-бензотриазола с дихлорметаном [11]. К настоящему времени описан ряд комплексов Вbtm, например производные меди [Cu(Вbtm)(NO3)2]n, [Cu(Вbtm) (H2O)(NO3)2]n, [Cu3(Вbtm)4(H2O)8]A6, A = ${\text{BF}}_{{\text{4}}}^{--},$ ${\text{ClO}}_{{\text{4}}}^{--}$ [12], [Cu(Вbtm)Cl2]n [13], [Cu2-(Вbtm)2Br4]n [14], кадмия [Cd2(Вbtm)(H2O)-(C2H5OH)Cl4]n ⋅ 1.5nH2O [9] и некоторых платиновых металлов [13]. В этих соединениях существенно различаются координационные полиэдры и размерность образуемых полимеров. Комплексы цинка c Вbtm к настоящему моменту не описаны.
МОКП на основе переходных металлов широко используются в реакции циклоприсоединения диоксида углерода к эпоксидам [15–17]. Одними из наиболее эффективных в данной реакции являются МОКП на основе цинка [18–26], позволяющие селективно получать циклические карбонаты с высокими выходами [18, 23–26], а также проводить реакцию в мягких условиях [18, 23–25] или c малым количеством катализатора [19]. В присутствии гетеробиметаллического золото-цинкового МОКП удается в мягких условиях карбоксилировать дизамещенные субстраты [27]. Следует отметить, что в большинстве случаев в данных Zn-МОКП в качестве металлоцентра выступал многоядерный кластер.
Цель настоящей работы – изучение координационных возможностей лиганда Вbtm при образовании комплексов цинк- и меди (II) с катионами средней жесткости по Пирсону – {[(Zn(Bbtm)- (H2O)4](NO3)2}n (I) и [Cu(Вbtm)(NO3)2]n (II). Кроме того, в работе изучены люминесцентные свойства комплексов цинка и его каталитическая активность в реакции карбоксилирования моно- и дизамещенных эпоксидов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованные в работе коммерчески доступные реагенты и растворители: нитраты цинка и меди(II) (“х. ч.”, Реахим). Лиганд Вbtm получали по известной методике [11] и охарактеризовали спектроскопией ЯМР 1Н.
ИК-спектры регистрировали на спектрометре FTIR Spectrum One Perkin-Elmer в таблетках KBr в области 400–4000 см–1 с разрешением 0.5 см–1.
Спектры флуоресценции порошкообразных образцов измеряли с помощью спектрофлуориметра Varian Cary Eclipse. Все спектры люминесценции и возбуждения измеряли с поправкой на инструментальные функции. Измерения проводили в кварцевых кюветах диаметром 5 мм при комнатной температуре.
Термический анализ проводили на приборе NETZSCHSTA 409 PC/PG в атмосфере воздуха при скорости нагрева 10°C/мин.
Элементный анализ выполняли с использованием микроанализатора Fision Instruments 1108.
Синтез комплекса I. Раствор 0.1487 г (0.5 ммоль) гексагидрата нитрата цинка в 5 мл воды помещали в пробирку, после чего, не допуская перемешивания слоев, приливали 1 мл смеси вода–ацетонитрил (1 : 1) и затем слой раствора 0.1251 г (0.5 ммоль) Вbtm в 2 мл ацетонитрила. Пробирку герметично закрывали и через 1 нед. выделившиеся белые кристаллы I отфильтровывали и высушивали в эксикаторе над CaCl2.
ИК-спектр (KBr; ν, см–1): 3650–3100 с, 3098 сл, 3020 сл, 2968 о.сл., 1972 оч. сл., 1937 о.сл., 1845 о.сл., 1811 о.сл., 1655 с, 1615 сл., 1592 сл., 1494 о.сл., 1457 сл., 1387 о.с., 1333 о.сл., 1292 сл, 1212 ср., 1165 сл., 1003 сл., 987 о.сл., 934 сл., 830 сл., 778 сл., 755 ср., 433 сл.
Синтез II выполняли по методике, аналогичной для I, с использованием Cu(NO3)2 ∙ 3H2O.
ИК-спектр (KBr; ν, см–1): 3022 о.сл., 2965 сл., 1972 ср., 1932 сл., 1841 о. сл., 1615 ср, 1490 с, 1377 о. с., 1334 ср, 1212 ср, 1168 сл, 1111 ср, 1000 сл, 987 о. сл, 933 о.сл., 831 сл, 877 сл, 778 сл., 751 ср.
РСА. Монокристаллы I и II были получены медленным испарением ацетонитрильных растворов. Сбор экспериментальных данных проведен на автоматическом четырехкружном дифрактометре Xcalibur Sapphire 3 при температуре 120 K (MoKα-излучениe, λ = 0.71073 Å, графитовый монохроматор) в режиме κ-сканирования. Учет поглощения введен по измерениям интенсивностей эквивалентных отражений [28]. Структуры расшифрованы прямым методом и уточнены полноматричным анизотропным МНК по F 2 для всех неводородных атомов [29]. Атомы водорода помещены в рассчитанные позиции и уточнены с использованием модели “наездника”. Кристаллографические данные, детали эксперимента и уточнения структур приведены в табл. 1.
Таблица 1.
Кристаллографические параметры и детали уточнения структур условия съемки I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Сингония | Моноклинная | Орторомбическая |
| Пр. гр | C2/c | Pna21 |
| а, Å | 18.7162(8) | 9.1109(6) |
| b, Å | 9.9145(3) | 15.1737(10) |
| c, Å | 13.9023(6) | 11.2731(7) |
| β, град | 114.6680(10) | 90 |
| V, Å3 | 2107.86(15) | 1558.46 |
| ρ(выч.), г/см3 | 0.971 | 1.124 |
| Z | 4 | 2 |
| Область сканирования по θ, град | 2.395–31.387 | 2.251–28.699 |
| Диапазон индексов | –15 ≤ h ≤ 26, –12 ≤ k ≤ 11, –20 ≤ l ≤ 17 |
–11 ≤ h ≤ 12, –20 ≤ k ≤ 20, –15 ≤ l ≤ 15 |
| Число измеренных/независимых рефлексов (Rint) | 6839/3320 (0.0231) | 22 563/4029 (0.0693) |
| Рефлексов с I > 2σ(I) | 2711 | 3118 |
| Число уточняемых параметров | 144 | 254 |
| GOOF по F 2 | 1.040 | 1.013 |
| R1 и wR2, I > 2σ(I) | R1 = 0.0568, wR2 = 0.1445 | R1 = 0.0363, wR2 = 0.0680 |
| Δρmax, Δρmin, e Å–3 | 1.988, –0.666 | 0.384, –0.643 |
Полные таблицы координат атомов, длин связей и валентных углов структур I и II депонированы в Кембриджском банке структурных данных: (ССDС № 1963126 и 1963127 соответственно; http://www.ccdc.cam.ac.uk).
Исследование каталитической активности. В стеклянный реактор низкого давления RLP15ML (15 мл), снабженный системой подачи газа, манометром и магнитной мешалкой помещали эпоксид 1 (1 ммоль), бромид тетрабутиламмония (0.016 ммоль) и 10 мг катализатора. Реакцию проводили без добавления растворителя в смеси субстратов. Реактор трехкратно заполняли CO2, затем давление газа устанавливали 5 атм (в случае 1а–1в) или 8 атм (в случае 1г, 1д). Реакционную смесь перемешивали при 80°C (в случае 1а–1г) или при 120°C (в случае 1д) в течение 20 ч. После этого реакционную смесь охлаждали до комнатной температуры, отфильтровывали катализатор и анализировали с помощью спектроскопии ЯМР. Продукт 2 очищали при помощи колоночной хроматографии на силикагеле (элюент – петролейный эфир). Выделенный продукт высушивали под вакуумом.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез комплексов в одинаковых мягких условиях приводит к образованию принципиально разных структур: линейного полимерного гидрата {[Zn(Вbtm)(H2O)4](NO3)2}n (I) и безводного двумерного полимера {[Cu(Bbtm)(NO3)2]n} (II). В I центральный атом находится в высокосимметричном октаэдрическом окружении, в то время как в II – симметрия окружения существенно искажена, что вызвано характерным для Cu2+ эффектом Яна–Теллера. Кристаллическая структура II ранее описана [12], поэтому мы сосредоточили свое внимание на комплексе цинка.
В ИК-спектрах обоих соединений присутствуют две полосы, соответствующие колебаниям нитрат-иона: 1377–1387 и 830–831 см–1. Также присутствуют полосы, характерные для колебаний связи N–CH2 лиганда 1,1'-Вbtm: 1610, 1490 и 950 см–1.
По данным ДТА (рис. 1), разложение комплекса I протекает в четыре стадии. Сначала при 80–180°С из комплекса эндотермически удаляются четыре молекулы воды ближней координационной сферы цинка. При нагревании до 240°С происходит частичное окислительное разложение лиганда Вbtm с отщеплением СО2, N2 и Н2О (так, незамещенный бензотриазол самовоспламеняется при 210°С), а полное разложение до ZnO заканчивается выше 600°С.
Рис. 1.
Кривые потери массы (ТГ), ДТА (а), а также сигналы с масс-спектрометрического детектора продуктов термического разложения для комплекса I (б).
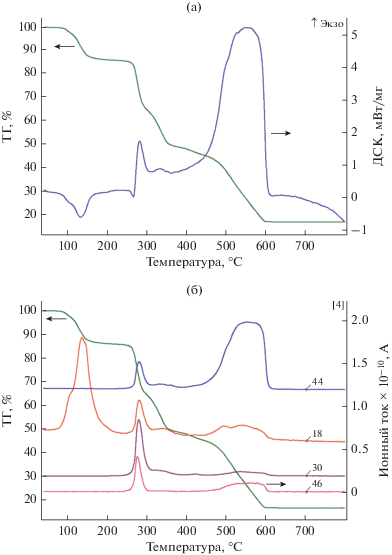
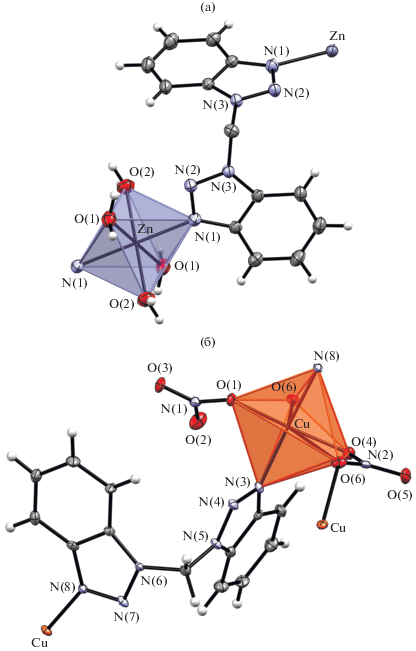
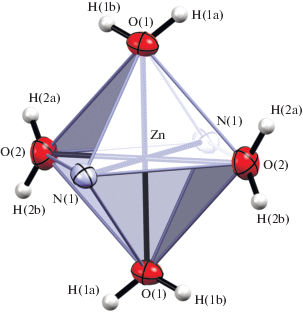
По данным РСА, структура I (рис. 2а) представляет собой зигзагообразный линейный полимер. Соседние полимерные цепи связаны нитрат-ионами, образуя таким образом плоский слой, состоящий из цепочек, находящихся на расстоянии 3.13–4.26 Å. Нитрат-ионы удерживают цепочки вместе путем образования водородных связей длиной от 2.810 до 2.977 Å с молекулами воды, входящими в координационное окружение атомов цинка. Атом цинка расположен в малоискаженном октаэдре (рис. 3), образованном двумя атомами азота лиганда (расстояния Zn–O 2.156 Å) и четырьмя кислородами молекул воды (расстояния Zn–O(H2O) попарно равны 2.088 и 2.103 Å). Углы NВbtmZnOH2O попарно равны 87.74° и 92.26°, что приводит к небольшому искажению координационного полиэдра. Связанные с атомом цинка молекулы лиганда расположены в транс-положении друг к другу, так что изгибы полимерной цепи вызваны только нелинейностью молекул лиганда. Угол ${\text{N}}{{{\text{C}}}_{{{\text{C}}{{{\text{H}}}_{{\text{2}}}}}}}{\text{N}}$ в лиганде (109.21 Å) меньше того же угла в некоординированном лиганде (111.87 Å).
Структура II (рис. 2б), как и в случае комплекса с цинком, представляет собой изогнутые цепи, связанные в плоский слой, однако здесь расстояние между соседними цепями больше – 4.20–5.18 Å. Также в комплексе меди соседние полимеры связаны нитрат-ионами, которые координируют атомами кислорода атомы меди, входящих в разные полимерные цепи. Атом меди расположен в полиэдре, образованном из двух атомов азота лиганда (длины 1.993 и 2.015 Å) и четырех атомов кислорода нитрат-ионов, причем один из ионов выступает в качестве хелатирующего, другой – в качестве мостикового. Координация нитрат-ионов к атомам меди соседних полимерных цепей приводит к удлинению связи до ~2.5 Å, что вызывает сильное искажение координационного полиэдра меди, промежуточного между октаэдром и тригональной призмой. В первом случае полиэдр может быть описан как октаэдр почти с квадратным основанием O(1), N(3), O(4), O(8) и двумя атомами кислорода О(6) в удаленных аксиальных позициях. Оба атома О(6) различных нитрат-групп смещены от центра октаэдра ближе к вершине О(4). В случае описания полиэдра как искаженной тригональной призмы можно выделить основания O(1)–N(6)–О(8) и N(3)–O(4)–O(6), сильно развернутые друг относительно друга.
Анализ структуры с помощью пакета Shape показывает, что пути минимального искажения для октаэдра и тригональной призмы составляют 5.403 и 12.071% соответственно. Длины связей Cu–O(NO3) составляют: 1.992 и 2.533 Å с кислородами O(4) и О(6) хелатирующего нитрат-иона, 2.501 Å с атомом О(6) и атомом меди соседнего фрагмента, 1.956 Å с кислородом О(1) нехелатирующего нитрат-аниона. Угол между кислородами одного нитрат-иона составляет 55.92°, углы N(1)NO3CuN(2)NO3, N(2)NO3CuN(3)NO3, N(3)NO3CuN(1)NO3 – 116.14°, 104.21°, 83.10° соответственно. Угол NC(CH2)N в лиганде Вbtm составляет 110.53°. Безусловно, причина столь серьезного искажения октаэдрической геометрии связана с проявлением характерного для гексакоординированных производных Cu2+ эффекта Яна–Телле-ра.
В одинаковых условиях нитраты цинка и меди по-разному реагируют с лигандом, образуя соединения различного строения. По-видимому, это связано со склонностью ионов меди(II) к образованию комплексов с искаженно-октаэдрическим окружением и сравнительно небольшой гибкостью лиганда на основе сопряженной бензотриазольной системы.
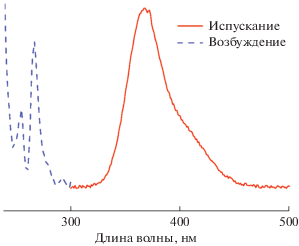
Комплекс цинка под действием УФ-излучения (254 нм) демонстрирует синюю флуоресценцию, для изучения которой были зарегистрированы спектры возбуждения и испускания (рис. 4). Максимум в спектре возбуждения составляет 265 нм, в спектре испускания – 365 нм с плечом при 395 нм. Положение и форма полос в целом соответствуют спектрам люминесценции комплексов цинка с 1,2,3-бензотриазолом [5, 6, 8].
Для изучения каталитической активности полученного МОКП был выбран ряд монозамещенных оксиранов 1а–1в, а также дизамещенные изобутиленоксид 1г и окись циклогексена 1д. Взаимодействие эпоксидов с CO2 представлена на схеме 1 .
Схема 1 .
Реакцию проводили в условиях, оптимизированных и использованных ранее для карбоксилирования эпоксидов в присутствии гетерогенного цинкового катализатора [30]: температура 60–80°C, ${{P}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}$ 5 атм и 1.6 мол. % бромида тетрабутил-аммония в качестве нуклеофильной добавки. Необходимость нуклеофильной добавки показана во многих работах по циклоприсоединению CO2 к эпоксидам [31], а в ряде случаев ее достаточно, чтобы реакция протекала и в отсутствие металлсодержащего катализатора [32]. Хотя в литературе есть несколько примеров успешного проведения синтеза без такого со-катализатора [20, 33], большинство каталитических систем на основе МОКП требуют его добавления [18, 19, 21, 22, 24–26]. Как видно из табл. 2, монозамещенные циклические карбонаты 1а–1д были получены с высокими выходами (87–91%). Для дизамещенных эпоксидов потребовалось повышение давления до 8 атм, однако выходы 1г и 1д остались умеренными. При этом 1,1-диметилоксиран 1г удалось прокарбоксилировать с выходом 59%, тогда как в случае окиси циклогексена 1д даже при повышении температуры до 120°C соответствующий карбонат 2д образовывался с выходом лишь 42%, что, однако, превосходит результативность иных МОКП на основе цинка, как в более мягких [22, 24, 25], так и сопоставимых [26] условиях.
Таблица 2.
Результаты исследования каталитической активности I
| Субстрат | Температура, °C | Выход, %* |
|---|---|---|
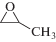 (1а) (1а)
|
80 | 91 |
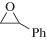 (1б) (1б)
|
80 | 89 |
 (1в) (1в)
|
80 | 87 |
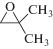 (1г) (1г)
|
80 | 59** |
 (1д) (1д)
|
120 | 42** |
Таким образом в одинаковых условиях нитраты меди и цинка с Bbtm образуют комплексы I и II, существенно отличающиеся по составу и структуре. Оба соединения – координационные полимеры, но в случае нитрата меди, помимо образования цепей за счет мостиковых молекул лиганда Вbtm, структура превращается в трехмерный полимер из-за мостиковых нитрат-ионов. В структуре I взаимодействие между соседними цепями происходит исключительно благодаря водородным связям внутрисферных молекул воды и нитрат-ионов. Соединение I проявляет лиганд-центрированную флуоресценцию в ближней УФ-области. Кроме того, этот линейный МОКП был протестирован в качестве катализатора реакции циклоприсоединения СО2 к эпоксидам и показал хорошую эффективность по сравнению с другими цинксодержащими МОКП.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Pettinari C., Marchetti F., Mosca N. et al. // Polym. Int. 2017. V. 66. P. 731.
Бутова В.В., Солдатов М.А., Гуда А.А. и др. //Успехи химии. 2016. Т. 85. С. 280.
Li Y., Zhang X., Xu P. et al. // Inorg. Chem. Frontiers. 2019. V. 6. P. 317.
Ahmadzadeh Z., Mokhtari J., Rouhani M.// RSC Advances. 2018. V. 8. P. 24203.
Hu R.F., Zhang J., Kang Y., Yao Y.G. // Inorg. Chem. Commun. 2005. V. 8. P. 828.
Yang E.C., Zhao H.K., Ding B. et al. // Cryst. Growth Des. 2015. V. 7. P. 2009.
Gkioni C., Psycharis V., Raptopoulou C.P. // Polyhedron. 2009. V. 28. P. 3425.
Shen Y.C., Li Z.J., Cheng J.K. et al. // Inorg. Chem. Commun. 2007. V. 10. P. 888.
Lider E.V., Piryaze D.A., Virovets A.V. et al. // J. Struct. Chem. 2010. V. 51. P. 514.
Burckhalter J.H., Stephen V.C., Hall L.A. // J. Am. Chem. Soc. 1952. V. 74. P. 3868.
Juliá S., del Mazo J.M., Avila L., Elguero J. // Org. Prep. Proc. Intern. 1984. V. 16. P. 299.
Peresypkina E.V., Lider E.V., Smolentsev A.I. et al. // Polyhedron. 2012. V. 48. P. 253.
Richardson C., Steel P.J. // Dalton Trans. 2003. P. 992.
Лидер Е.В., Потапов А.С., Пересыпкина Е.В. и др. // Журн. структур. химии. 2007. Т. 48. С. 543.
Jin X., Ding J., Xia Q. et al. // J. CO2 Utilization. 2019. V. 34. P. 115.
Trickett C.A., Helal A., Al-Maythalony B.A. et al. // Nature Rev. Mater. 2017. V. 2. P. 1704.
Beyzavi M.H., Stephenson C.J., Liu Y. et al. // Front. Energy Res. 2015. V. 2. P. 63.
Song J., Zhang Z., Hu S. et al // Green Chem. 2009. V. 11. P. 1031.
Kleist W., Jutz F., Maciejewski M., Baiker A. // Eur. J. Inorg. Chem. 2009. P. 3552.
Kim Y.-J., Park D.-W. // J. Nanosci. Nanotechnol. 2013. V. 13. P. 2307.
Han Q., Qi B., Ren W. et al. // Nature Communications. 2015. V. 6. P. 10007
Babu R., Roshan R., Kathalikkattil A.C. et al. // ACS Appl. Mater. Interfaces. 2016. V. 8. P. 33723.
Cao C.S., Shi Y., Xua H. et al. // Dalton Trans. 2018. V. 47. P. 4545.
Patel P., Parmar B., Kureshy R.I., Khan N. // ChemCatChem. 2018. V. 10. P. 2401.
Qiao W., Song T., Zhao B. // Chin. J. Chem. 2019. V. 37. P. 474.
Li Y., Zhang X., Xu P. et al. // Inorg. Chem. Front. 2019. V. 6. P. 317.
Tang L., Zhang S., Wu Q. et al. // J. Mater. Chem. A. 2018. V. 6. P. 2964.
Sheldrick G.M. SADABS. Program for Scaling and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 1997.
Sheldrick G.M. // Acta Crystallpgr. A. 2008. V. 64. P. 112.
Bondarenko G.N., Dvurechenskaya E.G., Ganina O.G. et al. // Appl. Catal. B. 2019. V. 254. P. 380.
Martín C., Fiorani G., Kleij A.W. // ACS Catal. 2015. V. 5. P. 1353.
Alves M., Grignard B., Mereau R. // Sci. Technol. 2017. V. 7. P. 2651.
Xu Y., Xie L., Xie J. et al. // Chem. Commun. 2019. V. 2. P. 42.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия