Координационная химия, 2020, T. 46, № 8, стр. 493-496
Неожиданное участие карбонатного аниона в сборке гексаядерного триметилацетатного комплекса кадмия(II)
Г. Н. Кузнецова 1, Д. С. Ямбулатов 1, М. А. Кискин 1, Н. В. Гоголева 1, *, М. А. Шмелев 1, А. А. Сидоров 1, И. Л. Еременко 1, 2
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: gogolevanv@inbox.ru
Поступила в редакцию 27.02.2020
После доработки 16.03.2020
Принята к публикации 22.03.2020
Аннотация
Взаимодействием триметилацетата кадмия(II), Cd(Рiv)2 · 2H2O, и 1,10-фенантролина (Рhen) при соотношении 2 : 1 в ацетонитриле на воздухе выделен новый необычный молекулярный комплекс [Cd6(CO3)(Рiv)10(Рhen)2] (I). Шесть атомов кадмия образуют тригонально-призматический металлоостов и связаны с находящимся внутри него карбонатным анионом. Структура комплекса I определена по данным РСА (CIF file CCDC № 1912223).
Строение гомометаллических комплексов кадмия(II) с анионами монокарбоновых кислот и хелатирующими лигандами, содержащими ароматические фрагменты: 2,2'-дипиридилом и 1,10-фенантролином (Phen), представлено достаточным количеством примеров. Так, получены моно-, би- и трехъядерные комплексы [2–7], в которых молекулы N-донорного лиганда концевые. Следует отметить большое сходство в строении подобных соединений кадмия(II) и комплексов Mn(II), Fe(II), Cо(II) и Zn(II), имеющих, как правило, меньшее координационное число (КЧ) (от 4 до 6 для 3d-металлов в сравнении с типичными КЧ 7–8 для кадмия).
В случае кобальта(II) ранее были получены несимметричные молекулярные биядерные пивалатные комплексы [Co2L(Рiv)4] (L = 2,2'-дипиридил, 2,2'-дипиридиламин) [8] с соотношением M : L = 2 : 1. Среди известных карбоксилатов кадмия(II) соединений подобного строения нет, хотя входящий в их состав структурный фрагмент из металлоцентров, связанных двумя мостиковыми и одним хелатно-мостиковым анионом карбоновой кислоты, присутствует в составе трехъядерных молекулярных комплексов линейного строения [7]. Соотношение Cd : Рhen при этом составляет 3 : 2. Аналогичные биядерные фрагменты наблюдали в координационных полимерах на основе анионов дикарбоновых кислот [9, 10], соотношение Cd : Phen в них также равно 3 : 2.
В настоящей работе мы сообщаем о необычном результате, зафиксированном при попытке синтеза пивалатного соединения кадмия(II) с 1,10-фенантролином (Cd(Рiv)2 : Рhen = 2 : 1) в растворе ацетонитрила на воздухе, – об образовании молекулярного гексаядерного комплекса [Cd6(CO3)(Рiv)10(Рhen)2] (I), в состав которого входит µ6-карбонат-анион.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом комплекса I, выполняли на воздухе с использованием ацетонитрила (“х. ч.”). Для синтеза I использовали коммерчески доступный моногидрат 1,10-фенантролина (99%, “Chempur”) и Cd(Рiv)2 · 2H2O, полученный по методике [11].
Синтез [Cd6(µ6-CO3-κ8O,O,O',O',O',O",O",O")- (µ-Рiv-κ3O,O,O')8(µ-Рiv-κ2O,O')2(Рhen)2] (I). К раствору Cd(Рiv)2 · 2H2O (0.2 г, 0.57 ммоль) в 15 мл ацетонитрила добавляли Рhen (0.051 г, 0.29 ммоль). Реакционную смесь перемешивали 5 мин при 20°С. Полученный бесцветный раствор оставляли медленно испаряться на воздухе при 20°C. Образовавшиеся через 14 сут бесцветные кристаллы, пригодные для РСА, отделяли от маточного раствора декантацией, промывали холодным ацетонитрилом (Т ≈ 5°C) и сушили на воздухе. Одновременно выделялся неизвестный мелкокристаллический продукт белого цвета, поэтому вычислить выход, выполнить элементный анализ и охарактеризовать дополнительными методами комплекс I не удалось.
РСА монокристаллов соединения I выполнен на дифрактометре Bruker Apex II (CCD-детектор, MoKα, λ = 0.71073 Å, графитовый монохроматор) [12]. Введена полуэмпирическая поправка на поглощение [13]. Структура I расшифрована прямыми методами и уточнена в полноматричном анизотропном приближении для всех неводородных атомов. Атомы водорода при атомах углерода органических лигандов генерированы геометрически и уточнены в модели “наездника”. Расчеты проведены по комплексу программ SHELX-2014/6 [14]. Кристаллографические параметры и детали уточнения структуры: C81H115Cd6N7O23, М = 2229.19 г/моль, размер кристалла 0.34 × 0.30 × 0.26 мм, бесцветный кристалл, T = 150(2) K, моноклинная сингония, пр. гр. P21/n, a = 16.9654(12), b = 30.488(2), c = 18.4769(11) Å, β = 95.829(2)°, V = 9507.5(11) Å3, Z = 4, ρ = = 1.557 г/см3, μ = 1.387 мм–1, θ = 1.84°–26.40°, ‒21 ≤ h ≤ 21, –37 ≤ k ≤ 38, –22 ≤ l ≤ 23, всего 87838 отражений, независимых 19 450, отражений с I ≥ 2σ(I) – 16929, Rint = 0.0296, Tmin/Tmax = = 0.672/0.725, S = 1.027, R1 = 0.0340, wR2 = 0.0643 (для всех данных), R1 = 0.0263, wR2 = 0.0600 (для I ≥ 2σ(I)), Δρmin/Δρmax = –0.606/1.171, е Å–3.
Полный набор рентгеноструктурных параметров для I депонирован в Кембриджском банке структурных данных (CIF file CCDC № 1912223; deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac. uk/data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
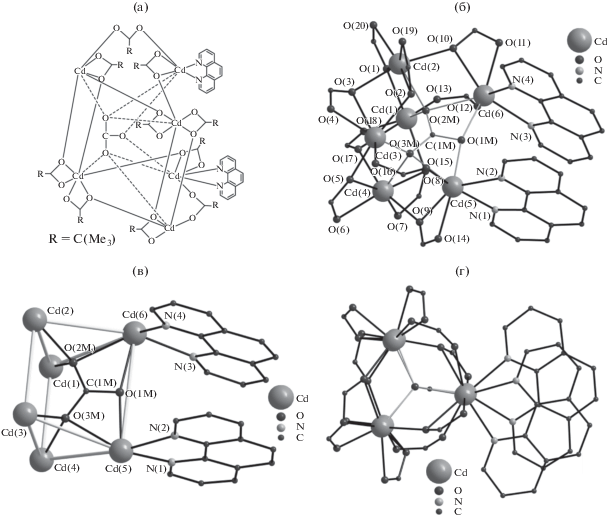
Взаимодействие Cd(Рiv)2 · 2H2O с недостатком Рhen в MeCN (Cd : Рhen = 2 : 1) и последующая многократная перекристаллизация с медленным испарением реакционного раствора при комнатной температуре на воздухе привела к выделению нескольких бесцветных призматических кристаллов. Был получен ранее неизвестный молекулярный гексаядерный комплекс I (рис. 1) с соотношением Cd : Рhen = 3 : 1. Атомы металлов расположены в вершинах искаженной тригональной призмы (двугранный угол между плоскостями треугольных граней составляет 16.24(2)°, расстояния Cd…Cd в треугольных фрагментах лежат в диапазоне 3.736(2)–3.908(2) Å, расстояния Cd…Cd между треугольными фрагментами – 3.700(2)–4.687(2) Å), в полости которой расположен карбонатный анион, координированный шестью атомами металла (рис. 1б). Дианион ${\text{СО}}_{{\text{3}}}^{{{\text{2}}--}}$ лежит в плоскости, практически перпендикулярной четырехугольной грани металлоостова Cd6, образованной ионами Cd(1), Cd(2), Cd(3) и Cd(4) (двугранный угол составляет 88.61(7)°). Атом кислорода О(1М) связывает металлоцентры Cd(5) и Cd(6) (Cd(5)–О 2.342(2), Cd(6)–О 2.383(2) Å). Два оставшихся атома кислорода ${\text{CO}}_{{\text{3}}}^{{{\text{2}}--}}$ связывают по три атома кадмия каждой из треугольных граней металлоостова (Cd(1)–O(2M) 2.270(2), Cd(2)–O(2M) 2.393(2), Cd(6)–O(2M) 2.487(2), Cd(3)–O(3M) 2.256(2), Cd(4)–O(3M) 2.361(2), Cd(5)–O(3M) 2.536(2) Å). Металлоцентры треугольных граней металлоостова попарно связаны одним мостиковым (Cd–O 2.215(2)–2.255(2) Å) и двумя хелатно-мостиковыми пивалат-анионами, замыкающими хелатные циклы на атомах Cd(2), Cd(4), Cd(5) и Cd(6) (Cd–O 2.307(2)–2.526(2) Å). Атомы кадмия Cd(1), Cd(2), Cd(3) и Cd(4) достраивают свое окружение до октаэдра (Cd(1)O6), пентагональной бипирамиды (Cd(2)O7, Cd(4)O7) и одношапочной треугольной призмы (Cd(3)O7) координацией хелатирующего пивалат-аниона, каждый из которых, проявляя µ-мостиковую функцию, попарно связывает атомы кадмия, принадлежащие разным треугольным фрагментам металлоостова (Cd–O 2.242(2)–2.544(2) Å). Атомы Cd(5) и Cd(6) дополнительно координируют по два атома N хелатных молекул Рhen, достраивая свое окружение (CdO5N2) до одношапочного октаэдра (Cd–N 2.325(2)–2.368(2) Å). Ароматические кольца молекул Рhen расположены друг над другом в плоскостях, близких к параллельным (двугранный угол 11.35(4)°), что приводит к реализации π-стекинг-взаимодействий (кратчайшее расстояние между атомами углерода ароматических колец 3.316(3) Å).
Рис. 1.
Схематичное изображение (а) и строение (б, в, г) молекулы комплекса I. Светло-серым выделены ребра металлоостова I (в), пунктиром – связи CO3 с металлоцентрами (а); трет-бутильные заместители (б, г) и анионы Piv (в) не показаны для наглядности.
Известно, что декарбоксилирование карбоновых кислот требует создания специальных условий (высокая температура [15], облучение [16], присутствие катализатора [17]). Проведение реакции, аналогичной для I, в атмосфере аргона позволило закристаллизовать ранее описанный биядерный комплекс [Cd2(Рiv)4(Рhen)2] (II) [1], идентифицированный по данным РФА и РСА. Соединение II содержит атомы Cd и молекулы Рhen в соотношении 1 : 1 вопреки вводимому в реакцию мольному соотношению 2 : 1. Пример формирования полиядерного металлоостова карбоксилатного комплекса с участием карбонатного аниона может быть перспективным для синтеза многоядерных карбоксилатных комплексов кадмия. Однако необходимо создание условий, препятствующих формированию нерастворимых неорганических карбонатов. Вероятно, в случае комплекса I такими условиями могут быть наличие органических лигандов с гидрофобными заместителями и низкая концентрация карбонатного аниона, присутствовавшего в растворе. Проведение реакции в атмосфере чистого углекислого газа не привело к получению каких-либо карбонатных комплексов. При соотношении Cd : Рhen = 3 : 1 и 2 : 1 удалось выделить только кристаллы упомянутого биядерного комплекса II [1]. Вероятно, источником карбонатных анионов может служить использованный для синтеза исходного Cd(Рiv)2 · 2H2O гидроксид калия, практически всегда содержащий примесь карбоната. Таким образом, получение шестиядерного комплекса I требует, очевидно, нахождения способа введения в реакционный раствор необходимого количества карбонатных анионов. Попытки синтеза комплекса I из свежеосажденного карбоната кадмия за счет его растворения в присутствии триметилуксусной кислоты и Рhen (в мольных соотношениях Cd : Рhen = 3 : 1, 2 : 1, 1 : 1) позволили получить только известный шестиядерный пивалат кадмия [Cd6(MeCN)2(Рiv)12] [18] и [Cd2(Рiv)4(Рhen)2] (II) [1].
Отметим, что в настоящее время известные полиядерные соединения, в которых бы карбонатный анион связывал шесть и более атомов металла немногочисленны. Преимущественно это островные молекулярные или ионные комплексы высокой ядерности, например {Cu20[µ9-CO3][µ3-HO]24[µ2-OOCMe-k2O,O']6[H2NC3H7]10[H2O]6(OOCMe)8} ∙ · 8H2O [19], {Zn8Cu12[µ10-CO3][µ3-HO]24[µ2-OOCMe-k2O,O']12[H2O]12}(OOCMe)2 ∙ HOOCMe [19], {Cd10[µ6-CO3][µ5-ClO4]2[µ3-C10H8N3O-k2N,N',k3O]6-[µ3-C10H7N3O-k2N,N',k3O]4} ∙ {Cd10[µ8-CO3][µ5-ClO4]- [µ4-ClO4-k4O,O',O''][µ3-C10H8N3O-k2N,N',k3O]6[µ3- C10H7N3O-k2N,N',k3O]4}(ClO4)4 ∙ хСН3ОН ∙ 11H2O (C10H8N3O = анион 2-((имидазол-2-ил)метилен-амино)фенола) [20]. Известны также координационные полимеры, построенные за счет связывания многоядерных каркасных металлофрагментов [21]. При этом отличительной чертой полученных молекулярных соединений является то, что полиядерный комплекс содержит только один карбонатный анион, образующий от 6 до 9 связей с атомами металла.
Следует отметить, что для карбоксилатов кадмия типично образование полиядерных соединений, в которых атомы металла связаны хелатно-мостиковыми карбоксилатными анионами. Так, мы получили шестиядерный молекулярный [Cd6(MeCN)2-(Рiv)12] и катионный [Cd6Cl(Рiv)12]+ комплексы [18], в первом кроме двух µ4-пивалат-анионов остальные десять хелатно-мостиковые, тогда как в катионном высокосимметричном комплексе металлоостов центрирован µ6-хлоридным анионом, все 12 карбоксилатных анионов хелатно-мостиковые. В шестиядерном комплексе I также все карбоксилатные анионы хелатно-мостиковые. Однако, в отличие от I, комплексы [Cd6(MeCN)2(Рiv)12] и катионный [Cd6Cl(Рiv)12]+ неустойчивы не только в присутствии хелатирующих лигандов, но и легко разрушаются монодентатными производными пиридина. Выделение соединения I показывает, что нахождение условий формирования подобных соединений открывает новые возможности для получения устойчивых полиядерных карбоксилатных комплексов переходных металлов за счет присутствия дополнительных лигандов, стабилизирующих каркас металлоостова (например, карбонат, фосфат, сульфат) и образующих с кадмием в неводных средах нерастворимые продукты. Однако факт получения кристалла соединения [Cd6(Рhen)2(µ6-CO3)(Рiv)10] свидетельствует в пользу возможности синтеза подобных соединений.
Список литературы
Гоголева Н.В., Шмелев М.А., Евстигнеев И.С. и др. // Изв. АН. Сер. хим. 2016. С. 181 (Gogoleva N.V., Shmelev M.A., Evstigneev I.S. et al. // Russ. Chem. Bull. 2016. V. 65. P. 181).
Yang Y.-Q., Tang Si-P., Zeng R.-Y. // Jiegou Huaxue (Chin.) (Chin. J. Struct. Chem.). 2014. V. 33. P. 1849.
Kruszynski R., Malinowska A., Czakis-Sulikowska D. et al. // J. Coord. Chem. 2009. V. 62. P. 911.
Wu W.P., Wang J., Lu L. et al. // Russ. J. Coord. Chem. 2016. V. 42. P. 71.
Cui F., Zhang S. // Acta Crystallogr. E. 2011. V. 67. P. m1247.
Yang Ying-Qun, Li Chang-Hong, Li Wei et al. // Wuji Huaxue Xuebao (Chin.) (Chin. J. Inorg. Chem.). 2009. V. 25. P. 1120.
Wang X.L., Zhang J.X., Liu G.C. et al. // Коорд. химия. 2010. Т. 36. № 9. С. 668 (Wang X.L., Zhang J.X., Liu G.C. et al. // Russ. J. Coord. Chem. 2010. V. 36. P. 662). https://doi.org/10.1134/S1070328410090058
Fomina I.G., Sidorov A.A., Aleksandrov G.G. et al. // Russ. Chem. Bull. 2004. V. 53. P. 118.
Yang Y., Zeng M.-H., Zhang S.-H. et al. // Struct. Chem. 2008. V. 19. P. 771.
Ye B.-H., Ding B.-B., Weng Y.-Q. et al. // Cryst. Growth Des. 2005. V. 5. P. 801.
Гоголева Н.В., Шмелев М.А., Кискин М.А. и др. // Изв. АН. Сер. хим. 2016. № 5. С. 1198. (Gogoleva N., Shmelev M., Kiskin M. et al. // Russ. Chem. Bull. 2016. V. 65. P. 1198).
SMART (control) and SAINT (integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
Krause L., Herbst-Irmer R., Sheldrick G.M. et al. // J. Appl. Cryst. 2015. V. 48. P. 3.
Sheldrick G.M. // Acta Crystfllpgr. A. 2008. V. 64. P. 112.
Нейланд О.Я. Органическая химия. М.: Высш. школа, 1990. 547 с.
Goudsmit G.-H., Jent F., Paul H. // Z. Phys. Chem. (Muenchen, Germany). 1993. V. 180. P. 51.
Lai C., Kim Y.I., Wang Ch.M. et al. // J. Org. Chem. 1993. V. 58. P. 1393.
Гоголева Н.В., Сидоров А.А., Нелюбина Ю.В. и др. // Коорд. химия. 2018. Т. 44. С. 219 (Gogoleva N.V., Sidorov A.A., Nelyubina Yu.V. et al. // Russ. J. Coord. Chem. 2018. V. 44. P. 473). https://doi.org/10.1134/S107032841808002X
Chen J., Zhou H., Xu F. // Inorg. Chem. 2016. V. 55. P. 4695.
Garcia-Deibe A.M., Portela-Garcia C., Fondo M. et al. // Chem. Commun. 2012. V. 48. P. 9915.
Liu F.-L., Kozlevcar B., Strauch P. et al. // Chem. Eur. J. 2015. V. 21. P. 18847.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


