Координационная химия, 2020, T. 46, № 9, стр. 522-529
Комплексы меди(II) С N,O-гибридными лигандами на основе пиридилсодержащих фосфоланоксидов
К. Р. Тригулова 1, *, А. В. Шамсиева 1, Р. Р. Файзуллин 1, П. Леннеке 2, Е. Хей-Хокинс 2, А. Д. Волошина 1, Э. И. Мусина 1, А. А. Карасик 1
1 Институт органической и физической химии им. А.Е. Арбузова Казанского научного центра РАН
Казань, Россия
2 Институт неорганической химии Лейпцигского университета
Лейпциг, Германия
* E-mail: kamtri95@mail.ru
Поступила в редакцию 10.01.2020
После доработки 04.02.2020
Принята к публикации 26.02.2020
Аннотация
На основе N,O-лигандов синтезированы новые водорастворимые бис-N,O-хелатные комплексы меди(II): [Cu(L2)2Cl2] (I), [Cu2(L1)2Cl4] (II), [Cu(L1)2Cl]2[CuCl4] (III) (L1, L2 = пиридилсодержащие оксиды фосфоланов. Комплексы охарактеризованы физико-химическими методами анализа: масс-спектрометрии, ИК-спектроскопии, элементного анализа и РСА (CIF filеs CCDC № 1976723 (I), 1976724 (II) и 1974303 (III)). Изучены их физико-химические свойства и установлена молекулярная и кристаллическая структура. Для биядерного комплекса состава [Cu2(L1)2Cl4] определена цитотоксичность по отношению к раковым клеточным линиям M-Hela и нормальным клеточным линиям Chang liver.
Хелатирующие лиганды, содержащие донорные атомы N и O, проявляют широкую биологическую и каталитическую активность [1]. Так, комплексы Ru(II) типа [(η6-арено)Ru(XY)Cl]PF6, где XY = N,O-хелатные аминоацидаты, проявляют цитотоксическое действие в отношении клеток рака поджелудочной железы и легких [2]. Хелатные металлокомплексы состава LMXn · H2O и L2MXn (где M = Ag+, Mn2+, Cu2+, Zn2+, Cd2+, Hg2+ или Fe3+; X = ${\text{NO}}_{{\text{3}}}^{ - },$ Br− или Cl−; в качестве лигандов L выступают основания Шиффа, содержащие фосфатную группу) проявляют значительную антибактериальную и противогрибковую активность [3]. Исследования in vitro комплексов Cu(II) на основе бис(имидазол-1-ил)метановых скорпионатных гетероциклических лигандов продемонстрировали потенциал их использования в качестве противоопухолевых агентов по отношению к линиям раковых клеток аденокарциномы молочной железы человека (MCF-7), шейки матки (He-La) и легких (A549) [4].
Наряду с биологической активностью комплексов меди(II) с N,O-хелатными лигандами (в качестве противовоспалительных [5], противотуберкулезных [6], антиоксидантных агентов [7]), изучаются альтернативные области применения этих комплексов, например, в селективном катализе [8].
N,O-лиганды, содержащие разные по типу донорные центры, позволяют стабилизировать различные ионы металлов и конструировать моно- и полиядерные гомо- или гетерометаллические комплексы [9, 10]. Обзор литературных данных показал, что в основном класс N,O-хелатных лигандов представлен основаниями Шиффа [11], аминокислотами [12], аминоспиртами [13], ена-минокетонами [14] и амидатами [15]. Отдельный интерес представляют N,O-содержащие макроциклические лиганды, имеющие так называемые подвески (pendant-armed), т.е. связанные с атомами цикла различные функциональные группы. Источником О-координационного центра в таких лигандах обычно является карбонильная, гидроксильная или карбоксильная группа [16–22], в то же время существуeт небольшой и поэтому менее изученный класс N,O-лигандов, в которых источником кислородного координационного центра выступают фосфорсодержащие функциональные группы, например фосфорильные [23–27] и фосфатные [28]. В связи с вышеописанным расширение библиотеки N,O-лигандов за счет введения альтернативного источника кислородного координационного центра, в частности фосфорильного фрагмента, представляется актуальной задачей. С этой точки зрения особый интерес представляют фосфиноксиды, включающие N-гетероциклический фрагмент (в нашем случае пиридильный заместитель), так как комплексы переходных металлов на основе пиридилсодержащих фосфиноксидов могут быть применены в качестве окисляющих агентов в реакциях эпоксидирования олефинов [29], радиофармацевтических препаратов [23], а также эмиттеров для органических свето-эмисионных диодов [30], молекулярных магнетиков [31], антибактериальных и противогрибковых агентов [3] и т.д.
С целью расширения библиотеки комплексов Cu(II) и структурной информации о них, мы в настоящей работе представляем синтез новых комплексов меди(II) на основе фосфорсодержащих N,O-лигандов – пиридилсодержащих фосфолан-оксидов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все растворители очищали и высушивали перед использованием. Исходные лиганды – пиридилсодержащие оксиды фосфоланов (L1, L2) и (пиридин-2-ил)фосфолан (L3) – синтезировали по ранее описанным методикам [32, 33].
ИК-спектры регистрировали на ИК спектрометре Tensor 27 (“Bruker”) в области 4000–400 см–1 с оптическим разрешением 4 см–1 и накоплением 32 сканов (образцы готовили в виде таблеток с KBr либо суспензий с вазелиновым маслом). Масс-спектры МАЛДИ получали на масс-спектрометре Bruker Ultraflex III TOF/TOF в режиме регистрации положительных ионов. В качестве матрицы использовали n-нитроанилин. Элементный анализ выполняли на приборе EuroVector-3000 (С, H, N) и вручную пиролизом навески в токе кислорода (P).
Синтез комплекса [Cu(L2)2Cl2] (I). Суспензию хлорида меди (0.32 г, 1.85 ммоль) в этаноле (4 мл) при перемешивании добавляли к фосфиноксиду L2 (0.72 г, 3.70 ммоль), растворенному в 4 мл этанола. Реакционную смесь перемешивали в течение 12 ч. Непрореагировавший хлорид меди(II) отфильтровывали, фильтрат упаривали при пониженном давлении. Остаток промывали сначала диэтиловым эфиром, затем ацетоном, и высушивали при пониженном давлении (2 × 10–2 мбар). Выход 0.71 г (73%). Тпл = 162°С. Масс-спектр МАЛДИ (m/z): 453 [M-2Cl]+, 582 [M + 2H2O + Na]+.
| Найдено, % : | С 45.87; | H 5.34; | N 5.14; | P 11.97; | Cu 12.34. |
| Для C20H28N2O2P2Cl2Cu | |||||
| вычислено, %: | C 45.77; | H 5.38; | N 5.34; | P 11.80; | Cu 12.11. |
ИК-спектр (вазелиновое масло; ν, см–1): 2959, 2921, 1605, 1452, 1404, 1263, 1164, 1027, 842, 713, 534, 453.
Синтез комплекса [Cu2(L1)2Cl4] (II). К раствору лиганда L1 (0.43 г, 1.19 ммоль) в EtOH (5 мл) добавляли раствор дигидрата хлорида меди(II) (0.16 г, 1.19 ммоль) в EtOH (4 мл). Реакционную смесь перемешивали в течение 12 ч, в результате образовывался осадок светло-зеленого цвета. Осадок отфильтровывали, промывали диэтиловым эфиром и высушивали при пониженном давлении (2 × 10–2 мбар). Выход 0.43 г (60%); Тпл = 245°C. Масс-спектр МАЛДИ (m/z): 460 [M-Cu-3Cl]+.
| Найдено, %: | С 34.31; | H 3.81; | N 4.34; | P 9.86; | Cu 20.17. |
| Для C18H24N2O2P2Cl4Cu2 | |||||
| вычислено, %: | С 34.25; | H 3.83; | N 4.44; | P 9.81; | Cu 20.13. |
ИК-спектр (вазелиновое масло ν, см–1,): 2925, 2854, 1590, 1453, 1377, 1261, 1165, 1128, 1100, 886, 857, 767, 739, 717, 537, 488, 448.
Синтез комплекса [Cu(L1)2Cl]2[CuCl4] (III). К раствору лиганда L3 (0.53 г, 3.2 ммоль) в ТГФ (7 мл) добавляли хлорид меди(I) (0.64 г, 6.4 ммоль). Реакционную смесь перемешивали в течение 12 ч. При хранении раствора в аэробных условиях в течение недели образовывались кристаллы желтого цвета комплекса III. Их отфильтровали, промыли диэтиловым эфиром, сушили при пониженном давлении (2 × 10–2 мбар). Выход 0.7 г (60%).
| Найдено, %: | С 38.33; | H 4.29; | N 4.97; | P 10.28; | O 5.67; | Cu 16.90. |
| Для C36H48N4O4P4Cl6Cu3 | ||||||
| вычислено, %: | С 38.37; | H 4.31; | N 4.89; | P 10.35; | O 5.62; | Cu 16.86. |
ИК-спектр (KBr; ν, см–1): 2930, 2860, 1588, 1450, 1380, 1270, 1163, 1130, 1105, 880, 860, 765, 740, 720, 535, 490, 450.
Медленным упариванием насыщенного раствора комплекса III в ТГФ при комнатной температуре получены монокристаллы [Cu(L1)2Cl]2-[CuCl4] · 2ТГФ (III · 2ТГФ) в виде сольвата.
Рентгеноструктурное исследование поликристаллических образцов выполнено на рентгеновском дифрактометре Bruker D8 Advance, оснащенном приставкой Vario и линейным координатным детектором Vantec. Использовано CuKα1-излучение (λ = 1.54063 Å), монохроматизированное изогнутым монохроматором Йохансона. Эксперименты выполнены при комнатной температуре в геометрии Брэгга–Брентано с плоским образцом. Поликристаллические порошки наносили на поверхность пластинки монокристаллического кремния. Порошковые дифрактограммы записаны в диапазоне 2θ от 5° до 50° с шагом 0.016° и временем набора 0.5–5 с в точке при вращении образца с частотой 15 об./мин.
РСА монокристаллов I и II выполнен на автоматическом дифрактометре Bruker KAPPA APEX II, для III ⋅ 2ТГФ – на дифрактометре Rigaku Gemini. Во всех случаях использовано монохроматическое излучение MoKα (λ = 0.71073 Å). Сбор и индексирование данных, определение и уточнение параметров элементарных ячеек, коррекция абсорбции и учет систематических ошибок проведены с использованием пакета программ APEX3 (v2019.1-0) или CrysAlisPro (v1.171.37.35). Интересно отметить, что моноклинная элементарная ячейка кристалла I характеризуется углом β, близким к 90°. Структуры расшифрованы прямыми методами программой SHELXT-2018/2 [34] (I и II) или SHELXS-2013/1 (III ⋅ 2ТГФ) [35] и уточнены полноматричным методом наименьших квадратов по F 2 программой SHELXL-2018/3 [36]. Неводородные атомы уточнены в анизотропном приближении. Атомы водорода метильных групп помещены в вычисленное положение и уточнены поворотом группы с идеализированными валентными углами. Остальные атомы водорода помещены в геометрически рассчитанные положения и включены в уточнение в модели “наездника”. Расчеты в основном проводили с использованием пакета программ WinGX-2018.3 [37]. Кристаллографические параметры и детали уточнения структур I–III приведены в табл. 1.
Таблица 1.
Кристаллографические данные и параметры уточнения структур I, II и III ⋅ 2ТГФ
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III · 2ТГФ | |
| Брутто-формула | C20H28N2O2P2Cl2Cu | C18H24N2O2P2Cl4Cu2 | C44H64N4O6P4Cl6Cu3 |
| Цвет кристалла | Зеленовато-голубой | Зеленый | Желтый |
| М | 524.82 | 631.21 | 1272.19 |
| Температура | 100(2) K | 293(2) K | 130(2) K |
| Сингония | Моноклинный | Моноклинный | Моноклинный |
| Пр. гр. | P21/с | P21/n | C2/c |
| а, Å b, Å c, Å β, град |
8.0406(4) 13.6498(7) 10.1145(6) 90.007(2) |
10.0287(4) 8.8328(3) 13.2044(5) 96.0378(17) |
27.2122(7)
18.4528(4) 10.9918(2) 102.230(2) |
| V, Å3 | 1110.09(10) | 1163.18(8) | 5394.2(2) |
| Z/Z′ | 2/0.5 | 2/0.5 | 4/0.5 |
| ρ(выч.), г см–3 | 1.570 | 1.802 | 1.567 |
| µ, мм–1 | 1.389 | 2.445 | 1.636 |
| F(000) | 542 | 636 | 2612 |
| θmin–θmax, град | 3.564–33.199 | 3.081–27.094 | 2.187–29.248 |
| Диапазон индексов | –12 ≤ h ≤ 12, –21 ≤ k ≤ 21, –15 ≤ l ≤ 15 |
–12 ≤ h ≤ 12, –10 ≤ k ≤ 11, –16 ≤ l ≤ 15 |
–31 ≤ h ≤ 34, –24 ≤ k ≤ 22, –14 ≤ l ≤ 14 |
| Общее число отражений | 29 116 | 20 869 | 22 763 |
| Число независимых отражений | 4232 | 2543 | 6391 |
| Rint | 0.0324 | 0.0356 | 0.0595 |
| Rσ | 0.0250 | 0.0251 | 0.0691 |
| Полнота данных к углу θmax, % | 99.6 | 99.4 | 87.0 |
| Tmax/Tmin | 0.4667/0.3574 | 0.3854/0.2261 | 1.0000/0.9502 |
| Число наблюдаемых отражений (I > 2σ(I )) | 3720 | 2150 | 4419 |
| Число уточняемых параметров | 134 | 136 | 348 |
| GOOF | 1.074 | 1.066 | 1.021 |
| R (I > 2σ(I)) | R1 = 0.0277, wR2 = 0.0644 |
R1 = 0.0271, wR2 = 0.0617 |
R1 = 0.0518, wR2 = 0.1179 |
| R (по всем отражениям) | R1 = 0.0349, wR2 = 0.0674 |
R1 = 0.0356, wR2 = 0.0646 |
R1 = 0.0873, wR2 = 0.1345 |
| Остаточная электронная плотность (max/min), e/Å3 | 0.652/–0.451 | 0.41 8/–0.341 | 0.947/–0.811 |
Полный набор рентгеноструктурных параметров структур I, II и III ⋅ 2ТГФ депонированы в Кембриджском банке структурных данных (CCDC № 1976723 (I), 1976724 (II) и 1974303 (III ⋅ 2ТГФ); https://www.ccdc.cam.ac.uk/structures/).
Исследования биологической активности. Цитотоксическое действие тестируемых соединений на рак и нормальные клетки человека оценивали с помощью многофункциональной системы визуализации клеток Cytell (GE Healthcare Life Science, Sweden) с использованием приложения Cell Viability Bio, которое подсчитывает количество клеток и оценивает их жизнеспособность по данным интенсивности флуоресценции. В экспериментах использовали два флуоресцентных красителя, которые избирательно проникают в клеточные мембраны и флуоресцируют на разных длинах волн. Низкомолекулярный 4',6-диамидин-2-фенилиндоловый краситель (DAPI) способен проникать через неповрежденные мембраны живых клеток и окрашивать ядра в синий цвет. Высокомолекулярный краситель, пропидий иодид, проникает только в мертвые клетки с поврежденными мембранами, окрашивая их в желтый цвет. В результате живые клетки окрашиваются в синий цвет, а мертвые клетки – в желтый. DAPI и пропидий иодид приобретали у Sigma-Aldrich. Для экспериментов использовали опухолевую культуру клеток M-Hela клон 11 (эпителиоидная карцинома шейки матки, сублиния Hela, клон M-Hela) из коллекции типовых культур Института цитологии РАН и культуру нормальных клеток печени (Chang liver) из Национального исследовательского центра эпидемиологии и микробиологии им. Н.Ф. Гамалеи. Клетки культивировали в стандартной питательной среде Игла, изготовленной в Институте полиомиелита и вирусного энцефалита им. М.П. Чумакова (компания PanE-co), и в нее добавляли 10% фетальной бычьей сыворотки и 1% заменимых аминокислот. Клетки высевали в 96-луночный планшет (Ep-pendorf) в концентрации 100 000 кл./мл, 150 мкл среды на лунку и культивировали в CO2-инкубаторе при 37°C. Через 24 ч после посева клеток в лунки исследуемое соединение добавляли при предварительно установленном разведении, по 150 мкл в каждую лунку. Разведения соединения готовили немедленно в питательных средах, для лучшей растворимости добавляли 5% диметилсульфоксидa, не вызывающий ингибирования клеток при этой концентрации. Эксперименты повторяли 3 раза. В качестве контроля использовали неповрежденные клетки, культивируемые параллельно с экспериментальными [38].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
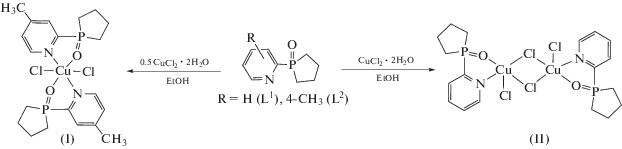
Фосфиноксиды L1 и L2, содержащие пиридильные заместители при атомах фосфора, были получены согласно методике, разработанной нами ранее [32]. Взаимодействием лигандов L2 и L1 с CuCl2 ∙ 2H2O в соотношении металл : лиганд = 1 : 2 и 1 : 1 в этаноле с хорошими выходами были получены комплексы I и II соответственно (схема 1 ).
Схема 1 .
Комплексы I и II хорошо растворимы в большинстве органических растворителей и в воде. Данные масс-спектрометрии и элементного анализа подтвердили состав комплексов. ИК-спектры комплексов сравнивали со спектрами свободных лигандов, чтобы определить участие в координации потенциальных донорных центров. Было обнаружено, что положения и интенсивности соответствующих спектральных полос изменяются при хелатировании. Более низкочастотное положение полос поглощения, соответствующих валентным колебаниям связи P=O в ИК-спектрах комплексов I и II (1158 и 1161 см–1 соответственно) по сравнению со свободными лигандами (1181–1183 см–1), подтверждает координацию фосфорильной группы [32]. Отсутствие ν(H2O) указывает на замещение координированных молекул воды исходного CuCl2 ∙ ∙ 2H2O фосфиноксидным лигандом.
Структуры комплексов были окончательно установлены методом РСА. Монокристаллы соединений I и II были получены медленным упариванием насыщенных растворов комплексов в ацетонитриле при комнатной температуре. Порошковые дифрактограммы поликристаллических образцов I и II хорошо согласуются с рассчитанными, основанными на данных рентгеноструктурного исследования, что подтверждает их чистоту и полиморфную идентичность.
Согласно рентгенодифракционным данным, комплекс I кристаллизуется в моноклинной пр. гр. P21/с и представляет собой центросимметричный нейтральный моноядерный комплекс Cu(II), в котором координационный центр характеризуется искаженной октаэдрической конфигурацией (рис. 1).
Рис. 1.
Геометрия комплекса I в кристалле. Эллипсоиды тепловых колебаний приведены с 50%-ной вероятностью. Надстрочным индексом i отмечены эквивалентные атомы, связанные операцией симметрии (1 – x, 1 – y, 1 – z). Избранные длины связей: Cu(1)–Cl(1) 2.3515(3), Cu(1)–O(1) 2.4390(9), Cu(1)–N(1) 1.9887(10), P(1)–O(1) 1.4969(9) Å.
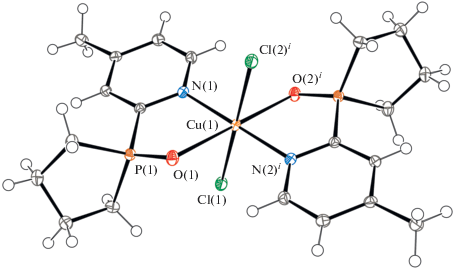
Первая координационная сфера комплекса сформирована гетероатомами двух N,O-лигандов, лежащими в четырехугольном основании октаэдра, и двумя хлорид-ионами в апикальных позициях. Исходный лиганд L2 координирует металлоцентр, формируя пятичленный N,O-хелатный металлоцикл. Обращает внимание существенно удлиненная координационная связь Cu∙∙∙O=P, что, по всей видимости, обусловлено эффектом Яна–Теллера, характерного для комплексов меди(II). Так, межатомные дистанции для координационных связей Cu(1)–O(1) и Cu(1)–N(1) составляют 2.4390(9) и 1.9887(10) Å соответственно. Дистанция для связи Cu(1)–Cl(1) равна 2.3515(3) Å.
Комплекс II кристаллизуется в моноклинной пр. гр. P21/n. Рентгенодифракционный эксперимент показал (рис. 2), что исследованное соединение является центросимметричным нейтральным биядерным комплексом Cu(II) с ядром Cu2Cl4, в котором два из четырех координированных хлорид-ионов оказываются мостиковыми (Cu(1)–Cl(2) 2.2680(6) и Cu(1)–Cl(2)i 2.7456(7) Å), что приводит к сближению двух формально заряженных металлоцентров (Cu(1)∙∙∙Cu(1)i 3.5215(6) Å).
Рис. 2.
Геометрия комплекса II в кристалле. Эллипсоиды тепловых колебаний приведены с 50%-ной вероятностью. Надстрочным индексом i отмечены эквивалентные атомы, связанные операцией симметрии (1 – x, 1 – y, 1 – z). Избранные длины связей: Cu(1)–Cl(1) 2.2318(6), Cu(1)–Cl(2) 2.2680(6), Cu(1)–Cl(2)i 2.7456(7), Cu(1)–O(1) 1.9756(15), Cu(1)–N(1) 2.0805(19), P(1)–O(1) 1.5069(16) Å.
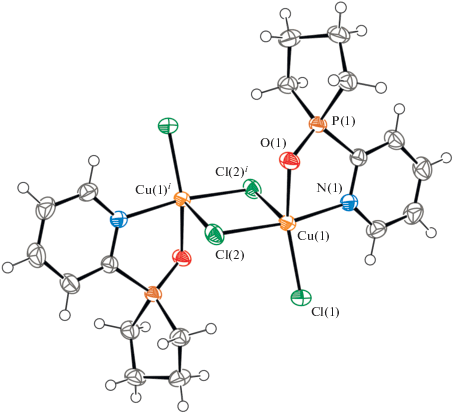
Интересно, что координационная связь с немостиковым хлорид-ионом немного короче и составляет Cu(1)–Cl(1) 2.2318(6) Å. Ион Cu2+ с КЧ 5 принимает искаженную квадратно-пирамидальную геометрию со структурным параметром τ5 = = 0.23, где основание пирамиды образовано атомами N(1) и O(1) лиганда и двумя хлоридными солигандами Cl(1) и Cl(2). Апикальное положение занимает хлорид-ион Cl(2)i. Следует отметить, что крайние значения параметра τ5 равны 0 и 1 и соответствуют идеальной тетрагональной пирамидальной и тригональной бипирамидальной геометрии соответственно [39]. В комплексах I и II исходный лиганд координирует металлоцентр, формируя пятичленный N,O-хелатный металлоцикл.
Межатомные дистанции для двойной связи P(1)=O(1) для комплексов I и II составляют 1.4969(9) и 1.5069(16) Å соответственно и близки к длинам связей P=O в комплексах Cu(II) с фосфиноксидами, содержащими ароматические (1.4979(17) [40], 1.488(1) [41]) и алифатические (1.5176(19) [42], 1.5155(13) Å [43]) заместители при атоме фосфора. Длины связей P=O в комплексах также сопоставимы с аналогичными связями в некоординированных фосфорильных соединениях с ароматическими (1.477(3) Å [44]) или алифатическими заместителями при атоме фосфора (1.518(2) Å [45]).
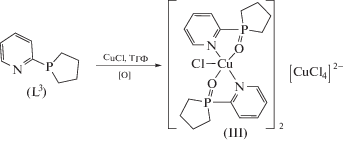
Оказалось, что взаимодействие неокисленного лиганда L3 с хлоридом меди(I) в ТГФ в соотношении 1 : 2 в аэробных условиях приводит к окислению как самого лиганда до L1, так и иона металла, в результате чего через неделю в реакционной смеси обнаруживается лишь комплекс III −[Cu(L1)2Cl]2[CuCl4] (схема 2 ).
Схема 2 .
В отличие от диамагнитных комплексов меди(I) с фосфиновыми лигандами, для которых в спектрах ЯМР 31Р наблюдаются характерные сигналы координированных лигандов, для парамагнитных комплексов меди(II) этот метод малоинформативен. Отсутствие сигнала и широкая базовая линия в спектре ЯМР 31Р комплекса III свидетельствует о парамагнетизме комплекса и, следовательно, об окислении Cu(I) в Cu(II). Кроме того, желтая окраска комплекса также свидетельствует об окислении иона меди. Окисление лиганда подтверждается появлением характерной полосы колебаний связи P=O в ИК-спектре при 1165 см–1 аналогично наблюдающейся в комплексах I и II.
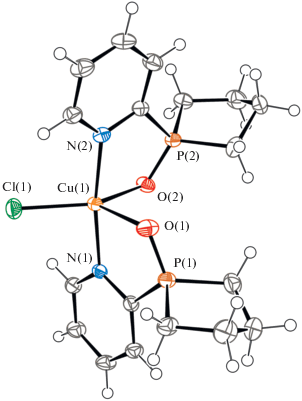
Структура комплекса III была окончательно подтверждена данными РСА. Монокристаллы III · 2ТГФ были получены медленным упариванием насыщенного раствора комплекса в ТГФ при комнатной температуре. Комплекс III, имеющий общую формулу [Cu(L1)2Cl]2[CuCl4], кристаллизуется в виде сольвата с двумя молекулами ТГФ в моноклинной пр. гp. C2/c с атомом меди комплексного аниона [CuCl4]2– в частном положении. Этот анион характеризуется искаженной тетраэдрической конфигурацией. Как продемонстрировано на рис. 3, катион [CuL12Cl]+ представляет собой моноядерный заряженный комплекс Cu(II) с сильно искаженной тригональной бипирамидальной геометрией, что подтверждается значением геометрического индекса τ5 = 0.47. Основание бипирамиды составляет координированный хлорид-анион и атомы кислорода двух пиридилсодержащих фосфиноксидных лигандов. Апикальные позиции занимают атомы азота этих лигандов. Как и в двух вышеописанных структурах I и II, N,O-лиганд, полученный in situ в процессе реакции, координирует металлоцентр, формируя пятичленный N,O-хелатный металлоцикл. Межатомные дистанции для координационных связей представлены в подписи к рис. 3.
Рис. 3.
Геометрия катиона комплекса III в кристалле. Эллипсоиды тепловых колебаний приведены с 50%-ной вероятностью. Противоион [CuCl4]2– и разупорядоченные молекулы ТГФ не показаны для ясности. Избранные длины связей: Cu(1)–Cl(1) 2.2348(10), Cu(1)–O(1) 2.155(3), Cu(1)–O(2) 2.052(3), Cu(1)–N(1) 1.999(3), Cu(1)–N(2) 2.000(3), P(1)–O(1) 1.500(3), P(2)–O(2) 1.509(3) Å.
Среди ионов металлов медь широко распространена в биологических системах, и известно, что комплексы меди обладают широким спектром биологического действия, в частности, координационные соединения меди оказались перспективными кандидатами для лечения рака [46]. Механизм опосредуемой комплексом меди(II) цитотоксичности может быть связан с их способностью связывать и расщеплять молекулы ДНК. Было обнаружено, что различные комплексы меди обладают высокой противоопухолевой активностью, что было проверено in vitro на нескольких линиях раковых клеток, и некоторые из них в экспериментах in vivo [47].
В связи с вышеизложенным водорастворимое соединение II было протестировано на цитотоксичность в отношении нормальных и раковых клеточных линий человека. Значение IC50 комплекса II по отношению к раковой клеточной линии M-Hela составляет 38.0 ± 2.9 мкM, что уступает препарату сравнения тамоксифену (28.0 ± 2.5 мкM). Однако в отношении нормальных клеточных линий Chang liver он оказался менее токсичным, чем стандартный противораковый препарат (IC50 составляет 53.0 ± 4.6 мкM против 46.2 ± 3.5 мкM для тамоксифена). Следует отметить, что свободный лиганд L1 цитотоксической активности не проявил.
Таким образом, оксиды фосфоланов, содержащие пиридильные группы при атомах фосфора, в комплексообразовании с хлоридом меди(II) выступают в качестве классических хелатирующих N,O-лигандов, образуя в зависимости от стехиометрии реакции заряженный моноядерный бис-хелатный комплекс I или нейтральный биядерный комплекс Cu(II) II с мостиковыми атомами хлора и монохелатной координацией металла. Продемонстрирована синтетическая возможность получения комплексов меди(II) (на примере получения III) из фосфиновых лигандов и производных меди(I) за счет аэробного окисления как лиганда, так и иона металла. Комплекс II показал умеренную цитотоксичность по отношению к раковой клеточной линии M-Hela, что делает перспективным синтез аналогичных комплексов и изучение их биологической активности.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Pier G.C. // Tutorial Rev. 2004. V. 119. P. 67.
Habtemariam A., Melchart M., Fernandez R. et al. // J. Med. Chem. 2006. V. 49. P. 6858.
Abd El-Wahab Z.H., El-Sarrag M.R. // Spectrochim. Acta. A. 2004. V. 60. P. 271.
Jayakumar S., Mahendirana D., Kalilur Rahimana A. // J. Coord. Chem. 2019. V. 72. № 12. P. 2015.
Alisir S.H., Dege N., Tapramaz R. // Acta Crystallogr. C. 2019. V. 75. P. 388.
Hegde G.S., Netalkar S.P., Revankar V.K. // Appl. Organomet. Chem. 2019. V. 33. P. 4840.
Hazra M., Dolai T., Pandey A. et al. // Bioinorg. Chem. Appl. 2014. P. 1
Lu X.-Q., Bao F., Kang B.-S. et al. // J. Organ. Chem. 2006. V. 691. P. 821.
Rivada-Wheelaghan O., Aristizabal S. L., Lopez-Serrano J. et al. // Angew. Chem. Int. Ed. 2017. V. 56. P. 16267.
Diaz O., Medina S., Valderrama M. et al. // J. Chil. Chem. Soc. 2008. V. 53. P. 1480.
Mohamed G.G., Omar M.M., Ibrahim A.A. // Eur. J. Med. Chem. 2009. V. 2009. P. 4801.
Jose V.L., Dolores B., Luisa C. et al. // Curr. Org. Chem. 2005. V. 9. № 3. P. 219.
Kapteijn G.M., Baesjou P.J., Alsters P.L. et al. // Chem. Ber. 1997. V. 130. № 1. P. 35.
Kovganko V.N., Kovganko N.N. // Russ. J. Org. Chem. 2006. V. 42. № 6. P. 907.
Pestov A.V., Slepukhin P.A., Charushin V.N. // Russ. Chem. Rev. 2015. V. 84. P. 310.
Koziol A.E., Palenik R.C., Palenik G.J. et al. // Inorg. Chim. Acta. 2006. V. 359. P. 2569.
Chen X.-D., Mak T.C.W. // J. Mol. Struct. 2005. V. 748. P. 183.
Kwiatek D., Kubicki M., Belter J. // Polyhedron. 2017. V. 133. P. 187.
Raju K., Dayakar G. // Asian J. Chem. 2008. V. 20. № 8. P. 6281.
Biswas M.K., Patra S.C., Maity A.N. et al. // Chem. Commun. 2013. V. 49. P. 4522.
Mahmudov K.T., Kopylovich M.N., Sabbatini A. et al. // Inorg. Chem. 2014. V. 53. P. 9946.
Salehi M., Mereiter K., Amirnasr M. // Russ. J. Coord. Chem. 2012. V. 38. № 8. P. 573. https://doi.org/10.1134/S1070328412070093
Machura B., Jankowska A., Kruszynski R. et al. // Polyhedron. 2006. V. 25. P. 2663.
Sun W., Zhang Q., Qin L. et al. // Eur. J. Inorg. Chem. 2010. V. 2010. P. 4009.
Espinet P., Hernando R., Iturbe G. et al. // Eur. J. Inorg. Chem. 2000. V. 2000. P. 1031.
Rohovec J., Vojtisek P., Lukes I. // Phosphorus, Sulfur Silicon Relat. Elem. 1999. V. 148. P. 79.
Balint E., Tripolszky A., Jablonkai E. et al. // J. Organomet. Chem. 2016. V. 801. P. 111.
Zurowska B., Slepokura K., Kalinowska-Lis U. et al. // Inorg. Chim. Acta. 2012. V. 384. P. 143.
Damiano J.-P., Munyejabo V., Postel M. // Polyhedron. 1995. V. 14. № 9. P. 1229.
Sun W., Zhang Q., Qin L. et al. // Eur. J. Inorg. Chem. 2010. P. 4009.
Zueva E.M., Petrova M.M., Shamsieva A.V. et al. // Int. J. Quantum Chem. 2019. P. e26145.
Shamsieva A.V., Trigulova K.R., Fayzullin R.R. et al. // Russ. Chem. Bull. Int. Ed. 2018. V. 67. P. 1206.
Musina E.I., Shamsieva A.V., Strelnik I.D. et al. // Dalton Trans. 2016. V. 45. P. 2250.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Farrugia L.J. // J. Appl. Crystallogr. 2012. V. 45. P. 849.
Voloshina A.D., Semenov V.E., Strobykina A.S. et al. // Russ. J. Bioorg. 2017. V. 43. P. 170.
Addison A.W., Rao N.T., Reedijk J. et al. // Dalton Trans. 1984. P. 1349.
Aleksanyan D.V., Nelyubina Yu.V., Dmitrienko A.O. et al. // Polyhedron. 2015. V. 85. P. 295.
Uvarova M.A., Sinelshchikova A.A., Golubnichaya M.A. et al. // Cryst. Growth Des. 2014. V. 14. № 11. P. 5976.
Szymanska I.B., Dobrzanska L. // Acta Crystallogr. E. 2011. V. 67. P. 1225.
Entzminger D.P.D, Cawker N.C., Graveson A.N. et al. // Z. Anorg. Allg. Chem. 2015. V. 641. № 2. P. 414.
Sharrock P., Melnik M., Beelanger-Gariepy F. et al. // Can. J. Chem. 1985. V. 63. P. 2564.
Lang H.-F., Fanwick P.E., Walton R.A. // Inorg. Chim. Acta. 2002. V. 329. P. 9.
Marzano C., Pellei M., Tisato F. et al. // Anticancer Agents Med. Chem. 2009. V. 9. P. 185.
Santini C., Pellei M., Gandin V. et al. // Chem. Rev. 2014. V. 114. P. 815.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия