Координационная химия, 2020, T. 46, № 9, стр. 530-544
Превращения трифторацетатов кобальта(II) в 1,4-диоксане: влияние природы растворителя на состав, строение и упаковку молекул в кристалле
М. А. Уварова 1, С. Е. Нефедов 1, *
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: snef@igic.ras.ru
Поступила в редакцию 25.02.2020
После доработки 26.03.2020
Принята к публикации 08.04.2020
Аннотация
Взаимодействие водного ацетата кобальта(II) с трифторуксусной кислотой в метаноле приводит к образованию комплекса [Co(OOCF3)2(OH2)4] (I). Проведение этой же реакции в смеси растворителей метанол–бензол–диоксан приводит к моноядерному комплексу [Co(OOCF3)2(OH2)6] ∙ O(CH2CH2)2O (II), в котором сольватная молекула диоксана формирует монокристалл посредством образования водородных связей с координированными молекулами воды. В аналогичной реакции, проведенной в чистом диоксане образуется трехъядерный комплекс {Co3(OOСCF3)4(OH2)2(OOСF3)2-[O(CH2CH2)2O]2} ∙ 2HOOСCF3 ∙ 2O(CH2CH2)2O (III), содержащий не только сольватные, но и координированные молекулы диоксана. При перекристаллизации III из смеси изопропанол–диоксан образуется комплекс [Co(OOСCF3)2(OH2)4] ∙ 2O(CH2CH2)2O (IV). Взаимодействие III с пиразолом (HРz) приводит к моноядерному комплексу [Co(OOСCF3)2(HРz)4] ∙ 2O(CH2CH2)2O (V). Реакция I с HРz в хлористом метилене приводит к моноядерному комплексу [Co(OOСCF3)2(HРz)4] (VI). Структура координационных соединений I–VI установлена методом РСА (СIF files CCDC № 1985667 (I), 1985666 (II), 1985671 (III), 1985670 (IV), 1985665 (V), 1985669 (VI) при Т = 296(2) K, 1985668 (VI) при Т = 150(2) K).
Знание особенностей координации и превращений анионов исходных соединений, а также используемого для проведения реакции растворителя, позволяет прогнозировать состав и строение образующихся координационных соединений [1, 2].
Известно, что анионы сильных кислот (например, трифторметансульфоновая или трифторуксусная) могут быть легко вытеснены из координационной сферы металла растворителями, содержащими нуклеофильные атомы, такими как ацетонитрил, тетрагидрофуран, диоксан, освобождая орбитали для фиксации различных донорных молекул. При этом используемый в качестве растворителя 1,4-диоксан, имеющий два противолежащих нуклеофильных центра, способен выступать в качестве мостикового лиганда, подобно γ,γ'-дипиридилу или пиразину, что приводит к получению полиядерных комплексов или координационных полимеров (КП) [3–7].
Недавно было показано, что, исходя из трифторацетатов 3d-переходных металлов, возможен синтез КП [8–10], а также дифторидов соответствующих металлов при термическом разложении Fe(OOCCF3)2(HOOCCF3)2, Mn2(OOCCF3)4-(HOOCCF3)4 и Co(OOCCF3)2(H2O)4 [11].
Отметим, что молекула гетероциклического пиразола, содержащая пиридиновый атом азота и пиррольный фрагмент, способный депротонироваться, рассматривается как удобный лиганд для изучения реакций переноса протона, а также синтеза структурных аналогов активной части природных металлоферментов [12–15].
В настоящей работе сообщается о синтезе и строении трифторацетатов кобальта(II), полученных в растворителях различной природы (метанол, метанол–бензол–диоксан, метанол–диоксан, диоксан) и продуктов их реакций с пиразолом (HPz).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез [Co(OOСCF3)2(OH2)4] (I). К раствору 1 г (4 ммоль) Co(OOСMe)2 ∙ 4H2O в 5 мл метанола добавляли 0.6 мл (8 ммоль) трифторуксусной кислоты. Открытую двугорлую колбу оставляли под тягой. Образовавшиеся при медленном испарении красные монокристаллы отделяли от маточного раствора декантацией, промывали последовательно охлажденным бензолом (5 мл), гексаном (5 мл) и сушили в атмосфере аргона. Выход I 1.2 г (87%).
ИК-спектр (ν, см–1): 3427 с. ш, 1713 с, 1683 с, 1629 ср, 1462 сл, 1207 с, 1157 с, 849 сл., 799 ср, 728 ср, 610 сл, 520 сл, 437 сл.
Синтез [Co(OOСCF3)2(OH2)6] ∙ O(CH2CH2)2O (II). К раствору 1 г (4 ммоль) Co(OOСMe)2 ∙ 4H2O в 5 мл метанола добавляли 0.6 мл (8 ммоль) трифторуксусной кислоты, 0.5 мл бензола (2–3% Н2О) и 0.3 мл (3.4 ммоль) диоксана. Открытую двугорлую колбу оставляли под тягой. Образовавшиеся при медленном испарении красные монокристаллы отделяли от маточного раствора декантацией, промывали последовательно охлажденным бензолом (10 мл), гексаном (10 мл) и сушили в атмосфере аргона. Выход II в виде порошока 1 г (55%).
ИК-спектр (ν, см–1): 3434 с. ш, 1710 с, 1682 с, 1447 сл, 1382 сл, 1205 с, 1148 с, 1080 сл, 900 сл, 870 сл, 797 ср, 726 ср, 601 сл, 418 сл.
Синтез {Co3(µ-OOСCF3)4(µ-OH2)2(OOСCF3)2-[O(CH2CH2)2O]2} ∙ 2HOOСCF3 ∙ 2O(CH2CH2)2O (III). К 1 г кристаллов (4 ммоль) Co(OOСMe)2 ∙ ∙ 4H2O добавляли 0.6 мл (8 ммоль) трифторуксусной кислоты и 5 мл диоксана. Полученную суспензию кипятили в течение 30 мин, удаляли в токе аргона растворитель до ~2 мл и оставляли остывать в масляной бане. Выпавшие крупные красные кристаллы отделяли от раствора декантацией, промывали последовательно холодным бензолом (10 мл), гексаном (10 мл) и сушили в атмосфере аргона. Выход III 1.3 г (69%).
ИК-спектр (ν, см–1): 3445 c. ш, 3247 с, 2934 сл, 2875 сл, 1712 с, 1460 ср, 1446 ср., 1381 сл., 1260 ср, 1195 с, 1144 с, 1112 с, 1080 ср, 1045 сл, 900 сл, 870 с, 853 ср, 796 с, 726 ср, 617 ср, 518 сл.
Синтез [Co(OOСCF3)2(OH2)4] ∙ 2O(CH2CH2)2O (IV). Монокристаллы комплекса III (0.3 г, 0.21 ммоль) растворяли в 5 мл изопропанола, добавляли 0.5 мл диоксана и нагревали до 60°С в течение 0.5 ч. Полученный красный раствор оставляли в открытой двугорлой колбе под тягой. Образовавшиеся при медленном испарении на воздухе через 3 сут красные монокристаллы при полном удалении растворителя промывали последовательно холодным бензолом, гексаном и сушили в атмосфере аргона. Выход IV 0.27 г (95%).
ИК-спектр (ν, см–1): 3123 ср. ш, 1663 с, 1524 сл, 1446 ср, 1292 сл, 1188 с, 1140 с, 988 сл, 857 ср, 794 с, 724 с, 606 ср, 517 ср, 500 сл, 468 сл.
Синтез [Co(OOСCF3)2(HРz)4] ∙ 2O(CH2CH2)2O (V). Монокристаллы комплекса III (0.3 г, 0.21 ммоль) растворяли в 5 мл хлористого метилена, добавляли 0.18 г (2.62 ммоль) HРz и кипятили в течение 0.5 ч. К полученному раствору добавляли 5 мл гексана, концентрировали до 5 мл и выдерживали в холодильнике при 5°С в течение 3 сут. Выпавшие оранжевые кристаллы отделяли от раствора декантацией, промывали последовательно холодным бензолом, гексаном и сушили в атмосфере аргона. Выход V 0.36 г (89%).
ИК-спектр (ν, см–1): 3070 сл. ш, 1560 с, 1518 с, 1492 сл, 1428 с, 1382 с, 1331 ср, 1253 сл, 1223 сл, 1107 сл, 1143 сл, 1020 сл, 872 сл, 846 с, 778 сл, 738 сл, 721 с, 674 ср, 659 ср, 622 ср, 515 сл, 429 сл.
Синтез [Co(OOСCF3)2(HРz)4] (VI). Монокристаллы комплекса I (0.5 г, 1.4 ммоль) растворяли в 5 мл хлористого метилена, добавляли 0.38 г (5.6 ммоль) HРz и кипятили в течение 0.5 ч. К полученному раствору добавляли 5 мл гексана, концентрировали до 5 мл и выдерживали в холодильнике при 5°С в течение 3 сут. Выпавшие оранжевые кристаллы отделяли от раствора декантацией, промывали последовательно холодным бензолом, гексаном и сушили в атмосфере аргона. Выход VI 0.72 г (92%).
ИК-спектр (ν, см–1): 3362 c. ш, 3147 ср, 2998 сл, 2642 сл, 2883 сл, 2821 сл, 1674 с, 1550 сл, 1524 ср, 1467 ср, 1435 ср, 1355 ср, 1253 ср, 1203 с, 1130 с, 1061 с, 1046 с, 941 ср, 912 сл, 890 сл, 865 сл, 833 ср, 796 ср, 766 с, 721 с, 656 сл, 604 с, 519 сл, 423 сл.
ИК-спектры соединений регистрировали на ИК спектрофотометре с Фурье преобразованием Perkin-Elmer Spectrum 65 методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 400–4000 см–1.
РСА кристаллов I–VI выполнены по стандартной методике на автоматическом дифрактометре Bruker SMART Apex II, оборудованном CCD-детектором (MoКα-излучение, λ = 0.71073 Å, графитовый монохроматор, ω-сканирование) при комнатной температуре. Уточнение структур выполнено с использованием комплекса программ SHELXTL PLUS (PC версия) [16–19]. Атомы водорода в структурах I–IV выявлены из разностного Фурье-ряда и уточнены изотропно. В комплексах атомы фтора CF3-заместителей разупорядочены по двум позициям с кратностями 0.7 : 0.3 в I, 0.5 : 0.5 в IV и 0.6 : 0.4 в VI. Кристаллы комплекса IV медленно разрушались в ходе рентгеноструктурного эксперимента. Кристаллографические данные и детали уточнения комплексов I–VI приведены в табл. 1, основные длины связей и валентные углы – в табл. 2, 3.
Таблица 1.
Кристаллографические параметры и детали уточнения структур комплексов I–VI
| Параметр | I | II | III | IV | V | VI | VI |
|---|---|---|---|---|---|---|---|
| Брутто-формула | C4H8O8F6Co | C8H20O12F6Co | C28H34O26F24Co3 | C20H24N8O6F6Co | C8H16O10F6Co | C16H16N8O4F6Co | C16H16N8O4F6Co |
| М. м. | 357.03 | 481.17 | 1419.34 | 645.40 | 445.14 | 557.30 | 557.30 |
| Цвет | Красный | Красный | Красный | Оранжевый | Красный | Оранжевый | Оранжевый |
| T, K | 296(2) | 150(2) | 150(2) | 150(2) | 296(2) | 296(2) | 150(2) |
| Сингония | Моноклинная | Триклинная | Моноклинная | Триклинная | Триклинная | Моноклинная | Триклинная |
| Пр. гр. | P21/c | P1 | P21/c | P1 | P1 | P21/c | P1 |
| a, Å | 4.900(3) | 5.1477(5) | 10.4165(8) | 8.2179(8) | 5.059(9) | 7.1945(16) | 8.2457(16) |
| b, Å | 11.990(6) | 8.4413(8) | 13.5030(10) | 8.8075(8) | 7.920(9) | 10.856(2) | 8.3960(16) |
| c, Å | 9.816(5) | 10.7821(11) | 18.6150(14) | 10.3827(10) | 11.054(13) | 14.580(3) | 8.4255(17) |
| α, град | 90 | 88.1580(10) | 90 | 111.4930(10) | 79.81(2) | 90 | 88.197(3) |
| β, град | 100.252(8) | 80.3310(10) | 103.2380(10) | 100.8440(10) | 89.51(2) | 95.775(4) | 89.552(3) |
| γ, град | 90 | 81.3910(10) | 90 | 91.0770(10) | 79.026(14) | 90 | 68.140(3) |
| V, Å3 | 567.6(5) | 456.65(8) | 2548.7(3) | 683.58(11) | 427.8(10) | 1133.0(4) | 541.09(18) |
| Z | 2 | 1 | 2 | 1 | 1 | 2 | 1 |
| ρ(выч.), мг/м3 | 2.089 | 1.750 | 1.849 | 1.568 | 1.728 | 1.634 | 1.710 |
| µ, мм–1 | 1.632 | 1.054 | 1.134 | 0.719 | 1.109 | 0.847 | 0.887 |
| F(000) | 354 | 245 | 1414 | 329 | 225 | 562 | 281 |
| Размеры кристалла, мм | 0.24 × 0.22 × 0.20 | 0.26 × 0.24 × 0.22 | 0.26 × 0.24 × 0.22 | 0.22 × 0.20 × 0.18 | 0.24 × 0.22 × 0.20 | 0.24 × 0.22 × 0.20 | 0.24 × 0.22 × 0.20 |
| θ-область сканирования, град | 2.71–30.00 | 2.44–30.57 | 2.51–30.54 | 2.50–30.00 | 2.66–24.99 | 2.34–29.99 | 2.42–30.00 |
| Интервалы индексов отражений | –6 ≤ h ≤ 6, –16 ≤ k ≤ 13, –13 ≤ l ≤ 13 |
–7 ≤ h ≤ 7, –11 ≤ k ≤ 12, –15 ≤ l ≤ 15 |
–14 ≤ h ≤ 14, –16 ≤ k ≤ 19, –26 ≤ l ≤ 26 |
–11 ≤ h ≤ 11, –12 ≤ k ≤ 12, –14 ≤ l ≤ 14 |
–5 ≤ h ≤ 6, –9 ≤ k ≤ 6, –13 ≤ l ≤ 8 |
–10 ≤ h ≤ 10, –15 ≤ k ≤ 13, –20 ≤ l ≤ 20 |
–11 ≤ h ≤ 11, –11 ≤ k ≤ 11, –11 ≤ l ≤ 11 |
| Число отражений | 4277 | 5509 | 21 226 | 8118 | 1402 | 9480 | 6273 |
| Число независимых отражений (Rint) | 1643 (0.1029) | 2747 (0.0117) | 7481 (0.0250) | 3964 (0.0159) | 1327 (0.0801) | 3252 (0.0285) | 3103 (0.0272) |
| GOOF | 1.112 | 1.045 | 1.046 | 1.037 | 1.063 | 0.965 | 1.052 |
| R1, wR2 (I > 2σ(I)) | 0.0840, 0.2424 | 0.0296, 0.0851 | 0.0385, 0.0913 | 0.0392, 0.1053 | 0.0933, 0.2659 | 0.0809, 0.2043 | 0.0390, 0.1163 |
| R1, wR2 (по всем рефлексам) | 0.0984, 0.2558 | 0.0306, 0.0859 | 0.0572, 0.1003 | 0.0422, 0.1083 | 0.1383, 0.2990 | 0.0862, 0.2070 | 0.0459, 0.1218 |
| Δρmax/Δρmin, e Å–3 | 1.586/–1.343 | 0.900/–0.570 | 0.517/–0.447 | 0.701/–0.526 | 1.131/–1.314 | 1.970/–0.663 | 1.069/–0.626 |
Таблица 2.
Основные длины связей (Å) и валентные углы (град) в комплексах I–III*
| Связь | d, Å | Связь | d, Å |
| I | |||
| Co(1)–O(3)#1 | 2.046(3) | Co(1)–O(3) | 2.046(3) |
| Co(1)–O(1)#1 | 2.116(3) | Co(1)–O(1) | 2.116(3) |
| Co(1)–O(4) | 2.128(3) | Co(1)–O(4)#1 | 2.128(3) |
| II | |||
| Co(1)–O(3) | 2.0674(10) | Co(1)–O(3)#1 | 2.0674(10) |
| Co(1)–O(2)#1 | 2.1001(10) | Co(1)–O(2) | 2.1001(10) |
| Co(1)–O(1) | 2.1000(9) | Co(1)–O(1)#1 | 2.1000(9) |
| III | |||
| Co(1)–O(2) | 2.0399(14) | Co(1)–O(8) | 2.0414(17) |
| Co(1)–O(6) | 2.0517(16) | Co(1)–O(4) | 2.0686(14) |
| Co(1)–O(9) | 2.0968(15) | Co(1)–O(1) | 2.1760(13) |
| Co(1)–Co(2) | 3.6374(3) | Co(2)–O(7)#1 | 2.0646(15) |
| Co(2)–O(7) | 2.0647(15) | Co(2)–O(3) | 2.0677(14) |
| Co(2)–O(3)#1 | 2.0678(14) | Co(2)–O(1)#1 | 2.1676(12) |
| Co(2)–O(1) | 2.1676(12) | ||
| Угол | ω, град | Угол | ω, град |
| I | |||
| O(3)#1Co(1)O(3) | 180.00(16) | O(3)#1Co(1)O(1)#1 | 88.79(13) |
| O(3)Co(1)O(1)#1 | 91.21(13) | O(3)#1Co(1)O(1) | 91.21(13) |
| O(3)Co(1)O(1) | 88.79(13) | O(1)#1Co(1)O(1) | 179.999(1) |
| O(3)#1Co(1)O(4) | 90.70(15) | O(3)Co(1)O(4) | 89.30(15) |
| O(1)#1Co(1)O(4) | 89.31(13) | O(1)Co(1)O(4) | 90.69(13) |
| O(3)#1Co(1)O(4)#1 | 89.30(15) | O(3)Co(1)O(4)#1 | 90.70(15) |
| O(1)#1Co(1)O(4)#1 | 90.69(13) | O(1)Co(1)O(4)#1 | 89.31(13) |
| O(4)Co(1)O(4)#1 | 180.000(1) | ||
| II | |||
| O(3)Co(1)O(3)#1 | 180.0 | O(3)Co(1)O(2)#1 | 86.50(4) |
| O(3)#1Co(1)O(2)#1 | 93.50(4) | O(3)Co(1)O(2) | 93.50(4) |
| O(3)#1Co(1)O(2) | 86.50(4) | O(2)#1Co(1)O(2) | 180.0 |
| O(3)Co(1)O(1) | 88.12(4) | O(3)#1Co(1)O(1) | 91.88(4) |
| O(2)#1Co(1)O(1) | 88.78(4) | O(2)Co(1)O(1) | 91.22(4) |
| O(3)Co(1)O(1)#1 | 91.88(4) | O(3)#1Co(1)O(1)#1 | 88.12(4) |
| O(2)#1Co(1)O(1)#1 | 91.22(4) | O(2)Co(1)O(1)#1 | 88.78(4) |
| O(1)Co(1)O(1)#1 | 180.0 | ||
| III | |||
| O(2)Co(1)O(8) | 86.88(7) | O(2)Co(1)O(6) | 94.88(7) |
| O(8)Co(1)O(6) | 177.00(6) | O(2) Co(1)O(4) | 174.89(6) |
| O(8)Co(1)O(4) | 91.46(7) | O(6)Co(1)O(4) | 86.99(7) |
| O(2)Co(1-O(9) | 88.63(6) | O(8)Co(1)O(9) | 94.93(7) |
| O(6)Co(1)O(9) | 87.56(6) | O(4)Co(1)O(9) | 86.69(6) |
| O(2)Co(1)O(1) | 93.74(6) | O(8)Co(1)O(1) | 89.48(6) |
| Угол | ω, град | Угол | ω, град |
| O(6)Co(1)O(1) | 87.98(6) | O(4)Co(1)O(1) | 91.08(5) |
| O(9)Co(1)O(1) | 175.11(6) | O(2)Co(1)Co(2) | 70.01(4) |
| O(8)Co(1)Co(2) | 110.10(5) | O(6)Co(1)Co(2) | 68.36(4) |
| O(4)Co(1)Co(2) | 115.09(4) | O(9)Co(1)Co(2) | 145.44(5) |
| O(1)Co(1)Co(2) | 33.06(3) | O(7)#1Co(2)O(7) | 180.0 |
| O(7)#1Co(2)O(3) | 89.97(7) | O(7)Co(2)O(3) | 90.03(7) |
| O(7)#1Co(2)O(3)#1 | 90.03(7) | O(7)Co(2)O(3)#1 | 89.97(7) |
| O(3)Co(2)O(3)#1 | 179.999(17) | O(7)#1Co(2)O(1)#1 | 88.81(5) |
| O(7)Co(2)(1)#1 | 91.19(5) | O(3)Co(2)O(1)#1 | 83.76(5) |
| O(3)#1Co(2)O(1)#1 | 96.24(5) | O(7)#1Co(2)O(1) | 91.19(5) |
| O(7)Co(2)O(1) | 88.81(5) | O(3)Co(2)O(1) | 96.23(5) |
| O(3)#1Co(2)O(1) | 83.77(5) | O(1)#1Co(2)O(1) | 180.0 |
| O(7)#1Co(2)Co(1) | 72.14(4) | O(7)Co(2)Co(1) | 107.87(4) |
| O(3)Co(2)Co(1) | 69.68(4) | O(3)#1Co(2)Co(1) | 110.32(4) |
| O(1)#1Co(2)Co(1) | 146.80(3) | O(1)Co(2)Co(1) | 33.20(3) |
| Co(2)O(1)Co(1) | 113.74(5) | C(1)O(2)Co(1) | 133.91(13) |
| C(1)O(3)Co(2) | 133.89(13) | C(3)O(4)Co(1) | 127.88(14) |
| C(5)#1O(6)Co(1) | 137.93(14) | C(5)O(7)Co(2) | 131.00(14) |
Таблица 3.
Основные длины связей (Å) и валентные углы (град) в комплексах IV, V, VI при Т = 296(2), 150(2) K*
| Связь | d, Å | Связь | d, Å |
| IV | |||
| Co(1)–O(3) | 2.108(8) | Co(1)–O(3)#1 | 2.108(8) |
| Co(1)–O(4) | 2.151(9) | Co(1)–O(4)#1 | 2.151(9) |
| Co(1)–O(1) | 2.172(7) | Co(1)–O(1)#1 | 2.172(7) |
| V | |||
| Co(1)–N(1)#1 | 2.0800(13) | Co(1)–N(1) | 2.0800(13) |
| Co(1)–N(3) | 2.0893(14) | Co(1)–N(3)#1 | 2.0893(14) |
| Co(1)–O(1)#1 | 2.2327(13) | Co(1)–O(1) | 2.2327(13) |
| VI (Т = 296(2)) | |||
| Co(1)–N(1)#1 | 2.108(4) | Co(1)–N(1) | 2.108(4) |
| Co(1)–O(1) | 2.142(3) | Co(1)–O(1)#1 | 2.142(3) |
| Co(1)–N(3) | 2.155(4) | Co(1)–N(3)#1 | 2.155(4) |
| VI (150(2) K) | |||
| Co(1)–N(3) | 2.1043(16) | Co(1)–N(3)#1 | 2.1043(16) |
| Co(1)–N(1)#1 | 2.1185(16) | Co(1)–N(1) | 2.1185(16) |
| Co(1)–O(1)#1 | 2.1979(14) | Co(1)–O(1) | 2.1979(14) |
| Угол | ω, град | Угол | ω, град |
| IV | |||
| O(3)Co(1)O(3)#1 | 180.0 | O(3)Co(1)O(4) | 91.0(4) |
| O(3)#1Co(1)O(4) | 89.0(4) | O(3)Co(1)O(4)#1 | 89.0(4) |
| O(3)#1Co(1)O(4)#1 | 91.0(4) | O(4)Co(1)O(4)#1 | 180.000(1) |
| O(3)Co(1)O(1) | 85.4(3) | O(3)#1Co(1)O(1) | 94.6(3) |
| O(4)Co(1)O(1) | 89.2(3) | O(4)#1Co(1)O(1) | 90.8(3) |
| O(3)Co(1)O(1)#1 | 94.6(3) | O(3)#1Co(1)O(1)#1 | 85.4(3) |
| O(4)Co(1)O(1)#1 | 90.8(3) | O(4)#1Co(1)O(1)#1 | 89.2(3) |
| O(1)Co(1)O(1)#1 | 180.0 | C(1)O(1) Co(1) | 124.6(6) |
| V | |||
| N(1)#1Co(1)N(1) | 179.999(2) | N(1)#1Co(1)N(3) | 89.92(5) |
| N(1)Co(1)N(3) | 90.08(5) | N(1)#1Co(1)N(3)#1 | 90.08(5) |
| N(1)Co(1)N(3)#1 | 89.92(5) | N(3)Co(1)N(3)#1 | 180.0 |
| N(1)#1Co(1)O(1)#1 | 88.17(5) | N(1)Co(1)O(1)#1 | 91.83(5) |
| N(3)Co(1)O(1)#1 | 92.54(5) | N(3)#1Co(1)O(1)#1 | 87.46(5) |
| N(1)#1Co(1)O(1) | 91.83(5) | N(1)Co(1)O(1) | 88.17(5) |
| N(3)Co(1)O(1) | 87.46(5) | N(3)#1Co(1)O(1) | 92.54(5) |
| O(1)#1Co(1)O(1) | 180.0 | C(7)O(1)Co(1) | 141.21(13) |
| C(1)N(1)Co(1) | 134.42(12) | N(2)N(1)Co(1) | 120.69(10) |
| C(5)N(3)Co(1) | 129.86(12) | N(4)N(3)Co(1) | 125.03(12) |
| VI (Т = 296(2)) | |||
| N(1)#1Co(1)N(1) | 180.0 | N(1)#1Co(1)O(1) | 88.50(15) |
| N(1)Co(1)O(1) | 91.50(15) | N(1)#1Co(1)O(1)#1 | 91.50(15) |
| Угол | ω, град | Угол | ω, град |
| N(1)Co(1)O(1)#1 | 88.50(15) | O(1)Co(1)O(1)#1 | 180.0 |
| N(1)#1Co(1)N(3) | 88.69(14) | N(1)Co(1)N(3) | 91.31(14) |
| O(1)Co(1)N(3) | 96.35(14) | O(1)#1Co(1)N(3) | 83.65(14) |
| N(1)#1Co(1)N(3)#1 | 91.31(14) | N(1)Co(1)N(3)#1 | 88.69(14) |
| O(1)Co(1)N(3)#1 | 83.65(14) | O(1)#1Co(1)N(3)#1 | 96.35(14) |
| N(3)Co(1)N(3)#1 | 180.0 | C(1)O(1)Co(1) | 143.6(3) |
| C(3)N(1)N(2) | 104.5(4) | C(3)N(1)Co(1) | 132.0(3) |
| N(2)N(1)Co(1) | 123.5(3) | C(9)N(3)Co(1) | 130.3(3) |
| N(4)N(3)Co(1) | 123.4(3) | ||
| VI (150(2) K) | |||
| N(3)Co(1)N(3)#1 | 180.0 | N(3)Co(1)N(1)#1 | 89.18(6) |
| N(3)#1Co(1)N(1)#1 | 90.82(6) | N(3)Co(1)N(1) | 90.82(6) |
| N(3)#1Co(1)N(1) | 89.18(6) | N(1)#1Co(1)N(1) | 180.0 |
| N(3)Co(1)O(1)#1 | 88.93(6) | N(3)#1Co(1)O(1)#1 | 91.07(6) |
| N(1)#1Co(1)O(1)#1 | 94.29(6) | N(1)Co(1)O(1)#1 | 85.71(6) |
| N(3)Co(1)O(1) | 91.07(6) | N(3)#1Co(1)O(1) | 88.93(6) |
| N(1)#1Co(1)O(1) | 85.71(6) | N(1)Co(1)O(1) | 94.29(6) |
| O(1)#1Co(1)O(1) | 180.0 | C(7)O(1)Co(1) | 140.35(13) |
| C(3)N(1)Co(1) | 128.81(13) | N(2)N(1)Co(1) | 123.49(12) |
| C(4)N(3)Co(1) | 129.69(14) | N(4)N(3)Co(1) | 124.89(13) |
Полные таблицы координат атомов, длин связей и валентных углов комплексов I–VI депонированы в Кембриджском банке структурных данных (CCDC № 1985667 (I), 1985666 (II), 1985671 (III), 1985670 (IV), 1985665 (V), 1985669 (VI) при Т = 296(2) K, 1985668 (VI) при Т = 150(2) K; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
РЕЗУЛЬТЫ И ИХ ОБСУЖДЕНИЕ
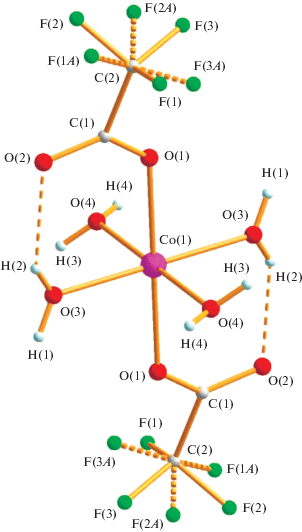
Обнаружено, что реакция водного ацетата кобальта с трифторуксусной кислотой (1 : 2) в метаноле при комнатной температуре приводит к обмену анионов с образованием моноядерного комплекса I (выход 87%). По данным РСА (298 К), в I (табл. 1, 2; рис. 1) атом металла, находящийся в частной позиции 0, 0.5, 0.5, имеет октаэдрическое окружение из шести атомов кислорода, два из которых принадлежат трифторацетат-анионам (Co–O(1) 2.116(3) Å), остальные – четырем координированным молекулам воды (Со–О(3) 2.046(3), Со–О(4) 2.128(3) Å). Существенное различие расстояний M–O, вероятно, определяется сложной системой водородных связей (ВС) в комплексе. Так, атомы кислорода анионов, занимающих аксиальные позиции, расположены в анти-положениях и образуют ВС не только внутримолекулярные (ВМ) с координированной молекулой воды (О(3)…О(2) 2.686(3) Å), но и межмолекулярные (ММ) с атомами кислорода O(4) (О(3)… О(4) 2.898 Å). В то же время атомы водорода координированной воды О(4) образуют дополнительно ММ связи c атомом кислорода О(2) аниона молекулы соседнего слоя (O(4)…O(2) 2.860 Å) и с атомом кислорода О(1) близлежащей молекулы комплекса, располагающихся в кристалле (O(4)…O(1) 2.849 Å), которой также принадлежит и атом кислорода О(3) (рис. 2). В комплексе атомы фтора CF3-аниона разупорядочены по двум позициям с кратностью 0.7 : 0.3.
При проведении структурного эксперимента при низкой температуре (T = 103 К [11] и 150 К [20]) неожиданно оказалось, что кристалл из моноклинной сингонии (P21/n) переходит в триклинную (P$\bar {1}$: a = 8.136(0), b = 9.033(0), c = 9.270(0) Å, α = = 75.14(0)°, β = 64.57(0)°, γ = 71.43(0)° (103 К), R = = 3.08%; a = 8.193(1), b = 9.105(2), c = 9.383(2) Å, α = 75.014(1)°, β = 64.14(1)°, γ = 71.27(1)° (150 К), R = 13.73%). Такой переход сопровождается существенным изменением строения молекулы. Так, атомы фтора карбоксилатов OOCF3 упорядочены, а атомы кислородов экваториально-расположенных анионов оказываются в син-позициях в отличие от I и связаны с атомами водорода лишь одной координированной молекулы воды (O(5)…О(2) 2.748, O(5)…О(4) 2.712 Å) (рис. 3).
Рис. 3.
Строение комплекса I при 100 К (на основании результатов, полученных авторами, совпадающих с данными [11, 20]). Некоторые длины связей и величины валентных углов: Co(1)–O(5) 2.069(7), Co(1)–O(7) 2.073(7), Co(1)–O(8) 2.087(7), Co(1)–O(6) 2.108(7), Co(1)–O(3) 2.115(7), Co(1)–O(1) 2.123(7) Å и O(5)Co(1)O(7) 176.8(3)°, O(5)Co(1)O(8) 88.5(3)°, O(5)Co(1)O(6) 94.0(3)°, O(5)Co(1)O(3) 92.4(3)°, O(5)Co(1)O(1) 92.2(3)°.
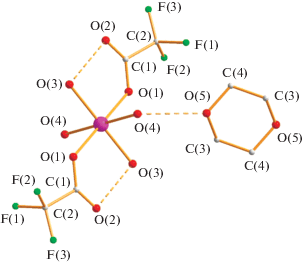
Аналогичная реакция Co(OOCMe)2 ∙ 4H2O с трифторуксусной кислотой при кипячении в смеси растворителей метанол–бензол (2–3% H2O)–диоксан приводит к образованию красных монокристалов моноядерного комплекса II (выход 56%). По данным РСА (табл. 1, 2; рис. 4, 5), в центросимметричной молекуле II атом металла имеет октаэдрическое окружение шестью координированными молекулами воды (Co–O(1) 2.1000(9), Co–O(2) 2.1001(10), Co–O(3) 2.0674(10) Å). Различия в длинах связей M–OH2 связаны с возникновением ММ водородных связей атомов кислородов внешнесферных трифторацетат анионов и сольватных молекул диоксана, которые формируют кристалл (О(1)…О(5) 2.670, О(1)…О(7) 2.733, О(2)…О(1) 2.847, О(2)…О(6) 2.706, О(3)…О(5) 2.674, О(3)…О(6) 2.721 Å).
Рис. 4.
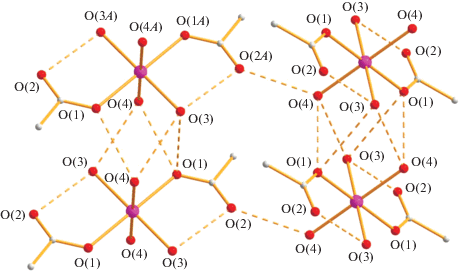
Водородные связи в кристалле комплекса I при 100 К (O(1)…O(8) 2.776, O(4)…O(8) 2.678, O(3)…O(6) 2.735, O(6)…O(7) 2.783, O(7)…O(8) 2.760).
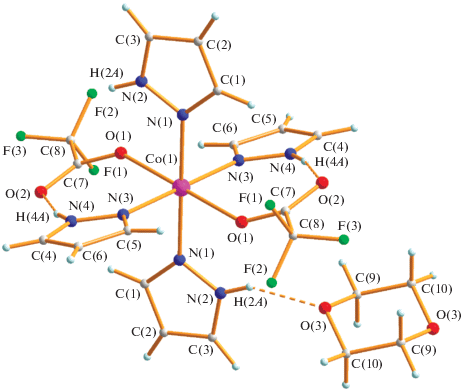
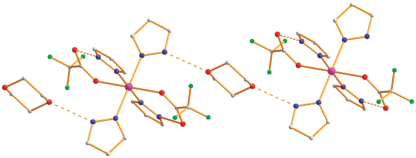
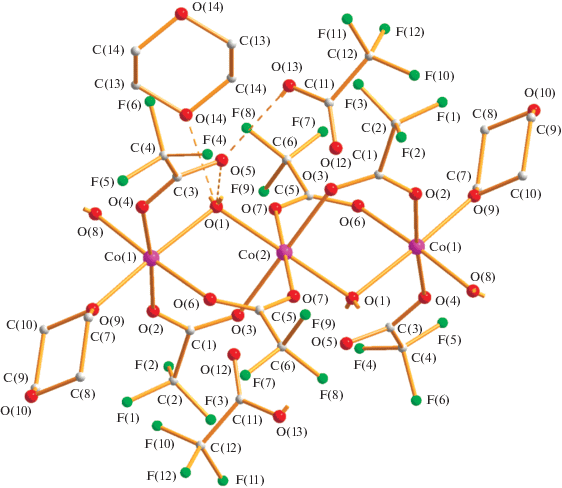
При замене растворителя на диоксан в реакции Co(OOСMe)2 ∙ 4H2O и HOOCF3 (1 : 2, кипячение 30 мин) образуется красный трехъядерный комплекс III (выход 69%). Согласно данным РСА (табл. 1, 2; рис. 6) в центросимметричной молекуле комплекса III три атома кобальта находятся на несвязывающих расстояниях металл–металл (3.6374(3) Å) и соединены попарно двумя мостиками µ-OOCF3 (Co(1)–O(2) 2.040(1), Co(1)–O(6) 2.052(1) Å, Co(2)–O(3) 2.068(1), Co(2)–O(7) 2.065(1) Å) и мостиковой молекулой воды (Co(1)–O(1) 2.176(1), Co(2)–O(1) 2.167(1) Å). Каждый периферийный атом кобальта имеет концевой анион (Со(2)–О(4) 2.069(1) Å) и координирован молекулой диоксана (Со(2)–О(9) 2.097(1) Å) и молекулой воды (Co(1)–O(8) 2.041(2) Å). Две сольватные молекулы кислоты образуют ВС с атомом кислорода О(5) (О(13)…О(5) 2.590 Å) концевого аниона, который, в свою очередь, связан с атомом водорода мостиковой молекулы воды (О(5)…О(1) 2.694 Å). Второй атом водорода этой молекулы соединен с атомом кислорода сольватного диоксана (О(1)…О(14) 2.681 Å). Координированная молекула воды имеет ВС с атомом кислорода сольватной молекулы кислоты (О(8)…О(12) 2.743 Å) и атомом кислорода диоксана, принадлежащего близлежащей молекуле комплекса (О(8)…О(10А) 2.688 Å), которая располагается под углом 94.6°. В итоге в кристаллической ячейке комплексы образуют волнообразные 2D-полимеры и кристалл формируется через ВС сольватных молекул диоксана с мостиковой молекулой воды. Отметим, что парамагнитный трехъядерный комплекс похожего строения [Co3(µ-OOCCF3)4(µ-H2O)2(OOCCF3)2-(H2O)2(C4H8O2)] ∙ 2C4H8O2 был синтезирован при кипячении Co(OOCCF3)2(H2O)4 (получали растворением СоО в горячей НООСF3) с трифторуксусной кислотой и ее ангидридом (10 : 1) в диоксане и охарактеризован данными РСА при комнатной температуре (Co…Co 3.632(3), Co-µ-Ow 2.143(3), 2.160(3), Co-µ-O(OOCF3) 2.053(3)–2.072(3)) [21].
Рис. 6.
Молекулярная структура комплекса III (разупорядоченные с кратностью 0.8 : 0.2 атомы фтора F(4A)–F(9A) не показаны).
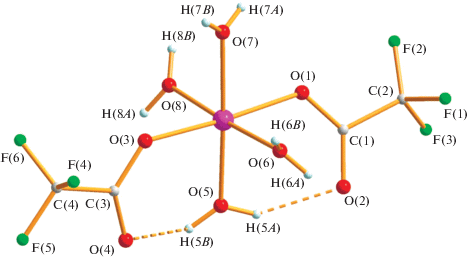
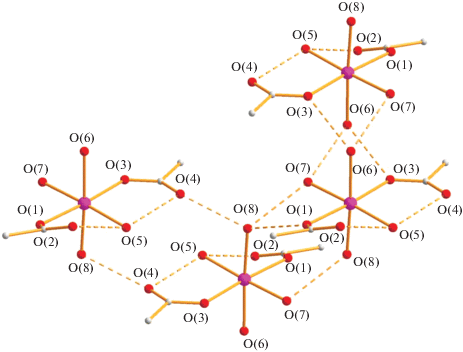
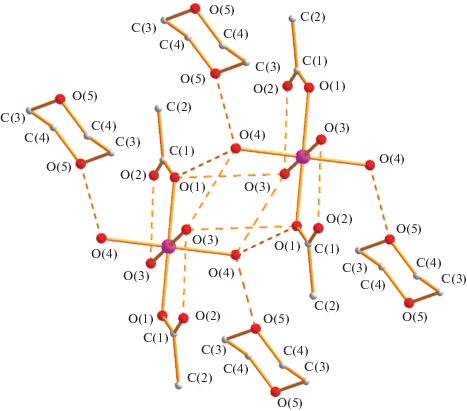
Растворение III в смеси изопропанол–диоксан с последующим нагреванием до 60°С в течение 15 мин приводит к образованию красных монокристаллов комплекса IV (выход 96%). По данным РСА (табл. 1, 3; рис. 7), в IV при комнатной температуре атом кобальта(II) находится в центре симметрии (позиция 0, 0, 0) и имеет октаэдрическое окружение четырех атомов кислорода воды (Co–O(3) 2.108(8), Co–O(4) 2.151(9) Å) и двух атомов кислорода анионов (Co–O(1) 2.172(7) Å), располагающихся в антиконформации. В комплексе все расстояния металл–кислород заметно увеличены по сравнению с обнаруженными в I–III, что, по-видимому, также связано с возникновением в кристалле сложной сетки ВМ, ММ водородных связей, а также присутствием сольватной молекулы диоксана (O(4)…O(5) 2.792 Å), образующими в совокупности 3D-полимер (рис. 8).
Рис. 8.
Водородные связи в кристалле комплекса IV (O(3)…O(2) 2.790, O(3)…O(4) 2.961, O(3)…O(1) 2.904; O(4)…O(1) 2.843 Å).
Растворение комплекса III в присутствии пиразола в кипящем хлористом метилене и последующая кристаллизация из смеси CH2Cl2–гексан при 5°С приводит к образованию оранжевых монокристаллов комплекса V (выход 86%). В октаэдрическом комплексе V (атом металла в частной позиции) Со(II) связан с четырьмя пиридиновыми атомами азота гетероциклов (Co–N(1) 2.0800(13), Co–N(3) 2.0893(14) Å) и двумя атомами кислорода двух трифторацетат анионов (Co–O(1) 2.2327(13) Å) (табл. 1, 3; рис. 9). Отметим, что длины связей металл–кислород заметно увеличены по сравнению с обнаруженными в исследованных ранее комплексах, что, по-видимому, связано со стерическими контактами пиразолов и трифторметильных заместителей в анионах.
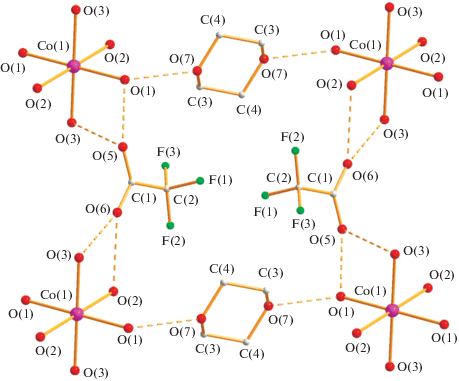
Атомы водорода двух пиррольных фрагментов пиразола образуют короткие ВМ связи с атомами кислорода анионов (N(4)…O(2) 2.749 Å), а два других NH-фрагмента – с атомами кислорода сольватных молекул диоксана (N(2)…O(3) 2.805 Å), формируя 1D-цепочки (рис. 10).
Такой же октаэдрический комплекс VI (выход 92%) образуется при взаимодействии комплекса I c Hpz в кипящем хлористом метилене с замещением всех молекул воды на пиразол. По данным РСА оранжевых монокристаллов VI (табл. 1, 3; рис. 11) атом металла связан с четырьмя атомами азота координированных пиразолов (Co–N(1) 2.108(4), Co–N(3) 2.155(4) Å) и двумя атомами кислорода анионов (Co–O(1) 2.142(3) Å). Небольшие различия в расстояниях металл–азот, вероятно, определяются возникновением различных ВС NH-фрагмента с атомом кислорода аниона, причем для атома N(4) они внутримолекулярные (N(4)…O(2) 2.739 Å), для N(2) межмолекулярные (N(2)…O(2) 2.805 Å), формирующие кристаллическую ячейку (рис. 12). Координированные молекулы пиразола располагаются под углом 97.8° по отношению друг к другу.
Рис. 11.
Строение комплекса VI при комнатной температуре (атомы фтора разупорядочены с кратностью 0.6 : 0.4).
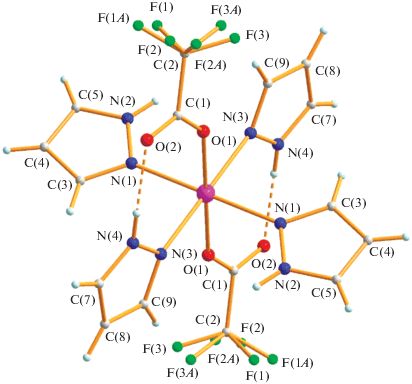
Рис. 12.
Расположение молекул комплекса VI в кристаллической ячейке при комнатной температуре (Co – фиолетовый, O – красный, N – синий).
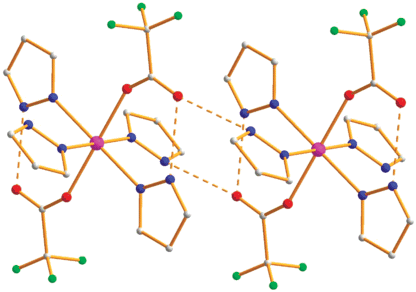
Отметим, что при поведении структурного эксперимента для VI при низкой температуре разупорядоченности фторов снимаются, что приводит к переходу от моноклинной ячейки к триклинной (табл. 1), но, в отличие от комплекса I, геометрия VI и характер ММ, ВМ водородных связей существенно не меняется (Co–O(1) 2.1979(14), Co–N(1) 2.1043(16), Co–N(3) 2.1185(16), O(2)…N(4) 2.731, O(2)…N(2) 2.893, угол HРz/HРz 96.6°).
Таким образом, в результате проведенных исследований обнаружено, что в присутствии в реакционном растворе воды или пиразола донорной способности бидентатного 1,4-диоксана недостаточно для непосредственной координации с атомом металла, однако он играет существенную роль в формировании кристаллической ячейки, образуя за счет водородных связей полимеры различной размерности. Как известно, 3,5-диметилпиразол характеризуется пониженной кислотностью NH-протона и повышенной донорной способностью атома азота пиридинового типа по сравнению с незамещенным HPz. Поэтому в случае анионов сильной трифторуксусной кислоты атом металла связывает четыре молекулы пиразола. В то же время в реакциях пивалата и бензоата Co(II) 3,5-диметилпиразол депротонируется с образованием биядерного пиразолат-мостикового [Co2(µ-Dmpz)2-(OOCtBu)2(HDmpz)2] [22, 23] и моноядерного [(HDmpz)2Co(OOCPh)2] [24] комплексов. Необходимо отметить также, что при переходе от комнатной к низкой температуре в трифторацетатах происходит переход, сопровождающийся не только изменением сетки водородных связей в кристаллической упаковке комплексов и разупорядоченностью заместителя CF3 в карбоксилат-анионе, но и, как было обнаружено в комплексе I, значительным изменением его геометрии.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Cotton F.A., Wilkinson G., Murillo C.A., Bochmann M. Advanced Inorganic Chemistry. John Wiley & Sons, Inc., 1999. P. 493.
Mehrotra R.C., Bohra R. Metal Carboxylates. London: Acad. Press, 1983. P. 396.
Becht M., Gerfin T., Dahmen K.-H. // Helv. Chim. Acta. 1994. V. 77. P. 1288. https://doi.org/10.1002/hlca.19940770511
Pratt R.C., Mirica L.M., Stack T.D.P. // Inorg. Chem. 2004. V. 43. P. 8030. https://doi.org/10.1021/ic048904z
Tomkowicz Z., Ostrovsky S., Foro S. et al. // Inorg. Chem. 2012. V. 51. P. 6046. https://doi.org/10.1021/ic202529p
Mikhalitsyna E.A., Tyurin V.S., Nefedov S.E. et al. // Eur. J. Inorg. Chem. 2012. V. 36. P. 5979. https://doi.org/10.1002/ejic.201200868
Hiroto S., Furukawa K., Shinokubo H., Osuka A. // J. Am. Chem. Soc. 2006. V. 128. P. 12380. https://doi.org/10.1021/ja062654z
Zhang You-Sheng, Enright Gary D., Breeze St. R., Wang S. // New J. Chem. 1999. V. 23. P. 625. https://doi.org/10.1039/A900562E
Malik Puthan P.A., Song Yu-Mei, Xiong Ren-Gen et al. // Eur. J. Inorg. Chem. 2010. P. 3856. https://doi.org/10.1002/ejic.201000375
Croitor L., Coropceanu E.B., Chisca D. et al. // Cryst. Growth Des. 2014. V. 14. P. 3015 https://doi.org/10.1021/cg500646r
Guntlin Ch.P., Zund T., Kravchyk K.V. et al. // J. Mater. Chem. A. 2017. V. 5. P. 7383. https://doi.org/10.1039/c7ta00862g
Lippard S.J., Berg J.M. Principles of Bioinorganic Chemistry. Mill Valley (CA): Univ. Science Books, 1994.
Solomon E.I., Sundaram U.M., Machonkin T.E. // Chem. Rev. 1996. V. 96. P. 2563. https://doi.org/10.1021/cr950046o
Holm R.H., Kennepohl P., Solomon E.I. // Chem. Rev. 1996. V. 96. P. 2239. https://doi.org/0.1021/cr9500390
Eady R.R. // Coord. Chem. Rev. 2003. P. 237. https://doi.org/10.1016/S0010-8545(02)00248-5
SMART (control) and SAINT (integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
SAINT. Area-Detector Integration Sofware. Madison (WI, USA). Bruker AXS Inc., 2012.
Sheldrick G.M. SADABS. Program for Scaling and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 1997.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Morozov I.V., Karpova E.V., Glazunova T.Yu. et al. // Russ. J. Coord. Chem. 2016. V. 42. P. 647. https://doi.org/10.1134/S107032841610002X
Calvo-Perez V., Ostrovsky S., Vega A. et al. // Inorg. Chem. 2006. 45. P. 644. https://doi.org/1021/ic051361o
Denisova T.O., Dobrokhotova Zh.B., Nefedov S.E., Ikorskii V.N. // Russ. J. Inorg. Chem. 2006. V. 51. № 9. P. 1363. https://doi.org/10.1134/S0036023606090051
Nefedov S.E. // Russ. J. Inorg. Chem. 2006. V. 51. Su-ppl. 1. P. S49. https://doi.org/10.1134/S0036023606130031
Anan’ev I.V., Yakovleva M.A., Perova E.V., Nefedov S.E. // Russ. J. Inorg. Chem. 2010. V. 55. № 7. P. 1057. https://doi.org/10.1134/S0036023610070119
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия