Координационная химия, 2021, T. 47, № 1, стр. 21-29
Синтез и строение комплексных соединений никеля(II) на основе дианилинглиоксима. Стимулирующие протеолитические свойства [Ni(DAnH)2] · 0.25H2O
Э. Б. Коропчану 1, 2, *, Д. Уреке 1, 2, А. П. Рижа 1, 2, А. А. Чилочи 3, С. Ф. Клапко 3, Е. Г. Дворнина 3, И. И. Булхак 1, М. Коку 1, П. Н. Боурош 1, 4
1 Институт химии
Кишинев, Республикa Молдова
2 Тираспольский государственный университет
Кишинев, Республикa Молдова
3 Институт микробиологии и биотехнологии
Кишинев, Республикa Молдова
4 Институт прикладной физики
Кишинев, Республикa Молдова
* E-mail: coropceanu.eduard@ust.md
Поступила в редакцию 18.05.2020
После доработки 02.07.2020
Принята к публикации 29.07.2020
Аннотация
При взаимодействии дианилинглиоксима (DAnH2) с хлоридом никеля(II) в разных условиях получены два новых бис- и трис-сольватоморфа с формулами [Ni(DAnH)2] · 0.25H2O (I) и [Ni(DAnH2)3]Cl2 · · 6CH3OH (II). Молекулярное строение комплексов I и II установлено методом РСА (CIF files CCDC № 1998570 и 1998571 соответственно). Комплексное соединение I в оптимально подобранных концентрациях обеспечивает стимулирующее действие на синтез протеаз штаммa микромицетов биотехнологического значения Fusarium gibbosum CNMN FD 12, увеличивая активность на 83.0% кислых протеаз и на 68.2% нейтральных протеаз по сравнению с контролем, и его можно рассматривать как потенциальный биостимулятор ферментообразования у некоторых штаммов мицелиальных грибов.
Диоксимы представляют собой удобные хелатные лиганды для синтеза устойчивых координационных соединений (КC) с широким спектром практического применения: в аналитической и биологической химии, медицине, окраске хлопчатобумажных тканей и т.д. [1]. Помимо того, что диоксиматы кобальта могут служить моделями витамина В12 [2], этот класс соединений продолжает вызывать интерес в качестве веществ, способных влиять на физиологические процессы микромицет, водорослей и сельскохозяйственных растений [3–10]. При этом клатратохелатные трис-диоксимины проявляют свойства, которые могут позволить вовлечь их в исследовании в области раковой терапии, а реакция самосборки клатратохелатов и их взаимодействие с нуклеиновыми кислотами может быть широко использовано в имуннологии и молекулярной биологии [11–13]. Би- и полиядерные соединения на основе диоксимов могут служить началом для получения пористых и люминесцентных материалов [14–16]. Интерес представляет синтез КС этого класса от моноядерных до координационных полимеров [17–24].
Получение виц-диоксимов открывает новые возможности для повышения разнообразия комплексов с новым составом, структурой и свойствами, которые могут зависеть от природы “крыльев” этих хелатных лигандов в моно- и полиядерных соединениях [25, 26]. Так как комплексы Co(III), содержащие сульфаниламид, проявляют свойства биостимуляторов процессов ферментообразования [27], представляют интерес присоединение этого фрагмента к молекуле диоксима с целью получения новых лигандов и выявление степени влияния КС переходных металлов с последними на биологические процессы. Кроме того, более объемные диоксиматы могут создать благоприятные условия для образования пористых материалов.
Дианилинглиоксим (DAnH2) получен поэтапно, в результате трех известных реакций (глиоксим–дихлорглиоксим–DAnH2), а его взаимодействие с хлоридом никеля приводит к образованию новых сольватоморфов известных бис- и трис-лигандных комплексов [Ni(DAnH)2] и [Ni(DAnH2)3]Cl2 [28] c формулами [Ni(DAnH)2] ⋅ ⋅ 0.25H2O (I) и [Ni(DAnH2)3]Cl2 ⋅ 6CH3OH (II), состав и структура которых определены методами элементного анализа, ИК-, ЯМР-спектроскопии и РСА. Для соединения I исследовано стимулирующее действие на синтез протеаз штаммa микромицетов биотехнологического значения Fusarium gibbosum CNMN FD 12. Ранее мы получили кристаллы и определили структуру DAnH2 в виде гидратных солей [DAnH3](ClO4) ⋅ H2O, [DAnH3](ClO4) ⋅ 1.25H2O и трех биядерных соединений цинка(II) и марганца(II) с этим лигандом [29].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза использовали коммерческие химические соединения, в том числе растворители, без предварительной очистки. Синтезы проводили согласно методикам: для глиоксима [29], дих-лорглиоксима [30], DAnH2 [31].
Синтез комплекса I. Навеску DAnH2 (0.27 г, 1 ммоль) растворяли в 10 мл метанола и нагревали на водянной бане при 50°C в течение 15 мин. К полученному раствору добавляли 0.12 г (0.5 ммоль) NiCl2 · 6H2O в 10 мл метанола. Через 5 мин к раствору добавляли 1–2 капли аммиачного раствора. Образованный коричневый осадок фильтровали, промывали холодным метанолом, затем эфиром. Выход ~56%. Кристаллы пригодные для РСА получали перекристаллизацией комплекса из метанола. Вещество растворимо в ДМФ, но слабо растворимо в спиртах и ДМСО.
| Найдено, %: | C 55.64; | H 4.36; | N 18.46; | Ni 9.61. |
| Для C28H26.5N8O4.25Ni | ||||
| вычислено, %: | C 55.88; | H 4.44; | N 18.62; | Ni 9.75. |
Синтез комплекса II. К теплому раствору, содержащему 0.27 г (1 ммоль) DAnH2, растворенного в 20 мл метанола, добавляли 0.15 г (0.5 ммоль) NiCl2 · 6H2O в 10 мл метанола, после чего подкисляли 1−2 каплями HCl (1 : 1) для сохранения кислой среды раствора (pH ~ 2). Через 2–3 сут в растворе образовывались кристаллы в форме призм зеленного цвета. Выход ~34%. Вещество растворимо в спиртах, ДМФ и ДМСО.
| Найдено, %: | C 50.77; | H 5.64; | N 14.73; | Ni 5.02. |
| Для C48H66N12O12Cl2Ni | ||||
| вычислено, %: | C 50.90; | H 5.87; | N 14.84; | Ni 5.18. |
Состав и строение соединений I и II установили на основе элементного анализа, ИК-, УФ-, ЯМР-спектроскопии, а для их монокристаллов провели РСА. ИК-спектры снимали на FT-IR Perkin-Elmer Spectrum 100 в вазелиновом масле в области 4000–400 см–1 и ATР в области 4000–650 см–1, УФ-спектры – на спектрофотометре Perkin-Elmer Lambda 25, спектры ЯМР 1H, 13C – на спектрометрe 400 Brucker с рабочей частотой 400.13 MHz для 1H и 100.61 MHz для 13C в растворах ДМСО-d6, используя внутренний стандард TMS. Сигналы выражены в м.д.
РСА. Структурные данные получены при комнатной температуре на дифрактометрe Xcalibur Е, излучение MoKα (λ = 0.71073 Å), графитовый монохроматор и ω-сканирование. Параметры элементарных ячеек уточнены по всему массиву экспериментальных данных. Кристаллические структуры решены прямыми методами и уточнены полноматричным МНК по $F_{{hkl}}^{{\text{2}}}$ в анизотропном приближении для неводородных атомов (SHELX-97) [32]. Позиции атомов водорода частично рассчитаны геометрически, частично определены их Фурье синтезов и уточнены изотропно в модели “жесткого тела”. Кристаллографические данные и характеристики эксперимента для I и II приведены в табл. 1, межатомные расстояния и валентные углы в координационных полиэдрах – в табл. 2, геометрические параметры водородных связей – в табл. 3.
Таблица 1.
Кристаллографические данные и характеристики эксперимента для I и II
| Параметры | Значение | |
|---|---|---|
| I | II | |
| M | 601.78 | 1132.74 |
| Сингония | Mоноклинная | Тригональная |
| Пр. гр. | P21/c | R3c |
| Параметры элементарной ячейки | ||
| a, Å | 13.9314(14) | 14.5230(5) |
| b, Å | 13.6263(11) | 14.5230(5) |
| c, Å | 14.7047(13) | 48.521(2) |
| α, град | 90 | 90 |
| β, град | 105.468(9) | 90 |
| γ, град | 90 | 120 |
| V, Å3 | 2690.3(4) | 8862.9(6) |
| Z | 4 | 6 |
| ρ(выч.), г/см3 | 1.486 | 1.273 |
| μ, мм–1 | 0.774 | 0.484 |
| F(000) | 1250 | 3576 |
| Размеры кристала, мм | 0.18 × 0.12 × 0.04 | 0.30 × 0.30 × 0.15 |
| Область θ, град | 2.87–25.50 | 3.08–25.49 |
| Интервалы индексов отражений | –16 ≤ h ≤ 15, –16 ≤ k ≤ 8, –17 ≤ l ≤ 17 | –16 ≤ h ≤ 17, –15 ≤ k ≤ 13, –24 ≤ l ≤ 22 |
| Число измеренных/независимых рефлексов (Rint) | 8423/4979 (0.0526) | 11279/1848 (0.0302) |
| Число рефлексов с I > 2σ(I) | 1986 | 1292 |
| Заполнение, % | 99.3 (θ = 25.50°) | 99.8 (θ = 25.49°) |
| Число уточняемых параметров | 374 | 147 |
| GOOF | 1.006 | 1.007 |
| R1, wR2 (I > 2σ(I)) | 0.0424, 0.0859 | 0.0290, 0.0722 |
| R факторы (по всему масиву) | R1 = 0.1339, wR2 = 0.1168 | R1 = 0.0468, wR2 = 0.0748 |
| Δρmax, Δρmin, e Å–3 | 0.287, –0.227 | 0.219, –0.198 |
Таблица 2.
Межатомные расстояния (d) и валентные углы (ω) в координационных полиэдрах соединений I и II*
| Связь | d, Å | |
|---|---|---|
| I | II | |
| Ni(1)–N(1) | 1.851(4) | 2.075(1) |
| Ni(1)–N(2) | 1.847(4) | |
| Ni(1)–N(3) | 1.863(3) | |
| Ni(1)–N(4) | 1.875(4) | |
| Угол | ω, град | |
| N(1)NiN(2)/N(1)#1 | 82.9(2) | 166.32(7) |
| N(1)NiN(3)/N(1)#2 | 177.9(2) | 76.73(7) |
| N(1)NiN(4)/N(1)#3 | 97.4(2) | 94.08(5) |
| N(2)/N(1)NiN(3)/N(1)#4 | 96.5(2) | 96.64(7) |
| N(2)/N(1)NiN(4)/N(1)#5 | 175.5(2) | 94.08(5) |
| N(3)NiN(4) | 83.1(2) | |
Таблица 3.
Геометрические параметры внутри- и межмолекулярых водородных связей в структуре I и II
| Контакт D–H⋅⋅⋅A | Расстояние, Å | Угол DHA, град | Координаты атомов А | ||
|---|---|---|---|---|---|
| D–H | H···A | D···A | |||
| I | |||||
| O(1)–H(1)···O(4) | 0.82 | 1.70 | 2.492(4) | 161 | x, y, z |
| O(3)–H(2)···O(2) | 0.82 | 1.71 | 2.486(4) | 158 | x, y, z |
| N(11)–H(1)···O(3) | 0.85 | 2.37 | 3.062(5) | 139 | x, –y + 1/2, z – 1/2 |
| N(21)–H(1)···O(1w) | 0.92 | 2.20 | 2.91(1) | 133 | –x + 2, –y + 1, –z |
| N(31)–H(1)···O(1) | 0.88 | 2.26 | 3.081(5) | 155 | x, –y + 1/2, z + 1/2 |
| N(41)–H(1)···O(4) | 0.87 | 2.19 | 2.944(5) | 145 | –x + 1, –y, –z |
| O(1w)–H(1)···O(2) | 0.85 | 2.36 | 3.21(1) | 179 | –x + 2, –y + 1, –z |
| O(1w)–H(2)···O(2) | 0.86 | 1.95 | 2.77(1) | 158 | x, y, z |
| II | |||||
| O(1)–H(1)···Cl(1) | 0.76 | 2.50 | 3.223(2) | 160 | x, y, z |
| O(2)–H(1)···Cl(1) | 0.93 | 2.33 | 3.232(2) | 164 | –x + 2, –y + 1, –z |
| N(2)–H(1)···O(2) | 0.79 | 2.11 | 2.853(2) | 158 | x, y, z |
Полная структурная информация для I и II депонирована в Кембриджском банке структурных данных (КБСД) (№ 1998570 и 1998571 соответственно; www.ccdc.cam.ac.uk/data_request/cif).
Биологические методы. Биологические свойства синтезируемых КС оценивали по степени их воздействия на процесс ферментообразования микромицетов Fusarium gibbosum CNMN FD 12 – активными продуцентами протеолитических ферментов [33]. Штаммы хранятся в Национальной Коллекции Непатогенных Микроорганизмов Республики Молдова при Институте микробиологии и биотехнологии.
Культивирование продуцентов осуществляли глубинным способом в конических колбах объемом 0.5 л с 0.1 л питательной среды ранее подобранного оптимального состава [34, 35] при 28–30°С, в условиях постоянного перемешивания на качалке со скоростью вращения 200 об./мин. Продолжительность культивирования для штамма Fusarium gibbosum CNMN FD 12 – 6 сут. Комплексные соединения вносили в стерильную питательную среду в растворенном виде в концентрациях 5, 10, 15 мг/л одновременно с посевным материалом. Контролем служила среда без добавления КС. В качестве посевного материала использовали водную суспензию спор 12–15-и сут культуры, выращенной на скошенной сусло-агаровой среде, в количестве 10% от инокулированного объема с плотностью спор 1–3 × 106 в мл.
Активность кислых (pH 3.6) и нейтральных (pH 7.4) протеаз определяли по методу Вильштеттера, основаному на определении количества свободных карбоксильных групп, образовавшихся при гидролизе 5%-ного раствора желатина. За единицу протеолитической активности принимали количество фермента, которое образует 1 мг аминного азота за 1 ч в стандартных условиях опыта [36].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При взаимодействии хлорида никеля(II) с дианилинглиоксимом в различных условиях получены бис-диоксимат и трис-диоксимин никеля(II). При этом для образования трис-диоксиминa необходим pH ~ 2, а бис-диоксимата – pH ~ 5–6; cоздание в растворе менее кислой или щелочной среды осуществлялось добавлением 1–2 капель аммиачного раствора, а кислой – соляной кислоты.
Для комплексов [Ni(DAnH)2] · 0.25H2O (I), [Ni(DAnH2)3]Cl2 · 6CH3OH (II) была определена кристаллическая структура. В результате установлено, что (хотя эти КС известны в литературе [28]) изменение условий синтеза привели к образованию новых сольватоморфов, отличающихся как внешней сферой, так и способом упаковки компонентов.
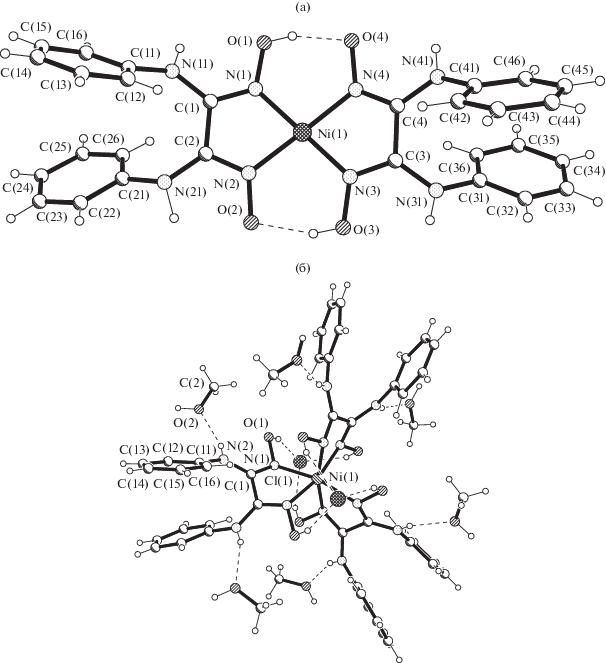
Структурные исследования показали, что соединения с подобным бис-лигандным комплексом I и [Ni(DAnH)2] · ДМФ (III) [28] кристаллизуются в пространственных группах P21/c (табл. 1) и P21/n моноклинной сингонии соответственно, но для них определены разные параметры элементарной ячейки (для III: a = 9.2341(4), b = 12.8587(5), c = = 15.0715(6) Å, β = 102.566(2)°, V 1746.70(12) Å3). При этом I содержит в кристалле остатки молекул воды, а III содержит молекулы ДМФ в соотношении к комплексам 2 : 1. Кроме того, если бис-лигандный комплекс III центросимметричный, то в I атом комплексообразователя находится в общем положении. Однако в комплексе I, так же как и в III, квадратно-плоскостной координационный полиэдр aтома Ni(1) (рис. 1а) сформирован четырьмя атомами азота, принадлежащих двум монодепротонированным лигандам дианилинглиоксима. Длины связей Ni–N находятся в интервале 1.847(4)–1.875(4) Å (табл. 2) и сопоставимы со значениями, представленными в [28]. В результате N,N-бидентатного координирования этих лигандов образуются два пятичленных металлоцикла, расположеных практически в одной плоскости (±0.020 Å). Выход атома никеля из плоскости донорных атомов N4 не превышает 0.056 Å. В комплексе между моноанионами диоксима образуются две внутримолекулярные водородные связи (ВС) O–H···O с расстоянием донор···акцептор 2.486(4) и 2.492(4) Å. Tакой способ стабилизации двух подобных лигандов с образованием псевдомакроцикла обнаружен практически во всех бис-диоксиматов переходных металлов найденных в КБСД [37].
Рис. 1.
Структура комплексного соединения [Ni(DAnH)2] в I (а) и ионного соединения [Ni(DAnH2)3]Cl2 · 6CH3OH (II) (б).
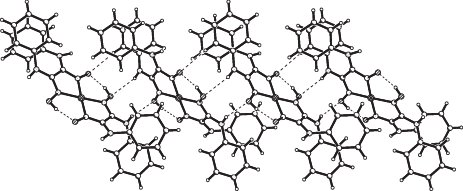
В кристалле I можно выделить цепочки из комплексов, связанных между собой межмолекулярными ВС N–H···O, в которых в качестве доноров протонов вовлечены группы NH, а в качестве акцепторов – атомы кислорода оксимных групп, стабилизированные дополнительно слабыми межмолекулярными ВС С–H···O (табл. 3, рис. 2). Однако комплексы Ni(II) объединены как напрямую, посредством водородных связей N–H···O, так и посредством молекул кристаллизационной воды с образованием водородных связей типа N–H···O(w) и O(w)–H···O (табл. 3, рис. 3а). В результате в кристалле комплексы объединены в трехмерный каркас. В кристалле III молекулы ДМФ также связаны с комплексами межмолекулярными ВС N–H···O.
Coeдинение II кристаллизуетcя в тригональной пространственной группе R$\bar {3}$c (табл. 1) в отличие от соединения с трис-лигандным комплексом [Ni(DAnH2)3]Cl2 · 2C2H5OH (IV) [28], содержащего в своем составе кристаллизационные молекулы этанола. Соединение IV кристаллизуется в пространственной группе P21/c моноклинной сингонии (a = 9.2683(2), b = 22.9694(7), c = = 24.0707(6) Å, β = 91.484(2)°, V = 5122.6(2) Å3). Соединение II, так же как и IV, ионное и состоит из комплексных катионов [Ni(DAnH2)3]2+, анионов Cl– и кристаллизационных молекул метанола в соотношении 1 : 2 : 6 (рис. 1б), но эти соединения отличаются сольватными молекулами. Симметрия комплексных катионов [Ni(DAnH2)3]2+ в II и IV разная. Комплексный катион в II имеет симметрию D3, так как центральный атом расположен на инверсионной оси третьего порядка, а оксимный лиганд имеет симметрию С2, при этом атом Cl(1) находится на тройной оси. В результате в комплексном катионе три лиганда диоксима координируютcя в нейтральной форме к комплексообразователю посредством атомов азота оксимных групп хелатно-бидентатным способом, образуя три пятичленных металлоцикла. В октаэдрическом координационном полиэдре металла межатомные расстояния Ni–N равны 2.075 Å (табл. 2), и они соответствуют подобным в IV [28], где длина связи Ni–N находится в интервале 2.039(3)–2.110(3) Å.
В кристалле II между комплексными катионами и анионами хлорида, кроме электростатистического взаимодействия, существует система межмолекулярных ВС, в которых в качестве доноров протонов вовлечены группы OH оксимных фрагментов (табл. 3, рис. 3б). Расстояние донор···акцептор в этих ВС равно 2.223(2) и 2.232(2) Å. При этом молекулы метанола объединены ВС как с анионами Cl–, в которых они вовлечены в качестве донора протонов, так и с комплексными катионами уже как акцепторы, в которых как доноры протонов выступают группы NH лигандов DAnH2. Расстояние донор···акцептор в N–H···O равно 2.853(2) Å.
В кристаллической структуре II комплексные катионы объединены только посредством ВС, в которые вовлечены анионы и молекулы метанола. Таким образом, устойчивость кристаллической решетки соединения II зависит от молекул растворителя, а нестабильность на воздухе данного соединения по сравнению с I можно объяснить их потерей. Определено, что в I потеря молекул воды не приводит к изменениям в кристаллической структуре, поскольку ее остов образован системой межмолекулярных ВС, которая объединяет сами комплексы, а молекулы воды лишь нанизаны на образованную решетку. По-видимому, другие молекулы растворителя в кристаллической структуре II могли повлиять на структуру в целом, так как в трис-диоксимине Ni(II) IV [28] как кристаллизационные вовлечены молекулы этанола, которые образуют водородные связи только с комплексным катионом. Нельзя не учитывать и роль групп NH диоксиминного фрагмента в образовании супрамолекулярной структуры соединений, поскольку они участвуют в образовании ВС в кристаллах, тем самым способствуя их устойчивости.
Работы последних лет указывают на возможность использования комплексных соединений (КС) переходных металлов с различными органическими лигандами в качестве стимуляторов синтеза вторичных метаболитов у микроорганизмов, в том числе внеклеточных гидролитических ферментов [38–40]. В более ранних исследованиях мы выявили стимулирующее действие ряда диоксиматов кобальта на биосинтез внеклеточных гидролаз (пектиназ, амилаз, липаз). Было показано, что комплексы кобальта(III) с диметилглиоксимом (DH2): [Co(DH)2(Thio)2]3F[SiF6] · 1.5H2O, [Co(DH)2(Thio)2]2[SiF6] · 3H2O, [Co(DH)2(Thio)2]- [BF4] · 3H2O – эффективные стимуляторы пектолитической активности штамма Rhizopus arrhizus FD 03 и увеличивают биосинтез фермента на 97.1–115.3% [41], а комплексы [Co(DH)2(An)2]2- [TiF6] · 3H2O, [Co(NioxH)2(Sam)2]2[TiF6] · 3H2O, [Co(NioxH)2(An)2]2[TiF6] · 3H2O обеспечивают сокращение цикла культивирования микромицета A. niger 33-19 CNMN FD 02A на 24–48 ч с повышением амилолитической активности на 23–64% [27].
Влияние координационного соединения I на биосинтез протеаз штамом микроскопического гриба Fusarium gibbosum CNMN FD 12 изучалось в динамике на 4–6-е сут культивирования (период, соответствующий максимуму биосинтеза изучаемых ферментов при классическом культивировании продуцента).
Добавление КС в концентрациях 5 и 10 мг/л в среду культивирования продуцента оказывает явный стимулирующий эффект на биосинтез как кислых, так и нейтральных протеаз. Aктивность ферментов в экспериментальных вариантах превышает уровень контроля на весь период культивирования. При концентрации 5 мг/л стимулирующий эффект составляет: 199.3 (4), 183.0 (5), 174.5% (6 сут) – для кислых протеаз, и 188.7 (4), 168.2 (5), 150.0% (6 сут) – для нейтральных протеаз. При концентрации 10 мг/л стимулирующий эффект значительно ниже: 127.2% (4); 148.9% (5); 125.5% (6 сут) – для кислых протеаз, 136.2% (4); 128.9% (5); 133.3% (6 сут) – для нейтральных протеаз. Внесение в среду культивирования КС в более высокой концентрации (15 мг/л) оказывает ингибирующее воздействие, снижая активность кислых протеаз на 78.9% (4); 57.4% (5) и 71.5% (6 сут), а нейтральных – на 27.7% (4); 40.2% (5); 48.8% (6 сут) по сравнению с контролем (табл. 4).
Таблица 4.
Влияние комплекса [Ni(DAnH)2] ⋅ 0.25H2O на протеолитическую активность микромицета Fusarium gibbosum CNMN FD 12
| Концентрация координационных соединений, мг/л |
Активность кислых протеаз (рН 3.6) | |||||
|---|---|---|---|---|---|---|
| 4-е сут | 5-е сут | 6-е сут | ||||
| ед./мл | % к контролю | ед./мл | % к контролю | ед./мл | % к контролю | |
| 5 | 2.93 ± 0.02 | 199.3/131.4* | 4.08 ± 0.08 | 183.0 | 3.49 ± 0.06 | 174.5 |
| 10 | 1.87 ± 0.04 | 127.2 | 3.32 ± 0.05 | 148.9 | 2.51 ± 0.01 | 125.5 |
| 15 | 0.31 ± 0.01 | 21.1 | 0.95 ± 0.01 | 42.6 | 0.57 ± 0.01 | 28.5 |
| Контроль | 1.47 ± 0.01 | 100.0 | 2.23 ± 0.04 | 100.0 | 2.00 ± 0.04 | 100.0 |
| Активность нейтральных протеаз (рН 7.4) | ||||||
| 5 | 2.66 ± 0.02 | 188.7/111.3* | 4.02 ± 0.07 | 168.2 | 1.26 ± 0.01 | 150.0 |
| 10 | 1.92 ± 0.01 | 136.2 | 3.08 ± 0.05 | 128.9 | 1.12 ± 0.02 | 133.3 |
| 15 | 1.02 ± 0.02 | 72.3 | 1.43 ± 0.02 | 59.8 | 0.43 ± 0.01 | 51.2 |
| Контроль | 1.41 ± 0.01 | 100.0 | 2.39 ± 0.02 | 100.0 | 0.84 ± 0.01 | 100.0 |
Из табл. 4 видно, что максимум активности как кислых, так и нейтральных протеаз в контрольном варианте проявляется на 5-е сут культивирования продуцента и составляет 2.23 и 2.39 ед./мл соответственно. Сопоставление полученных результатов показывает, что этот максимум при использовании КС в концентрации 5 мг/л достигается на сутки (24 ч) раньше с превышением максимального контроля (5-е сут культивирования) на 31.4% (кислые протеазы) и 11.3% (нейтральные протеазы), составляя 2.93 и 2.66 ед./мл соответственно.
На 5-е сут культивирования продуцента – день проявления максимума в контрольном варианте, активности кислых и нейтральных протеаз в экспериментальных вариантах составляет 4.08 и 4.02 ед./мл соответственно, превышая контроль на 83.0 и 68.2% (табл. 4).
Комплексное соединение [Ni(DAnH)2] ⋅ 0.25H2O в оптимально подобранной концентрации (5 мг/л) стимулирует биосинтез внеклеточных протеаз при глубинном культивировании микромицета Fusarium gibbosum CNMN FD 12, обеспечивая:
– при оптимальном периоде культивирования штамма (5 сут) повышение активности кислых протеаз на 83.0% и нейтральных протеаз на 68.2% по сравнению с активностью в контроле;
– сокращение (на 24 ч) периода культивирования штамма (4 сут) при одновременном повышении активности на 31.4% (кислые протеазы) и на 11.3% (нейтральные протеазы) по сравнению с максимальной активностью, получаемой в контроле на сутки позже (5 сут).
Список литературы
Coropceanu E. // Studia Universitatis Moldaviae. Ştiinţe reale şi ale naturii. 2013. № 6(66). P. 183.
Schrauzer G.N., Lee L.P. // J. Am. Chem. Soc. 1970. V. 92. № 6. P. 1551.
Gerbeleu N., Simonov Yu., Deseatnic A. et al. Patent MD 1203. 1999.
Deseatnic A., Tiurin J., Gerbeleu N. et al. Patent MD 1748. 2002.
Gerbeleu N., Simonov Yu., Bourosh P. et al. Patent MD 2833. 2005.
Deseatnic A., Stratan M., Coropceanu E. et al. Patent MD 3943. 2009.
Боурош П.Н., Коропчану Э.Б., Десятник А.А. и др. // Коорд. химия. 2009. Т. 35. № 10. С. 761 (Bourosh P.N., Koropchanu E.B., Ciloci A.A. et al. // Russ. J. Coord. Chem. 2009. V. 35. № 10. P. 751). https://doi.org/10.1134/S1070328409100078
Боурош П.Н., Коропчану Э.Б., Чилочи А.А. и др. // Коорд. химия. 2013. Т. 39. № 11. С. 669 (Bourosh P.N., Coropceanu E.B., Ciloci A.A. // Russ. J. Coord. Chem. 2013. V. 39. № 11. P. 777). https://doi.org/10.1134/S107032841311002X
Rudic V., Coropceanu E., Cepoi L. et al. Patent MD 4254. 2013.
Ştefîrţă A., Bulhac I., Botnari V. et al. Patent MD 813. 2014.
Mokhir A., Kramer R., Voloshin Y.Z., Varzatskii O.A. // Bioorg. Med. Chem. Lett. 2004. V. 14. № 11. P. 2927.
Волошин Я.З., Варзатский О.А., Бубнов Ю.Н. // Изв. АН. Сер. хим. 2007. № 4. С. 555.
Voloshin Y.Z., Kostromina N.A., Kramer R. Clathrochelates: Synthesis, Structure and Properties. Amsterdam: Elsevier, 2002. 419 p.
Coropceanu E., Rija A., Lozan V. // Cryst. Growth Des. 2016. V. 16. № 2. P. 814.
roitor L., Coropceanu E.B., Siminel A. // Inorg. Chim. Acta. 2011. V. 370. P. 411
Croitor L., Coropceanu E.B., Siminel A.V. // CrystEngComm. 2012. V. 14. P. 3750.
Kabay N., Altunbaş A. K., Misir M.N., Gok Y. // J. Incl. Phenom. Macrocycl. Chem. 2012. V. 74. P. 285.
Coropceanu E.B., Croitor L., Fonari M.S. // Polyhedron. 2012. V. 38. P. 68.
Coropceanu E.B., Croitor L., Wicher B. et al. // Inorg. Chim. Acta. 2009. V. 362. P. 2151.
Coropceanu E.B., Croitor L., Siminel A.V., Fonari M.S. // Inorg. Chem. Commun. 2011. V. 14. P. 1528.
Coropceanu E.B., Croitor L., Botoshansky M.M., Fonari M.S. // Polyhedron. 2011. V. 30. P. 2592.
Croitor L., Coropceanu E., Masunov A. et al. // J. Phys. Chem. C. 2014. V. 118. № 17. P. 9217.
Croitor L., Coropceanu E., Petuhov O. et al. // Dalton Trans. 2015. V. 44. № 17. P. 7896.
Croitor L., Grabco D., Coropceanu E. et al. // CrystEngComm. 2015. V. 17. № 12. P. 2450.
Ocak U., Kantekin H., Gok Y., Misir M.N. // New J. Chem. 2003. V. 27. № 8. P. 1251.
Gumus G., Ahsen V., Lebrun C. et al. // New J. Chem. 2004. V. 28. № 2. P. 177.
Stratan M. Biotehnologii de cultivare a tulpinii Aspergillus niger 33-19 CNMN FD 02A producător de amilaze. Chişinău: CEP USM. 2011. 30 p.
Yuksel F., Gurek G., Durmus M. et al. // Inorg. Chim. Acta. 2008. V. 361. № 8. P. 2225.
Glyoxime, Diaminofurazan and Some Energetic Derivatives, by AXT // Sciencemadness.org. http://www. sciencemadness.org/member_publications/energetic_glyoxime_and_diaminofurazan_derivatives.pdf.
Kurtoǧlu M., Serin S. // React. Inorg. Met.-Org. Chem. 2001. V. 31. № 7. P. 1129.
Уреке Д., Булхак И., Рижа А. и др. // Коорд. химия. 2019. Т. 45. № 12. С. 720 (Ureche D., Bulhac I., Rija A. et al. // Russ. J. Coord. Chem. 2019. V. 45. № 12. P. 843). https://doi.org/10.1134/S107032841912008X
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Deseatnic-Ciloci A., Tiurina J., Lupaşcu G. et al. Patent MD 4186 // BOPI. 2012. № 11.
Clapco S., Bivol C., Ciloc A. et al. // Anal. Univ. din Oradea, Fasc. Biologie. 2013. V. 20. № 1. P. 53.
Deseatnic-Ciloci A., Coropceanu E., Clapco S. et al. // Studia universitatis moldaviae, seria Ştiinţe reale şi ale naturii. 2014. № 6(76). P. 57.
Грачёва И.М., Грачёв Ю.П. и др. Лабораторный практикум по технологии ферментных препаратов. М.: Легкая и пищ. пром-ть, 1982. 240 с.
Allen F.H. // Acta Crystalljgr. B. 2002. V. 58. № 3–1. P. 380.
Варбанец Л.Д., Разаева О.Н., Авдюк Е.В. и др. // Микробиол. журн. 2007. Т. 69. № 3. С. 11.
Varbaneţ L.D., Matselyukh E. V., Gudzenko E. V. et al. // Ukr. Biochem. J. 2011. V. 83. № 3. P. 25.
Varbaneţ L.D., Matseliukh E.V., Seifullina I.I. et al. // Ukr. Biochem. J. 2014. V. 86. № 3. P. 49.
Coropceanu E., Deseatnic A., Tiurin J. et al. // Analele USM. Ştiinţe chimico-biol. 2000. P. 256.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия