Координационная химия, 2021, T. 47, № 1, стр. 48-57
Разнолигандные дитиокарбаматно-хлоридные комплексы висмута(III) состава [Bi(S2CNR2)Cl2] и [Bi(S2CNR2)2Cl] (R = C3H7, изо-C4H9): получение, 1D-полимерные структуры, гетероядерный (13C, 15N) CP-MAS ЯМР и термическое поведение
Е. В. Новикова 1, К. Л. Исаковская 2, 3, О. Н. Анцуткин 4, 5, А. В. Иванов 1, *
1 Институт геологии и природопользования ДВО РАН
Благовещенск, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
3 Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
4 Университет технологий
Лулео, Швеция
5 Университет Варвика
Ковентри, Великобритания
* E-mail: alexander.v.ivanov@chemist.com
Поступила в редакцию 18.03.2020
После доработки 22.04.2020
Принята к публикации 06.05.2020
Аннотация
Получены кристаллические дитиокарбаматно-хлоридные комплексы висмута(III) состава [Bi{S2CN(C3H7)2}Cl2] (I) и [Bi{S2CN(изо-C4H9)2}2Cl] (II), которые сравнительно исследованы методами CP-MAS ЯМР (13C, 15N), ИК-спектроскопии и РСА (CIF files CCDC № 1971976 и 1971975 соответственно). Для дитиокарбаматных лигандов характерна S,S'-изо- (I) или анизо- (II) бидентатно-терминальная координация. В каждом из соединений за счет одного или двух лигандов μ2-Cl– соседние молекулы объединяются в зигзагообразные полимерные цепочки, в которых комплексообразователь формирует шестерное окружение: [BiS2Cl4] (I) или [BiS4Cl2] (II). Узел связывания в полимерных цепочках I представляет собой четырехчленный металлоцикл [Bi–(μ-Cl)2–Bi] в конформации “бабочка” (двугранный угол 140.51(3)°). Поэтому следствием более высокой степени связывания разнолигандных молекул I в полимерных цепочках является существенно меньшее межатомное расстояние Bi–Bi (4.0904(4) Å) в сравнении с цепочками II (4.8772(4) Å). Термическое поведение разнолигандных соединений висмута(III) изучено методом синхронного термического анализа с одновременной регистрацией кривых ТГ и ДСК. Хотя основным продуктом термических превращений I и II является Bi2S3, использование метода микрозонда позволило также выявить присутствие восстановленного висмута и BiCl3.
Наряду с дитиокарбаматными комплексами, висмут(III) образует и дитиокарбаматно-галогенидные соединения со смешанной координационной сферой [1–8]. Некоторые из них являются удобными прекурсорами в одностадийных термохимических процессах получения наноразмерных сульфидов висмута(III) Bi2S3 [1]; тогда как для других обнаружена высокая цитотоксическая активность в отношении раковых клеток [2, 3]. Структурные данные о разнолигандных дитиокарбаматно-хлоридных соединениях висмута(III) относительно немногочисленны: к настоящему времени структуры установлены только для четырех комплексов общего состава [Bi(S2CNR2)2Cl] ⋅ L (R = СН3 [2], C3H7 [4]; R2 = C2H5, C2H4OH; L = H2O [5], R2 = (CH2)4; L = CHCl3 [1]) и одного биядерного аддукта с тиомочевиной [Bi2{SC(NH2)2}2- {S2CN(CH2)4}4(μ2-Cl)2] [6]. Однако очевидно, что при переходе от BiХ3 к [Bi(Dtc)3] (Dtc – дитиокарбаматный лиганд) вышеуказанным комплексам должны предшествовать соединения состава [Bi(Dtc)Х2]. Действительно, в [9] был получен и структурно охарактеризован представитель такого рода дитиокарбаматно-галогенидных комплексов висмута(III) [Bi(S2CNEt2)I2]. Однако кристаллизация соответствующего дихлоридного аналога из раствора в пиридине привела к выделению аддукта состава [Bi(S2CNEt2)Cl2(Рy)3] ⋅ Рy, включающего как внешне-, так и внутрисферные молекулы N-донорного основания [10]; тогда как из смеси диметилформамид–бутанол неожиданно была получена сольватированная форма пентаядерного соединения [Bi5(S2CNEt2)8Cl7] ⋅ Dmf [11]. И только спустя 13 лет были получены соответствующие кристаллы и методом РСА установлены структуры комплексов состава [Bi(S2CNEt2)Х2] (Х = Cl, Br) [12], которые вместе с [Bi(S2CNR2)I2] (R = CH3 [3], C2H5 [9]) до настоящего времени остаются единственными представителями разнолигандных соединений висмута(III) данного типа.
В продолжение наших исследований комплексов висмута(III) настоящая работа посвящена синтезу и сравнительному исследованию разнолигандных дитиокарбаматно-хлоридных соединений состава [Bi{S2CN(C3H7)2}Cl2] (I) и [Bi{S2CN(изо-C4H9)2}2Cl] (II), охарактеризованных методом гетероядерной (13C, 15N) CP-MAS ЯМР спектроскопии. В 1D-полимерных структурах полученных кристаллических комплексов, установленных прямым методом РСА, все атомы хлора выполняют μ2-мостиковую функцию. Изучение термического поведения комплексов по данным синхронного термического анализа (СТА) позволило установить характер протекания их термолиза, а также идентифицировать промежуточные и финальные продукты термических превращений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
N,N-диалкилдитиокарбаматы натрия состава Na{S2CN(C3H7)2} · H2O и Na{S2CN(изо-C4H9)2} · 3H2O получали взаимодействием диалкиламинов, HN(C3H7)2 (Merck) и HN(изо-C4H9)2 (Aldrich) соответственно, с сероуглеродом (Merck) в щелочной среде [13].
Синтез 1D-полимерных комплексов катена-поли[ди(μ2-хлоро)-(N,N-дипропилдитиокарбамато-S,S')висмута(III)] (I) и катена-поли[(μ2-хлоро)-бис(N,N-ди-изо-бутилдитиокарбамато-S,S')висмута(III)] (II) получали по следующим реакциям:
Реакции между BiCl3 · H2O и Na{S2CN(C3H7)2} · · H2O/Na{S2CN(изо-C4H9)2} · 3H2O проводили в растворе ацетона. Исходные соли висмута использовали в 3%-ном сверхстехиометрическом избытке. Реакционные смеси перемешивали на магнитной мешалке в течение 1 ч и оставляли на сутки при комнатной температуре. Затем растворы полученных комплексов отделяли от осадков NaCl фильтрованием. Светло-желтые/блестящие лимонно-желтые кристаллы I/II получали медленным испарением ацетона/смеси ацетон–этанол (1 : 1) при комнатной температуре. Выход 84.8/82.2%; Тпл = 186–190°С/130–134°С.
ИК-спектры I (KBr; ν, см–1): 2964 с, 2930 ср, 2872 ср, 1504 о.с, 1463 ср, 1430 с, 1380 сл, 1364 ср, 1343 сл, 1305 ср, 1271 сл, 1243 с, 1190 ср, 1146 с, 1102 сл, 1086 ср, 1039 о.сл, 1030 сл, 959 ср, 894 сл, 768 сл, 750 ср, 625 сл, 599 сл, 530 сл; и II (KBr; ν, см–1): 2965 с, 2948 сл, 2930 ср, 2919 о.сл, 2865 ср, 1486 о.с, 1467 ср, 1433 сл, 1424 с, 1385 ср, 1352 ср, 1338 ср, 1285 ср, 1245 с, 1193 ср, 1172 сл, 1148 с, 1121 сл, 1093 с, 972 ср, 918 ср, 880 сл, 819 сл, 615 сл, 606 сл.
Cпектры CP-MAS ЯМР (13С, 15N) для I (δ, м.д.): 189.2 (–S2CN=); 57.9, 57.6 (1 : 1, =NCH2–); 22.1, 20.7 (1 : 1, –CH2–); 13.8, 13.5 (1 : 1, –CH3); 165.2 (–S2CN=); и для II (δ, м.д.): 204.3 (25)11, 200.8 (31)1 (1 : 1, –S2CN=); 64.2, 62.4, 59.1, 58.3 (1 : 1 : 1 : 1, =NCH2–); 29.2, 28.8, 28.2, 28.1 (1 : 1 : 1 : 1, >CH–); 24.5, 23.6, 23.1, 22.9, 22.3, 20.8 (1 : 1 : 1 : 1 : 2 : 2, ‒CH3); 142.2, 135.9 (1 : 1, –S2CN=).
Спектры CP-MAS ЯМР 13C/15N регистрировали на спектрометре Ascend Aeon (Bruker)22 с рабочей частотой 100.64/40.55 МГц, сверхпроводящим магнитом (В0 = 9.4 Тл) с замкнутым циклом конденсации гелия через внешний компрессор и Фурье-преобразованием. Использовали кросс-поляризацию (CP) с протонов: контактное время 1H−13C/1H−15N 2.0/1.5 мс. Подавление взаимодействий 13C−1H/15N−1H основывалось на эффекте декаплинга при использовании радиочастотного поля на резонансной частоте протонов (400.21 МГц) [16]). Поликристаллические образцы I/II массой ~103/63 мг помещали в 4.0 мм керамический ротор из ZrO2. При измерениях ЯМР 13C/15N использовали вращение образцов под магическим углом (MAS) на частоте 5300–6300/4000–5000(1) Гц; число накоплений 720–2000/22 700–85 880; длительность протонных π/2-импульсов 2.7/2.7 мкс; интервал между импульсами 2.0/2.0 с. Изотропные хим. сдвиги, δ(13C)/δ(15N) даны относительно одной из компонент внешнего стандарта – кристаллического адамантана (δ = 38.48 м.д. относительно тетраметилсилана)/кристаллического NH4Cl (δ = 0.0 м.д., –341 м.д. в абсолютной шкале [17]) с поправкой на дрейф напряженности магнитного поля, частотный эквивалент которого составил 0.031/0.011 Гц/ч.
ИК-спектры комплексов I и II, запрессованных в таблетках с KBr, регистрировали на интерференционном ИК-спектрометре с Фурье-преобразованием ФСМ–1201 в диапазоне 400–4000 см–1. Управление прибором и обработку спектров осуществляли по программе FSpec (версия 4.0.0.2 для Windows, ООО “Мониторинг”, Россия).
РСА выполнен c пластинчатых (I) и столбчатых (II) монокристаллов на дифрактометре Bruker Apex II DUO при 120 K (CCD-детектор, MoKα, λ = 0.71073 Å, графитовый монохроматор). Расчеты по определению структур выполнены при использовании программы SHELXT [18]; последующее уточнение проводили в полноматричном МНК с помощью программы OLEX2 [19] в анизотропном приближении неводородных атомов. Положения атомов водорода рассчитаны геометрически и включены в уточнение в модели “наездника”. Основные кристаллографические данные и параметры уточнения структур I, II приведены в табл. 1, основные длины связей и углы – в табл. 2.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Брутто-формула | C7H14NS2Cl2Bi | C18H36N2S4ClBi |
| M | 456.21 | 653.16 |
| Сингония | Ромбическая | Моноклинная |
| Пр. гр. | Pna21 | P21/c |
| Z | 4 | 4 |
| a, Å | 7.8651(6) | 10.0413(4) |
| b, Å | 16.5286(13) | 26.1320(10) |
| c, Å | 10.0539(8) | 9.5518(4) |
| α, град | 90 | 90 |
| β, град | 90 | 91.8160(10) |
| γ, град | 90 | 90 |
| V, Å3 | 1307.00(18) | 2505.13(17) |
| ρ(выч.), г/см3 | 2.318 | 1.732 |
| μ, см−1 | 141.77 | 74.85 |
| F(000) | 848 | 1288 |
| Размер кристалла, мм | 0.20 × 0.15 × 0.01 | 0.66 × 0.20 × 0.18 |
| Область сбора данных по θ, град | 2.37–29.00 | 2.03–26.00 |
| Интервалы индексов отражений | –10 ≤ h ≤ 11, –23 ≤ k ≤ 23, –14 ≤ l ≤ 14 |
–12 ≤ h ≤ 12, –32 ≤ k ≤ 32, –11 ≤ l ≤ 11 |
| Число измеренных отражений | 11 470 | 24 550 |
| Число независимых отражений | 3460 | 4924 |
| Число отражений с I > 2σ(I) | 3035 | 4292 |
| Количество уточняемых параметров | 120 | 243 |
| R1 (для отражений с I > 2σ(I)) | 0.0274 | 0.0254 |
| wR2 (для всех отражений) | 0.0578 | 0.0510 |
| GOOF | 0.831 | 1.067 |
| Остаточная электронная плотность (min/max), e/Å3 | –1.426/1.285 | –1.634/0.577 |
Таблица 2.
Длины связей (d, Å), валентные (ω, град) и торсионные (φ, град) углы в структурах I и II*
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| I | |||
| Bi(1)–S(1) | 2.6437(13) | S(1)–C(1) | 1.747(5) |
| Bi(1)–S(2) | 2.6323(14) | S(2)–C(1) | 1.735(6) |
| Bi(1)–Cl(1)а | 2.6823(14) | N(1)–C(1) | 1.311(7) |
| Bi(1)–Cl(2)а | 2.8798(13) | N(1)–C(2) | 1.474(7) |
| Bi(1)–Cl(1) | 3.0668(13) | N(1)–C(5) | 1.479(7) |
| Bi(1)–Cl(2) | 2.7717(13) | ||
| II | |||
| Bi(1)–S(1) | 2.7845(10) | S(3)–C(10) | 1.731(4) |
| Bi(1)–S(2) | 2.6287(10) | S(4)–C(10) | 1.728(4) |
| Bi(1)–S(3) | 2.7590(10) | N(1)–C(1) | 1.331(5) |
| Bi(1)–S(4) | 2.6468(10) | N(1)–C(2) | 1.480(5) |
| Bi(1)–Cl(1) | 2.9606(10) | N(1)–C(6) | 1.476(5) |
| Bi(1)–Cl(1)а | 3.0424(9) | N(2)–C(10) | 1.332(5) |
| S(1)–C(1) | 1.724(4) | N(2)–C(11) | 1.479(5) |
| S(2)–C(1) | 1.740(4) | N(2)–C(15) | 1.476(5) |
| Угол | ω, град | Угол | ω, град |
| I | |||
| S(2)C(1)S(1) | 117.2(3) | S(2)Bi(1)Cl(1)а | 88.44(4) |
| S(1)Bi(1)S(2) | 68.57(4) | S(2)Bi(1)Cl(2) | 88.80(4) |
| S(1)Bi(1)Cl(1) | 70.48(4) | S(2)Bi(1)Cl(2)а | 85.38(4) |
| S(1)Bi(1)Cl(1)а | 95.09(4) | Bi(1)Cl(1)Bi(1)а | 90.46(4) |
| S(1)Bi(1)Cl(2) | 91.44(4) | Bi(1)Cl(2)Bi(1)а | 92.71(5) |
| S(1)Bi(1)Cl(2)а | 153.94(4) | Cl(1)Bi(1)Cl(1)а | 109.01(4) |
| S(2)Bi(1)Cl(1) | 136.60(4) | Cl(2)Bi(1)Cl(2)а | 88.45(3) |
| II | |||
| S(1)C(1)S(2) | 117.7(2) | S(2)Bi(1)S(4) | 85.63(3) |
| S(1)Bi(1)S(2) | 66.33(3) | S(1)Bi(1)Cl(1) | 97.00(3) |
| S(3)C(10)S(4) | 118.0(2) | S(2)Bi(1)Cl(1) | 160.85(3) |
| S(3)Bi(1)S(4) | 66.48(3) | S(3)Bi(1)Cl(1)а | 74.21(3) |
| S(1)Bi(1)S(3) | 137.76(3) | S(4)Bi(1)Cl(1)а | 81.57(3) |
| S(1)Bi(1)S(4) | 78.30(3) | Bi(1)Cl(1)Bi(1)b | 108.67(3) |
| S(2)Bi(1)S(3) | 87.75(3) | Cl(1)Bi(1)Cl(1)а | 122.17(3) |
| Угол | φ, град | Угол | φ, град |
| I | |||
| Bi(1)S(1)S(2)C(1) | –179.4(4) | S(1)C(1)N(1)C(5) | 1.7(7) |
| S(1)Bi(1)C(1)S(2) | –179.5(3) | S(2)C(1)N(1)C(2) | 0.0(7) |
| S(1)C(1)N(1)C(2) | –178.8(4) | S(2)C(1)N(1)C(5) | –179.5(4) |
| II | |||
| Bi(1)S(1)S(2)C(1) | 177.7(3) | S(2)C(1)N(1)C(2) | –177.2(3) |
| Bi(1)S(3)S(4)C(10) | 168.8(3) | S(2)C(1)N(1)C(6) | –0.8(5) |
| S(1)Bi(1)C(1)S(2) | 178.0(2) | S(3)C(10)N(2)C(11) | –4.1(5) |
| S(3)Bi(1)C(10)S(4) | 170.3(2) | S(3)C(10)N(2)C(15) | –177.1(3) |
| S(1)C(1)N(1)C(2) | 4.2(5) | S(4)C(10)N(2)C(11) | 173.0(3) |
| S(1)C(1)N(1)C(6) | –179.4(3) | S(4)C(10)N(2)C(15) | 0.1(5) |
Координаты атомов, длины связей, валентные углы и температурные параметры для полученных комплексов депонированы в Кембриджском банке структурных данных (CCDC № 1971976 (I) и 1971975 (II); deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk).
Термическое поведение I/II изучали методом СТА с одновременной регистрацией кривых термогравиметрии (ТГ) и дифференциальной сканирующей калориметрии (ДСК). Исследование проводили на приборе STA 449C Jupiter (фирмы NETZSCH) в корундовых тиглях под крышкой с отверстием, обеспечивающим давление паров в процессе термолиза, равное 1 атм. Скорость нагрева составляла 5°С/мин до 400°С в атмосфере аргона. Масса исследуемых образцов 4.897–13.235/ 3.457–10.411 мг. Точность измерения температуры ±0.7°С, изменения массы ±1 × 10−4 мг. После проведения термического анализа комплексов дисперсность и морфологические особенности образцов остаточного вещества исследовали на растровом электронном микроскопе Zeiss SIGMA (Германия), оснащенном системой микроанализа Oxford X-MAX (Англия) с дисперсией по энергии и длинам волн. Качественное определение химического состава выполняли методом микрозонда с применением энергодисперсионного спектрометра.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В ИК-спектрах комплексов I/II наиболее интенсивные полосы поглощения при 1504/1486 см–1 обусловлены валентными колебаниями связи ν(C–N) в группах =NC(S)S– лигандов PrDtc и изо-BuDtc. Оба эти значения не попадают в диапазоны колебаний ни ординарных, ν(C–N) 1360–1250 см–1, ни двойных связей, ν(C=N) 1690–1640 см–1, занимая промежуточное положение между ними, что указывает на частично двойной характер связи C$\underline \ldots $N в дитиокарбаматных группах. При этом, поскольку большей частоте колебаний обсуждаемой связи ν(C–N) соответствует больший вклад двоесвязанности, среди изученных нами дитиокарбаматно-хлоридных соединений висмута(III) наиболее короткая связь N‒C(S)S ожидается для комплекса I (в сравнении с II и [Bi{S2CN(C3H7)2}2Cl] ν(C–N) 1493 см–1 [4]). Кроме того, важно отметить, что в ряду соединений [Bi{S2CN(C3H7)2}3] (1487, 1476 см–1) [20], [Bi{S2CN(C3H7)2}2Cl] [4], [Bi{S2CN(C3H7)2}Cl2] замещение лигандов PrDtc на хлорид-ионы сопровождается последовательным возрастанием частоты колебаний связи C–N в дитиокарбаматной группе.
Интенсивные полосы поглощения при 1146/1148 см–1 и полосы средней интенсивности при 959/972 см–1 отнесены к асимметричным νas(СS2) и симметричным νs(СS2) валентным колебаниям соответственно [21–23]. В ИК-спектрах I/II отмечены также полосы, обусловленные валентными колебаниями связей C–H в алкильных заместителях при атоме азота Dtc лигандов [24]: νas(СН3) 2964/2965 см–1 и νs(СН3) 2872/2865 см–1, νas(СН2) 2930/2930 см–1 и ν(СН) 2919 см–1.
Структура полученных соединений висмута(III) была установлена методом РСА. В состав элементарной ячейки I/II входят четыре формульные единицы [Bi{S2CN(C3H7)2}Cl2]/[Bi{S2CN(изо-C4H9)2}2Cl] (табл. 1, рис. 1, 2). Внутренняя сфера комплексов включает один или два лиганда Dtc, у которых длина связей N–C(S)S (1.311–1.332 Å) свидетельствует о значительном вкладе двоесвязанности (за счет проявления мезомерного эффекта дитиокарбаматных групп). При этом, как и ожидалось из данных ИК-спектроскопии, длина связи N–C(S)S в комплексе I (1.311 Å) заметно короче, чем в II (1.331 и 1.332 Å).
Рис. 1.
Проекции полимерной структуры I на плоскости xz (а) и yz (б). Полимерные цепочки направлены вдоль оси x.
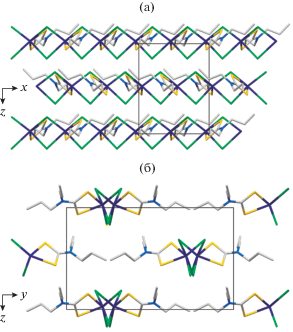
Рис. 2.
Проекции полимерной структуры II на плоскости xz (а) и yz (б). Полимерные цепочки направлены вдоль оси z.
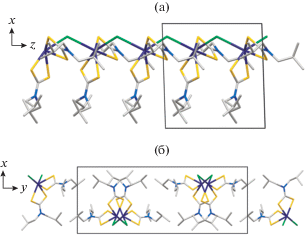
Близкие значения длины связей Bi–S 2.6323 и 2.6437 Å в первом соединении (табл. 2) определяют практически S,S′-изобидентатную координацию лиганда PrDtc. Тогда как во втором, характер координации структурно неэквивалентных лигандов изо-BuDtc выраженно S,S′-анизобидентатный: длина связей Bi–S 2.6287, 2.7845 Å и 2.6468, 2.7590 Å. Координация каждого из дитиокарбаматных лигандов сопровождается формированием четырехчленного металлоцикла [BiS2C]. При этом в структуре I геометрия обсуждаемого цикла близка к идеально плоской: отклонение от 180° соответствующих торсионных углов BiSSC и SBiCS не превышает 0.6° (табл. 2). В структуре II торсионные углы BiSSC (177.7° и 168.8°) указывают на различную степень отклонения атомов от копланарного расположения в двух металлоциклах [BiS2C], что можно представить небольшим перегибом их плоскостей вдоль оси S–S. Угол между среднеквадратичными плоскостями обсуждаемых циклов близок к прямому (85.38(3)°).
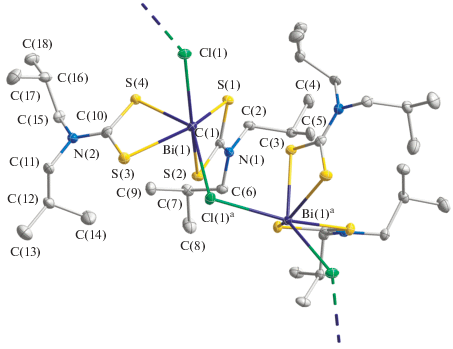
В разнолигандных комплексах I и II для всех анионов Cl– характерна μ2-мостиковая структурная функция, что приводит к асимметричному связыванию соседних молекул [Bi{S2CN(C3H7)2}Cl2] или [Bi{S2CN(изо-C4H9)2}2Cl] с формированием соответствующих зигзагообразных полимерных цепочек (рис. 3, 4), ориентированных вдоль оси x (I) или z (II). В обеих цепочках комплексообразователь (при учете дополнительной координации мостиковых лигандов) имеет шестерное окружение: [BiS2Cl4] (в I) или [BiS4Cl2] (в II). При этом полимерная цепочка в II (∠Bi(1)aBi(1)Bi(1)b 156.605(5)°) имеет несколько более сглаженный характер, чем в I (∠Bi(1)aBi(1)Bi(1)b 148.059(5)°). Существенное структурное различие между обсуждаемыми цепочками заключается в том, что в первом случае ближайшие металлические атомы объединяются при участии двух лигандов μ2-Cl–, тогда как во втором – в связывании участвует только один лиганд. Поэтому для соединения I узлом связывания является четырехчленный металлоцикл [Bi–(μ-Cl)2–Bi], характеризующийся конформацией “бабочка”, двугранный угол которой (между плоскостями [BiCl2]) составляет 140.51(3)°. В обеих цепочках длина одной из связей Bi–Cl практически одинакова (табл. 2); тогда как остальные связи Bi–Cl (2.6823–2.8798 Å) в цепи I заметно короче, чем в II (2.9606 Å). Следствием более высокой общей прочности связывания атомов висмута в цепочке I является весьма существенное уменьшение межатомного расстояния Bi–Bi (4.0904(4) Å) в сравнении с соответствующим расстоянием в II (4.8772(4) Å) или [Bi{S2CN(C3H7)2}2Cl] (4.9128(6) Å [4]).
Рис. 3.
Двухзвенный фрагмент полимерной цепочки [Bi{S2CN(C3H7)2}Cl2]n. Эллипсоиды 50%-ной вероятности; симметрическое преобразование: a 1/2 + x, 1/2 – y, z. Атомы водорода не приводятся.
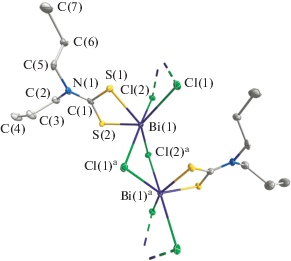
Рис. 4.
Двухзвенный фрагмент полимерной цепочки [Bi{S2CN(изо-C4H9)2}2Cl]n. Эллипсоиды 50%-ной вероятности; симметрическое преобразование: ax, 3/2 – y, –1/2 + z. Атомы водорода не приводятся.
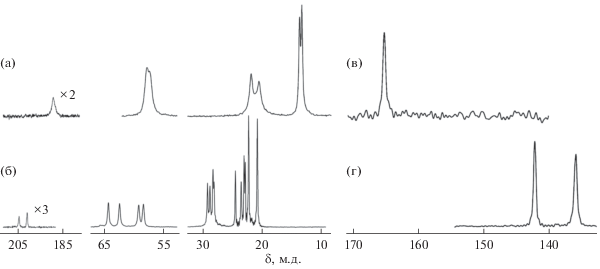
По данным гетероядерной (13C, 15N) спектроскопии CP-MAS ЯМР кристаллические соединения I, II представляют собой индивидуальные вещества. В экспериментальных спектрах ЯМР 13C и 15N группы >NC(S)S– представлены одним или двумя (1 : 1) резонансными сигналами (рис. 5а, 5б), что корректно отражает присутствие в структуре комплексов одного лиганда PrDtc или двух неэквивалентных изо-BuDtc. При этом спектральная картина групп >NCH2– (1 : 1), –CH2– (1 : 1) и –CH3 (1 : 1) в I, а также групп >NCH2– (1 : 1 : 1 : 1), >CH– (1 : 1 : 1 : 1 ) и –CH3 (1 : 1 : 1 : 1 : : 2 : 2) в II указывает на неэквивалентность соответственных химических групп в соседних цепочках алкильных заместителей, –C3H7 и –изо-C4H9, в составе дитиокарбаматных лигандов. Следует также отметить, что для резонансных сигналов неэквивалентных групп >NC(S)S– в спектре ЯМР 13С комплекса II проявляется асимметрия, обусловленная диполь-дипольным взаимодействием ядер 13С (I = 1/2) с квадрупольным ядром 14N (I = 1). Экспериментальные спектры MAS ЯМР 15N (рис. 5в, 5г), включающие один или два (1 : 1) резонансных сигнала дитиокарбаматных групп, полностью согласуются с обсуждавшимися выше данными ЯМР 13C, независимым образом подтверждая вхождение соответствующего числа лигандов PrDtc и изо-BuDtc в структуру кристаллических комплексов I и II. При этом сопоставление данных MAS ЯМР 13C, 15N позволяет отметить, что переход от 1D-полимерного [Bi{S2CN(C3H7)2}2Cl]n (ближайшее окружение комплексообразователя [S4Cl2] [4]) к 1D-полимерному [Bi{S2CN(C3H7)2}Cl2]n (I) (окружение [S2Cl4]) сопровождается весьма существенным антибатным изменением хим. сдвигов 13С и 15N для групп >NC(S)S–: в среднем значения δ(13С) уменьшаются на 10.5 м.д. при одновременном возрастании δ(15N) на 22.7 м.д. (Последнее свидетельствует о более высокой чувствительности хим. сдвига 15N, в сравнении с хим. сдвигом 13С, к малым структурным различиям дитиокарбаматных лигандов.)
Рис. 5.
Спектры CP-MAS ЯМР 13C (а, б) и 15N (в, г) поликристаллических образцов I (а, в) и II (б, г). Число накоплений/частота вращения образцов (в Гц) составили: 2000/5300 (а), 720/6300 (б), 22 700/5000 (в) и 85 880/4000 (г).
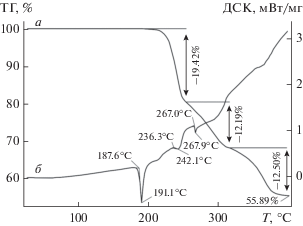
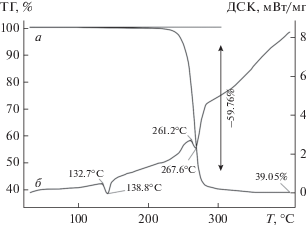
Термическое поведение разнолигандных комплексов висмута(III) изучено в атмосфере аргона методом СТА с одновременной регистрацией кривых ТГ и ДСК (рис. 6, 7). Комплексы I/II термически устойчивы до 210/200°С. Соответствующие участки кривых ДСК (рис. 6б, 7б) регистрируют эндоэффекты (с экстремумами при 191.1/138.8°С), обусловленные плавлением комплексов: экстраполированные Tпл = 187.6/132.7°С. (Диапазоны плавления веществ в стеклянном капилляре: 186–189/131–134°C.) Интенсивный термолиз комплексов, который отражают крутопадающие участки кривых ТГ, начинается с 216/230°С. Для комплекса II формально он проходит в одну стадию (230–305°С) с основной потерей массы в 59.76% (рис. 7а). На кривой ДСК процесс термолиза отображается эндоэффектом при 267.6°С (рис. 7б). Последующий пологий участок кривой ТГ обусловлен плавной десорбцией летучих продуктов термолиза (1.19%). Масса остатка (39.05%), регистрируемая по завершении процесса при 400°С, близка к ожидаемому значению (расч. 39.36%) для образующегося Bi2S3.
Крутопадающий участок кривой ТГ соединения I включает две точки перегиба при 255 и 317°C, разделяющие его на три сопряженные ступени (рис. 6а), что указывает на сложный характер протекания термолиза. Потеря массы в 19.42% на первой ступени (210.0–255.0°) согласуется с предположением о диссоциации алкильных заместителей лиганда PrDtc (расч. 18.45%). На второй ступени (255.0–317.0°С) с потерей массы в 12.19% продолжающийся термолиз комплекса включает диссоциацию связей Bi–Cl (расч. 15.54%) с восстановлением небольшой части висмута(III) до элементного состояния. На это указывает узкий низкоинтенсивный эндоэффект на кривой ДСК при 267.9°С (экстраполированная Тпл = 267.0°С), обусловленный плавлением висмута (Тпл компактного металла 271.442°С [25]). Понижение Тпл висмута обусловлено присутствием Bi2S3 как основного компонента и малым размером металлических частиц [25]. Третья ступень завершает процесс термолиза с финальным формированием Bi2S3, испарением летучих продуктов термолиза и стабилизацией массы остаточного вещества (55.89%), которая несколько ниже расчетной для сульфида висмута(III) – 56.35%.
В обоих случаях при вскрытии тиглей обнаружены порошкообразные вещества черного цвета, исследованные методами растровой электронной микроскопии и микрозонда. Энергодисперсионные спектры позволили установить, что частицы остаточного вещества в основном представляют собой Bi2S3 (рис. 8а). Однако в продуктах термолиза обнаружено также присутствие восстановленного висмута: на рис. 8б показано сферическое образование диаметром 70 мкм, представляющее собой пустотелую микросферу, в окружении частиц Bi2S3. Кроме того, на поверхности образцов отмечены области выделения BiCl3 в форме тонких (∼0.15 мкм) нитевидных кристаллов (рис. 8в).
Рис. 8.
Размер, форма частиц и энергодисперсионные спектры Bi2S3 (а), восстановленного висмута (б), Bi-Cl3 (в).

Таким образом, препаративно выделены новые дитиокарбаматно-хлоридные комплексы висмута(III) состава [Bi{S2CN(C3H7)2}Cl2] и [Bi{S2CN(изо-C4H9)2}2Cl], детально охарактеризованные методами гетероядерного (13С, 15N) CP-MAS ЯМР, ИК-спектроскопии и РСА. В кристаллическом состоянии оба соединения формируют зигзагообразные 1D полимерные цепочки при участии одного или двух лигандов μ2-Cl–, в результате чего комплексообразователь достраивает свое окружение до шестерного – [BiS2Cl4] или [BiS4Cl2]. Термическое поведение разнолигандных комплексов висмута(III) изучено методом СТА с одновременной регистрацией кривых ТГ и ДСК. Исследование остаточного вещества методом микрозонда позволило, наряду с основным продуктом термических превращений комплексов – Bi2S3, также идентифицировать присутствие в образцах восстановленного металлического висмута и BiCl3.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Koh Y.W., Lai C.S., Du A.Y. et al. // Chem. Mater. 2003. V. 15. № 24. P. 4544.
Ozturk I.I., Banti C.N., Kourkoumelis N. et al. // Polyhedron. 2014. V. 67. P. 89.
Arda M., Ozturk I.I., Banti C.N. et al. // RSC Adv. 2016. V. 6. № 35. P. 29026.
Новикова Е.В., Иванов А.В., Егорова И.В. и др. // Коорд. химия. 2019. Т. 45. № 10. С. 599 (Novikova E.V., Ivanov A.V., Egorova I.V. et al. // Russ. J. Coord. Chem. 2019. V. 45. № 10. P. 695). https://doi.org/10.1134/ S1070328419100038
Jamaluddin N.A., Baba I., Halim S.N.A., Tiekink E.R.T. // Z. Kristallogr. NCS. 2015. V. 230. № 3. P. 239.
Battaglia L.P., Corradi A.B. // Dalton Trans. 1986. № 8. P. 1513.
Raston C.L., Rawbottom G.L., White A.H. // Dalton Trans. 1981. № 6. P. 1352.
Adeyemi J.O., Onwudiwe D.C. // Molecules. 2020. V. 25. № 2. P. 305.
Raston C.L., Rawbottom G.L., White A.H. // Dalton Trans. 1981. № 6. P. 1366.
Raston C.L., Rawbottom G.L., White A.H. // Dalton Trans. 1981. № 6. P. 1379.
Raston C.L., Rawbottom G.L., White A.H. // Dalton Trans. 1981. № 6. P. 1372.
Bharadwaj P.K., Lee A.M., Skelton B.W. et al. // Aust. J. Chem. 1994. V. 47. № 2. P. 405.
Бырько В.М. Дитиокарбаматы. М.: Наука, 1984. 341 с.
Hexem J.G., Frey M.H., Opella S.J. // J. Chem. Phys. 1982. V. 77. № 7. P. 3847.
Harris R.K., Jonsen P., Packer K.J. // Magn. Reson. Chem. 1985. V. 23. № 7. P. 565.
Pines A., Gibby M.G., Waugh J.S. // J. Chem. Phys. 1972. V. 56. № 4. P. 1776.
Ratcliffe C.I., Ripmeester J.A., Tse J.S. // Chem. Phys. Lett. 1983. V. 99. № 2. P. 177.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. № 1. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Ap-pl. Crystallogr. 2009. V. 42. № 2. P. 339.
Иванов А.В., Герасименко А.В., Егорова И.В. и др. // Коорд. химия. 2018. Т. 44. № 4. С. 266 (Ivanov A.V., Gerasimenko A.V., Egorova I.V. et al. // Russ. J. Coord. Chem. 2018. V. 44. № 8. P. 518). https://doi.org/10.1134/ S1070328418080043
Yin H.D., Li F., Wang D. // J. Coord. Chem. 2007. V. 60. № 11. P. 1133.
Brown D.A., Glass W.K., Burke M.A. // Spectrochim. Acta. A. 1976. V. 32. № 1. P. 137.
Kellner R., Nikolov G.S., Trendafilova N. // Inorg. Chim. Acta. 1984. V. 84. № 2. P. 233.
Казицына Л.A., Куплетская Н.Б. Применение УФ-, ИК-, ЯМР- и масс-спектроскопии в органической химии. М.: Изд-во Моск. ун-та, 1979. 240 с.
Lin J.-C., Sharma R.C., Chang Y.A. // J. Phase Equilib. 1996. V. 17. № 2. P. 132.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия